多样本类型通用宏基因组快速检测方法
文献发布时间:2023-06-19 18:30:43
技术领域
本申请属于体外诊断领域,具体而言,涉及一种基于纳米孔测序的多样本类型通用的宏基因组快速检测方法。
技术背景
传统的临床样本感染的确定是基于培养鉴定,而培养方法往往存在培养时间长、培养阳性率低(假阴性)等问题。随着测序行业的发展于成熟,基于高通量测序平台的宏基因组检测方法逐步应用于临床病原检测。此类方法具有鉴定周期短、感染病原鉴定更全面、更准确的优势。目前主流的高通量宏基因组测序方案包括二代测序方法和三代测序方法。其中二代高通量宏基因组测序方案多采用不去宿主方案,存在宿主数据比例高、病原数据比例低,造成大量的数据浪费的问题;而已知的三代高通量宏基因组测序专利方案多采用不完全去宿主的方案,虽然较二代测序方案的病原数据比例有一定的提升,但还是存在大量宿主数据的浪费。
有鉴于此,提出本申请。
发明内容
为解决上述技术问题,本申请提出如下技术方案:
本申请首先提供一种适于感染宏基因组样本快速检测的通用样本处理方法,所述方法包括如下步骤:
1)样本解稠:向粘稠类样本中加入解稠剂,恒温孵育;
2)样本前处理:取非粘稠样本和/或步骤1)解稠后样本,离心收集沉淀;向沉淀中加入预配的皂素和HL-SAN酶混合液,恒温孵育;
3)细胞破壁:取前处理后样本离心收集沉淀,加入裂解液重悬后转入破壁管破壁,离心机后收上清;
4)核酸提取。
进一步的,所述步骤1)中的解稠剂为自配试剂,包含0.7-0.8g/100ml NaCl,0.02-0.1g/100ml KCl,0.1-0.2g/100ml Na
优选的,所述步骤1)中的孵育条件为:40-42℃,300-500rpm孵育5-10min。
更优选的,所述步骤1)具体为:向150-250ul粘稠类样本中加入0.8-1.2ml解稠剂,充分混匀,置于恒温震荡金属浴中,35-45℃,300-500rpm孵育5-10min。
进一步的,所述步骤2)中酶混合液中包含终浓度为0.05-0.1%的皂素和终浓度为20-22U/ml的HL-SAN酶;所述酶混合液的Buffer为自配试剂,包含2-2.5g/100ml MgCl
优选的,所述步骤2)中的孵育条件为:35-40℃、800-1000rpm孵育5-10min。
更优选的,所述步骤2)具体为:取0.8-1.2ml的非粘稠样本和/或步骤1)解稠后样本置于高速离心机,12000-14000g离心3-5min,收集沉淀;向沉淀中加入150-250ul PBS重悬沉淀,加入皂素和HL-SAN酶混合液,立即混匀,35-40℃、800-1000rpm孵育5-10min。
进一步的,所述步骤3)中的裂解液为ZYMO的Lysis Solution裂解液;所述破壁管为Lysing Matrix E破壁管;优选的,所述破壁条件为:15-20m/s,破壁30-120s。
优选的,所述步骤3)和步骤4)具体为:向步骤2)前处理后样本中加入0.8-1ml的PBS,充分混匀,置于高速离心机,8000-12000g,离心3-5min;收集沉淀;向沉淀中加入550-650ul的裂解液重悬,转入Lysing Matrix E破壁管中进行破壁,置于高速离心机,15000-17000g离心1-5min;收集上清液。
进一步的,所述步骤4)具体为:向步骤3)收集的上清液中加入350-450ul的缓冲液GB和20-25ul的蛋白酶K,56-70℃孵育10-15min;加入350-450ul无水乙醇,室温环境下静置5-10min;将反应产物分2次转入吸附柱,8000-12000rpm离心弃滤液;加入缓冲液GD,8000-12000rpm离心弃滤液;分两次,各加入漂洗液PW,8000-12000rpm离心弃滤液;用无核酸酶水悬空滴在柱膜上,10000-12000rpm离心1-2min,获得核酸。
进一步的,上述感染宏基因组样本包括但不限于:痰液、肺泡灌洗液、腹透液、脓胸引流液、纤支镜冲洗液和心包积液;
进一步的,上述检测为基于三代测序技术的检测,优选的为纳米孔测序的检测。
进一步的,上述方法进一步包括如下步骤:
5)耶氏肺孢子菌特异检测评价:取非粘稠和/或解稠后样本,在不经去宿主条件下,对耶氏肺孢子菌进行特异性检测;
优选的,所述特异性检测的引物和探针序列如下:
正向引物序列:CTTAAAATAAATAATCAGACTATGTGCGATAAG;
反向引物序列:GGAGCTTTAATTACTGTTCTGGGC;
探针序列:6-FAM-AGATAGTCGAAAGGGAAC-BHQ1。
本申请还提供一种基于纳米孔测序的多样本类型通用的宏基因组文库构建方法,包上述任一所述方法步骤,并进一步包括如下步骤:
6)取提取核酸,补水并加入打断试剂FRM,混匀后进行片段化处理;
优选的,所述打断试剂FRM为Rapid PCR Barcoding Kit试剂盒组分;
7)向步骤6)反应产物中加barcode primer,STAR GXL Buffer,dNTP Mixture,PrimeSTAR GXL DNA Polymerase和Nuclease-free water;混匀后置于PCR仪上进行文库扩增。
优选的,所述barcode primer为Rapid PCR Barcoding Kit试剂盒组分;所述其它扩增试剂为
本申请的有益技术效果至少包括如下:
1.粘稠类样本的高效雾化解稠
本申请采用自主设计的解稠试剂,可实现粘稠类样本(如痰液)在10min内实现雾化解稠。
2.高效的一步法前处理方案
本申请前处理方案基于差异裂解的原理实现宿主细胞的高效去除;与文献或已有发明相比较,优化了反应体系,简化了反应步骤,将皂素溶液、HL-SAN Buffer和HL-SAN酶与样本一起配置成反应体系,实现宿主细胞的高效一步法去除,10min即可实现99%以上宿主细胞去除。
3.前处理方案的通用性高
本申请对去宿主反应体系进行优化,实现了多样本类型(包括痰液、肺泡灌洗液、腹透液、脓肿引流液、纤支镜冲洗液等)的通用性,无需针对不同样本类型调整反应体系中比如皂素、HL-SAN Buffer和HL-SAN酶的浓度和使用量。
4.测序数据量要求降低
本申请实现99%以上宿主细胞的高效去除,明显提高病原菌的数据占比,因此测序数据要求量显著下降,大大降低了测序的数据成本。
5.检测时效性高
本申请流程简洁,全周期检测时间(从样本到实验室到检出报告)仅需要6h,大大缩短了临床样本的检测周期,实现了当天样本当天出检测结果,有利于临床医生对病患进行针对性准确的治疗。
6.耶氏肺孢子菌特异性检测
针对去宿主流程对耶氏肺孢子菌检出的影响,本发明针对性的进行耶氏肺孢子菌特异QPCR验证,有效避免因去宿主导致的耶氏肺孢子菌漏检情况。
附图说明
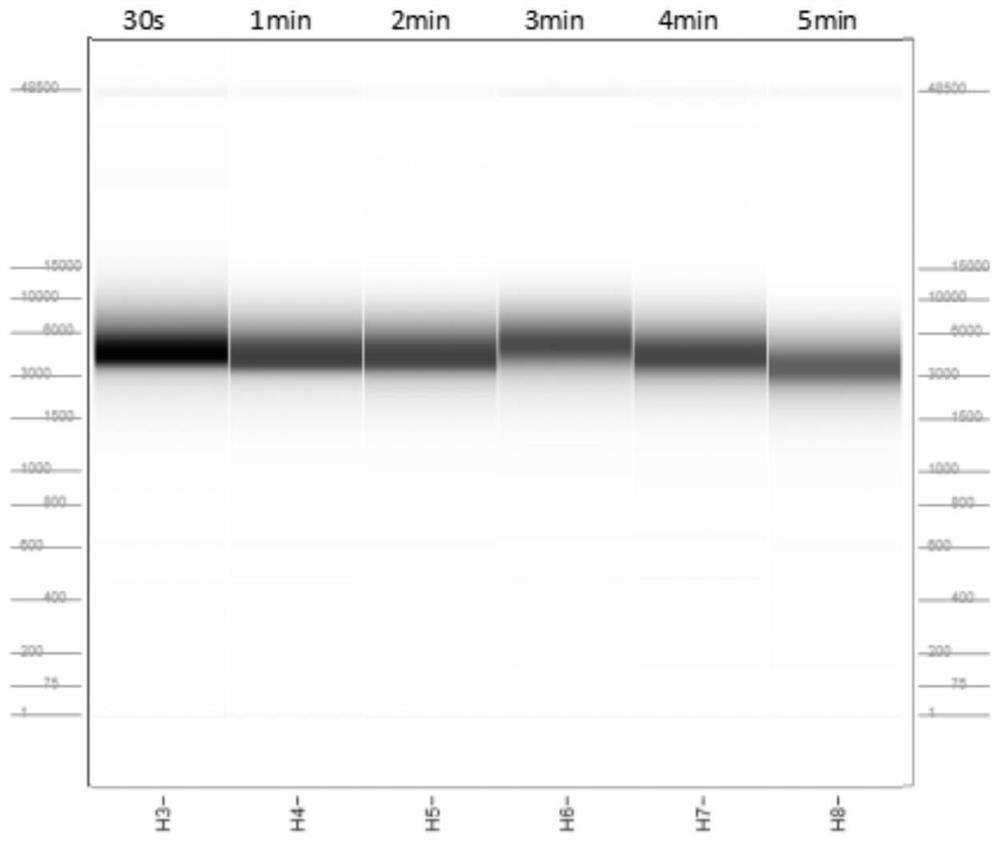
图1不同破壁条件下的核酸毛细管电泳结果。
图2自配解稠试剂与成品解稠试剂对比效果。
图3耶肺引物探针法QPCR效果图。
图4耶肺引物染料法QPCR效果图。
具体实施方式
下面将结合实施例对本申请的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本申请,而不应视为限制本申请的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市场购买获得的常规产品。
部分术语定义,除非在下文中另有定义,本申请具体实施方式中所用的所有技术术语和科学术语的含义意图与本领域技术人员通常所理解的相同。虽然相信以下术语对于本领域技术人员很好理解,但仍然阐述以下定义以更好地解释本申请。
本申请中的术语“大约”表示本领域技术人员能够理解的仍可保证论及特征的技术效果的准确度区间。该术语通常表示偏离指示数值的±10%,优选±5%。
如本申请中所使用,术语“包括”、“包含”、“具有”、“含有”或“涉及”为包含性的(inclusive)或开放式的,且不排除其它未列举的元素或方法步骤。术语“由…组成”被认为是术语“包含”的优选实施方案。如果在下文中某一组被定义为包含至少一定数目的实施方案,这也应被理解为揭示了一个优选地仅由这些实施方案组成的组。
此外,说明书和权利要求书中的术语第一、第二、第三、(a)、(b)、(c)以及诸如此类,是
用于区分相似的元素,不是描述顺序或时间次序必须的。应理解,如此应用的术语在适当的环境下可互换,并且本申请描述的实施方案能以不同于本申请描述或举例说明的其它顺序实施。
本申的适于感染宏基因组样本快速检测的通用样本处理方法,大体包括如下步骤:
1)样本解稠:向粘稠类样本中加入解稠剂,恒温孵育;
2)样本前处理:取非粘稠样本和/或步骤1)解稠后样本,离心收集沉淀;向沉淀中加入预配的皂素和HL-SAN酶混合液,恒温孵育;
3)细胞破壁:取前处理后样本离心收集沉淀,加入裂解液重悬后转入破壁管破壁,离心机后收上清;
4)核酸提取等。
本申请步骤1)中的解稠剂通过实验自主设计和优化,由实施例中图2所示,本申请自配解稠试剂,可在5min内将样本完全解稠,而商品化解稠剂在5min时仍然有部分絮状物,在10min状态下才达到与自配试剂相当的解稠效果。可见此自配解稠试剂可实现粘稠样本(如痰液)在5-10min内充分雾化解稠,在时效性和雾化效果方面都显著优于商品化解稠剂。具体的,其组分包含0.7-0.8g/100ml NaCl,0.02-0.1g/100ml KCl,0.1-0.2g/100mlNa
在一些实施方式中,所述步骤1)中的孵育条件为:40-42℃,300-500rpm孵育5-10min。
在一些更具体的实施方式中,所述步骤1)具体为:向150-250ul粘稠类样本中加入0.8-1.2ml解稠剂,充分混匀,置于恒温震荡金属浴中,35-45℃,300-500rpm孵育5-10min。
为有效节省了整个流程时间,本申请通过混合一步法去宿主,可在5-10min内实现宿主细胞99%以上的高效去除,该效果明显优于传统的不去宿主方法。而且,与前期常用的去宿主过程中依次添加皂素和添加HL-SAN分步法的效果类似,所以可以将该一步法应用与本申请的宏基因组快速检测中,有效节省了操作时间。
另外,为满足各类感染样本的通用处理和测序检出,本申请还对皂素和HL-SAN等的浓度进行了优化探索。
在一些实施方式中,所述步骤2)中酶混合液中包含终浓度为0.05-0.1%的皂素和终浓度为20-22U/ml的HL-SAN酶;所述酶混合液的Buffer为自配试剂,包含2-2.5g/100mlMgCl
在一些实施方式中,所述步骤2)中的孵育条件为:35-40℃、800-1000rpm孵育5-10min。
在一些具体实施方式中,所述步骤2)具体为:取0.8-1.2ml的非粘稠样本和/或步骤1)解稠后样本置于高速离心机,12000-14000g离心3-5min,收集沉淀;向沉淀中加入150-250ul PBS重悬沉淀,加入皂素和HL-SAN酶混合液,立即混匀,35-40℃、800-1000rpm孵育5-10min。
本申请在DNA核酸提取过程中对裂解液、破壁管以及操作条件进行了优化选择,在一些实施方式中,所述步骤3)中的裂解液为ZYMO的Lysis Solution裂解液;所述破壁管为Lysing Matrix E破壁管;优选的,所述破壁条件为:15-20m/s,破壁30-120s。
在一些具体实施方式中,所述步骤3)和步骤4)具体为:向步骤2)前处理后样本中加入0.8-1ml的PBS,充分混匀,置于高速离心机,8000-12000g,离心3-5min;收集沉淀;向沉淀中加入550-650ul的裂解液重悬,转入Lysing Matrix E破壁管中进行破壁,置于高速离心机,15000-17000g离心1-5min;收集上清液。
在一些实施方式中,所述步骤4)具体为:向步骤3)收集的上清液中加入350-450ul的缓冲液GB和20-25ul的蛋白酶K,56-70℃孵育10-15min;加入350-450ul无水乙醇,室温环境下静置5-10min;将反应产物分2次转入吸附柱,8000-12000rpm离心弃滤液;加入缓冲液GD,8000-12000rpm离心弃滤液;分两次,各加入漂洗液PW,8000-12000rpm离心弃滤液;用无核酸酶水悬空滴在柱膜上,10000-12000rpm离心1-2min,获得核酸。
本申请实施例已经证实了包括病灶灌洗液、心包积液、肺泡灌洗液、痰液、纤支镜冲洗液等各类样本的处理效果,因此本申请的方法所处理的的感染宏基因组样本包括但不限于:痰液、肺泡灌洗液、腹透液、脓胸引流液、纤支镜冲洗液和心包积液等;
本申请的检测为基于三代测序技术的检测,优选的,为纳米孔测序的检测。
为解决样品处理过程中个别病原微生物的损失而导致的假阳性问题,本申请经反复分析后确认耶氏肺孢子菌存在损失。因此,针对去宿主流程引入的耶氏肺孢子菌假阴性检测问题,本申请又针对性的开发了针对该菌的补充检测流程。
因此,在一些实施方式中,上述方法还包括包括如下步骤:
5)耶氏肺孢子菌特异检测评价:取非粘稠和/或解稠后样本,在不经去宿主条件下,对耶氏肺孢子菌进行特异性检测;
优选的,所述特异性检测的引物和探针序列如下:
正向引物序列:CTTAAAATAAATAATCAGACTATGTGCGATAAG;
反向引物序列:GGAGCTTTAATTACTGTTCTGGGC;
探针序列:6-FAM-AGATAGTCGAAAGGGAAC-BHQ1。
在上述样本处理方法的基础上,本申请还提供一种基于纳米孔测序的多样本类型通用的宏基因组文库构建方法,除包上述任一所述方法步骤外,还包括如下步骤:
6)取提取核酸,补水并加入打断试剂FRM,混匀后进行片段化处理;
在一些实施方式中,所述打断试剂FRM为Rapid PCR Barcoding Kit试剂盒组分;
7)向步骤6)反应产物中加barcode primer,STAR GXL Buffer,dNTP Mixture,PrimeSTAR GXL DNA Polymerase和Nuclease-free water;混匀后置于PCR仪上进行文库扩增。
在一些实施方式中,所述barcode primer为Rapid PCR Barcoding Kit试剂盒组分;所述其它扩增试剂为
下面结合具体的实施例来阐述本申请。
实施例1本申请方法的探索和优化
本申请拟获得一种对感染样本类型通用、满足测序检出要求、且能快速高效的样本前处理体系和方法。为实现该目的,本申请尝试从样本解稠、前处理、核酸提取等多方面进行探索和优化,具体可参见如下实验例。
优化例1、前处理思路的优化
为充分压缩前处理时间,本申请通过探索,在去宿主思路中,尝试将多各步骤压缩到一起,把添加皂素和DNA消化酶等溶液体系混合制备成一个混合体系,在实际前处理过程中,通过直接加入混合体系尝试实现一步法处理。
1.1实验方法
1.1.1分别选取临床粘稠样本和非粘稠样本作为测试对象,每个样本均质后取2等份于新的离心管中。其中所述的粘稠样本取样150-250ul,进行解稠后用于后续提取,非粘稠样本取0.8-1.2ml用于后续处理。
1.1.2样本经过12000-14000g离心3-5min,弃上清富集沉淀;
1.1.3向平行测试中的1份样本中加入一次性加入皂素溶液、HL-SAN buffer和HL-SAN酶;另一份平行样本沉淀作为对照组,不添加去宿主试剂,直接进行1.1.5步骤;
1.1.4反应体系经过37℃,300-500rpm孵育5-10min,加入0.8-1.2ml的PBS充分混匀,置于高速离心机,12000-14000g离心3-5min,弃上清。
1.1.5向沉淀中加入PBS进行重悬,破壁仪破壁后离心,取等体积的上清液进行提取。
1.1.6按照天根微量样品基因组DNA提取试剂盒说明书进行核酸的提取。
1.1.7提取的核酸进行human和16S的QPCR测定。
1.1.8其中所述的human QPCR反应Froward Primer引物为TGAAGCCGTGCGGAAGG。
其中所述的human QPCR反应Reverse Primer引物为ACAAGAGAGCCAAGTGTCG。
其中所述的human QPCR反应Probe Primer引物为TACCACGTCATCTCCTTTGATGGCTCCTAT。
其中所述的16S QPCR反应Froward Primer引物为TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG。
其中所述的16S QPCR反应Reverse Primer引物为GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC。
1.2实验结论如表1
表1一步法宿主背景去除效果
可见,本申请的混合一步法去宿主,可在5-10min内实现宿主细胞99%以上的高效去除,该效果明显优于传统的不去宿主方法。另外,与前期常用的去宿主过程中依次添加皂素步骤和添加HL-SAN步骤的分步方法的效果类似,所以可以将该一步法应用与本申请的宏基因组快速检测中,有效节省了操作时间。
优化例2、前处理过程中的皂素浓度优化
基于上述一步法的处理思路,本实施例继续对该体系中的皂素添加浓度进行优化。
2.1实验方法
2.1.1分别选取临床粘稠样本(如痰液)和非粘稠样本(如肺泡灌洗液、腹透液等)作为测试对象,每个样本均质后取4等份与新的离心管中。其中所述的粘稠样本取样200ul,进行解稠后用于后续提取,非粘稠样本取1ml用于后续处理。
2.1.2向同一样本等分的4个离心管中添加终浓度为0.05%,0.1%、1.0%和2.2%的皂素溶液,HL-SAN buffer和HL-SAN酶使用量保持一致。
2.1.3反应体系经过37℃,300-500rpm孵育5-10min,加入0.8-1.2ml的PBS充分混匀,置于高速离心机,12000-14000g离心3-5min,弃上清。
2.1.4向去宿主沉淀中加入150-250ulPBS进行重悬,破壁仪破壁后离心,取等体积的上清液进行提取。
2.1.5按照天根微量样品基因组DNA提取试剂盒说明书进行核酸的提取。
2.1.5提取的核酸取1ul进行Qubit4.0的浓度测定。
2.1.6提取的核酸进行human和16S的QPCR测定。
其中所述的human QPCR反应Froward Primer引物为TGAAGCCGTGCGGAAGG。
其中所述的human QPCR反应Reverse Primer引物为ACAAGAGAGCCAAGTGTCG。
其中所述的human QPCR反应Probe Primer引物为TACCACGTCATCTCCTTTGATGGCTCCTAT。
其中所述的16S QPCR反应Froward Primer引物为TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG。
其中所述的16S QPCR反应Reverse Primer引物为GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC。
2.2实验结果
测试统计结果见下表1所示:
表1、不同皂素添加浓度下的提取宿主去除效果
可见,不同皂素浓度下的提取核酸浓度有明显的差异,其中在皂素添加终浓度在0.05%和0.1%时的提取核酸浓度明显低于1.00%和2.2%浓度下提取能读;人源QPCR结果显示,在0.05%和0.1%浓度下的人源背景去除效果优于1.00%和2.2%浓度;16S QPCR结果显示在不同皂素浓度下,提取样本核酸中微生物核酸的含量无显著差异。考虑到本申请拟建立一套样本类型通用的前处理体系,所以本发明流程最终选择低浓度皂素的添加为0.05-0.1%。
优化例3、DNA核酸提取过程中裂解液的优化
核酸提取过程中,高效的裂解液既可以有效裂解细胞释放包内核酸,又可有效抑制包内核酸酶对核酸的破坏,保证核酸的完整性。实践中,由于高效的一步法去宿主,往往去宿主后的样本提取浓度偏低,甚者测不到浓度。本发明针对不同裂解液下的提取效果进行了相应的测试。
3.1实验方法
3.1.1分别选取临床粘稠和非粘稠样本作为测试对象,每个样本均质后取3等份于新的离心管中。其中所述的粘稠样本取样150-250ul,进行解稠后用于后续提取,非粘稠样本取0.8-1.2ml用于后续提取。
3.1.2样本置于高速离心机,12000-14000g离心3-5min,弃上清。
3.1.3向同一样本的3份沉淀中分别加入550-650ul的PBS、Buffer GB(天根)和Lysis solution(ZYMO,D4300-1-40/D4300-1-150)进行重悬,破壁仪破壁后离心,取等体积的上清液进行提取。
3.1.4按照天根微量样品基因组DNA提取试剂盒说明书进行核酸的提取。
3.1.5提取的核酸进行Qubit4.0的浓度测定。
3.2实验结果
测试统计结果见下表3。
表3、不同裂解液的提取效果
可见,样本去宿主后,添加不同裂解液,提取核酸浓度有明显的差异。其中使用Lysis solution(ZYMO)裂解液,核酸提取浓度最高。综合测试结果,本发明流程最终选择Lysis solution(ZYMO)作为裂解液进行去宿主产物的重悬。
优化例4、DNA核酸提取过程中的破壁条件优化
实践中,本发明涉及的纳米孔测序平台具有长度长的优势,对建库起始核酸的完整性要求较高。破壁仪在细胞破壁的同时,会对释放的核酸进行物理剪切,从而影响核酸的完整性。本实施例针对前处理过程中不同破壁条件下的提取效果进行了测试和优化。
4.1实验方法
4.1.1选取临床样本作为测试对象,每个样本均质后取6等份于新的离心管中。其中所述样本为粘稠样本,取样150-250ul,进行解稠后用于后续提取。
4.1.2样本置于高速离心机,12000-14000g离心3-5min,弃上清。
4.1.3向同一样本的6份沉淀中分别加入550-650ul Lysis solution(ZYMO)进行重悬。
4.1.4将破壁管分别置于破壁仪器上,15-20m/s,分别进行30S、1min、2min、3min、4min和5min的破壁反应。
4.1.5破壁完成后进行高速离心,取等体积的上清液进行提取。
4.1.6按照天根微量样品基因组DNA提取试剂盒说明书进行核酸的提取。
4.1.7提取的核酸进行Qubit4.0的浓度测定。
4.1.8提取的核酸进行人源和16S的QPCR测定。
4.1.9提取的核酸进行Agilent Fragment Analyzer 5200全自动毛细管电泳检测。
4.2实验结果
测试统计结果见下表4。
表4不同破壁条件下的提取结果
可见,测试样本在不同的破壁条件下提取核酸浓度无明显的差异。16S QPCR测试结果显示,在不同破壁条件下提取的核酸中微生物的含量无明显差异(表4)。毛细管电泳结果(图1)显示在15-20m/s,30-120s破壁条件下核酸完整性无明显变化。综合测试结果,本发明流程最终选择,15-20m/s,30-120s作为提取环节细胞破壁条件。
优化例5、解稠剂的探索优化
本申请还通过实验探索,通过自主配置一种用于痰液等粘稠样本的解稠剂,该解稠剂工作液包含0.7-0.8g/100ml NaCl,0.02-0.1g/100ml KCl,0.1-0.2g/100ml Na
5.1实验方法
5.1.1选取临床痰液样本作为测试对象,样本均质后取2等份于新的离心管中。
5.1.2分别向步骤5.1.1管中加入自配解稠剂(实验组)和商品化解稠剂a(对照组)。
充分混匀;
5.1.3将样本置于恒温震荡金属浴上进行解稠反应。
其中,所述的解稠条件为40-42℃,300-500rpm孵育5-10min。
5.1.4每隔2-3min记录对比样本解稠状态。
5.2实验结果
解稠比较结果见图2,通过平行对比测试,本申请自配解稠试剂,可在5min内将样本完全解稠,而商品化解稠剂在5min时仍然有部分絮状物,在10min状态下才达到与自配试剂相当的解稠效果。可见,通过此自配解稠试剂可实现粘稠样本(如痰液)在5-10min内充分雾化解稠,在时效性和雾化效果方面都显著优于商品化解稠剂。
实施例2、本申请方法体系建立
经过上述实验例1-5的探索优化,本申请最终确定一种基于纳米孔测序的多样本类型通用的宏基因组快速检测方法,具体方法步骤如下:
其中所述的一种基于纳米孔测序的多样本类型通用的宏基因组快速检测方法具体方法为:
1粘稠样本解稠
1.1试剂准备
1.1.1按照每0.8-1mL解稠剂母液加入5-7μL DTT的比例混合,配置成解稠工作液。
其中所述的解稠剂成分包含0.7-0.8g/100ml NaCl,0.02-0.1g/100ml KCl,0.1-0.2g/100ml Na
1.1.2称取适量的皂素粉末,用Nuclease-free water稀释溶解成1-2%浓度工作液体,0.22μm滤膜过滤后,遮光保存备用。
1.2解稠操作
1.2.1取150-250ul的粘稠样本转移至2.0ml的离心管中,加入1-1.2mL配置好的解稠工作液。
1.2.2充分混匀,置于恒温震荡金属浴中,40-42℃,300-500rpm孵育5-10min;
1.2.3解稠反应完成后,将样本取下,待下一步去宿主操作。
2样本的前处理
2.1样本去宿主
2.1.1取不粘稠样本和/或解稠好的粘稠样本0.8-1.2mL,置于2.0mL离心管中;同时取0.8-1.2mL阴性质控品置于准备好的2.0mL离心管中,标记为NC。
2.1.2样本管置于高速离心机,12000-14000g离心3-5min。
2.1.3弃上清,不要触碰到沉淀。
2.1.4加入150-250μL的PBS重悬沉淀。
2.1.5加入35-45μL配置好的1-2%的皂素溶液、150-250μL的HL-SAN Buffer、8-10μL的HL-SAN酶。其中所述的皂素终浓度为0.05%-0.1%,HL-SAN酶至终浓度20U-22.2U/ml。其中所述的HL-SAN Buffer包含2-2.5g/100ml MgCl
2.1.6充分混匀,置于恒温震荡金属浴上进行反应。其中所述的反应条件为35-40℃300-500rpm孵育5-10min。
2.1.7向反应完成样本中加入0.8-1mL的PBS溶液,充分混匀,置于高速离心机,12000-14000g离心3-5min,弃上清,沉淀待进行下一步提取工作。
2.1.8去宿主的同时,取0.8-1.2ml样本原液,置于2.0mL离心管中;12000-14000g高速离心3-5min,富集沉淀,作为不去宿主的平行,直接进行后续的DNA核酸提取。
2.2 DNA核酸提取
2.2.1向去宿主或原液沉淀中加入550-650μL的裂解液进行重悬。其中所述的裂解液为Lysis Solution(ZYMO)。
2.2.2重悬后的样本全部转入Lysing Matrix E破壁管中。
2.2.3使用JXFSTPRP-4D进行破壁。其中所述的破壁条件为15-20m/s,30-120S运行一次。
2.2.4破壁完成后,置于高速离心机,15000-17000g离心1min。
2.2.5吸取350-450μL上清转入新的的2.0ml离心管,参照微量样品基因组DNA提取试剂盒(天根)流程说明书完成DNA核酸的提取工作。
2.2.6提取完成DNA核酸使用Qubit4.0进行定量。
3宏基因组文库构建
本申请使用Rapid PCR Barcoding Kit(ONT)和
3.1DNA的片段化
3.1.1准备新的0.2mL PCR管,依次加入DNA样本和FRM,Nuclease free water补充反应体积至8μ。其中所述样本核酸总量不超10ng,核酸体积不超6ul。其中所述FRM用量为2ul。
3.1.2轻弹混匀,瞬时离心,PCR仪上进行反应。其中所述的反应条件为30℃1min,80℃1min。
3.2 PCR扩增
3.2.1向片段化产物反应完成的产物中依次加入不同的barcode primer。
其中所述的barcode primer添加量为2ul。
3.2.2依次加入20ul 5×PrimeSTAR GXL Buffer,8ul dNTP Mixture和4ulPrimeSTAR GXL DNA Polymerase。添加Nuclease free water补充反应体积至100μL。
3.2.3轻弹混匀,瞬时离心,PCR仪上进行扩增反应。
其中所述扩增反应条件为预变性98℃2min,循环98℃15s,56℃15s,68℃45s,25-35cycles,补偿延申68℃4min。
3.2.4扩增好的文库使用Qubit4.0进行定量。
4文库pooling纯化
4.1扩增合格文库,按等质量混样原则,进行文库的pooling。其中所述的文库量为100-200ng。
4.2pooling好的混合文库进行DNA Clean Beads纯化。其中所述的DNA CleanBeads用量为Pooling液的1/2体积。
4.3pooling纯化产物最终使用12-15ul洗脱试剂进行洗脱。其中,所述的洗脱试剂成分为10M Tris-HCL&50mM NaCl。
4.4洗脱文库使用Qubit进行定量。
5上机测序
采用ONT官方推荐的Flow Cell Priming Kit(EXP-FLP002)和Flow Cell(FLO-MIN106D)试剂和芯片,在测仪器上完成文库的上机测序反应。其中所述的测序仪器包括GridION MK1和MInION。
6数据分析与报告解读
下机数据进行相关的数据库比对分析,跟据分析结果,进行病原检出情况的解读,最终形成检测报告。
实施例3、耶氏肺孢子菌QPCR特异检测
本申请在采用上述去宿主技术进行样本的处理中发现,似乎个别病原微生物存在损失,经反复分析后确认耶氏肺孢子菌存在损失。因此,针对去宿主流程引入的耶氏肺孢子菌假阴性检测问题,本申请又针对性的开发了针对该菌的补充检测流程,并通过生息数据分析优化设计了一组特异引物和探针,对可能存在的耶氏肺孢子菌进行QPCR验证。
所述验证方法包括如下步骤:
1)探针法耶肺QPCR验证:取2ul不去宿主提取的核酸,分别加入0.4ul PrimerForward、0.4ul Primer Reverse、0.4ul Primer Probe和10ul 2×SGExcel GoldStarTaqMan Mixture,Nuclease-Free water补充至终体积20ul。
2)染料法耶肺QPCR验证:取2ul不去宿主提取的核酸,分别加入0.4ul PrimerForward、0.4ul Primer Reverse和10ul 2×AceQ Universal SYBR qPCR Master Mix,Nuclease-Free water补充至终体积20ul。
其中,所述的2×SGExcel GoldStar TaqMan Mixture来自于Takara公司的成品试剂盒;2×AceQ Universal SYBR qPCR Master Mix来自于Vazyme公司成品试剂盒。
其中,所述的验证样本均进行2-3复孔重复检测。
其中,所述反应以耶氏肺孢子菌DNA核酸为阳性参考品,以Nuclease-Free water为阴性参考品。
其中,所述的primer Forward引物序列为CTTAAAATAAATAATCAGACTATGTGCGATAAG。
其中所述的primer Reverse引物序列为GGAGCTTTAATTACTGTTCTGGGC。
其中所述的primer Probe引物序列为AGATAGTCGAAAGGGAAC。
其中所述的primer Probe引物序列的修饰为5'6-FAM,3'BHQ1。
3)反应体系放置于QPCR仪器上进行反应。其中所述的反应条件为预变性95℃3min,循环95℃15s,55℃20s,72℃25s循环数40-45cycles。
其中所述72℃25s条件下收集荧光。
4)以阳性参考品为参照,确定待测样本峰型变化及荧光信号收集情况,判定待测样本是否含有耶氏肺孢子菌感染。
实验结果如图3和4所示,上述引物探针体系具有非常高的特异性和灵敏度。无论是探针法(扩增曲线)还是染料法(溶解曲线),均可以有效的鉴定出耶肺阳性;同时对杂菌核酸的干扰具有很高的容忍性(无杂峰、阴性无扩增)。
实施例4、临床样本检测
临床实验检测针对EICU68岁男性患者,该患者主诉干咳,乏力10天伴发热,喘憋3天;传统培养结果阴性。
本实施例采集该患者下呼吸道肺泡灌洗液样本,4℃运输至实验室,通过实施例2-3的流程进行检测。
采用本申请流程进行定量检测与报告解读,检测结果如下表所示。结果表明,采用本申请流程,不仅能够实现临床样本宿主背景的有效去除,还在测序1h内实现了阳性病原感染的检出与报告。
最后应说明的是:以上各实施例仅用以说明本申请的技术方案,而非对其限制;尽管参照前述各实施例对本申请进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本申请各实施例技术方案的范围。
- 检测基因组多突变类型的方法
- 基因组分布分析:一种检测复杂生物样品中多种类型生物的存在的快速方法
- 用于从样品中的一种或多种类型的微生物的多样性群体中提取核酸分子的通用方法
