一种外泌体的分离提取方法
文献发布时间:2023-06-19 18:30:43
技术领域
本发明属于生物技术领域,具体涉及一种外泌体的分离提取方法。
背景技术
外泌体(Exosomes)是细胞所分泌的直径为30~150nm,密度在1.13~1.21g/mL的双层磷脂囊泡,通常情况下是以胞吐形式释放到细胞外环境。其表面含有和功能相关的蛋白质和脂质成分,其膜表面表达特异性的蛋白质如CD9、CD63、CD81、TSC101和HSP70等,内部包裹了供体来源的蛋白质、核酸等活性物质。当外泌体和靶细胞接触后,其携带的生物分子以胞吞的形式被接收,在靶细胞中释放出来并发挥作用。近年来,随着对外泌体研究的进一步加深,发现不同组织细胞来源的外泌体呈现组织细胞的特异性,能够携带来源细胞的生物活性蛋白质、脂质、核酸等;在机体生理和病理状态下,外泌体内含的物质会随着细胞环境的变化而发生变化,因此,外泌体诊断在临床应用中越来越被重视。
外泌体能够在细胞间穿梭,有利于细胞间物质和信息的交换,通过装载外来药物来改变受体细胞的功能和状态,实现靶向治疗的目的。外泌体作为装载的工具,能够携带各种类型的药物,到达体内的各个系统,在神经系统疾病中,药物很难通过血脑屏障进入到靶细胞发挥作用,而外泌体可以通过实现对疾病的治疗。
外泌体的提取主要有以下几种方式:(1)超速离心法,是目前的金标准方法,此种方法采用低速离心高速离心交替进行分离外泌体,纯度高,但综合产量不高;(2)密度梯度离心法,使外泌体聚集在特定的密度阶层,纯度高,综合产量较好,但操作繁琐;(3)超滤离心法,利用不同截留相对分子质量的超滤膜对样品进行分离,此方法比较粗糙,操作简单;(4)磁珠免疫法,用包被抗标记物的磁珠分离外泌体,这种方法特异性较高,标记物标记的抗体较难拿到,有严格的要求。现在虽然有不同的外泌体提取方法,但均无法解决规模化提取的问题,常用的超速离心法一次离心的液体量有限;超滤法可以上规模但纯度有限;凝胶柱可以达到纯化效果但一次上样量有限。这些提取方法各有优缺点,多数方法只能做到小批量提取,能够做到大规模提取的,目前还没有一种很有效的方法。
发明内容
本发明的目的是提供一种可实现大规模高纯度提取外泌体的方法,整个操作过程不需要离心机,操作过程简单,只经过一次超滤膜过滤,过一次凝胶、一次色谱柱就可实现大规模提取,且整个实验过程中没有使用化学性质强的试剂和剧烈的反应,过程温和没有造成对所提外泌体结构性质的影响,提取的外泌体结构完整、性质稳定,能够实现对各种外泌体的提取。
针对上述目的,本发明采用的外泌体的分离提取方法包括下述步骤组成:
1、将含外泌体的液体样品用孔径0.45nm的超滤膜进行过滤,收集滤液;
2、将步骤1收集的滤液穿过多聚赖氨酸修饰的阳离子树脂柱,再用洗脱液洗脱树脂柱,收集粗提的外泌体溶液;其中,所述多聚赖氨酸修饰的阳离子树脂是将含-COOH或-NH
3、将粗提的外泌体溶液穿过CD63-CNBr-Sepharose 4B层析柱或CD81-CNBr-Sepharose 4B层析柱或CD9-CNBr-Sepharose 4B层析柱,再用盐酸-甘氨酸洗脱层析柱,对外泌体进行进一步的精提;
4、将精提的外泌体溶液和PBS缓冲液等体积混合,然后用100KD孔径的超滤膜超滤,此过程重复3~5次,得到纯度95%以上的外泌体。
上述步骤1中,所述含外泌体的液体样品为牛奶、羊奶、人乳、细胞培养上清、尿液、血清中任意一种。
进一步优选,上述步骤2中,先用1.5~2倍柱体积的20mmol/L pH=7.35的PBS缓冲液平衡树脂柱,待电导及紫外吸收值稳定后,将步骤1收集的滤液进行上样,上样量为1.5~2个柱体积,上样速度为0.5~3mL/分钟,上样结束后静置5~10分钟,用1~2个柱体积的20mmol/L pH=7.35的PBS缓冲液再次平衡树脂柱;基线稳定后,用1个柱体积的洗脱液洗脱树脂柱,然后静置5~10分钟,继续用洗脱液洗脱树脂柱,收集粗提的外泌体溶液。
上述步骤2中,所述含-COOH的阳离子树脂为羧基化硅胶、羧基化琼脂糖、羧基化葡聚糖中任意一种;所述含-NH
上述步骤2中,所述多聚赖氨酸修饰的阳离子树脂是在缩合剂、添加剂的作用下,将含-COOH的阳离子树脂与多聚赖氨酸的-NH
上述两端均为-COOH的Linker为HOOC-CH
上述缩合剂为N,N'-二异丙基碳二亚胺、二环己基碳二亚胺中任意一种;所述添加剂为2-肟氰基乙酸乙酯、1-羟基苯并三唑、N-羟基琥珀酰亚胺中任意一种或多种。
上述步骤2中,所述尿素溶液、盐酸胍溶液、异硫氰酸胍溶液用PBS缓冲液配制或者纯水配制。
本发明的有益效果如下:
1、本发明将含有外泌体的液体样品溶液用孔径0.45nm的超滤膜进行过滤,收集滤液,所得滤液穿过多聚赖氨酸修饰的阳离子树脂柱,外泌体被多聚赖氨酸吸附,其他杂蛋白、脂类、盐从柱子穿过,通过尿素溶液、盐酸胍溶液、异硫氰酸胍溶液等洗脱液进行洗脱得到粗提的外泌体溶液;粗提的外泌体溶液再经过CD63/81/9-CNBr-Sepharose 4B层析柱,外泌体再次和层析柱结合,用盐酸-甘氨酸(HCl-Gly)缓冲液进行洗脱,根据峰形收集外泌体,这一步分离去除杂蛋白和凋亡小体,还可以除去所引入的尿素、盐酸胍、异硫氰酸胍等化学试剂对外泌体的影响,达到了对外泌体的精细提取;最后用100KD孔径的超滤膜超滤,除去盐酸-甘氨酸及部分小分子蛋白和水分,对精提的外泌体进行浓缩,获得纯度95%以上的外泌体。
2、本发明提取的外泌体包括牛奶、羊奶、人乳、细胞培养上清、尿液、血清等含外泌体的液体,提取方法无需超速离心,即可实现从培养上清和乳品中提取高纯度外泌体,整个提取过程操作简单,稳定,容易操作,提取的外泌体结构完整、纯度高、回收率高,并且不需要复杂的仪器就能完成外泌体的提取,是一种从微量提取到规模提取的全新方法。
附图说明
图1是实施例1中粗提的外泌体的颗粒粒径分布图片(NTA)。
图2是实施例1中粗提的外泌体的电镜验证图片(TEM)。
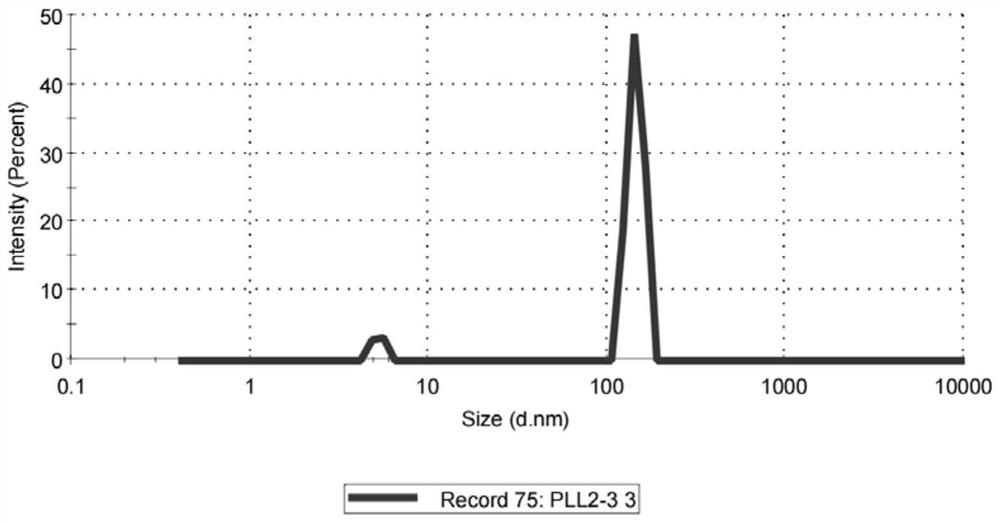
图3是实施例1中精提的外泌体的颗粒粒径分布图片(NTA)。
图4是实施例1中对提取的外泌体标志物CD63进行蛋白标志物进行验证(Westernblot)。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
以人脐带间充质干细胞中的外泌体提取为例
1、将第三代人脐带间充质干细胞的培养基离心去除杂质,分离出培养上清液,将50mL上清液用孔径0.45nm的超滤膜进行过滤,除去细胞及细胞碎片,收集滤液。
2、先用2倍柱体积的20mmol/L pH=7.35的PBS缓冲液平衡α-多聚赖氨酸修饰的硅胶柱,柱子的长度为10cm、内径为16mm,平衡速度2mL/分钟;待电导及紫外吸收值稳定后,将步骤1收集的滤液进行上样,上样量为50mL,上样速度为1mL/分钟,上样结束后静置5分钟,用1个柱体积的20mmol/L pH=7.35的PBS缓冲液再次平衡硅胶柱;基线稳定后,用1个柱体积的洗脱液洗脱硅胶柱,然后静置5分钟,继续用洗脱液洗脱硅胶柱,观测峰形图,大约在4~7min起峰时收集溶液,得到粗提的外泌体溶液。其中,α-多聚赖氨酸修饰的硅胶是将羧基化硅胶在N,N'-二异丙基碳二亚胺、1-羟基苯并三唑的作用下,α-多聚赖氨酸的-NH
3、先用2倍柱体积的平衡液(1000mL 50mmol/L Tris-HCl缓冲液加入29g NaCl配制而成)冲洗CD63-CNBr-Sepharose 4B层析柱(长度为10cm、内径为16mm),流速为2mL/分钟;待电导及紫外吸收值稳定后,将步骤2粗提的外泌体溶液进行上样,上样量为2个柱体积,上样速度为1mL/分钟,上样结束后静置15分钟,用1个柱体积的平衡液再次冲洗层析柱,流速为0.5mL/分钟;基线稳定后,用1个柱体积的pH=2.8的盐酸-甘氨酸(HCl-Gly)缓冲液(16.8mL 200mol/L HCl水溶液和50mL 200mol/L甘氨酸水溶液混合后加33.2mL去离子水配制而成)洗脱层析柱,流速为0.5mL/分钟,洗脱完后静置5分钟,继续用HCl-Gly缓冲液洗脱层析柱,观测峰形图,大约在4~7min起峰时收集溶液,得到精提的外泌体溶液,精提外泌体NTA检测结果见图3。由图3可见,精提的外泌体颗粒粒径分布在100~200nm之间。
4、将精提的外泌体溶液和20mmol/L pH=7.35的PBS缓冲液等体积混合,然后用100KD孔径的超滤膜超滤,除去尿素、盐酸-甘氨酸及部分小分子蛋白和水分,此过程重复3次,得到纯度95%以上的外泌体。采用Western blot验证所得外泌体的定性检测结果,由图4可见,条带清楚,可满足实验要求。
实施例2
本实施例的步骤2中,α-多聚赖氨酸修饰的硅胶是将氨基化硅胶在N,N'-二异丙基碳二亚胺、1-羟基苯并三唑的作用下,α-多聚赖氨酸的-COOH与氨基化硅胶的-NH
实施例3
本实施例的步骤2中,用ε-多聚赖氨酸修饰的硅胶柱替换实施例1中α-多聚赖氨酸修饰的硅胶柱,所述ε-多聚赖氨酸修饰的硅胶是将羧基化硅胶在N,N'-二异丙基碳二亚胺、1-羟基苯并三唑的作用下,ε-多聚赖氨酸的-NH
实施例4
本实施例的步骤2中,用ε-多聚赖氨酸修饰的硅胶柱替换实施例2中α-多聚赖氨酸修饰的硅胶柱,所述ε-多聚赖氨酸修饰的硅胶是在N,N'-二异丙基碳二亚胺、1-羟基苯并三唑的作用下,将ε-多聚赖氨酸的-COOH与氨基化硅胶的-NH
实施例5
本实施例的步骤2中,以HOOC-CH
实施例6
本实施例的步骤2中,以H
实施例7
本实施例的步骤2中,以HOOC-CH
实施例8
本实施例的步骤2中,以H
表1
由表1可见,洗脱液选择浓度为3~7mol/L尿素溶液时均可以获得较高的外泌体回收率,其中尿素浓度为5~6mol/L时外泌体回收率达到峰值。且对比实施例1~8的结果可见,实施例5中所采用的α-多聚赖氨酸修饰的硅胶柱相比较其他7个实施例,外泌体分离回收效果最好,在尿素浓度为6mol/L时回收率达到80%。
实施例9
本实施例的步骤2中,洗脱液选取0.5mol/L、1mol/L、3mol/L、4mol/L、5mol/L、6mol/L、7mol/L盐酸胍溶液和异硫氰酸胍溶液,其他步骤与实施例5相同,洗脱液中尿素浓度对外泌体回收率的影响见表2。
表2
由表2可见,盐酸胍和硫氰酸胍的浓度为3~7mol/L时均可以获得较高的外泌体回收率,其中盐酸胍浓度为5~6mol/L时外泌体回收率达到峰值。
实施例10
以鲜牛奶中的外泌体提取为例
1、将新鲜牛乳50mL用孔径0.45nm的超滤膜进行过滤,收集滤液。
2、先用2倍柱体积的20mmol/L pH=7.35的PBS缓冲液平衡α-多聚赖氨酸修饰的硅胶柱,柱子的内径为16mm、长度为10cm,平衡速度2mL/分钟;待电导及紫外吸收值稳定后,将步骤1收集的滤液进行上样,上样速度为0.5mL/分钟,上样结束后静置10分钟,用1个柱体积的20mmol/L pH=7.35的PBS缓冲液再次平衡硅胶柱;基线稳定后,用1个柱体积的洗脱液洗脱硅胶柱,然后静置5分钟,继续用洗脱液洗脱硅胶柱,观测峰形图,大约在4~7min起峰时收集溶液,得到粗提的外泌体溶液。其中,α-多聚赖氨酸修饰的硅胶与实施例5相同;所述洗脱液选取浓度为5mol/L尿素溶液,所选用的尿素溶液用20mmol/L pH=7.35的PBS缓冲液配制。
3、该步骤与实施例1步骤3相同。
4、该步骤与实施例1步骤4相同,得到纯度95%以上的牛奶外泌体,冻存即可。
- 用于血液外泌体采集的试管及外泌体分离方法
- 一种外泌体分离制备方法
- 一种高效形貌无损的外泌体分离方法
- 一种脐带间充质干细胞外泌体培养以及分离方法
- 外泌体的破坏方法、外泌体的破坏试剂盒及来自正常细胞的外泌体的分离方法
- 外泌体的破坏方法、外泌体的破坏试剂盒及来自正常细胞的外泌体的分离方法
