一种能够分泌N-酰基高丝氨酸内酯合成酶的LuxL重组工程菌的制备方法及其应用
文献发布时间:2023-06-19 18:30:43
技术领域
本发明涉及工程菌的基因改造领域,尤其涉及一种能够分泌N-酰基高丝氨酸内酯(AHL)合成酶的LuxL重组工程菌的制备方法及其应用。
背景技术
生物膜反应器(BR)是在反应器中添加各种填料以便微生物附着生长使在填料上形成了一层类似于膜的生物结构。在生物膜反应器中,在填料表面上附着微生物以及可溶性底物通过微生物层和膜的传质为生物膜生长创造了有利的生态位。生物膜在生物膜反应器(BR)中起着主导作用,它可以帮助最大限度地减少水中的有机物并处理废水,有助 于确保反应器的性能在长期运行中保持稳定。生物膜系统在废水处理中变得越来越普遍, 它们已被证明在环境和成本考虑方面都拥有巨大的优势。
然而,生物膜初始形成阶段所需的时间在各种类型的废水之间有很大差异,从几天到 几个月不等,长启动期一直以来是生物膜反应器面临的难题。为了实现生物膜反应器快速 挂膜,本发明研究了一种更有希望的益生菌策略,用于快速启动生物膜反应器,提高反应 器性能和稳健性。
群体感应(QS)系统是调控生物膜形成的核心机制。QS作为微生物的细胞间通 讯系统,通过统称为自诱导剂的信号分子来调节和监测种群密度的变化,这些信号分子在 环境中局部积累,然后在达到适当的阈值浓度后,与受体蛋白相互作用并触发QS相关基 因和性状的表达。据研究,生物膜形成与AHL信号分子介导的QS系统密切相关。通过 外源添加AHL(~μg/L水平)可以显著促进好氧污泥颗粒EPS分泌和生物膜形成。然而, 自然界中AHLs纯化提取工艺复杂、纯品获得难度大,导致外源添加AHLs经济成本高, 致使外源添加AHLs促进挂膜大规模应用不现实。本发明研究了一种更有希望的益生菌策 略,利用基因工程手段构建了一株高效表达LuxL合成酶的AHL强化工程菌,用于快速 促进生物膜挂膜,提高生物膜工艺的脱氮性能和稳健性。
发明内容
本发明的主要目的在于提供一种能够分泌N-酰基高丝氨酸内酯(AHL)合成酶的LuxL重组工程菌的制备方法及其促进生物膜形成的应用,该制备方法能够重组LuxL工程菌,重组后的LuxL工程菌对铜绿假单胞菌和生物反应器中污泥细菌的生物膜的生长具有显著促进作用。
为达到以上目的,本发明采用的技术方案为:一种LuxL重组工程菌的制备方法,所述LuxL重组工程菌能够分泌N-酰基高丝氨酸内酯合成酶,所述制备方法具体包括如下步骤:
S1:构建包含LuxL基因的大肠杆菌重组表达载体pET-LuxL;
S2:将大肠杆菌重组表达载体pET-LuxL转化到肠埃希氏菌,得到LuxL重组工程菌。
优选地,步骤S1具体包括如下步骤:
S11:将哈维弧菌接菌至LB培养基中培养一段时间;
S12:提取哈维弧菌的基因组作为扩增模板,对重组前的LuxL基因进行PCR扩增;
S13:对PCR扩增产物进行回收、纯化;
S14:用限制性内切酶BamH I、Hind III分别双酶切纯化后的PCR扩增产物和载 体pET-28a(+);
S15:将双酶切后的LuxL基因和pET-28a载体骨架连接,得到重组表达载体 pET-LuxL。
优选地,PCR引物序列如下,下划线表示酶切位点:
LuxL-F:CG
LuxL-R:CC
优选地,步骤S2具体包括如下步骤:
S21:取一定量的大肠杆菌感受态细胞冰上溶解,取一定量的重组表达载体 pET-LuxL加入大肠杆菌感受态细胞中轻轻混匀,冰上静置一定时间,然后水浴一段时间, 再立即冰上静置一段时间,然后加入一定量的无菌SOC培养基于培养箱振荡活化一段时 间;
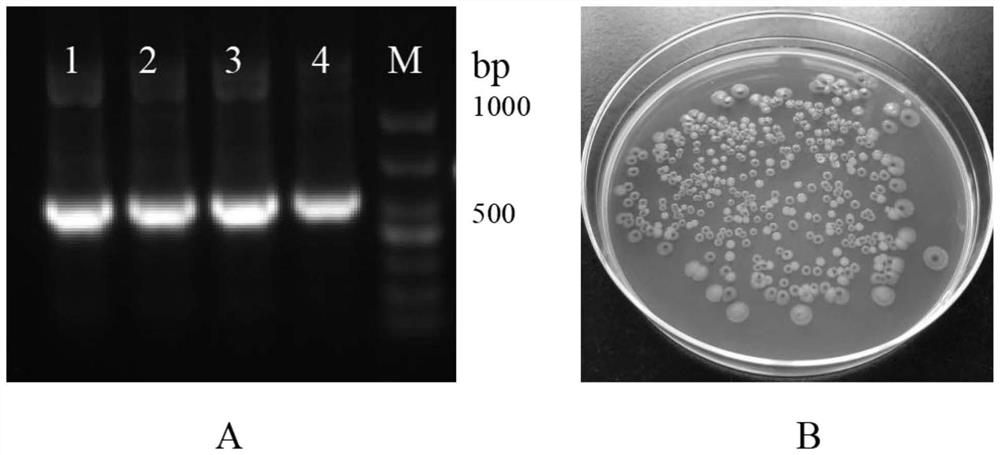
S22:取适量活化后的重组菌液涂布于含有X-Gal、Kan和IPTG的固体LB培养 基中培养一段时间,挑取阳性单克隆重组工程菌测序,测序正确的重组工程菌即为LuxL 重组工程菌,命名为pET-LuxL。
本发明还提供了一种N-酰基高丝氨酸内酯合成酶的制备方法,包括以下步骤:
S3:将得到的LuxL重组工程菌进行扩培,培养过程中采用IPTG诱导LB培养基;
具体包括如下步骤:
S31:将LuxL重组工程菌接种于IPTG诱导LB培养基增殖液体中培养,振摇培 养一段时间;
S32:通过离心超声破碎获得重组蛋白LuxL,即得到含N-酰基高丝氨酸内酯合成酶的粗蛋白。
优选地,所述制备方法还包括以下步骤:
S4:利用SDS-PAGE凝胶电泳对步骤S3得到的AHL合成酶LuxL进行电泳分析;
S41:取适量LuxL蛋白上清液,加入适量Laoding Buffer染液混匀,水浴沸腾5min,取10ul上样,蛋白Marker上样3ul,电泳条件为:120V,1h;
S42:电泳结束后使用考马斯亮蓝试剂染色观察。
本发明还提供了一种LuxL重组工程菌在促进污泥菌生物膜形成中的应用,其特征在于,所述LuxL重组工程菌采用上述制备方法制备的LuxL重组工程菌。
本发明具有以下有益效果:
本发明利用大肠杆菌重组了LuxL基因,构建了AHL-合成酶强化工程菌,构建的 重组工程菌能够过表达N-酰基高丝氨酸内酯(AHL)合成酶,N-酰基高丝氨酸内酯(AHL) 合成酶能够促进生物膜的形成,进而过表达得到更多的N-酰基高丝氨酸内酯(AHL)合 成酶能够更快速地促进生物膜的形成,缩短生物膜工艺的挂膜启动期。
附图说明
图1是本发明的LuxL基因扩增电泳分析图及转化BL21蓝白斑筛选;
图2是本发明的LuxL蛋白酶SDS凝胶电泳分析及LuxL蛋白三级结构图谱;
图3是对重组工程菌的AHL分泌活性验证图;
图4是重组工程菌对PAO1菌和污泥菌的生物膜形成促进情况对比图。
图5是重组工程菌对生物膜形成的促进效果对比图;
图6是重组工程菌促进生物膜反应器(BR)中的细菌生物膜的挂膜情况对比图。
具体实施方式
以下描述用于揭露本发明以使本领域技术人员能够实现本发明。以下描述中的优选实施例只作为举例,本领域技术人员可以想到其他显而易见的变型。
实施例一
一种LuxL重组工程菌的制备方法,所述LuxL重组工程菌能够分泌N-酰基高丝氨酸内酯(AHL)合成酶,所述制备方法具体包括如下步骤:
S1:构建包含LuxL基因的大肠杆菌重组表达载体pET-LuxL,重组前的LuxL基因 从NCBI GenBank中获取,参考序列号为ID:L13940.1;
S2:将大肠杆菌重组表达载体pET-LuxL转化大肠埃希氏菌得到LuxL重组工程菌。
步骤S1具体又包括如下步骤:
S11:将哈维弧菌接菌至LB培养基中,30℃培养12h;
S12:提取哈维弧菌的基因组作为扩增模板,对重组前的LuxL基因进行PCR扩增;
S13:对PCR扩增产物进行回收、纯化;
S14:用限制性内切酶BamH I、Hind III分别双酶切纯化后的PCR扩增产物和载 体pET-28a(+);
S15:将双酶切后的LuxL基因和pET-28a载体骨架连接,得到重组表达载体 pET-LuxL。
PCR引物序列如下,下划线表示酶切位点:
LuxL-F:CG
LuxL-R:CC
如图1A所示,经PCR扩增后在1%琼脂糖凝胶电泳上观察到580bp处有清晰可 见的亮带,即为LuxL目的基因扩增条带,经NCBI在线BLAST对比分析与已知的LuxL 基因同源性高达100%。
LuxI扩增基因的测序序列为:
ATGAAATTAATGTTGTCATTAGGCTCGCTGTCGGCTAACAGTTTGCCTATCGA AAAAAAACAGCAAGTGCTGATCGATCTTGTGATCCGCACTTATCAGTCACACGAGC GAACGGAGCTTTTTAAGGCAATTACGGAATATCGTAAAAACCAACTGATCGCTCTCT TTCCTGAACATGCTAACAAAAGCTATTCCATTATCTTTGAGCTGATGGACTATCGTGA CCTTATTGAACGATATCCTAGCACCCTGTCCGAAGAAGCTACTTTGCTTGAAAAAGT CGTTGGTCAGTGCTTTATGCATTGGTTGGACTTCTGGTGTGAGTGCGAGATTGCCGCT ATTAAAGCGAAGTTTCCGTTGAAGGAAAACGAACTACCAGCTCCACAACTTCTCTTT GAAGACAGTGCTTACTATGGTGCTCTAGTTGAGCGAGTAGAAGACACTCAACTTATG GTACAAATCCCAAGCCACCCGCAGGCAATGCCACTTAGTGATGCGATCACGT
步骤S2具体包括如下步骤:
步骤S21:取100ul大肠杆菌感受态细胞(DE3)冰上溶解,取10ul重组表达载体pET-LuxL加入DE3中轻轻混匀,冰上静置30min,然后42℃水浴90s,再立即冰上静置3min,然后加入800ul无菌SOC培养基于37℃培养箱振荡活化1h;
步骤S22:取适量活化后的重组菌液涂布于含有X-Gal(20mg·mL
实施例二
该实施例是采用实施例一种的LuxL重组工程菌分泌N-酰基高丝氨酸内酯(AHL)合成酶,采用以下步骤:
S3:将得到的LuxL重组工程菌进行扩培,培养过程中采用IPTG诱导LB培养基, 一方面能够实现LuxL重组工程菌的扩培,另一方面在LuxL重组工程菌生长的过程中过 表达N-酰基高丝氨酸内酯合成酶,以分泌更多AHL信号分子。
步骤S3具体包括如下步骤:
S31:将LuxL重组工程菌接种于0.1mM IPTG诱导LB培养基增殖液体中培养, 温度为37℃,220rpm振摇培养过夜;
S32:通过离心超声破碎获得重组蛋白LuxL,即得到含N-酰基高丝氨酸内酯(AHL)合成酶的粗蛋白。具体地,超声破碎菌体,每次4s,间歇10s,功率40~50%,持续50min 至澄清。
所述制备方法还包括以下步骤:
S4:利用SDS-PAGE凝胶电泳对步骤S32得到的AHL合成酶LuxL进行电泳分析, 具体包括如下步骤:
S41:取适量LuxL粗蛋白上清液,加入适量Laoding Buffer混匀,水浴沸腾5min,取10ul上样,蛋白Marker(10-180KDa)上样3ul,电泳条件为:电压120V,时间1h。
S42:电泳结束后使用考马斯亮蓝试剂染色2h,脱色后观察目的条带。
LuxI蛋白酶的氨基酸分子量约20KDa,序列如下:
MKLMLSLGSLSANSLPIEKKQQVLIDLVIRTYQSHERTELFKAITEYRKNQLIAL FPEHANKSYSIIFELMDYRDLIERYPSTLSEEATLLEKVVGQCFMHWLDFWCECEIAAIK AKFPLKENELPAPQLLFEDSAYYGALVERVEDTQLMVQIPSHPQQCHLVMRSR。
利用SDS-PAGE蛋白电泳以蛋白标准Marker为参照,对全蛋白表达量进行定量。 如图2A所示,分别对含pET-28a、pET-LuxL载体重组菌进行SDS-PAGE凝胶电泳分析, 将得到的泳道1(pET-LuxL)和泳道2(pET-28a)进行对比并结合蛋白标准Marker分析 得到泳道1箭头所指位置为目的蛋白条带,在20KDa大小处观察到明显的粗带,蛋白电 泳结果符合预期;图2B所示为通过SWISS-MODEL在线软件构建的LuxI蛋白的三级结 构图。
实施例三
该实施例用于对实施例一中得到的LuxL重组工程菌的活性进行验证。
如图3所示,实验分为2组,采用含X-Gal的Agrobacterium tumefaciens A136菌液作为检测AHLs的指示菌,将含有X-Gal(10mg/ml)的根癌农杆菌液(OD
第1组取500ul过夜培养的转化pET-28a空白质粒的大肠杆菌液重组工程菌液(OD
第2组取500ul过夜培养的LuxL工程菌液(OD
每组设置三个重复,每孔液体总体积为1ml,28℃反应2h并观察离心管中菌液颜色变化。
A.tumefaciens菌用于AHL信号分子的检测。AHL在这里作为信号分子,诱导在A136菌中的β-半乳糖苷酶基因表达,当β-半乳糖苷酶酶作用于其底物X-Gal时,它会 产生绿色,进而判断环境中AHL信号分子的存在。从图中对比分析可以看出,在仅含有 pET-28a质粒的E.coli菌的孔观察到其颜色从浅黄色变为较浅的蓝绿色;仅含有pET-28a 质粒的E.coli菌作为革兰氏阴性菌本身产生少量AHL,导致孔中液体呈现较浅的蓝色; 而经过改造后含有pET-LuxL质粒的E.coli工程菌拥有了强化的AHL分泌活性,使其周围 的AHL浓度提高,液体迅速从浅黄色变为较深的蓝绿色;如图3对比观察可以看出,重 组工程菌能拥有更强的AHL分泌能力,说明LuxL基因在重组工程菌中具有高效的AHL 产生活性。
实施例四
该实施例用于对不同浓度下LuxL重组工程菌对铜绿假单胞菌以及污泥菌生物膜形成量的影响。
在96微孔板中通过结晶紫染色法测定了不同细胞比例(1:1、1:2、1:3)的LuxL 重组工程菌对铜绿假单胞菌以及污泥菌生物膜形成量(Biofilm formation index,BFI)的影响。如图4所示,与PAO1纯培养(PAO1菌)和添加转化pET-28a空载的大肠杆菌(E.coli 菌)对照相比,添加LuxL重组工程菌(LuxL工程菌)显著促进了PAO1生物膜形成64%~68% (P<0.05);从图5可以观察到,生物膜形成的促进效果在污泥菌生物膜形成中更为明显 88%~126%(P<0.05)。此外,研究发现随着QS-AHL工程菌的不断加入并不会显著促进PAO1生物膜形成,这种现象在污泥菌生物膜形成实验组中也存在,说明QS-AHL工程菌 或AHL的浓度与生物膜形成并没有线性关系。总体而言,LuxL重组工程菌株显著促进了 细菌生物膜形成。
通过在250ml锥形瓶中模拟生物膜反应器生长条件测定了不同细胞比例(1:1、 1:3)的LuxL工程菌株对生物膜反应器中好氧活性污泥细菌生物膜附着挂膜的影响。如图 6所示,与原始污泥细菌组(A)和添加转化pET-28a空载的大肠杆菌(B)对照组相比, 添加LuxL工程菌株组(C、D)观察到明显的生物膜生物量附着在瓶壁上,总体而言,LuxL 工程菌对生物膜反应器中好氧活性污泥细菌生物膜附着观察到显著的促进效果。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明的范围内。本发明要求的保护范围由所附的权利要求书及其等同物界定。
- 一种N-酰基高丝氨酸内酯淬灭菌及其在病害防控中的应用
- 含苯基脲取代的N-硫代酰基高丝氨酸内酯类化合物、其制备方法及应用
- 含苯环类取代的N-酰基高丝氨酸内酯类化合物、其制备方法及应用
