培养物的制造方法和细胞回收方法
文献发布时间:2023-06-19 18:32:25
技术领域
本公开涉及培养物的制造方法、细胞回收方法、试剂盒和含细胞组合物。
背景技术
细胞培养大致分为:平板培养,在平板状的培养载体上使黏附细胞生长为单层;以及,悬浮培养,使黏附细胞黏附于主要为粒子状的培养载体的表面,形成黏附细胞与培养载体的复合体,以悬浮于培养体系的状态进行细胞培养。
在悬浮培养中,培养载体作为细胞增殖的支架发挥功能而高效地增加细胞,在细胞培养后,使用酶、螯合剂等将细胞从培养载体剥离并回收。作为能够用于悬浮培养的培养载体,有可溶性的培养载体和不溶性的培养载体,在使用可溶性的培养载体的情况下,在细胞培养后使培养载体溶解,通过过滤器等仅回收细胞。在细胞的大量培养中,优选使用这样的悬浮培养。已对可溶性培养载体建立起与其构成成分相应的溶解手段,能够按照方案在细胞培养后使其良好地溶解。
例如,在日本特表2016-523086号公报中公开了一种细胞培养物品,其包含含有果胶酸等聚半乳糖醛酸化合物的基质和位于基质表面的粘接性聚合物,提出了通过使用果胶酶和螯合剂使培养载体溶解而容易地采集细胞的方案。
发明内容
发明所要解决的技术问题
将使用培养载体大量得到的细胞例如作为细胞制剂利用时,要求尽可能除去细胞以外的夹杂物。但是,可溶性培养载体在按照已建立的方案使其良好地溶解时,在细胞悬液中产生溶解残留物。溶解残留物大多与细胞的大小相等或比细胞的大小更小,因此即使想要从细胞悬液中仅回收细胞,也难以完全避免溶解残留物的混入。
本公开提供杂质的混入少、黏附细胞的纯度高的培养物的制造方法和细胞回收方法、适于这些方法的试剂盒、以及黏附细胞的纯度高的含细胞组合物。
用于解决技术问题的手段
本公开的各实施方式如下所述。
[1]一种培养物的制造方法,其包括:使黏附细胞与比所述黏附细胞的大小更大的可溶性培养载体接触,将所述黏附细胞配置于所述可溶性培养载体的表面;将配置于所述可溶性培养载体的表面的所述黏附细胞在培养基中进行悬浮培养;为了使所述悬浮培养中的所述黏附细胞从所述可溶性培养载体的表面脱离,对所述可溶性培养载体进行将表面的至少一部分改性的改性处理;以及,在所述改性处理之后,基于大小差异,从比所述黏附细胞的大小更大的改性处理后可溶性培养载体上分离并回收所述黏附细胞。
[2]根据[1]所述的培养物的制造方法,其中,所述可溶性培养载体包含多糖类、蛋白质、或它们的组合。
[3]根据[1]或[2]所述的培养物的制造方法,其中,所述可溶性培养载体包含选自葡聚糖(Dextran)、纤维素、胶原、明胶、聚半乳糖醛酸、海藻酸、及它们的衍生物中的至少1种。
[4]根据[1]至[3]中任一项所述的培养物的制造方法,其中,所述可溶性培养载体为多孔性。
[5]根据[1]至[4]中任一项所述的培养物的制造方法,其中,所述改性处理包括:利用表面改性剂对所述可溶性培养载体进行改性。
[6]根据[1]~[5]中任一项所述的培养物的制造方法,其中,使用分离装置将所述黏附细胞与所述改性处理后可溶性培养载体分离。
[7]根据[6]所述的培养物的方法,其中,所述分离装置具有20~50μm的孔径。
[8]根据[1]~[7]中任一项所述的培养物的制造方法,其中,所述改性处理后可溶性培养载体的大小为:最小直径超过50μm。
[9]一种细胞回收方法,其包括:准备包含细胞复合体的细胞悬液,所述细胞复合体含有黏附细胞和比所述黏附细胞的大小更大的可溶性培养载体、且是所述黏附细胞被配置于所述可溶性培养载体的表面而成的;为了使所述黏附细胞从所述可溶性培养载体的表面脱离,对所述细胞悬液中的所述细胞复合体进行将所述可溶性培养载体的表面的至少一部分改性的改性处理;以及,基于大小差异,从比所述黏附细胞的大小更大的改性处理后可溶性培养载体上分离并回收所述细胞悬液中的所述黏附细胞。
[10]一种试剂盒,其包含可溶性细胞培养载体和使用说明书,所述使用说明书记载了在[1]~[8]中任一项所述的培养物的制造方法或[9]所述的细胞回收方法中使用所述可溶性细胞培养载体的内容。
[11]一种试剂盒,其包含:表面改性剂,其用于对可溶性细胞培养载体进行改性处理;和,使用说明书,其记载了在[1]~[8]中任一项所述的培养物的制造方法或[9]所述的细胞回收方法中使用所述表面改性剂的内容。
[12]一种含细胞组合物,其含有黏附细胞,并且,具有20μm以下的大小的可溶性培养载体的溶解残留物的含有率相对于每1×10
[13]可溶性细胞培养载体在[1]~[8]中任一项所述的培养物的制造方法、[9]所述的细胞回收方法、或[10]所述的试剂盒中的用途。
[14]用于对可溶性细胞培养载体进行改性处理的表面改性剂在[1]~[8]中任一项所述的培养物的制造方法、[9]所述的细胞回收方法、或[10]所述的试剂盒中的用途。
发明效果
根据本公开,能够提供杂质的混入少、黏附细胞的纯度高的培养物的制造方法和细胞回收方法、适于这些方法的试剂盒、以及黏附细胞的纯度高的含细胞组合物。
附图说明
图1是实施例和比较例中制作的细胞悬液的改性处理后的1个视野的相位差显微镜图像。
图2是比较例中制作的细胞悬液的改性处理和移液后的1个视野的相位差显微镜图像。
具体实施方式
本说明书中,使用“~”表示的数值范围表示包含“~”前后记载的数值分别作为最小值和最大值的范围。在本说明书中阶段性地记载的数值范围中,某阶段性数值范围的上限值或下限值可以与其他阶段性数值范围的上限值或下限值任意组合。在本说明书所记载的数值范围中,该数值范围的上限值或下限值可以置换为实施例所示的值。本说明书中,在组合物中存在多种相当于各成分的物质的情况下,只要没有特别说明,则组合物中的各成分的含量是指存在于组合物中的该多种物质的合计量。在本说明书中,“工序”这一术语不仅包含独立的工序,即使在无法与其他工序明确区别的情况下,只要能够实现该工序的所期望的作用,则也包含在本术语中。只要没有特别说明,要素表示单个或多个要素。
以下,对本公开的实施方式进行说明。本发明并不限定于以下的实施方式中的例示。以下说明中的术语及表述并不受后述的实施例的具体例限定。
[培养物的制造方法]
本公开的实施方式的培养物的制造方法可以包括:使黏附细胞与比黏附细胞的大小更大的可溶性培养载体接触,将黏附细胞配置于可溶性培养载体的表面;将配置于可溶性培养载体的表面的黏附细胞在培养基中进行悬浮培养;为了使悬浮培养中的黏附细胞从可溶性培养载体的表面脱离,对可溶性培养载体进行将表面的至少一部分改性的改性处理;以及,在改性处理之后,基于大小差异从比黏附细胞的大小更大的改性处理后可溶性培养载体上分离并回收黏附细胞。
根据该培养物的制造方法,能够得到杂质的混入少、黏附细胞的纯度高的培养物。即,根据本培养物的制造方法,为了使黏附细胞从表面具有黏附细胞的可溶性培养载体脱离,不使可溶性培养载体整体溶解,而进行将表面的至少一部分改性的改性处理。在黏附细胞以可溶性培养载体的表面作为黏附的支架时,认为改性处理使黏附细胞失去黏附的支架,从培养载体的表面脱离,但并不受该理论约束。另外,改性处理停留在对可溶性培养载体的表面进行改性,因此不会产生将可溶性培养载体整体溶解时产生的大量的溶解残留物,且改性处理后得到的“改性处理后可溶性培养载体”的大小不会小于黏附细胞的大小。其结果,能够基于黏附细胞与改性处理后可溶性培养载体的大小差异,从改性处理后可溶性培养载体上高精度且简便地分离、回收黏附细胞。
优选得到的培养物中含有黏附细胞,不含可溶性培养载体,来自可溶性培养载体的残留物的含有率极低。更详细而言,优选在得到的培养物中可溶性培养载体溶解时产生的溶解残留等残留物、即与细胞的大小同等或比其小的残留物的含有率极低。
在以下的说明中,细胞复合体是指:含有黏附细胞和可溶性培养载体、且黏附细胞被配置于可溶性培养载体的表面而成的材料。细胞悬液是指含有黏附细胞的液体。
培养物的制造方法可以包括:使黏附细胞与大于黏附细胞的大小的可溶性培养载体接触,使黏附细胞配置于可溶性培养载体的表面。
黏附细胞可以是能够担载于可溶性培养载体的表面、且在配置于可溶性培养载体的表面的状态下能够促进细胞的生长的细胞。黏附细胞可以与水性介质一起构成细胞悬液。作为构成细胞悬液的水性介质,可以为培养基、生理盐水、磷酸缓冲液等。
细胞优选为源自动物的细胞,更优选为源自哺乳动物的细胞。作为哺乳动物,可列举例如:人、猴子、黑猩猩、牛、猪、马、绵羊、山羊、兔、大鼠、小鼠、豚鼠、狗、猫等。细胞来源的组织没有特别限定,例如可以是皮肤、肝脏、肾脏、肌肉、骨、血管、血液、神经组织等。细胞可以是原代培养细胞、培养细胞株、重组培养细胞株等。
作为干细胞,例如可举出间充质干细胞、造血干细胞、神经干细胞、骨髓干细胞、生殖干细胞、牙髓干细胞等成体干细胞等,优选为间充质干细胞。间充质干细胞广义上是指存在于个体的各种组织中,能够分化为成骨细胞、软骨细胞和脂肪细胞等间充质细胞中的全部或几种的成体干细胞。作为间充质干细胞,可列举源自骨髓的间充质干细胞、源自脐带的间充质干细胞、源自脂肪组织的间充质干细胞等。
作为干细胞,例如可以使用人工多能干细胞(iPS细胞)、胚胎干细胞(ES细胞)、胚胎生殖干细胞(EG细胞)、多能生殖干细胞(mGS细胞)、胚胎癌细胞(EC细胞)、Muse细胞等多能干细胞。
作为细胞,例如可以是内皮细胞、表皮细胞、上皮细胞、心肌细胞、成肌细胞、神经细胞、骨细胞、成骨细胞、成纤维细胞、脂肪细胞、肝细胞、肾细胞、胰细胞、肾上腺细胞、牙周膜细胞、牙龈细胞、骨膜细胞、皮肤细胞、树突状细胞、巨噬细胞、淋巴细胞等分化后的细胞;处于从干细胞向这些分化后的细胞的前阶段的前体细胞等。
上述细胞可以单独使用1种或组合使用2种以上。
可溶性培养载体是指由能够通过酶、热等手段分解的材料构成的培养载体。可溶性培养载体能够在表面担载黏附细胞,在表面配置黏附细胞,能够形成包含可溶性培养载体和黏附细胞的细胞复合体。另外,可溶性培养载体优选为通过改性处理而表面被改性、从而担载黏附细胞的作用减弱的载体。
可溶性培养载体只要能够将其表面用作黏附细胞增殖的支架,就可以没有特别限制地使用。可溶性培养载体例如可以包含多糖类、蛋白质、多肽、或它们的组合,优选包含多糖类、蛋白质、或它们的组合,更优选包含多糖类。可溶性培养载体可以是天然高分子和合成高分子中的任一种。
作为多糖类,例如可列举出果胶、果胶酸等聚半乳糖醛酸;海藻酸、纤维素、葡聚糖、琼脂糖、壳聚糖、糖胺聚糖等;它们的衍生物等。它们可以具有交联结构,例如可以举出交联纤维素、交联葡聚糖、交联琼脂糖、交联壳聚糖等。其中,优选聚半乳糖醛酸、聚半乳糖醛酸酯、海藻酸、海藻酸酯、纤维素、交联纤维素、葡聚糖、交联葡聚糖、或它们的组合。
作为蛋白质,例如可以举出胶原、明胶等。
可溶性培养载体优选包含选自由葡聚糖、纤维素、胶原、明胶、聚半乳糖醛酸、海藻酸、及它们的衍生物组成的组中的至少1种。纤维素及葡聚糖分别可以为交联或非交联。其中,优选包含葡聚糖、交联葡聚糖、或它们的组合,更优选包含交联葡聚糖。
为了提高与黏附细胞的担载性(黏附性),可以在可溶性培养载体的表面导入阳离子性官能团。作为阳离子性官能团,例如可列举出具有取代基的氨基、伯氨基、季铵基等。作为具有取代基的氨基,例如可以举出具有碳原子数1~10、优选碳原子数1~4的烷基的氨基等,可以是单烷基氨基和二烷基氨基中的任一种,具体而言,可以举出甲基氨基、二甲基氨基、乙基氨基、二乙基氨基、甲基乙基氨基、丙基氨基、二丙基氨基、丁基氨基、二丁基氨基等。阳离子性官能团可以是具有取代或未取代的氨基的官能团,例如可以举出氨基烷基等,具体而言,可以举出氨基乙基、氨基丙基、甲基氨基乙基、二甲基氨基乙基、乙基氨基乙基、二乙基氨基乙基等。这些阳离子性官能团可以在可溶性培养载体的表面单独导入或组合2种以上而导入。
另外,从促进黏附细胞的担载性的观点出发,可以在可溶性培养载体的表面配置细胞黏附性聚合物,构成可溶性培养载体的表面的一部分或全部。作为细胞黏附性聚合物,可列举例如:胶原、明胶、海藻酸或其盐、Matrigel(商标)基质胶(BD Biosciences公司)、透明质酸、层粘连蛋白、纤连蛋白、玻连蛋白、弹性蛋白、硫酸乙酰肝素、葡聚糖、硫酸葡聚糖、硫酸软骨素等。其中,优选胶原、明胶、层粘连蛋白、纤连蛋白、玻连蛋白等细胞黏附性多肽。
作为可溶性培养载体的具体例,可举出具有二烷基氨基的葡聚糖或交联葡聚糖、覆盖有胶原或改性胶原的葡聚糖或交联葡聚糖等。
作为可溶性培养载体的形状,没有特别限定,只要能够担载黏附细胞即可,例如可举出球状、扁平状、圆柱状、板条、棱柱状等。可溶性培养载体优选包含球状可溶性培养载体。
可溶性培养载体可以是在表面、内部或这两者中具有细孔的多孔性培养载体,也可以是在内部或内部和表面这两者中不具有细孔的实心的培养载体。通过使用多孔性培养载体作为可溶性培养载体,能够增大可溶性培养载体的表面积,增加担载于可溶性培养载体的表面的黏附细胞的数量。
作为本实施方式的可溶性培养载体,例如可以举出Cytiva公司的Cytodex(注册商标,以下省略)系列、Cytopore系列、Sephadex(注册商标,以下省略)系列等。
可溶性培养载体可以具有比黏附细胞大的大小(尺寸)。可溶性培养载体的大小大于黏附细胞例如可以通过使含有黏附细胞和可溶性培养载体的细胞悬液通过具有规定孔径的过滤器来确认。该确认中可使用的过滤器的孔径只要是大于黏附细胞的大小且小于可溶性培养载体的范围即可。
更具体而言,黏附细胞的大小根据黏附细胞的种类而不同,例如可以为1~50μm、10~30μm、10~20μm、或10~18μm。另外,黏附细胞例如可以是孔径为10μm以上且能够通过50μm以下、30μm以下、20μm以下或18μm以下的过滤器的大小。
在改性处理前,可溶性培养载体的平均粒径(D50)例如可以为40~1000μm、50~500μm、100~250μm、或100~200μm。在该范围内,在改性处理前可溶性培养载体的大小大于黏附细胞的大小,能够在可溶性培养载体的表面担载多个黏附细胞,能够有助于促进细胞的增殖。另外,在该范围内,通过在改性处理前使可溶性培养载体的大小大于黏附细胞的大小,从而在改性处理后也容易维持可溶性培养载体的大小大于黏附细胞的大小的状态,能够基于细胞的大小从改性处理后可溶性培养载体上简便地分离黏附细胞。
本公开中,可溶性培养载体的平均粒径设为作为生理盐水或培养基中的体积基准的中值粒径(D50)而测定的值。可溶性培养载体的平均粒径可以利用激光衍射散射式的粒径分布测定装置进行测定。但是,在可溶性培养载体为市售品的情况下,可以参照产品所附带的产品信息。
在改性处理之前,可溶性培养载体的大小优选最小直径超过50μm。在改性处理之前,可溶性培养载体的大小的最小直径例如可以为超过50μm、80μm以上、100μm以上、150μm以上或170μm以上。通过使改性处理前的可溶性培养载体的大小为该范围,容易维持改性处理后的改性处理后可溶性培养载体与黏附细胞的尺寸差异,由此,能够容易地从改性处理后可溶性培养载体分离及回收黏附细胞。
本公开中,可溶性培养载体的最小直径可以是指通过以下的测定方法得到的值或D5的值。可溶性培养载体的最小直径可以在多个部位例如5个视野进行利用相位差显微镜的观察,参照显微镜附带的量具或标尺来确认。此时,可以对可溶性培养载体进行荧光着色。另外,可溶性培养载体的最小直径可以简易地使用具有50μm的孔径的过滤器来确认。本公开中,可溶性培养载体的D5是测定生理盐水或培养基中的体积基准的粒度分布,从粒径小的一侧起的体积的累积达到5%时的粒径。可溶性培养载体的粒度分布可以利用激光衍射散射式的粒径分布测定装置进行测定。但是,在可溶性培养载体为市售品的情况下,可以参照产品所附带的产品信息。
可溶性培养载体的平均粒径(D50)、D5、最小直径可以在改性处理的前后以同样的步骤求出。
作为使黏附细胞与可溶性培养载体接触的方法,例如可列举出:在培养开始前、开始时或培养开始后,向细胞培养容器内的培养基等中投入可溶性培养载体和黏附细胞。对于投入的顺序没有特别限制。投入到介质中的可溶性培养载体和黏附细胞的量没有特别限制,根据细胞培养的规模、设备等适当选择即可。
培养物的制造方法可以包括将配置于可溶性培养载体的表面的黏附细胞在培养基中进行悬浮培养。
配置于可溶性培养载体的表面的黏附细胞可以直接使用使上述黏附细胞与可溶性培养载体在培养基中接触而得到的物质。即,在培养基中投入黏附细胞和可溶性培养载体的情况下,可以从该状态开始悬浮培养,也可以将使上述黏附细胞和可溶性培养载体在缓冲液等培养基以外的介质中接触而得到的物质与培养基混合,开始悬浮培养。
在培养容器内,黏附细胞随着悬浮培养的时间推移而进行增殖,形成作为黏附细胞与可溶性培养载体的复合体的细胞复合体,黏附细胞在该细胞复合体的可溶性培养载体上增殖。需要说明的是,在细胞悬液中,不仅可以包含细胞复合体,还可以包含通过多个细胞聚集而形成的细胞块(聚集体)、细胞未黏附的培养载体等。作为细胞未黏附的培养载体,有在悬浮培养期间追加投入的追加可溶性培养载体等。
培养开始时的黏附细胞的接种密度根据细胞的种类、培养条件等而不同,例如可以为5×10
用于培养黏附细胞的培养基优选含有无机盐、氨基酸、糖和水。培养基可以进一步含有血清、维生素、激素、抗生素、生长因子、黏附因子等任意成分。作为培养基,可以使用作为细胞培养用的基础培养基而已知的培养基。即,作为培养基,只要是已知用于培养所选择的细胞的培养基,就可以没有特别限制地使用。
作为培养基,并不限定于此,例如可举出DMEM(Dulbecco’s改良Eagle培养基)、MEM(Eagle最小必需培养基)、αMEM培养基(Eagle最小必需培养基α改良型)、GMEM(Glasgow最小必需培养基)、IMDM(Iscove's改良Dulbecco’s培养基)、Ham’s F12(营养混合物F-12ham)、RPMI-1640(RPMI-1640培养基)、McCoy’s 5A(McCoy’s 5A培养基)、MSC生长培养基2型(Promocell公司)、Prime XV XSFM(Irvine Scientific公司)等。它们可以单独使用或组合2种以上使用。
在培养基中添加血清的情况下,例如可以使用胎牛血清(FBS)、马血清、人血清等血清等。
培养中使用的培养基可以不含异源成分。不含异源成分的培养基可以代替来自动物的血清而包含血清的代替添加物(例如血清替代物(Knockout Serum Replacement;KSR)(Invitrogen公司)、Chemically-defined Lipid concentrated(Gibco公司)、Glutamax(Gibco公司))等。
此外,可以使用Essential 8(Thermo Fisher公司)、mTeSR1(STEMCELLTechnologies公司)、Stem Fit系列(Takara Bio株式会社)、StemFlex(Thermo FisherScientific公司)等无血清培养基。
培养基中可以根据需要添加添加剂。作为添加剂,可列举例如:维生素A、维生素B1、维生素B2、维生素B6、维生素B12、维生素C、维生素D等维生素;叶酸等辅酶;甘氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、异亮氨酸、亮氨酸等氨基酸;乳酸等作为碳源的糖或有机酸;EGF、FGF、PFGF、TGF-β等生长因子;IL-1、IL-6等白细胞介素;TNF-α、TNF-β、瘦素等细胞因子;转铁蛋白等金属转运蛋白;铁离子、硒离子、锌离子等金属离子;β-巯基乙醇、谷胱甘肽等SH试剂;白蛋白等蛋白质等。
细胞培养方法没有特别限定,使用适合于各细胞的方法即可。细胞培养的温度为细胞悬液的温度,例如可以为20~45℃、或30~40℃的范围内,优选为36~37℃。细胞培养的pH为细胞悬液的pH,例如可以在6.2~7.7的范围内,优选为7.4。细胞培养的CO
悬浮培养可以是连续或间歇地进行搅拌、振荡等摇动的动态悬浮培养、或不伴有摇动的静态悬浮培养。适合于摇动的培养容器没有特别限定,例如可列举出烧瓶、生物反应器、罐、培养袋等。摇动的方法没有特别限定,可以应用与所选择的培养容器相应的方法。作为摇动方法,例如可列举出搅拌、振荡、倾斜、或它们的组合等。
在悬浮培养的中途,可以根据需要适当地进行培养基的更换。关于培养基的更换,可以全部更换,也可以更换培养基的一部分,例如一半量。悬浮培养可以根据黏附细胞的增殖状态适当地追加培养基而使细胞悬液的体积增加,实现培养的规模扩大。作为培养的规模扩大,例如可举出以0.3L以上、2L以上、4L以上、10L以上的方式依次扩大的方式,但并不限定于该方式。
培养物的制造方法可以包括:为了使悬浮培养中的黏附细胞从可溶性培养载体的表面脱离,对可溶性培养载体进行将表面的至少一部分改性的改性处理。
在改性处理中,表面具有黏附细胞的可溶性培养载体的表面的至少一部分被改性即可,也可以使可溶性培养载体的整个表面被改性。由此,可溶性培养载体的担载黏附细胞的能力降低,黏附细胞能够从培养载体的表面脱离。
改性处理只要是改变可溶性培养载体的表面的性状、例如损害作为细胞的支架的功能而使黏附细胞能够脱离的处理即可,可以根据可溶性培养载体的种类、大小、形状等适当选择。改性处理可以通过温度变化等来进行,也可以使用表面改性剂来进行。
在可溶性培养载体由温度敏感性的材料构成的情况下,通过将温度改变至能够改变作为细胞支架的性状的程度,则能够使黏附细胞脱离。温度的调整可根据构成可溶性培养载体的材料而适当选择。
作为表面改性剂,可以是能够对可溶性培养载体的表面的作为细胞的支架的性状进行改性的成分。通过使用这样的表面改性剂,例如可溶性培养载体的表面被表面改性剂改性至不会大幅损害可溶性培养载体的大小、且损害可溶性培养载体的表面的作为支架的功能的程度。由此,能够使黏附细胞容易从可溶性培养载体的表面脱离。
该改性处理后可溶性培养载体的大小大于黏附细胞的大小,从能够使用过滤器等分离装置进行分离的观点出发,可以为黏附细胞的大小的1.5倍以上、2倍以上、3倍以上、5倍以上、8倍以上、或10倍以上。该改性处理后可溶性培养载体的大小与改性处理前的可溶性培养载体的大小相比,例如可以为50%以上、80%以上或90%以上。作为改性处理前后的可溶性培养载体的大小的比较的确认方法,可以举出以下的方法。改性处理后,利用相位差显微镜进行观察或拍摄图像,利用显微镜附带的量具或标尺,确认改性处理后可溶性培养载体的大小。每1个视野中取30~40个改性后可溶性培养载体的最小直径的平均值,对5个视野实施该操作,算出平均值,求出将改性处理前的可溶性培养载体的最小直径设为100%时的比例。
改性处理后可溶性培养载体的平均粒径(D50)例如可以为40~1000μm、50~500μm、100~250μm、或100~200μm。在该范围内,能够基于细胞的大小从改性处理后可溶性培养载体更简便地分离黏附细胞。
改性处理后可溶性培养载体的大小优选最小直径超过50μm。改性处理后可溶性培养载体的大小的最小直径例如可以为超过50μm、80μm以上、100μm以上、150μm以上或170μm以上。通过使改性处理后可溶性培养载体的大小具有该范围的最小直径,从而在作为后续工序的分离回收工序中与黏附细胞的大小差异达到足以进行分离回收的大小,能够容易地进行分离及回收。
改性处理后可溶性培养载体的平均粒径(D50)、D5、最小直径可以通过与上述改性处理前的可溶性培养载体同样的步骤求出。需要说明的是,在改性处理后可溶性培养载体的测定中,可以使用从改性处理后的细胞悬液中经过分离和回收而除去了细胞的试样。
利用表面改性剂对可溶性培养载体的表面进行改性处理的条件根据所使用的表面改性剂的种类、细胞的状态而不同,但与用于完全溶解可溶性培养载体的条件相比缓和,从而本领域技术人员可以适当设定浓度、处理时间等。
表面改性剂可以根据所使用的可溶性培养载体的种类从公知的溶解剂或分解剂中选择。作为表面改性剂的具体例,可举出酶、螯合剂、酸、碱等。作为酶,可以举出糖类分解酶、蛋白水解酶等。作为糖类分解酶,可列举例如、果胶酶、聚半乳糖醛酸酶、纤维素酶、海藻酸裂解酶、琼脂糖酶、壳聚糖酶等。作为蛋白水解酶,例如可举出胶原酶、胰蛋白酶等。作为螯合剂,可以举出乙二胺四乙酸(EDTA)、乙二胺-N,N’-二琥珀酸(EDDS)等。
例如,在可溶性培养载体中含有酯化合物的情况下,可以使用酸或碱等作为催化剂,将可溶性培养载体的表面水解来进行改性处理。作为该用途中使用的酸和碱,可以使用公知的酸和碱。
上述表面改性剂可以单独使用或组合2种以上使用。
表面改性剂可以根据可溶性培养载体的种类适当选择。例如可列举:含有葡聚糖或交联葡聚糖的可溶性培养载体与葡聚糖酶的组合、含有纤维素或交联纤维素的可溶性培养载体与纤维素酶的组合、含有果胶等聚半乳糖醛酸的可溶性培养载体与果胶酶或聚半乳糖醛酸酶的组合、含有胶原的可溶性培养载体与胶原酶或胰蛋白酶的组合、含有明胶的可溶性培养载体与胰蛋白酶的组合、含有海藻酸的可溶性培养载体与海藻酸裂合酶的组合、表面具有细胞黏附性多肽的可溶性培养载体与胰蛋白酶的组合等。聚半乳糖醛酸酯、海藻酸酯等酯化合物可通过使用酸或碱作为催化剂而促进水解,将表面改性,因此也可以使用酸或碱作为表面改性剂。
在改性处理之后可溶性培养载体的大小比细胞大的改性处理的条件例如可以调节表面改性剂的种类、表面改性剂的浓度、改性处理温度、改性处理的时间等。例如可以举出:使表面改性剂在细胞悬液中的浓度低于用于完全溶解的浓度、使改性处理时间短于用于完全溶解的时间、使改性处理温度低于或高于用于完全溶解的温度、或者它们的组合等。通过利用表面改性剂的改性处理设为比用于使可溶性培养载体完全溶解的条件更缓和的条件,能够在不对黏附细胞过度施加负荷的情况下进行改性处理。
作为表面改性剂的其他例子,在可溶性培养载体能够通过pH进行表面改性的情况下,可以举出pH调节剂。作为pH调节剂,可以使用酸或碱。在利用pH调节剂进行改性处理的情况下,可以在比用于使可溶性培养载体完全溶解的条件缓和的条件下进行处理。
为了促进黏附细胞从可溶性培养载体的表面剥离,可以与表面改性处理同时或另行进行细胞剥离处理。作为用于细胞剥离处理的细胞剥离剂,只要是公知的细胞剥离剂就可以没有特别限制地使用,例如可以举出蛋白水解酶、螯合剂等,具体而言,可以举出胰蛋白酶、EDTA(乙二胺四乙酸)等;它们的组合、例如TrypLE(Thermo Fisher Scientific公司)等。
在改性处理之后且在分离和回收细胞之前,也可以对细胞悬液进行移液。通过移液,可溶性培养载体和从可溶性培养载体脱离的黏附细胞被分散,在后续的工序中,能够容易地分离和回收细胞。
培养物的制造方法可以包括:在改性处理后,基于大小差异从比黏附细胞的大小更大的改性处理后可溶性培养载体上分离并回收黏附细胞。
黏附细胞的分离及回收基于黏附细胞与改性处理后可溶性培养载体的大小之差来进行,因此能够简便且高精度地分离、回收黏附细胞。
改性处理如上所述是将可溶性培养载体的表面改性、而不是将可溶性培养载体完全溶解,因此在改性处理后,在上述范围内维持大小的倾向高。其结果,改性后培养载体能够维持比细胞大的大小。
由于改性处理后可溶性培养载体的大小大于黏附细胞的大小,因此可以基于大小差异而从改性处理后可溶性培养载体上分离并回收黏附细胞。例如,在分离中能够使用过滤器等分离装置。
分离装置的孔的形状只要能够过滤黏附细胞、将黏附细胞与改性处理后可溶性培养载体分离,则可以为任意形状。作为分离装置的孔的形状,例如可举出圆形、椭圆形、矩形、多边形等。
分离装置的孔径可以考虑黏附细胞的大小、可溶性培养载体的大小等而适当选择。例如,分离装置的孔径优选大于黏附细胞的大小,且小于改性处理后可溶性培养载体的大小。具体而言,分离装置的孔径可以比黏附细胞的最长的直径大,且比改性处理后可溶性培养载体的最短的直径小。分离装置的孔径例如可以为20~50μm、20~40μm或20~30μm的范围。
在本公开中,分离装置的孔径在孔的形状为圆形的情况下是指直径,在孔的形状为圆形以外的情况下,是指在孔的截面中通过该孔的中心点的任意的直线中最长的直线的长度。
从改性处理后可溶性培养载体上分离和回收的黏附细胞可以用磷酸缓冲液等清洗。
[细胞回收方法]
本公开的实施方式的细胞回收方法可以包括:准备包含细胞复合体的细胞悬液,所述细胞复合体含有黏附细胞和比黏附细胞的大小更大的可溶性培养载体、且是黏附细胞被配置于可溶性培养载体的表面而成的;为了使黏附细胞从可溶性培养载体的表面脱离,对细胞悬液中的细胞复合体进行将可溶性培养载体的表面的至少一部分改性的改性处理;以及,基于大小差异从比黏附细胞的大小更大的改性处理后可溶性培养载体上分离并回收细胞悬液中的黏附细胞。
根据该细胞回收方法,能够将配置于可溶性培养载体的表面的黏附细胞高效地从可溶性培养载体分离,以高纯度回收。
细胞回收方法可以包括准备包含细胞复合体的细胞悬液,所述细胞复合体含有黏附细胞和比黏附细胞的大小更大的可溶性培养载体、且是黏附细胞被配置于可溶性培养载体的表面而成的。
黏附细胞可以是配置于可溶性培养载体的表面并进行了悬浮培养的培养物。在该情况下,能够获得配置于可溶性培养载体的表面并进行了悬浮培养的培养物,实施本公开的细胞回收方法,或者,能够在使用可溶性培养载体通常进行的黏附细胞的悬浮培养之后实施本公开的细胞回收方法。
细胞悬液可以包含在可溶性培养载体的表面配置有黏附细胞的细胞复合体。黏附细胞和可溶性培养载体可以分别使用上述物质。在可溶性培养载体的表面配置有黏附细胞的细胞复合体的详细情况如上所述。
在细胞悬液中,在可溶性培养载体的表面可以部分表面或整个表面地配置黏附细胞。
作为细胞悬液中所含的水性介质,可以举出培养基、生理盐水或磷酸缓冲液等液体。
细胞回收方法可以包括:为了使黏附细胞从可溶性培养载体的表面脱离,对细胞悬液中的细胞复合体进行将可溶性培养载体的表面的至少一部分改性的改性处理。
关于改性处理,可以直接应用本公开的培养物的制造方法中的改性处理。
细胞回收方法可以包括:基于大小差异从比黏附细胞的大小更大的、改性处理后可溶性培养载体上分离并回收细胞悬液中的黏附细胞。关于分离回收细胞的方法,可以直接应用本公开的培养物的制造方法中的改性处理。
从改性处理后可溶性培养载体上分离和回收的黏附细胞可以用磷酸缓冲液等清洗。
回收的黏附细胞可以与培养基、生理盐水或磷酸缓冲液等液体组合而为细胞悬液的形态。在以细胞悬液形态被回收的情况下,本细胞回收方法还可以包括对细胞悬液进行冷冻保存处理。由此,能够得到杂质少的黏附细胞的冷冻保存物。
[含细胞组合物]
本公开的实施方式的含细胞组合物含有黏附细胞,其中,具有20μm以下的大小的可溶性培养载体的残留物的含有率相对于每1×10
含细胞组合物中,与黏附细胞同等或更小的具有20μm以下的大小的可溶性培养载体的残留物的含有率相对于每1×10
在此,含细胞组合物只要是将黏附细胞与可溶性培养载体一起培养后与可溶性培养载体分离而得到的组合物即可,例如可以举出将黏附细胞与可溶性培养载体一起培养后对可溶性培养载体进行酶处理而得到的黏附细胞的培养物、通过本公开的一个实施方式的培养物的制造方法得到的培养物、通过本公开的另一实施方式的细胞回收方法得到的细胞悬液等、或它们的冷冻保存物等。
可溶性培养载体的残留物是指通过用于将可溶性培养载体从黏附细胞分离的处理而得到的物质,可举出溶解处理后的可溶性培养载体的溶解残留物(溶解残留)、改性处理后的可溶性培养载体的改性残留物等。作为溶解残留物,例如可列举出使用酶作为表面改性剂时产生的糖链片段、多肽片段等。含细胞组合物可以与黏附细胞一起包含通过可溶性培养载体的改性处理而得到的残留物。
可溶性培养载体的残留物的含有率以20μm以下、优选1μm以上且20μm以下的残留物计,相对于每1×10
在此,含细胞组合物中的具有20μm以下的大小的可溶性培养载体的残留物相对于每1×10
含细胞组合物为通过上述的可溶性培养载体的表面的改性处理而得到的组合物可以通过以下的方法来确认。即,使改性处理后的细胞悬液通过具有20μm以上的孔径的网后,用40倍以上的相位差显微镜确认通过物。在改性处理后的含细胞组合物的情况下,通过该观察,能够在每1个视野中确认1个以上1μm以下的残留物。作为其他确认方法,也可以是回收所得到的通过物而确认有无残留物的方法。为残留物或残留物的存在例如可以通过公知的确认方法、例如显色反应、使用色素等的试验等来确认。
本公开的一个实施方式的培养物的制造方法和本公开的一个实施方式的细胞回收方法能够不对黏附细胞施加过度的负荷而简便且高精度地制造培养物或回收细胞。因此,所得到的培养物和黏附细胞能够显示出高存活率。
通过本公开的一个实施方式的培养物的制造方法得到的培养物、通过本公开的一个实施方式的细胞回收方法回收的细胞、以及本公开的一个实施方式的含细胞组合物中,细胞以外的杂质、例如可溶性培养载体、可溶性培养载体的溶解残留物等少。因此,通过本公开的一个实施方式的培养物的制造方法得到的培养物、通过本公开的一个实施方式的细胞回收方法回收的细胞、以及本公开的一个实施方式的含细胞组合物可以适合用作细胞制剂用的细胞或含细胞组合物。
[试剂盒]
本公开的一个实施方式的试剂盒包含可溶性细胞培养载体和使用说明书。在使用说明书中,优选记载了在本公开的一个实施方式的培养物的制造方法或本公开的一个实施方式的细胞回收方法中使用可溶性细胞培养载体的内容。作为使用说明书中记载的可溶性细胞培养载体,可以仅是本公开的一个实施方式的培养物的制造方法或本公开的一个实施方式的细胞回收方法中记载的可溶性细胞培养载体,也可以是其他可溶性细胞培养载体,还可以是它们的组合。
本公开的另一实施方式的试剂盒包含用于对可溶性细胞培养载体进行改性处理的表面改性剂和使用说明书。在使用说明书中,优选记载了在本公开的一个实施方式的培养物的制造方法或本公开的一个实施方式的细胞回收方法中使用表面改性剂的内容。作为使用说明书中记载的表面改性剂,可以仅是本公开的一个实施方式的培养物的制造方法或本公开的一个实施方式的细胞回收方法中记载的表面改性剂,也可以是其它表面改性剂,还可以是它们的组合。
本公开的又一实施方式的试剂盒包含可溶性细胞培养载体、用于对可溶性细胞培养载体进行改性处理的表面改性剂和使用说明书。在使用说明书中,优选记载了在本公开的一个实施方式的培养物的制造方法或本公开的一个实施方式的细胞回收方法中使用可溶性细胞培养载体和表面改性剂的内容。作为使用说明书中记载的表面改性剂,可以仅是本公开的一个实施方式的培养物的制造方法或本公开的一个实施方式的细胞回收方法中记载的表面改性剂,也可以是其它表面改性剂,还可以是它们的组合。作为使用说明书中记载的可溶性细胞培养载体,可以仅是本公开的一个实施方式的培养物的制造方法或本公开的一个实施方式的细胞回收方法中记载的可溶性细胞培养载体,也可以是其他可溶性细胞培养载体,还可以是它们的组合。
根据本公开的一个实施方式的试剂盒,试剂盒内包含的可溶性细胞培养载体、表面改性剂或它们的组合与记载了它们的一个或多个实施方式的使用说明书一起提供,因此能够迅速且简便地实现可溶性细胞培养载体、表面改性剂或它们的组合的实施方式。
在上述各试剂盒中,本公开的一个实施方式的培养物的制造方法或本公开的一个实施方式的细胞回收方法的详细情况如上所述,各方法中可使用的可溶性细胞培养载体或表面改性剂的详细情况也如上所述。上述各试剂盒可以进一步包含培养基、生理盐水、磷酸缓冲液、过滤器等分离装置、容器、或它们中的2种以上的组合。
上述试剂盒中分别包含的使用说明书包含能够将其说明内容传达给用户的所有介质。作为使用说明书,例如可以是在纸、其他片状材料上印刷了说明内容的附件,也可以是在包装容器、包装纸、包装袋等包装材料上印刷了说明内容的文件,还可以是在CD、DVD、蓝光光盘等光盘、闪存、磁盘等记录介质中作为数据记录说明内容并能够由计算机读取的文件。或者,使用说明书也可以是提供说明内容的因特网站点的地址,因特网站点的地址也可以印刷或记录于附件、包装材料、数据记录介质等来提供。关于使用说明书,可以针对可溶性细胞培养载体或表面改性剂的一个包装而提供一个使用说明书,也可以针对可溶性细胞培养载体或表面改性剂的多个包装而提供一个或多个使用说明书。
实施例
以下,通过实施例更详细地说明本发明,但只要不脱离本发明的技术思想,本发明就不受该实施例限定。
[实施例1~3]
(1)细胞培养
使用6孔板培养细胞。具体而言,以体积2.0mL/孔培养人间充质干细胞(MSCs)。作为培养基,设为添加了10%(v/v)的FBS(胎牛血清)的1.0L的αMEM。在培养基中与细胞一起投入作为培养载体的微载体,在温度37℃、维持CO
作为微载体,使用Cytodex1(具有N,N-二乙基氨基乙基的交联性葡聚糖,D50:180μm)(Cytiva公司)。确认Cytodex1的最小直径,结果为超过50μm。
需要说明的是,细胞的接种密度为3000细胞/mL,微载体的初始投入量为0.001g/mL(5cm
(2)细胞回收
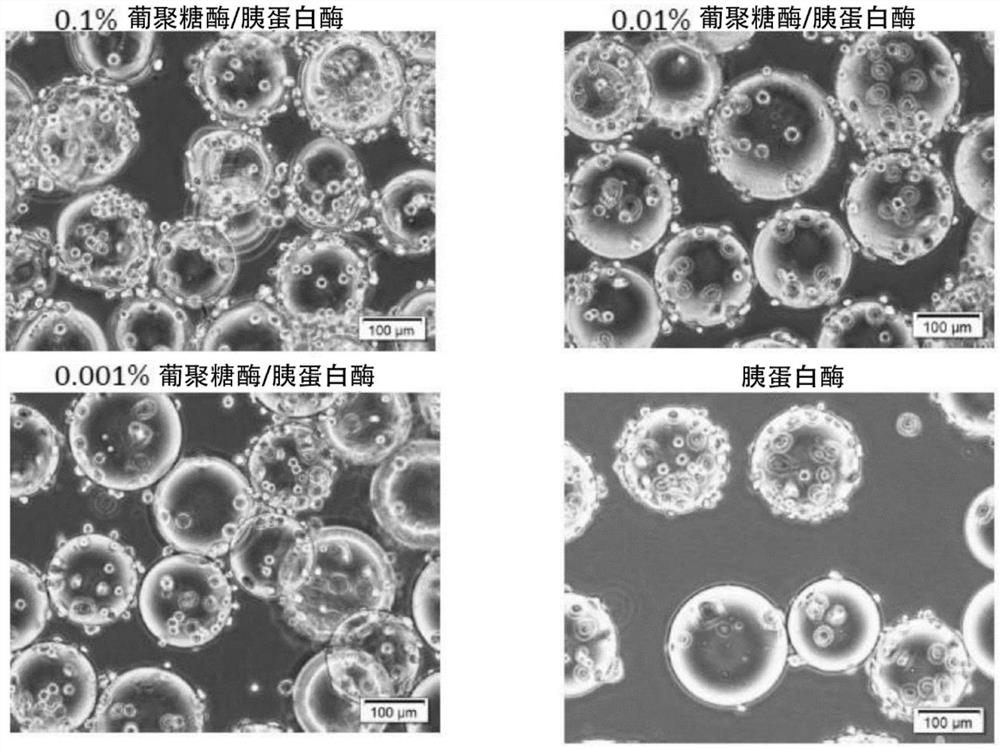
从装有培养了1周的细胞的6孔板中,回收包含作为细胞复合体的细胞和微载体的细胞悬液,用DPBS(Dulbecco’s磷酸缓冲溶液)清洗2次。清洗后抽吸上清液后,添加用37℃的葡聚糖酶(Sigma公司)与胰蛋白酶-EDTA溶液(0.25w/v%、0.02w/v%、Sigma公司)制备的试剂,使其分别成为1mL/孔,接种于各孔中,直接静置。葡聚糖酶的最终浓度相对于孔中的细胞悬液的总体积分别设为0.1v/v%、0.01v/v%、0.001v/v%,胰蛋白酶的最终浓度设为0.2w/v%。此时的培养基的pH为7.1~7.2。10分钟后用相位差显微镜观察细胞(观察结果1)。
将改性处理后的各细胞悬液移液10次后,用相位差显微镜进行观察(观察结果2)。然后,使细胞悬液通过具有20μm的孔径的网(细胞过滤器、CORNING株式会社),回收细胞,使用(NucleoCounter(注册商标)NC-200、Chemometec公司)评价细胞回收率和细胞存活率。将结果示于表1。
细胞回收率是回收的细胞数相对于培养后的细胞数的比例。细胞存活率是存活的细胞数相对于回收的细胞数的比例。
[比较例1]
在实施例1的(2)中,在清洗细胞悬液后抽吸上清后,以1mL/孔的方式添加37℃的胰蛋白酶-EDTA溶液(0.25w/v%、仅由0.02w/v%制备的试剂(胰蛋白酶最终浓度:0.25w/v%),除此以外,同样地进行处理。然后,与实施例1同样地回收细胞,评价细胞回收率和细胞存活率。将结果示于表1。
[比较例2]
在实施例1的(2)中,回收细胞,用DPBS清洗后,按照微载体的产品说明书的记载,将葡聚糖酶500U/mg(产品编号:D0443-250ML,Sigma公司)以相对于50mL微载体为10mg/50mL的浓度的方式添加到各孔中,在37℃、pH6.0下进行20分钟微载体的溶解处理。然后,与实施例1同样地回收细胞,评价细胞回收率和细胞存活率。将结果示于表1。
[比较例3]
在实施例1的(2)中,将葡聚糖酶的浓度设为1%(v/v),将反应时间设为20分钟,除此以外,同样地进行处理。然后,与实施例1同样地回收细胞,评价细胞回收率和细胞存活率。将结果示于表1。
在改性处理后,用相位差显微镜(CKX53,奥林巴斯株式会社)观察细胞悬液,按照以下的基准评价结果(上述观察结果1)。将结果示于表1。
A:观察到微载体和细胞,比细胞的大小更小的微载体相对于每1×10
B:观察到细胞,粒子状的微载体被溶解而未观察到,但观察到大量与细胞同等或比细胞小的来自微载体的残留物。
[表1]
在图1和图2中,针对以下的实施例和比较例,示出在改性处理后利用相位差显微镜观察细胞悬液而得到的照片图像。
图1是上述观察结果1的倍率10倍的照片图像,图1左上为实施例1,图1右上为实施例2,图1左下为实施例3,图1右下为比较例1。图2是上述观察结果2的倍率40倍的照片图像,是比较例3。
在实施例1~3中,如表1所示,细胞回收率均为15%以上,细胞存活率均为90%以上。另外,如图1所示,在改性处理后观察细胞悬液,结果微载体没有完全溶解而与细胞一起存在。进行使用相位差显微镜的观察,通过显微镜附带的测量,在5个视野中确认微载体的大小的最小直径,结果均超过50μm,取最小直径的平均值,与改性处理前的微载体的尺寸进行对比,结果均为90%以上。另一方面,尝试通过同样的方法确认微载体的溶解残留等残留物,但无法确认与细胞的尺寸同等或比其小的微载体的溶解残留等残留物(参照图1)。因此,通过在细胞的回收中使用筛网,能够容易地分离微载体,高精度地仅回收细胞。
另一方面,在比较例1中,如表1所示,细胞回收率低,为1成以下。另外,如图1所示,在改性处理后观察细胞悬液,结果细胞悬液中微载体没有完全溶解而与细胞一起存在。用与上述同样的方法确认残留物的个数,结果无法确认与细胞的尺寸同等或比其小的微载体的溶解残留等残留物。因此,在细胞的回收中,虽然使用筛网能够容易地将细胞从微载体分离,但是大量黏附细胞以挂在残留于筛网上的微载体的表面的方式存在。由此可知,仅利用细胞剥离剂对于使细胞从微载体脱离而言是不充分的。
比较例2和比较例3中,在改性处理后观察细胞悬液,结果微载体几乎完全溶解,取而代之,观察到大量由多个细胞构成的细胞块。在移液后确认细胞悬液的结果是,移液前确认到的细胞块已被分散为单细胞,但与细胞一起,微载体的残留物以具有20μm以下的大小的细小的粒子、换言之比细胞的大小更小的微细物形式大量存在(比较例3:参照图2。比较例2也相同。未图示)。需要说明的是,图2中的3处箭头表示比细胞小的残留物、即溶解残留。
另外,在比较例2和比较例3中,如表1所示,细胞回收率和细胞存活率高,该细胞回收率高基于微载体整体被溶解。
然而,如上所述,细胞悬液中含有大量20μm以下的微载体的残留物,即使想要使用筛网等仅回收细胞,也会混入大量的残留物,无法高精度地仅分离细胞。
本申请的公开与2021年3月31日申请的日本特愿2021-060494号所记载的主题相关联,它们的全部公开内容通过引用而引用于此。应注意的是,除了已经叙述的内容以外,也可以在不脱离本公开的新的且有利的特征的情况下对上述的实施方式施加各种修正、变更。因此,意图将这样的全部的修正、变更包含于所附的权利要求书。
- 包含间充质系干细胞的细胞群的制造方法、间充质系干细胞、细胞群、以及医药组合物
- 确定细胞培养物的感染部位的数量的方法
- 一种含有牡丹干细胞活性物的培养提纯方法及应用
- 组合物、细胞保存组合物、细胞培养组合物、细胞制剂、包含微小气泡的对象物的制造方法、细胞的保存方法、细胞的培养方法和细胞制剂的制造方法
- 容器的制造方法及它的制造装置和细胞培养容器、细胞培养方法、细胞培养容器的制造方法及细胞培养容器的制造装置
