一种搭载促成骨分化的外泌体微球在骨修复的应用
文献发布时间:2023-06-19 18:32:25
技术领域
本发明属采用微流控芯片制备PEGDA/GelMA/Exo微球(PGExo) 进行的基础研究领域,更具体地说,本发明涉及对MC3T3细胞过表达Rab27a基因修饰,提取了具有促成骨分化作用的外泌体,从而促使PGExo微球所搭载的最佳外泌体浓度以及有效的缓释时间。
背景技术
骨组织工程的种子细胞—骨髓间充质干细胞(BMSCs)在骨组织工程中的使用尤其广泛,可以迁移到损伤部位参与组织修复,快速地向成骨细胞分化。然而,直接使用BMSCs也存在一定的局限性:采集会对患者本身造成创伤。因此,形成了无细胞支架用于组织工程,BMSCs的旁分泌作用属于一种细胞通讯行为,可通过外泌体(Exo) 介导细胞间信号传递。外泌体较BMSCs具有更多的应用优势:外泌体可由细胞培养液中大量提取;性质稳定可冻干制成粉剂储存;没有免疫原性;传递率高,可通过血脑屏障;利用外泌体搭载药物。上述优势使外泌体替代BMSCs用于骨组织损伤修复治疗成为可能。
研究显示外泌体对于组织损伤修复有良好的治疗效果,但随着被靶细胞摄取内化或被巨噬细胞捕获,外泌体浓度会较快下降,因而外泌体用于骨组织工程治疗,就要搭配外泌体载量大、可长时间缓释给药的药物递送体系。常用方法如微球载体包载:通过微流控、自组装等方式利用生物材料制成的微球/颗粒混合或包载外泌体,经过微球/颗粒被降解或者发生结构改变,释放外泌体。从而实现持续性缓释给药,维持外泌体释药浓度。
载药微球是一类被广泛应用的药物递送载体,通过将药物溶解或分散在微球中制成微米级的小球。载药微球的制备工艺和材料种类较多,常用的制备工艺如喷雾干燥法、乳化交联法、相分离法等等。其中利用微流控技术采用乳液法制备微球,可以得到粒径分布均匀的载药微球,该技术简单高效,材料消耗量小,粒径便于调控,受到广泛关注。甲基丙烯酰酸酯化明胶(GelMA)水凝胶是含有大量甲基丙烯酰胺基团和甲基丙烯酸酯集团的明胶衍生物,其中含有明胶的氨基酸序列如 RGD序列和MMP酶解序列,因此具有良好的生物相容性可促进细胞粘附生长,并且在体内可生物降解。GelMA结构中的甲基丙烯酰化取代基决定了其可在光引发剂和紫外光条件下引发自由基聚合交联反应形成水凝胶。聚乙二醇二丙烯酸酯(PEGDA)是在聚乙二醇PEG的分子末端接枝上C=C双键,使其可以光固化形成水凝胶。GelMA和PEGDA 混合材料经紫外光交联,会形成两种聚合物分子的双网络水凝胶。
发明内容
本发明通过对MC3T3细胞过表达Rab27a基因修饰,提取了具有促成骨分化作用的外泌体(Exo)。采用GelMA、PEGDA混合Exo作为材料,通过微流控芯片技术制作PEGDA/GelMA/Exo(简称PGExo) 微球。
附图说明
图1为本发明实施例1Rab27a-pcDNA3.1-3xFlag-C重组质粒。
图2为本发明实施例1BCA检测外泌体蛋白浓度。
图3为本发明实施例1微流控芯片。
图4为本发明实施例1分散相压力调控时分散相形态的微距相片。
图5为本发明实施例1PGExo微球扫描电镜。
图6为本发明实施例1PGExo微球释放外泌体总浓度。
图7为本发明实施例1PGExo微球5d释放外泌体平均浓度。
图8为本发明实施例1激光共聚焦检测PGExo释放外泌体。
图9为本发明实施例2BMSCs细胞成骨分化染色
具体实施方式
以下结合实施例,对本发明进行进一步详细说明。
实施例1:微球的制备及外泌体缓释检测
材料与方法
细胞和试剂:大肠杆菌DH5α菌种为实验室保藏菌株,制成感受态细胞后转化Rab27a-pcDNA3.1-3xFlag-C重组质粒如图1,使用 Lipofectamine2000脂质体转染试剂盒对MC3T3细胞进行重组质粒转染即制成MC3T3-Rab27a细胞。BCA蛋白浓度试剂盒,Lipofectamine2000脂质体转染试剂盒等购自Thermo。猪皮明胶、甲基丙烯酸酐、PEGDA等购自Sigma
实验仪器:微流控压力泵、微距摄像头、倒置激光共聚焦显微镜等购自武汉Mesobiosystem
外泌体提取
将MC3T3细胞培养液吸入离心管并按如下梯度离心:4℃条件下,1 000×g离心10min,3000×g离心30min,10000×g离心60min,100 000×g离心70min。从沉淀中收集外泌体并重悬于PBS中。提取的外泌体悬液可放置于4℃下保存3d并尽快使用。
GelMA合成制备
将10g猪皮明胶在50℃水浴中溶解于100mL PBS溶液中,完全溶解后,以0.5mL/min速度缓慢滴加甲基丙烯酸酐,50℃反应3h。将反应溶液滴加3倍体积的无水乙醇,去除甲基丙烯酸酐副产物,用 50mL离心管3000g离心5min,除去上清,所得沉淀用50℃去离子水溶解后,再次用无水乙醇提纯一次。所得沉淀用50℃去离子水溶解后,放入5k透析袋中40℃透析3d。透析后溶液进行冷冻干燥,冻干产物GelMA避光干燥储存,备用。
微流控分散相PEGDA/GelMA/Exo材料配制
将1.5g GelMA在40℃水浴中溶解于10mL PBS溶液中,将1.5g PEGDA室温溶解于10mL PBS溶液中。从成骨诱导培养7d MC3T3-Rab27a的培养基中提取Exo,外泌体经PKH26染色后,通过 BCA蛋白浓度测定将Exo溶液浓度稀释为10mg/mL、5mg/mL、1 mg/mL。取GelMA溶液、PEGDA溶液、Exo溶液各1mL,加入7.5 mg LAP蓝光引发剂。溶液经0.22μm滤膜过滤除菌后置于15mL 离心管中,作为微流控的分散相溶液。
微流控流动相材料配制
取300μL Span80加入2.7mL矿物油,置于15mL离心管中,作为微流控的流动相溶液。
微流控芯片制备微球
将装有分散相、连续相溶液的离心管分别连接注压瓶盖,注压瓶盖气路接头一端分别连接至微流控压力泵V1a、V2a接口,注压瓶盖液路接头一段连接微流控芯片的对应接口,确保液路的毛细管下降至离心管底部与材料溶液充分接触。按图2连接微流控芯片,启动压力泵在微距摄像头下观察分散相、连续相溶液交汇处,调节压力泵V1a、V2a 旋钮调节气压,至分散相呈分撒小液滴如图3,打开紫外灯聚光于芯片后段如图1所示。用EP管于芯片溶液出口处盛接液滴,芯片滴出液滴中含有PGExo微球。注意观察芯片后段,如小液滴减少则暂停紫外灯照射,用微距摄像头观察分散相、连续相溶液交汇处,并调整气压;如加大V1a气压但分散相流速较慢,则停止压力泵,拔除V1a 于芯片的接口,检查并清除交联于管道中的分散相材料。吸取少量微球液滴于载玻片上,显微镜镜检,如未见镜下液滴融合现象,即说明分散相材料以交联形成微球。对盛有微球液滴的EP管2000g离心 30s,吸出顶部溶液,加入500μLPBS重悬,8000g离心30s,吸出顶部清液。微球样品存放于4℃备用。
统计分析
所有实验均进行3次独立的生物学重复。使用Prism software确定统计显着性。使用两尾t检验确定P值。*P<0.05
结果分析
外泌体BCA浓度测定
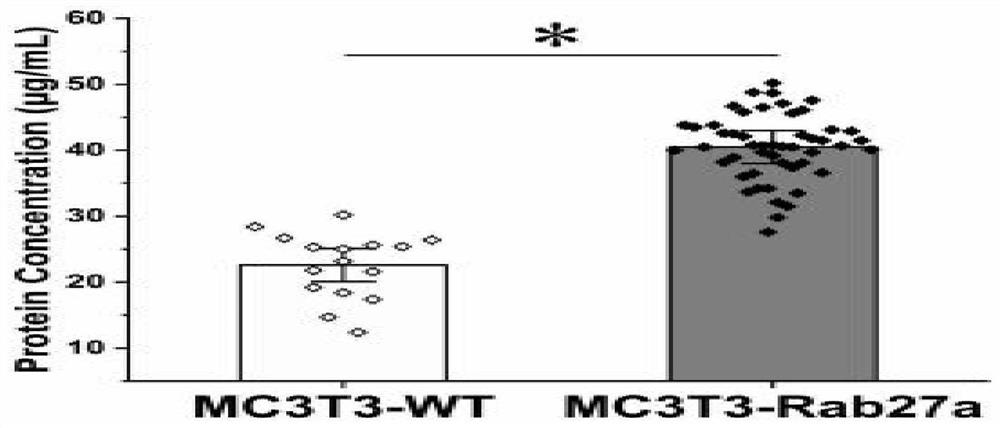
用蛋白分析方法可知图4,每毫升MC3T3-Rab27a细胞和MC3T3-WT 细胞培养液中提取的外泌体含量分别是40.36±4.57μg和22.9±4.41 μg,两者具有统计学差异(P<0.05),这说明了MC3T3细胞过表达 Rab27a基因有效提高了细胞分泌外泌体的水平。
PGExo微球微观形貌
PGExo微球的扫描电镜如图5,其大小较均一,分散良好,粒径为56.4 ±8.21μm。
PGExo微球缓释外泌体的检测
不同的外泌体载入浓度(10、5、1mg/mL)的PGExo微球向周围SBF 溶液释放外泌体的效率存在显著差异,从释放总浓度如图6,平均释放浓度如图7可看出,1mg/mL和5mg/mL外泌体的PGExo微球的平均释放浓度分别是116.49μg/mL和423.31μg/mL,10mg/mL外泌体的PGExo微球释放浓度超出BCA检测量程,1mg/mL外泌体的 PGExo微球的5d平均释放浓度更接近之前实验得到的促成骨分化作用浓度。PGExo微球释放荧光标记外泌体(1mg/mL)的效果如图8 可见,PGExo可长效缓释外泌体达30d。综合结果可得PGExo包载1 mg/mL外泌体即可有效促进BMSCs成骨分化,且可实现长达30d 的长效缓释。
实施例2:微球对BMSCs成骨分化的影响
细胞和试剂:MC3T3-Rab27a细胞,BMSCs-WT,即野生型小鼠骨髓间充质干细胞。碱性磷酸酶染色试剂盒,碱性磷酸酶活性检测试剂盒购于碧云天。
实验分组:PM组:采用DMEM完全培养基培养的BMSCs细胞; OM组:采用成骨诱导培养液培养的BMSCs细胞;OM-Rab27a-Exo组:成骨诱导培养基培养的MC3T3-Rab27a细胞7
ALP染色
将BMSCs以1×105个/mL密度接种于12孔板中,待细胞生长约 80%融合,分别给予不同的条件进行培养,4d全换液一次。于7d 采用ALP染色试剂盒进行染色:PBS洗涤3min。4%多聚甲醛固定 20min,PBS洗涤3次,每次3min。将显色缓冲液、BCIP液、NBT 液按照体积300:1:2进行混合配成工作液,每孔加入工作液500μ L,室温孵育30min,蒸馏水洗1min。
茜素红矿化结节染色
将BMSCs以1×105个/mL密度接种于12孔板中,待细胞生长约 80%融合,分别给予不同的条件进行培养,4d全换液一次。于7、 14、21d时间点进行茜素红矿化结节染色:PBS洗涤3min。4%多聚甲醛固定20min,PBS洗涤3次,每次3min。每孔加入茜素红染色液500μL,室温孵育30min,蒸馏水洗1min,镜检。对染色后的孔板于酶标仪读取562nm的OD值。
结果分析
Rab27a对BMSCs成骨分化染色的影响
如图9,通过ALP和茜素红染色可以看出,成骨分化效果最好的是成骨诱导的BMSCs-Rab27a细胞,其次是BMSCs-WT细胞。这表明了微球能够促进BMSCs成骨分化。
- 肿瘤来源外泌体在制备促进破骨分化和骨溶解药物中的用途
- 一种促软骨修复外泌体缓释微球的微流控制备方法、缓释微球及其应用
