引物对及其应用和试剂盒、样本检测系统及检测方法
文献发布时间:2023-06-19 18:32:25
【技术领域】
本发明涉及宫颈癌检测技术领域,尤其涉及一种引物对及其应用和试剂盒、样本检测系统及检测方法。
【背景技术】
人乳头瘤病毒(英文全称:human papilloma virus;简称:HPV)是一种属于乳多空病毒科的乳头瘤空泡病毒A属,是球形DNA病毒,能引起人体皮肤黏膜的鳞状上皮增殖。具体表现为寻常疣、生殖器疣(尖锐湿疣)等症状;随着性病中尖锐湿疣的发病率急速上升和宫颈癌、肛门癌等的增多,HPV感染越来越引起人们的关注。目前发现的HPV基因型已经超过200种,其中只有14种可以诱发宫颈癌,即HPV16、18、31、33、35、39、45、51、52、56、58、59、66和68。此外,即使是这14种高危型HPV中也并不是每一种基因型都具有相同的致癌能力。HPV16和18是其中危害最大的两个基因型,二者分别导致55%和15%的宫颈癌病例。根据侵犯的组织部位不同和致病性可划分为四种类型:皮肤低危型、皮肤高危型、黏膜低危型和黏膜高危型,高危型与宫颈癌的发病有关,低危型与生殖道疣状物有关。为避免感染以及感染时获得及时的治疗,需要对人是否感染HPV以及感染的HPV类型进行检测,但是,由于HPV分型检测的特殊性,目前的检测方法至少存在以下缺陷:
(1)、难以找到合适的、具有特异性的引物。由于引物的通用性与引物的特异性,检测的通用性与检测的敏感性,是一对相互对立的矛盾。既要覆盖尽可能多的型别,又要检测精准,是引物设计与扩增条件设置的难点,这也是导致现有检测覆盖率低的主要原因。
(2)、温度影响检测结果的准确性,导致不容易判断。有研究者通过测试显示,引物结合温度变动0.5℃,也对分型的检测结果具有较大影响。如Micalessi等对31个HPV质粒进行SPF10实时定量PC扩增测试,显示这些质粒具各自Tm值,范围在79.7℃~83.4℃。对用SPF10常规PCR条件(10μL/49℃)扩增鉴定出HPV型别的4例标本(两个16型和两个31型),随后设定49.0℃、49.5℃、50.0℃共3个温度梯度,并用1μL和10μL两个待测样品量再用实时定量PCR测试。结果显示,有一个HPV16型阳性的样品3次未检出,3次检出;一个HPV31型阳性的样品4次检出有44型的波峰。对1:1~1000比例混合的HPV16和HPV31全序列质粒进行实时定量PCR扩增测试显示,如若获得正确的分型结果,扩增的Cp(crossing point)为19.5~33.56,Tm(melting temperature)为80.7℃~81.5℃,Cp和Tm均不相同。
(3)、容易出现假阳性或者假阴性。由于HPV基因变异的存在,试图在HPV基因组序列内找到完全一致的序列,设计出型别全覆盖的引物是不可能实现的,所以难以避免检测时出现假阴性。提高引物的通用性是以牺牲引物的特异性和型特异最适反应条件为代价的,这势必降低了检测的敏感性和准确性,从而造成漏检、错检。
基于上述缺陷,有必要提供一种新的技术方案以解决现有HPV检测存在的上述技术问题。
【发明内容】
本发明的目的之一在于提供一种引物对,以解决现有人乳头瘤病毒检测的引物对特异性差、易出现假阴性或假阳性以及检测准确性较低等问题。
为实现上述技术目标,采用如下的技术方案:
引物对,包括引物对1、引物对2、引物对3和引物对4;
所述引物对1包括:上游引物1,编码核苷酸序列如SEQ ID NO.1所示;下游引物1,编码核苷酸序列如SEQ ID NO.2所示;
所述引物对2包括:上游引物2,编码核苷酸序列如SEQ ID NO.3所示;下游引物2,编码核苷酸序列如SEQ ID NO.4所示;
所述引物对3包括:上游引物3,编码核苷酸序列如SEQ ID NO.5所示;下游引物3,编码核苷酸序列如SEQ ID NO.6;
所述引物对4包括:上游引物4,编码核苷酸序列如SEQ ID NO.7所示;下游引物4,编码核苷酸序列如SEQ ID NO.8所示。
本发明的目的之二在于提供上述引物对在制备用于人乳头瘤病毒检测的扩增试剂盒中的应用。
与现有技术相比,本发明目的一和二提供的引物对及其应用,对人乳头瘤病毒具有高特异性和高敏感性,可以极大的降低检测的假阳性或假阴性,从而提高人乳头瘤病毒检测的准确性,本发明实施例的引物对适合用于制备人乳头瘤病毒检测的扩增试剂盒。
本发明的目的之三在于提供一种试剂盒,其具体的技术方案如下:
试剂盒,用于人乳头瘤病毒检测的核酸扩增反应,包括荧光标记的探针1、荧光标记的探针2、荧光标记的探针3、荧光标记的探针4以及上述所述的引物对。
进一步地,所述探针1至探针4的编码核苷酸序列分别如SEQ ID NO.9至SEQ IDNO.12所示;
且/或,所述试剂盒中,所述引物对1、所述引物对2、所述引物对3及所述引物对4的摩尔比为(1.1~1.3):(1.4~1.6):(1.8~2.2):(0.9~1.1)。
与现有技术相比,本发明目的之三提供的试剂盒,由于包含上述的四个引物对,因此,对人乳头瘤病毒具有高特异性和高敏感性,在对人乳头瘤病毒进行扩增检测时具有良好的特异性,在短时间内即可扩增至可检测的水平,并且不易出现假阳性或者假阴性,有利于提高检测的效率和准确性。
本发明的目的之四在于提供一种样本检测系统,具体的技术方案如下:
样本检测系统,用于检测人乳头瘤病毒,包括:
即时检测模块,所述即时检测模块用于对样本进行检测并生成对应的第一反馈信息;
免疫筛查模块,所述免疫筛查模块用于对所述样本进行检测并生成对应的第二反馈信息;
形态学检测模块,所述形态学检测模块用于对所述样本进行形态学检测,以获取所述样本的形态学信息并反馈给所述控制模块;
控制模块,所述控制模块与所述即时检测模块、所述免疫筛查模块以及所述形态学检测模块分别连接,以用于根据所述第一反馈信息控制所述免疫筛查模块工作以及用于根据所述第二反馈信息控制所述形态学检测模块工作。
优选地,所述即时检测模块包括预处理装置、核酸扩增装置以及核酸检测装置,所述预处理装置、所述核酸扩增装置及所述核酸检测装置依次连接。
优选地,所述核酸扩增装置包括上述所述的试剂盒。
优选地,所述免疫筛查模块中包括与E6蛋白特异性结合的第一抗体和/或与E7蛋白特异性结合的第二抗体。
优选地,所述第一抗体包括HPV16 E6/18E6抗体;所述第二抗体包括HPV16 E7抗体;
且/或,所述第一抗体和所述第二抗体都携带有荧光标记物。
优选地,所述形态学检测模块包括制样装置和显微装置;所述制样装置以及所述显微装置分别与所述控制模块连接。
与现有技术相比,本发明目的之四提供的样本的检测系统,将即时检测模块、免疫筛查模块以及形态学检测模块三个模块联合,并通过控制模块控制这三个模块工作,整个检测过程不超过2h,多个检测模块联合能够可以实现精准检测,极大地降低了假阳性、假阴性出现的概率;本样本的检测系统能够高效智能一体化地完成样本的检测,快速提供样本检测的结果,提高了检测效率。
本发明的目的之五在于提供一种样本的检测方法,具体的技术方案如下:
样本的检测方法,包括以下步骤:
提供样本;
对所述样本进行即时检测,以获得第一检测结果;
根据所述第一检测结果判断是否启动对所述样本进行免疫检测,以获得第二检测结果;
根据所述第二检测结果判断是否启动对所述样本进行形态学检测,以获得第三检测结果;
其中,所述第一检测结果用于显示是否存在人乳头瘤病毒和显示所述人乳头瘤病毒是否为黏膜高危型;
所述第二检测结果用于显示E6蛋白和/或E7蛋白的表达量及将所述表达量和预设阈值进行比较;
所述第三检测结果为细胞形态学的检测结果。
优选地,所述即时检测包括对所述样本进行核酸扩增的步骤;
所述核酸扩增采用重组酶聚合酶扩增方法,且扩增时向所述样本中加入荧光标记的探针1、荧光标记的探针2、荧光标记的探针3、荧光标记的探针4以及上述的引物对;所述探针1至探针4的编码核苷酸序列分别如SEQ ID NO.9至SEQ ID NO.12所示;
或者,所述核酸扩增步骤采用上述所述的试剂盒进行扩增。
优选地,加入的所述引物对中,所述引物对1、所述引物对2、所述引物对3及所述引物对4的摩尔比为(1.1~1.3):(1.4~1.6):(1.8~2.2):(0.9~1.1)。
优选地,所述E6蛋白和/或E7蛋白的表达量的检测包括向所述样本中加入与所述E6蛋白特异性结合的第一抗体和/或与所述E7蛋白特异性结合的第二抗体以获取表达量信息;
和/或,所述样本包括人体细胞、人血液、人体分泌物中的任一种。
优选地,所述第一抗体包括HPV16 E6/18E6抗体;所述第二抗体包括HPV16 E7抗体;
且/或,所述第一抗体和所述第二抗体都携带有荧光标记物。
优选地,所述E6蛋白的预设阈值为10ng/mL;
和/或,所述E7蛋白的预设阈值为10ng/mL。
与现有技术相比,本发明目的之五提供的样本的检测方法,将即时检测、免疫检测和形态学检测三者相结合,可在15min内获得样本是否含有人乳头瘤病毒及人乳头瘤病毒是否为黏膜高危型的信息;根据得到的黏膜高危型信息进一步对样本进行E6蛋白和/或E7蛋白表达量的检测,根据E6蛋白和/或E7蛋白的表达量,进行细胞形态学检测,整个检测流程不超过2h,具有特异性高且耗时短的特点,能有效解决假阳性或假阴性的问题,从而有效提高检测的准确性。
【附图说明】
图1为本发明实施例提供的样本检测系统的简化示意图;
图2为向本发明实施例提供的样本检测系统的即时检测模块输送样本的简化示意图;
图3为向本发明实施例提供的样本检测系统的免疫筛查输送样本的简化示意图;
图4为向本发明实施例提供的样本检测系统的形态学检测模块输送样本的简化示意图;
图5为本发明实施例提供的样本的检测方法的简化流程示意图;
图6为本发明实施例提供的样本的检测方法中步骤S02的检测结果图;
图7为本发明实施例提供的样本的检测方法中步骤S03的第一抗体对鳞状上皮细胞样本的染色结果图;
图8为本发明实施例提供的样本的检测方法中步骤S03的第二抗体对鳞状上皮细胞样本的染色结果图;
图9为样本的检测方法中步骤S04对鳞状上皮细胞样本的细胞形态学检测结果图。
附图标记:
10、样本检测系统;11、即时检测模块;111、预处理装置;112、核酸扩增装置;113、核酸检测装置;12、免疫筛查模块;13、形态学检测模块;131、制样装置;132、显微装置;14、控制模块;15、轨道模块;151、第一轨道;152、第二轨道;153、第三轨道;16、储样腔。
【具体实施方式】
下面结合附图和实施方式对本发明作进一步说明。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
另外,在本发明中涉及“第一”、“第二”等的描述仅用于描述目的,而不能理解为指示或暗示其相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。另外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。
第一方面,本发明实施例提供了一种引物对,所述引物对包括引物对1、引物对2、引物对3以及引物对4。
其中,所述引物对1包括上游引物1和下游引物1,其中,所述上游引物1的编码核苷酸序列如SEQ ID NO.1所示,亦即:
5’-AAGGCTTGTTTGGGCTTGTGTTGGAGTTGAAG-3’;
所述下游引物1的编码核苷酸序列如SEQ ID NO.2所示,亦即:
5’-TCAACTCCAGCATTAGCAGCGTAAGCTGAAGC-3’;
所述引物对2包括上游引物2和下游引物2,其中,所述上游引物2的编码核苷酸序列如SEQ ID NO.3所示,亦即:
5’-TAATAAGGTGCCTGCGGTGCCAGAAACCGTTG-3’;
所述下游引物2的编码核苷酸序列如SEQ ID NO.4所示,亦即:
5’-TTGGAGTCGTTCCTGTCGTGCTCGGTTGCAGCACG-3’;
所述引物对3包括上游引物3和下游引物3,其中,所述上游引物3的编码核苷酸序列如SEQ ID NO.5所示,亦即:
5’-TGGGTCGAGTTGGTCCAAGACTGTTGTCTCTTAC-3’;
所述下游引物3的编码核苷酸序列如SEQ ID NO.6所示,亦即:
5’-TCGTCGTCGCAACAACAATGTTCGTTGTGG-3’;
所述引物对4包括上游引物4和下游引物4,其中,所述上游引物4的编码核苷酸序列如SEQ ID NO.7所示,亦即:
5’-AGACAAGAGGTAAGTGCGGCGGAGGCAGATACGATG-3’;
所述下游引物4的编码核苷酸序列如SEQ ID NO.8所示,亦即:
5’-ATTCGCCTCCACCTCCACTAACCGCCACCGC-3’。
本发明实施例的所述引物对人乳头瘤病毒具有高敏感性和特异性,在人乳头瘤病毒检测的核酸扩增过程中加入,可以直接加入或者制成引物液后加入。具体地,在采用重组酶聚合酶扩增(英文全称:Recombinase polymerase amplification;简称:RPA)反应加入本发明实施例提供的引物对后,使得人乳头瘤病毒样本的核酸在短时间内扩增到可检测的水平,具有优异的扩增能力和稳定的Tm值,从而可以有效降低人乳头瘤病毒检测过程中出现的假阳性或者假阴性,以提高人乳头瘤病毒检测的准确性。在向RPA反应体系中加入所述的引物对时,所述引物对1、所述引物对2、所述引物对3以及所述引物对4的投料摩尔比为(1.1~1.3):(1.4~1.6):(1.8~2.2):(0.9~1.1)。在一些实施方式中,按照摩尔比,所述引物对1:引物对2:引物对3:引物对4=1.2:1.5:2.0:1.0,在该投料摩尔比下,人乳头瘤病毒样本的所有目的基因能够稳定扩增,并且具有较高的产率,扩增能力强以及Tm值的稳定性好。
基于本发明实施例提供的引物对具有的高敏感型和特异性,所述引物对可以在制备用于人乳头瘤病毒检测的扩增试剂盒中应用。
因此,第二方面,本发明实施例提供了一种试剂盒,所述试剂盒包括:
(1)、引物对,包括上文所述的引物对1、上文所述的引物对2、上文所述的引物对3及上文所述的引物对4;
(2)、荧光标记的探针,荧光标记的探针1、荧光标记的探针2、上荧光标记的探针3以及荧光标记的探针4;其中,
所述探针1的编码核苷酸序列如SEQ ID NO.9所示,亦即:
CTGACATATCTACTTGAGAAMCTAG;
所述探针2的编码核苷酸序列如SEQ ID NO.10所示,亦即:
TACTACACAGTYTCGTGTACCTGG;
所述探针3的编码核苷酸序列如SEQ ID NO.11所示,亦即:
TGCCATTATGCACGGAAGTAAMTAATGAAG;
所述探针4的编码核苷酸序列如SEQ ID NO.12所示,亦即:
TACGATGAACACTGAAGCACCTGTCCCGATG。
其中,所述探针1以羧基荧光素(Carboxy fluorescein,缩写为FAM)标记,如5-FAM、6-FAM等;所述探针2以六氯荧光素(Hexachloro fluorescein,缩写为HEX)标记;所述探针3以荧光染料CY3(cyanine-3)标记;所述探针4以荧光染料CY5(cyanine-5)标记。
(3)、20×的反应混合物,所述反应混合物包括重组酶、聚合酶、单链结合蛋白、防冻剂及缓冲剂;
(4)、2×的反应缓冲液,所述反应缓冲液中包括腺嘌呤(adenine,缩写为A)、胸腺嘧啶(thymine,缩写为T)、胞嘧啶(cytosine,缩写为C)和鸟嘌呤(guanine,缩写为G)、500mM氯化钾、缓冲剂;
(5)、280mM的醋酸镁;
(6)、10×的磷酸肌酸溶液;
(7)、阳性对照模板;
(8)、阳性对照引物。
需要说明的是,上述“20×”是指试剂盒会提前混合反应所需的成分,在使用时只需要取出来稀释20倍即可。其余“2×”、“10×”具有相同的意思,故不再展开赘述。
在一些实施方式中,试剂盒里所述引物对1、所述引物对2、所述引物对3以及所述引物对4的摩尔比为(1.1~1.3):(1.4~1.6):(1.8~2.2):(0.9~1.1)。在一些实施方式中,所述引物对1、所述引物对2、所述引物对3及所述引物对4的摩尔比为1.2:1.5:2.0:1.0。
请参阅图1,第三方面,本发明实施例提供一种样本检测系统10,用于检测样本中含有的人乳头瘤病毒的情况,其包括即时检测模块11、免疫筛查模块12、形态学检测模块13以及控制模块14。其中,即时检测模块11用于对样本进行检测并生成对应的第一反馈信息;免疫筛查模块12用于对样本进行检测并生成对应的第二反馈信息;形态学检测模块13用于对样本进行形态学检测,以获取样本的形态学信息并反馈给控制模块14;控制模块14与即时检测模块11、免疫筛查模块12以及形态学检测模块13分别连接,控制模块14根据第一反馈信息控制免疫筛查模块12工作,并根据第二反馈信息控制形态学检测模块13工作,从而可以一体化高效地完成样本的检测,并获得样本中人乳头瘤病毒的情况。
请参阅图1,上述的即时检测模块11为分子检测(point-of-care testing,简称:POCT)模块。在一些实施方式中,即时检测模块11包括预处理装置111、核酸扩增装置112以及核酸检测装置113,预处理装置111与核酸扩增装置112连接,核酸检测装置112与核酸扩增装置113连接。其中,预处理装置111用于获取样本,并且将样本进行处理至可以进行核酸扩增的水平,经过预处理装置111处理的样本,可以递送至核酸扩增装置112中进行扩增,当核酸扩增装置112将样本的核酸扩增至达到可检测水平时,核酸检测装置113对核酸进行检测,并将检测得到的第一反馈信息传递给控制模块14,由控制模块14分析并根据分析结果确定是否启动免疫筛查模块12。
请参阅图1,在一些实施方式中,核酸扩增装置112包括重组酶聚合酶链式反应的试剂盒。重组酶聚合酶链式反应的试剂盒即为本发明实施例第二方面提供的试剂盒,为节约篇幅,在此不再对试剂盒展开赘述。
请参阅图1,在一些实施方式中,免疫筛查模块12中包括与E6蛋白特异性结合的第一抗体和/或与E7蛋白特异性结合的第二抗体。在一些实施方式中,第一抗体包括HPV16E6/18E6抗体(C1P5-FITC;货号:sc-460 FITC;200μg/mL;使用前可按照1:50~1:500稀释);所述第二抗体包括HPV16 E7抗体(ED17-PE;货号:sc-6981PE;200μg/mL;使用前可按照1:50~1:500稀释),并且第一抗体携带的荧光标记物为异硫氰酸荧光素(FITC);所述第二抗体携带的荧光标记物为藻红素(PE)。免疫筛查模块12对样本进行检测,并将检测得到的第二反馈信息传递给控制模块14,由控制模块14分析并根据分析结果确定是否启动形态学检测模块13。
请参阅图1,在一些实施方式中,形态学检测模块13包括制样装置131和显微装置132,至少显微装置132与控制模块14连接。其中,制样装置131用于获取样本并对样本进行处理,并将样本制成可以在显微装置132中观察分析的状态,而显微装置132则用于观察样本的细胞形态学,并将观察到的样本的细胞形态学信息反馈给控制模块14,由控制模块14根据细胞形态学信息输出给用户。在一些实施方式中,显微装置132包括显微镜(图中未标示)和摄像机(图中未标示),摄像机和控制模块14连接,从而可以在控制模块14端操控摄像机将显微镜观察到的细胞形态学信息拍摄成照片,并将照片上传至控制模块14。
请参阅图1,在一些实施方式中,样本检测系统10还包括轨道模块15模块,轨道模块15包括第一轨道151和第二轨道152,即时检测模块11通过第一轨道151与免疫筛查模块12连接,免疫筛查模块12通过第二轨道152与形态学检测模块13连接,放置在样本检测系统10进样端(即即时检测模块11的进样端)的样本,以被输送至即时检测模块11中,以供即时检测模块11对样本进行检测;或者沿着第一轨道151输送至免疫筛查模块12,以供免疫筛查模块12对样本进行检测;或者沿着第一轨道151和第二轨道152输送至形态学检测模块13,以供形态学检测模块13对样本进行检测。在一些实施方式中,第一轨道151和第二轨道152共轨或者相互连接,这时候,即时检测模块11安装于轨道模块15的一端,形态学检测模块13安装于轨道模块15的另一端,而免疫筛查模块12安装于即时检测模块11和形态学检测模块13之间的轨道模块15上,即,免疫筛查模块12夹在即时检测模块11和形态学检测模块13之间。
请参阅图1,在一些实施方式中,样本检测系统10还包括储样腔16,轨道模块15还包括第三轨道153,储样腔16设于即时检测模块11的前端,储样腔16用于储存样本,并且储样腔16通过第三轨道153与即时检测模块11连接,从而可以通过第三轨道153将样本分别输送至即时检测模块11、免疫筛查模块12以及形态学检测模块13进行检测。通过储样腔16,可以保证样本在整个检测过程中不被污染或者干扰或者不会出现其他意外情况。
在一些实施方式中,样本检测系统10还包括送样装置(图中未标示)送样装置与轨道模块15可移动连接,并与轨道模块15协同作用,以进一步提高样本的输送效率。送样装置与控制模块14连接,由控制模块14控制送样装置是否向即时检测模块11、免疫筛查模块12以及形态学检测模块中13中送样。
请参阅图1至图4,本发明实施例提供的样本检测系统10的基本工作过程如下:
请参阅图1和图2,将样本放置在样本检测系统10的储样腔16中;
控制模块14控制送样装置从储样腔16将适量样本转移至轨道模块15上,并由轨道模块15输送至即时检测模块11(如图2的箭头所示),并控制即时检测模块11工作,由即时检测模块11生成对应的第一反馈信息;
即时检测模块11将第一反馈信息反馈给控制模块14,控制模块14根据第一反馈信息,控制是否启动免疫筛查模块12;
请参阅图1和图3,若控制模块14根据第一反馈信息确认需要对样本进行免疫筛查检测,则控制模块14控制送样装置从储样腔16中将适量样本转移至轨道模块15上,并由轨道模块15输送至免疫筛查模块12中(如图3的箭头所示),同时启动免疫筛查模块12工作,由免疫筛查模块12生成对应的第二反馈信息;
免疫筛查模块12将第二反馈信息反馈给控制模块14,控制模块14根据第二反馈信息,控制是否启动形态学检测模块13;
请参阅图1和图4,若控制模块14根据第二反馈信息确认需要对样本进行免疫筛查检测,则控制模块14控制送样装置从储样腔16中将适量样本转移至轨道模块15上,并由轨道模块15输送至免形态学检测模块13中(如图4的箭头所示),同时启动形态学检测模块13工作,由形态学检测模块13生成样本的形态学信息并反馈给控制模块14,控制模块14控制形态学检测模块13输出最终的检测结果。
请参阅图5,第四方面,本发明实施例提供一种样本的检测方法,包括以下步骤:
步骤S01、提供样本。
在一些实施方式中,所述样本包括人体细胞、人血液、人体分泌物中的任一种。样本的获取,一般是将采集到的人体细胞、人血液、人体分泌物等标本进行预处理,从而得到样本。
具体地,标本的预处理可以按照如下的方式进行:
步骤S011、将采集到的标本转移至棉签中;
步骤S012、将棉签浸泡在缓冲液里,浸泡约10min后,将棉签放至医药废弃物收集装置等不易引起感染或污染的地方,缓冲液中溶入标本,由此得到样本,将样本在适宜的环境中保存,待用。
在一些实施方式中,缓冲液中主要含有0.15mol/L的NaCl、0.01mol/L的甘露醇以及0.75mmol/L的异噻唑啉酮。
步骤S02、取步骤S01得到的样本,进行即时检测,获得第一检测结果。
具体地,即时检测包括进行核酸提取处理、核酸扩增以及核酸的检测。
其中,核酸的提取处理步骤可以按照以下的方法进行:
步骤S021、将10μL~20μL步骤S01的样本溶于20μL~40μL的溶解剂中,混匀;
步骤S022、待样本完全溶解后进行离心处理,静置待用。
其中,溶解剂中含有0.8M的异硫氰酸胍、体积分数为0.6%的聚乙二醇辛基苯基醚(Triton X100)、体积分数为0.6%的吐温20(Tween-20)以及100μg/mL的蛋白酶K。由于该溶解剂在-20℃中保存,使用前在冰上复融、过滤即可。本发明实施例提供的溶解剂,在无需强酸碱及高温的条件下即可将样本中细胞以及HPV等的核酸释放出来,从而可以有效地保证后续的扩增过程的顺利进行。
步骤S023、对步骤S022得到的核酸进行扩增处理。
具体地,核酸扩增处理采用重组酶聚合酶扩增(英文全称:RecombinasePolymerase Amplification;简称:RPA)反应方式。具体可以使用本发明第二方面的试剂盒,也可以使用TwistDx试剂盒(英文全称:TwistAmp Liquid Basic Kit;货号:TALQBAS01)进行,使用TwistDx试剂盒时,需要加入本发明第一方面的引物对。此外,当然也可以使用其他即用型RPA检测试剂盒进行扩增处理。
在一种实施方式中,采用TwistDx试剂盒进行RPA扩增处理,具体包括以下步骤:
(1)、在10.0μL包含单链DNA结合蛋白酶、链置换DNA聚合酶和能结合单链核酸的重组酶这三种混合酶的反应体系中加入2.0μL步骤S022得到的核酸液,混匀。
(2)、向步骤(1)中加入2.0μL本发明第一方面发明方案中提供的引物对制成的引物液,混匀。
在一些实施方式中,所述引物液中,所述引物对1、所述引物对2、所述引物对3及所述引物对4的摩尔比为(1.1~1.3):(1.4~1.6):(1.8~2.2):(0.9~1.1)。在一些实施方式中,先分别将引物对1、引物对2、引物对3及引物对4稀释到浓度为5.0μM~15.0μM之后再加入。当然,在其他浓度的条件下添加也可以,只要保证可操作及最后各个引物对的摩尔比在上述比例范围均可行。
在一些优选的实施方式中,所述引物液中所述引物对1、所述引物对2、所述引物对3、所述引物对4的摩尔比为1.2:1.5:2.0:1.0。在该投料比例下,可以保证所有的目的基因能够下稳定扩增且扩增效果优异,能够在3min~15min内即可扩增至可检测的水平,同时Tm值较为稳定,从而有利于提高检测效率,结合引物对1至引物对4对人乳头瘤病毒具有高敏感性和特异性,因此可有效降低检测结果出现假阴性或假阳性,从而有利于提高检测的准确度。
(3)、向步骤(2)中加入1.0μL的探针1、1.0μL的探针2、1.0μL的探针3及1.0μL的探针4,随后加入双蒸水补齐至20.0μL;其中,所述探针1以FAM标记;所述探针2以HEX标记;所述探针3以CY3标记;所述探针4以CY5标记。
(4)、在37℃~42℃的温度下进行反应。
本发明实施例使用的扩增为恒温扩增方式,在上述反应温度条件下,只需少量核酸分子可在3min~15min即可扩增至可检测水平。
步骤S024、对步骤S023扩增得到的核酸进行核酸的检测处理。
具体地,使用荧光终点分析法对核酸进行检测,经过核酸检测,得到第一检测结果,第一检测结果用于显示样本中是否存在人乳头瘤病毒和显示所述人乳头瘤病毒是否为黏膜高危型。
其中,若第一检测结果显示样本中不含有人乳头瘤病毒,则停止检测;
若第一检测结果显示样本中含人乳头瘤病毒,即,则判断所述人乳头瘤病毒是否为黏膜高危型;
若所述人乳头瘤病毒显示为非黏膜高危型,则停止检测;
若所述人乳头瘤病毒显示为黏膜高危型,则进行步骤S03的检测。
步骤S03、取步骤S01得到的样本,并对样本进行免疫检测,以获得第二检测结果。
具体地,第二检测结果用于显示样本中E6蛋白和/或E7蛋白的表达量以及将E6蛋白和/或E7蛋白的表达量和预设阈值进行比较。
在一些实施方式中,E6蛋白和/或E7蛋白的表达量包括以下步骤:
步骤S031、对样本进行固定。
具体是将50μL~100μL的样本固定在玻片上,使用磷酸盐吐温缓冲液(PBST)进行1~5次洗脱,使得未固定的样本被洗脱。
步骤S032、抗体的孵育。
具体是向步骤S031的玻片中加入标记好的荧光抗体,在常温至37℃的条件下孵育30min,采用PBST进行1~5次洗脱,每次2min,使得未与样本结合的抗体被洗脱。
荧光抗体包括与E6蛋白特异性结合的第一抗体和/或与E7蛋白特异性结合的第二抗体。
在一些实施方式中,第一抗体包括HPV16 E6/18E6抗体(C1P5-FITC;货号:sc-460FITC;200μg/mL;使用前可按照1:50~1:500稀释);所述第二抗体包括HPV16 E7抗体(ED17-PE;货号:sc-6981PE;200μg/mL;使用前可按照1:50~1:500稀释)。
在一些实施方式中,第一抗体携带的荧光标记物为异硫氰酸荧光素(FITC);所述第二抗体携带的荧光标记物为藻红素(PE)。
步骤S033、荧光强度检测。
利用荧光扫描仪记录荧光强度或者使用酶标仪检测显色深度,从而间接判断E6蛋白和/或E7蛋白的表达量。
步骤S031~S033中,对每个样品进行三次平行对照检测,并根据三次检测的结果取平均值,由平均值确定E6蛋白和/或E7蛋白的表达量。
对于第二检测结果,即获得E6蛋白和/或E7蛋白的表达量数据后,做如下的分析判断:
若E6蛋白和/或E7蛋白的表达量低于预设阈值,则停止检测;
若E6蛋白和/或E7蛋白的表达量超过预设阈值,则进行步骤S04的检测。
在一些实施方式中,E6蛋白的预设阈值为10ng/mL;E7蛋白的预设阈值为10ng/mL。
此外,对于步骤S03,还可以使用ELISA方法、化学发光免疫分析技术等来获得E6蛋白和/或E7蛋白的表达量信息,再与预设阈值进行比较。
其中,当使用ELISA的方法来获得E6蛋白和/或E7蛋白的表达量信息时,包括以下步骤:
将样本稀释后加到ELISA板上,以将目标蛋白固定于ELISA板的孔底;使用与E6蛋白特异性结合的抗体和/或与E7蛋白特异性结合的抗体孵育后洗去多余的未结合的抗体,再孵育带有HRP标记的二抗,洗去多余二抗后用3,3',5,5'-四甲基联苯胺(TMB)显色,可定量和定性检测E6/E7蛋白。其中,与E6蛋白特异性结合的抗体包括HPV16 E6/18E6(C1P5):m-IgG Fc BP-HRP套装(货号:sc-528112);与E7蛋白特异性结合的抗体包括HPV16 E7(ED17):m-IgG Fc BP-HRP套装(货号:sc-526488)。
当使用化学发光免疫分析技术时,根据不同的标记方法可选择直接化学发光、酶促化学发光和电化学发光等。
如,直接化学发光是用吖啶酯直接标记E6/E7抗体,与待测样本中相应的抗原发生免疫反应后,形成固相包被抗体-待测抗原-吖啶酯标记抗体复合物,这时加入氧化剂(H
又如,酶促化学发光是以酶标记E6/E7抗体进行免疫反应,免疫反应复合物上的酶再作用于发光底物,在信号试剂作用下发光,用发光信号测定仪进行发光测定,酶的浓度决定了化学发光的强度。辣根过氧化物酶(HRP)和碱性磷酸酶(ALP)为化学发光酶免疫分析常用的标记酶,发光底物以鲁米诺、1,2-二氧环已烷衍生物(AMPPD)为代表。
再如,电化学发光技术是以电化学发光剂三联吡啶钌标记抗体,以三丙胺(TPA)为电子供体,在电场中因电子转移而发生特异性化学发光反应,它包括电化学和化学发光两个过程。在电化学发光免疫分析系统中,磁性微粒为固相载体包被抗体,用三联吡啶钌标记抗体,在反应体系内待测样本与相应的抗体发生免疫反应后,形成磁性微粒包被抗体-待测抗原-三联吡啶钌标记抗体复合物,这时将上述复合物吸入流动室,同时引入TPA缓冲液。当磁性微粒流经电极表面时,被安装在电极下面的电磁铁吸住,而未结合的标记抗体和样本被缓冲液冲走。与此同时电极加压,启动电化学发光反应,使三联吡啶钌和TPA在电极表面进行电子转移,产生电化学发光,光的强度与待测抗原浓度成正比。对于电化学发光技术,则与E6蛋白特异性结合的抗体包括HPV16 E6/18E6抗体(C1P5)(货号:sc-460);与E7蛋白特异性结合的抗体包括HPV16 E7抗体(ED17)(货号:sc-6981)。
步骤S04、取步骤S01得到的样本,进行细胞形态学检测,并输出第三检测结果,第三检测结果即为细胞形态学的检测结果。
具体地,将样本固定在玻片上,然后按照巴氏染色(TCT)进行染色,染色结束后,将玻片置于显微镜下观察,并将观察到的结果输出。在一些实施方式中,显微镜还包括摄像机,通过将摄像机与计算机联机,即可将观察到的细胞形态学结果进行拍摄,上传,以供分析。
在一些实施方式中,还可以对步骤S04输出的细胞形态学检测结果进行进一步的分析。如,根据细胞形态学检测结果,如果结果显示正常,未见上皮内病变及恶性病变则建议定期复查;如果结果显示微生物感染及反应性细胞性改变,则建议进一步进行阴道镜及病理学诊断;如果结果显示意义不明的不典型鳞状细胞(ASCUS),则提示有癌变风险,建议进行进一步确诊;如果结果显示低度鳞状上皮内病变(LSIL),则提示有一定癌变可能,需进行病理学诊断;如果结果显示高度鳞状上皮内病变(HSIL),则有较大可能出现癌变,尽快进行检查并作出相应治疗;如果结果显示鳞状细胞癌(SCC),则极有可能已经出现较严重病变,需立即进行病理检查,并配合医生治疗。
在一些实施方式中,样本的检测方法采用样本检测系统10进行检测。
根据步骤S01至步骤S04,对鳞状上皮细胞样本进行检测,具体如下:
首先,对鳞状上皮细胞进行即时检测,即对鳞状上皮细胞进行核酸的提取,以及对提取得到的核酸进行RPA扩增。
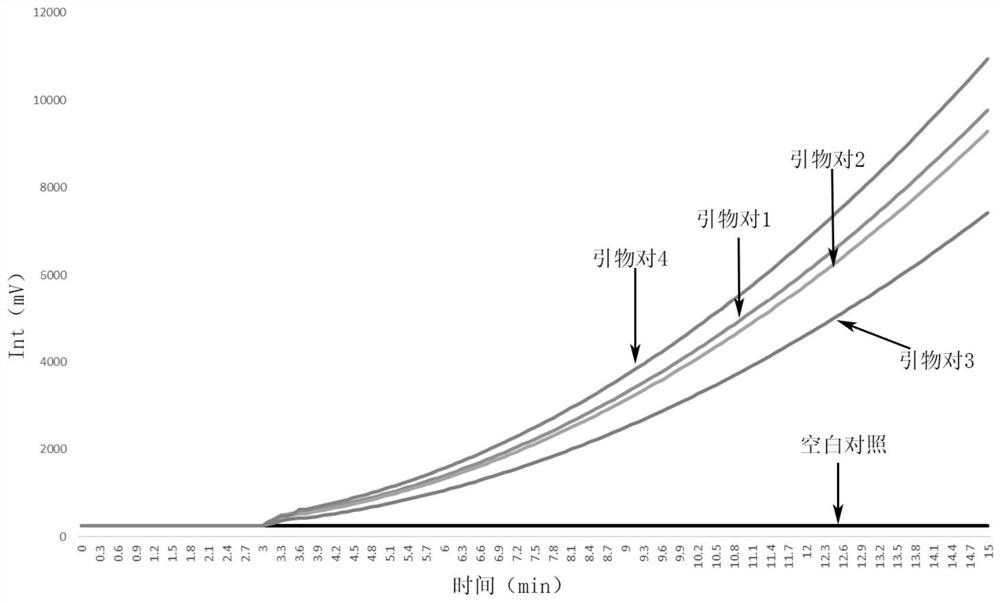
在RPA扩增时,向TwistDx试剂盒的反应体系中加入的引物液中,按照摩尔比,引物对1:引物对2:引物对3:引物对4=1.2:1.5:2:1;空白对照的反应体系中不添加引物液,3min后用荧光扫描仪上机进行荧光强度检测,每0.1s检测一次,汇总得到如图6所示的曲线。
从图6可以看出,引物对1、引物对2、引物对3以及引物对4均能成功地扩增出目标产物,且在15min内荧光累积呈指数增长,而空白对照无扩增的趋势。
其次,对鳞状上皮细胞样本进行免疫检测,具体是参照步骤S03对鳞状上皮细胞进行染色,结果如图7和图8所示。
从图7可以看出第一抗体将表达在鳞状上皮细胞的E6蛋白染成绿色,并且E6蛋白的表达量超过预设阈值。从图8可以看出第二抗体将表达在鳞状上皮细胞的E7蛋白染成红色,并且E7蛋白的表达量超过预设阈值。
再次,对鳞状上皮细胞样本进行细胞形态学检测,具体是进行巴氏染液染色观察,结果如图9所示。
从图9中可以看出,方框部分是比较典型的核质比变大,这个检测结果提示样本已经有低级别细胞病变,需要引起重视。
由此可见,本发明实施例提供的样本的检测方法,先按照先分子层面的即时检测确定样本中是否含有HPV以及免疫筛查E6蛋白、E7蛋白的表达量,再于细胞学层面进行筛查确认。整个样本的检测过程先微观再宏观,并且在微观层面,采用了多重恒温扩增技术,一方面,可以避免假阳性和假阴性,保证检测的准确率;另一方面,可以在同一时间内检测出HPV16和HPV18这两种黏膜高危型HPV病毒,有效地减少了HPV检测的难度、提高了检测的效率,同时可以避免假阳性或者假阴性,最终提高了样本检测的准确性。
以上所述的仅是本发明的实施方式,在此应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出改进,但这些均属于本发明的保护范围。
序列表
<110> 深圳市瑞图生物技术有限公司
<120> 引物对及其应用和试剂盒、样本检测系统及检测方法
<160> 12
<170> SIPOSequenceListing 1.0
<210> 1
<211> 32
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
aaggcttgtt tgggcttgtg ttggagttga ag 32
<210> 2
<211> 32
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
tcaactccag cattagcagc gtaagctgaa gc 32
<210> 3
<211> 32
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
taataaggtg cctgcggtgc cagaaaccgt tg 32
<210> 4
<211> 35
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
ttggagtcgt tcctgtcgtg ctcggttgca gcacg 35
<210> 5
<211> 34
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
tgggtcgagt tggtccaaga ctgttgtctc ttac 34
<210> 6
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
tcgtcgtcgc aacaacaatg ttcgttgtgg 30
<210> 7
<211> 36
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
agacaagagg taagtgcggc ggaggcagat acgatg 36
<210> 8
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
attcgcctcc acctccacta accgccaccg c 31
<210> 9
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
ctgacatatc tacttgagaa mctag 25
<210> 10
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
tactacacag tytcgtgtac ctgg 24
<210> 11
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 11
tgccattatg cacggaagta amtaatgaag 30
<210> 12
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 12
tacgatgaac actgaagcac ctgtcccgat g 31
- 用于检测沙门氏菌的引物系统和试剂盒以及他们的应用和检测沙门氏菌的方法
- 一种A型塞尼卡病毒检测引物、试剂盒、病毒检测方法和应用
- 用于检测控制玉米茎秆强度主效QTL连锁的分子标记的引物、试剂盒、检测方法及应用
- 一种检测支原体的引物、试剂盒、检测方法和应用
- 人参病程相关基因及其检测引物、试剂盒及应用与检测方法
- 用于检测HBV核酸的引物组、探针、试剂盒及检测样本中HBV核酸的方法
- 用于检测HBV核酸的引物组、探针、试剂盒及检测样本中HBV核酸的方法
