一种K252c衍生物的生物合成方法及其应用
文献发布时间:2023-06-19 18:34:06
技术领域
本发明属于生物医药领域,涉及一种K252c衍生物的生物合成方法及其应用。
背景技术
癌症严重威胁人类健康,其诱发因素往往源于信号通路中激酶的异常活化。另外,自身免疫病、神经退行病等常见高发慢性病也与激酶异常密切相关。2001年,第一个激酶抑制剂类药物格列卫(Gleevec)在美获批上市,开启了癌症靶向治疗新时代,疗效显著优于化疗。截至2019年底,FDA共批准了52个激酶抑制剂。虽然数量较多,但由于癌症种类繁多、涉及的异常激酶众多且变异类型多样、以及使用后耐药等因素,癌症在临床上仍存在重大未满足的治疗需求。另外,这些上市药物仅靶向大约25个激酶,仅占人体518个激酶中的5%,尚有大量激酶暂未成药。因此,这类药物研发空间巨大。
抗肿瘤新药主要来源于天然产物类似物。因此,有效合成天然产物类似物的创新技术对于新药发现来说至关重要。天然产物往往结构复杂,含有多个手性中心。相对于化学合成,因具有严格的区域和立体选择性,生物合成更有优势。尤其是合成生物学原理与技术的日益成熟,使得天然产物类似物的有效合成易于实现。
双吲哚生物碱是一类含有两个吲哚基团的天然产物,代表化合物为具有抗肿瘤活性的星孢菌素(Staurosporine)。星孢菌素是一种来源于放线菌的天然产物,具有广谱强效的激酶抑制活性。据不完全统计,星孢菌素能够有效抑制200多种人体激酶,多个激酶的半抑制浓度(IC50)能够达到nM级别。开发双吲哚生物碱类似物的有效合成技术,是促成这类化合物广泛成药的关键因素。
星孢菌素的生物合成基因簇DNA序列在2002年被测定,天然合成酶系被初步识别。随后,多个天然合成酶如StaO、StaD、StaP、StaC等的催化活性在体外生化实验中得到证实,式I显示了星孢菌素的生物合成途径,其中R基团表示=O或者=NH,两者可逆。
基于已鉴定的星孢菌素的生物合成途径酶系,研究人员在异源宿主白色链霉菌(Streptomyces albus)体内实现了多个双吲哚生物碱类似物的生物合成,例如,以色氨酸为起始使用酶组合RebO,RebD,RebP和StaC实现了K252c的合成,上述组合均在白色链霉菌中表达,且产量均未知。
因此,一方面,提供一种合成星孢菌中间体(即K252c)的生物合成路径对于提高星孢菌素的产量具有重要意义,另一方面(更为重要的是),K252c作为合成星孢菌素的中间体,其本身也具有广谱强效的激酶抑制活性,也具有较多的激酶作用靶点,然而本领域公知,靶点越多,其毒性往往越强,而且基于目前药物领域逐渐趋于特异性作用的研究趋势,如何筛选出特异性好、毒性小的抗癌药物具有重要的意义。
为解决这一问题,本发明首次提出从K252c的衍生物入手,提供一种快速、方便、低成本合成K252c的衍生物的方法,并从这些衍生物中筛选得到具有激酶抑制活性的同时激酶靶点少(最好为1-3个)的化合物来作为药物合成中间体,对于特异性好、毒性小的抗癌药物的筛选和研发而言具有重要的意义。
发明内容
针对现有技术的不足,本发明的目的在于提供一种K252c衍生物的生物合成方法及其应用。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供一种K252c衍生物的生物合成方法,所述K252c衍生物的结构为
所述R
所述生物合成方法包括:将重组质粒转入大肠杆菌,得到重组大肠杆菌,活化后,将菌株、培养基、诱导剂与原料化合物混合,诱导培养,得发酵液,萃取,即得所述K252c衍生物;
所述重组质粒携带编码L-色氨酸氧化酶VioA、CPA合成酶VioB、单加氧酶RebP和单加氧酶SpcC的核苷酸序列;
所述原料化合物的结构为
所述R
特别说明,本申请采用所述方法对于具有上述结构的K252c衍生物都成功合成了,由于暂未进行激酶抑制活性的测试或测试结果不理想,因此未展示所有化合物的具体结果。本领域技术人员应当知晓,采用本申请提供的方法对于具有上述结构的K252c衍生物来说均适用。
优选地,所述K252c衍生物选自4F-K252c-1、4F-K252c-2或4,4’F-K252c中的任意一种,分别依次对应如下结构:
所述原料化合物的结构为
优选地,所述重组质粒包括pETDuet系列、pACYCDuet系列、pRSFDuet系列、pCOLADuet或pCDFDuet系列表达载体中的任意一种。
优选地,所述重组质粒包括pCDFDuet-1_vioAvioBrebPspcC。
优选地,所述大肠杆菌包括大肠杆菌BL21(DE3)。
优选地,所述培养基包括M9培养基。
M9培养基中不含色氨酸,避免了K252c的产生。
优选地,所述诱导剂包括IPTG(异丙基-β-D-硫代半乳糖苷)。
优选地,所述IPTG的加入量为0.3-0.5mM,例如0.3mM、0.32mM、0.35mM、0.37mM、0.4mM、0.42mM、0.45mM、0.47mM、0.5mM等。
优选地,所述原料化合物的加入量为3-5mM,例如3mM、3.2mM、3.5mM、3.7mM、4mM、4.2mM、4.5mM、4.7mM、5mM等。
优选地,所述诱导培养的温度为15-25℃,例如15℃、17℃、20℃、22℃、25℃等,所述诱导培养的时间为36-48h,例如36h、38h、40h、42h、44h、46h、48h等。
优选地,所述活化包括:将重组大肠杆菌接种至LB培养基中进行活化培养。
优选地,所述活化培养的温度为33-40℃,例如33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃等。
优选地,所述萃取中使用的萃取试剂包括乙酸乙酯。
优选地,所述萃取在15-40℃下进行,例如15℃、17℃、20℃、22℃、25℃、27℃、30℃、32℃、35℃、37℃、40℃等。
优选地,所述萃取前还包括对发酵液进行加热,所述加热的温度为80-90℃,例如80℃、81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、89℃、90℃等,所述加热的时间为10-20min,例如10min、11min、12min、13min、14min、15min、16min、17min、18min、19min、20min等。
第二方面,本发明提供如第一方面所述的K252c衍生物的生物合成方法或由所述生物合成方法合成的K252c衍生物在制备抗癌药物中的应用。
第三方面,本发明提供如第一方面所述的K252c衍生物的生物合成方法或由所述生物合成方法合成的K252c衍生物在制备激酶抑制剂中的应用。
优选地,所述激酶抑制剂包括ALK5抑制剂、FLT3ITD抑制剂、PIM1抑制剂或PIM3抑制剂中的任意一种或至少两种的组合。
优选地,当所述K252c衍生物为4,4’F-K252c时,所述激酶抑制剂为FLT3ITD抑制剂、PIM1抑制剂或PIM3抑制剂中的任意一种或至少两种的组合。
优选地,当所述K252c衍生物为4F-K252c-1,所述激酶抑制剂为FLT3ITD抑制剂和/或PIM1抑制剂。
优选地,当所述K252c衍生物为4F-K252c-2时,所述激酶抑制剂为ALK5抑制剂、FLT3ITD抑制剂或PIM1抑制剂中的任意一种或至少两种的组合。
本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
相对于现有技术,本发明具有以下有益效果:
本发明首次提出从K252c的衍生物入手,提供一种快速、方便、低成本合成K252c的衍生物的方法,并从这些衍生物中筛选得到具有激酶抑制活性的同时激酶靶点少(最好为1-3个)的化合物来作为药物合成中间体,对于特异性好、毒性小的抗癌药物的筛选和研发而言具有重要的意义。
具体地,本发明采用所述方法同时合成了3种K252c衍生物:4F-K252c-1、4F-K252c-2和4,4’F-K252c,产物之间可以相互分离,且不受其他物质干扰,纯度高,产量高,合成方法快速、方便、低成本。
本发明提供的3种K252c衍生物仅有2-3个激酶靶点,远少于K252c,因此在特异性、毒性方面相较于K252c具有显著优势。可用于制备对于特异性、毒性要求高的抗癌药物。
其中4,4’F-K252c意外地具有抑制PIM3的作用,而这是K252c所不具备的。可用于制备PIM3抑制剂或以PIM3为靶点的抗癌药物。
附图说明
图1是实施例1中所得产物的LC/MS检测图谱,其中A为产物在316nm处的紫外吸收图谱;其中,3.277min、3.407min和3.538min处的蜂分别对应4F-K252c-1、4,4’F-K252c和4F-K252c-2;B为产物中质荷比(m/z)为330(M+1)的离子图谱,框出的两处蜂分别对应4F-K252c-1和4F-K252c-2;C为产物中质荷比(m/z)为348(M+1)的离子图谱,对应4,4’F-K252c。
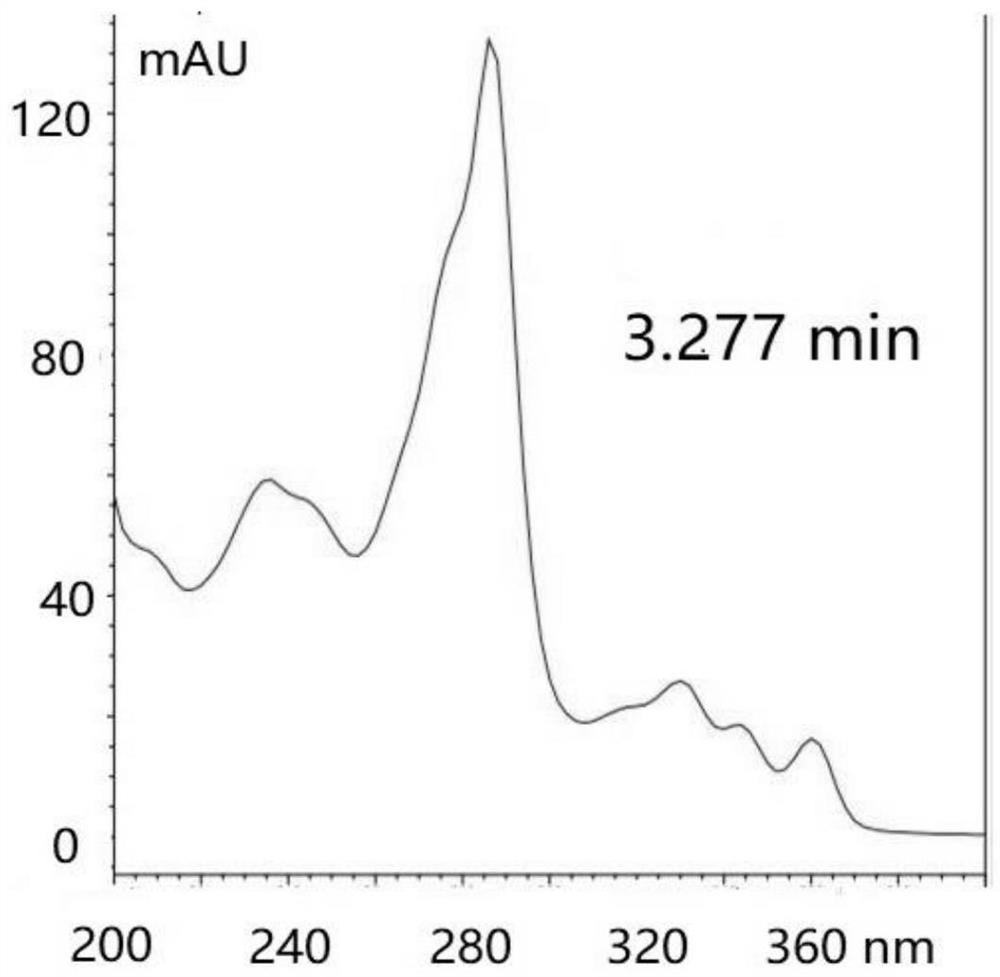
图2为实施例1中LC/MS检测图谱中4F-K252c-1(3.277min)紫外吸收峰所对应蜂的全波长扫描图谱。
图3为实施例1中LC/MS检测图谱中4,4’F-K252c(3.407min)紫外吸收峰所对应蜂的全波长扫描图谱。
图4为实施例1中LC/MS检测图谱中4F-K252c-2(3.538min)紫外吸收峰所对应蜂的全波长扫描图谱。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
以下实施例中,若无特殊说明,所有的试剂及耗材均购自本领域常规试剂厂商;若无特殊说明,所用的实验方法和技术手段均为本领域常规的方法和手段。
本发明中涉及的重组质粒pCDFDuet-1_vioAvioBrebPspcC的制备方法为本领域常规技术手段,例如可参照CN112980864A中的实施例1的方法。
实施例1
将重组质粒pCDFDuet-1_vioAvioBrebPspcC转入大肠杆菌BL21(DE3),挑取单克隆接种至含10mL LB培养基的试管中,37℃,200rpm振荡培养。待菌液OD600增长至0.6-0.8时,4℃,6000rpm离心取菌泥,加入M9(葡萄—矿物盐)培养基悬浮菌泥,得菌液,并加入0.4mMIPTG诱导酶蛋白表达,同时加入4mM4F-L-Trp(购自苏州爱玛特生物科技有限公司),温度降至20℃,振荡培养42h。
发酵结束后,金属浴85℃加热15min,然后冷却至室温(25℃)加入1倍体积的乙酸乙酯充分混匀进行萃取,37℃,200rpm,30min后离心收集有机相上清,并重复一次。将收集到的有机相上清合并后,在40℃蒸干,加入50μLDMSO溶解后进行LC/MS检测。
所述大肠杆菌中K252c衍生物的合成路径如式Ⅱ所示:
LC/MS检测结果如图1所示,A为产物在316nm处的紫外吸收图谱,其中,3.277min、3.407min、3.538min处的蜂分别对应4F-K252c-1(全波长扫描结果见图2)、4,4’F-K252c(全波长扫描结果见图3)和4F-K252c-2(全波长扫描结果见图4);B为产物中质荷比(m/z)为330(M+1)的离子图谱,框出的两处蜂分别对应4F-K252c-1和4F-K252c-2;C为产物中m/z为348(M+1)的离子图谱,对应4,4’F-K252c。而产物在m/z为312(K252c的质荷比)处并无出峰。
上述结果证实了本实施例成功合成了3种K252c衍生物:4F-K252c-1、4F-K252c-2和4,4’F-K252c,各衍生物可以相互分离,且无K252c干扰。
实施例2
将重组质粒pCDFDuet-1_vioAvioBrebPspcC转入大肠杆菌BL21(DE3),挑取单克隆接种至含10mL LB培养基的试管中,37℃,300rpm振荡培养。待菌液OD600生长至0.6-0.8时,4℃,8000rpm离心取菌泥,加入M9(葡萄—矿物盐)培养基悬浮菌泥,得菌液,并加入0.4mMIPTG诱导酶蛋白表达,同时加入3mM 4F-L-Trp,温度降至23℃,振荡培养38h。
发酵结束后,金属浴90℃加热10min,然后冷却至室温加入2倍体积的乙酸乙酯充分混匀进行萃取,37℃,200rpm,30min后离心收集有机相上清,并重复一次。将收集到的有机相上清合并后,在40℃蒸干,加入50μL DMSO溶解后进行LC/MS检测。
结果:本实施例成功合成了3种K252c衍生物:4F-K252c-1、4F-K252c-2和4,4’F-K252c,各衍生物可以相互分离,且无K252c干扰。
实施例3
将重组质粒pCDFDuet-1_vioAvioBrebPspcC转入大肠杆菌BL21(DE3),挑取单克隆接种至含10mL LB培养基的试管中,38℃,200rpm振荡培养。待菌液OD600生长至0.6-0.8时,4℃,5000rpm离心取菌泥,加入M9(葡萄—矿物盐)培养基悬浮菌泥,得菌液,并加入0.4mMIPTG诱导酶蛋白表达,同时加入5mM4F-L-Trp,温度降至18℃,振荡培养48h。
发酵结束后,金属浴80℃加热20min,然后冷却至室温加入2倍体积的乙酸乙酯充分混匀进行萃取,37℃,200rpm,30min后离心收集有机相上清,并重复一次。将收集到的有机相上清合并后,在40℃蒸干,加入50μL DMSO溶解后进行LC/MS检测。
结果:本实施例成功合成了3种K252c衍生物:4F-K252c-1、4F-K252c-2和4,4’F-K252c,各衍生物可以相互分离,且无K252c干扰。
测试例
分别对实施例1合成的3种衍生物进行激酶抑制活性测试,同时将K252c一并测试,进行对比。该测试委托由上海润诺生物科技有限公司进行,利用Mobility shift assay的方法,分别测试待测化合物对于不同种激酶的抑制率,待测化合物的测试浓度为1000nM,单浓度,复孔检测。结果见表1(抑制率为50%以上则视为该化合物对于该激酶有抑制活性,“-”表示低于50%,无抑制活性)。
表1
结果显示,虽然各待测化合物结构比较接近,但其在激酶的抑制方面差异显著。K252c对于大多数激酶均有抑制活性,但对于PIM3不具备抑制活性。本发明合成的K252c衍生物4,4’F-K252c对PIM3、FLT3ITD和PIM1这三种激酶具有抑制活性。4F-K252c-1对FLT3ITD和PIM1这两种激酶具有抑制活性。4F-K252c-2对FLT3ITD、PIM1和ALK5这三种激酶具备抑制活性。
分析以上结果可知,本发明提供的3种K252c衍生物仅有2-3个激酶靶点,远少于K252c,因此在特异性、毒性方面相较于K252c具有显著优势。
4,4’F-K252c意外地具有抑制PIM3的作用,而这是K252c所不具备的。
申请人声明,本发明通过上述实施例来说明本发明的一种K252c衍生物的生物合成方法及其应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
- 一种N-(6-羟基己基)咔唑衍生物及N-(6-羟基己基)咔唑及其衍生物的合成方法
- 一种F-18标记的5-氨基乙酰丙酸衍生物、合成方法及应用
- 一种吲唑类衍生物的合成方法及抗肿瘤应用
- 一种具有抗菌活性的苯佐卡因单取代衍生物的合成方法和应用
- 一种异氟尓酮硝基的衍生物及其合成方法和应用
- 一种星孢菌素中间体K252c及其衍生物的催化合成体系及催化合成方法
- K252c衍生物的制备方法和在制备抗肿瘤转移药物中的应用
