检测miRNA-21的荧光壳聚糖纤维的制备方法及检测miRNA-21的方法
文献发布时间:2023-06-19 18:46:07
技术领域
本发明涉及分子生物学领域,涉及miRNAs的检测分析技术,具体涉及一种检测miRNA-21的荧光壳聚糖纤维的制备方法及检测miRNA-21的方法。
背景技术
miRNAs是内源的微小非编码RNA,可调节基因表达,在各种癌症的发生、发展和治疗中发挥重要作用。换言之,它们作为致癌的miRNA或肿瘤抑制的miRNA(tsmiRNA),可以调节许多肿瘤的生物学功能,包括细胞增殖和凋亡,血管生成,侵入,迁移和转移。临床上已在PDAC患者中发现了几种miRNA失调,也发现许多可能在PC的启动、进展和转移中起重要作用的miRNA。因此将其视为PC的早期诊断、预后和有益治疗的潜在生物标志物。其中miRNA-21在胰腺癌患者中的表达显著升高,可以作为胰腺癌早期诊断的潜在生物标志物。
传统的Northern印迹和原位杂交检测技术费操作繁琐且缺乏灵敏度。芯片技术和定量聚合酶链式反应(qPCR)等新技术虽然功能先进,但由于其复杂性,仍然仅限于中央实验室。因此,迫切需要开发更加简便的技术来检测miRNA的水平。
经典基因和肿瘤标志物检测分别主要基于聚合酶链反应(PCR)和酶联免疫吸附测定技术(ELISA)。尽管PCR和ELISA是灵敏的方法,但它们昂贵、费时,并且需要专业的技术人员以及严格的实验条件。因此,迫切需要一种成本低、检测时间短,灵敏度高,易于使用且专用的工具来检测PanIN和早期诊断PDAC。
生物传感器旨在通过将生物识别转换为可以检测和分析的可测量信号,对特定的生物分析物进行定性和半定量检测。荧光生物传感器是灵敏、特异且具有成本效益的设备,可以直接评估体液,例如血液,血清,尿液,唾液等的一些特性。然而目前荧光检测仍然存在一些困境,例如背景信号泄露严重、光漂白、与背景荧光光谱相重叠等等。因此开发一种荧光生物传感器系统,快速、高选择性和高灵敏度地进行miRNAs的检测仍然是一项非常有意义的挑战。本课题组曾研发出一种FITC-壳聚糖微米纤维联合光波导平台进行miRNA-198的检测。相较于荧光素与壳聚糖凝胶的直接耦连,通过化学反应形成酰胺键,使得罗丹明B与壳聚糖分子的连接更加广泛和牢固,并且相较于FITC,罗丹明-B光稳定性更好。
发明内容
本发明针对现有技术的不足,提供一种检测miRNA-21的荧光壳聚糖纤维的制备方法及检测miRNA-21的方法,制备一维荧光壳聚糖纤维,并结合荧光共振能量转移原理、CHA放大原理、toehold调控的链替换反应及浓缩富集效应等,设计灵敏度高、特异性强的新型生物传感器用于在复杂的生物环境中微量miRNA-21的检测。
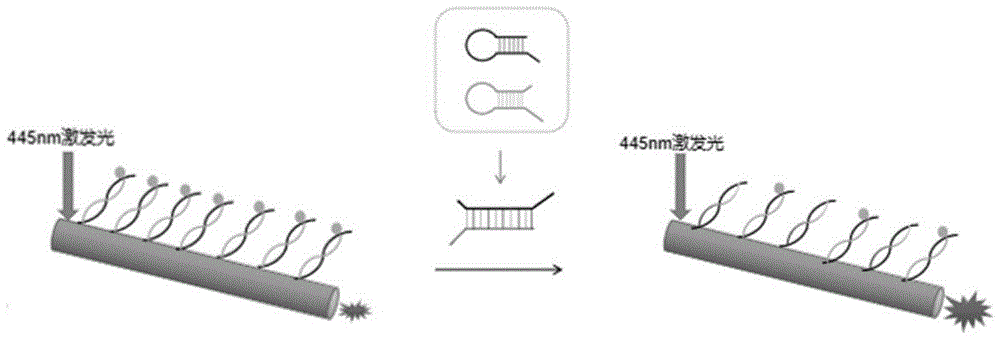
本发明提供了一种BHQ2修饰的荧光壳聚糖纤维对于胰腺癌相关microRNA-21的微量检测方法。该方法基于目标分子miRNA-21催化hairpin探针组装,形成双链结构并进行循环放大,通过toehold取代荧光壳聚糖纤维上带有淬灭基团BHQ2的probe2,从而使微米管端头光波导由淬灭转而恢复。随着反应循环进行,低浓度的目标miRNA-21就可产生高的信号,而单碱基变异,三碱基变异以及其他microRNA产生极低的信号。该检测方法,对miRNA-21显示了极高的灵敏性和选择性,检测过程简便、灵敏、快速,检测结果准确。
本发明的目的通过如下技术方案实现:
一种检测miRNA-21的荧光壳聚糖纤维的制备方法,包括将罗丹明B溶于乙腈中制备罗丹明B溶液,将N-羟基琥珀酰亚胺(NHS)溶于乙腈中制备N-羟基琥珀酰亚胺溶液,将罗丹明B溶液和N-羟基琥珀酰亚胺溶液混合于容器中,水浴加热并搅拌;将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)完全溶解于乙腈中,并滴加入所述容器中,反应,室温搅拌,旋干,得到羧基活化的罗丹明B-NHS产物,溶解于Na
具体地,一种检测miRNA-21的荧光壳聚糖纤维的制备方法:将罗丹明B溶于乙腈中制备罗丹明B溶液,将N-羟基琥珀酰亚胺(NHS)溶于乙腈中制备N-羟基琥珀酰亚胺溶液,将罗丹明B溶液和N-羟基琥珀酰亚胺溶液混合于锥形瓶中,45℃水浴加热并搅拌。将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)完全溶解于乙腈中,并滴加入锥形瓶,45℃反应1小时,室温搅拌12h,旋干,得到羧基活化的罗丹明B-NHS产物,溶解于PH约为11.0的Na
优选地,所述壳聚糖为中等分子量(80-200)*10
本发明还提供了一种非诊断目的的检测miRNA-21的方法,包括以下步骤:
步骤一、将单链DNA探针probe1修饰到如上所述的方法制备的荧光壳聚糖纤维上,将碱性条件(1mol/L Na
步骤二、将带有荧光淬灭基团BHQ2的DNA探针probe2修饰到荧光壳聚糖纤维上进行荧光淬灭,所述probe2与所述probe1部分碱基互补配对,通过DNA的链杂交反应将接有淬灭基团BHQ2的probe2修饰到荧光壳聚糖纤维上,根据荧光共振能量转移原理进行荧光淬灭;
步骤三、将淬灭后的荧光壳聚糖纤维与CHA反应所需的发夹探针H1、发夹探针H2以及含有目标miRNA-21的样品混合,检测荧光淬灭后的荧光壳聚糖纤维端头光波导荧光亮度的变化;miRNA-21作为催化剂通过toehold催化发夹探针H1、发夹探针H2杂交形成双链结构,形成的双链H1-H2替换下probe2,使微米管端头光波导荧光恢复;
步骤四、将microRNA-21,单碱基突变,、三碱基突变的microRNA-21,microRNA-198,以及不含miRNA的发夹探针H1、发夹探针H2放置于CHA链置换反应中,来反映探针组对miRNA-21的特异性;所述探针组包括发夹探针H1、发夹探针H2、探针probe1和探针probe2,所述发夹探针H1的序列如SEQ ID NO:3所示;所述发夹探针H2的序列如SEQ ID NO:4所示;发夹探针H1和发夹探针H2会形成发夹结构,在目标miRNA-21的存在下会催化两个发夹探针组装成双链,形成双链的探针会取代与probe1部分碱基互补配对的probe2,将杂交成双链的probe1探针和probe2探针分开。
进一步地,所述probe1探针的序列如SEQ ID NO:1所示;所述probe2探针的序列如SEQ ID NO:2所示。
进一步地,所述发夹探针H1的序列如SEQ ID NO:3所示;所述发夹探针H2的序列如SEQ ID NO:4所示。
本发明还提供一种检测miRNA-21的探针组,包括H1探针和H2探针,所述H1探针的序列如SEQ ID NO:3所示;所述H2探针的序列如SEQ ID NO:4所示。
进一步地,H1和H2探针会形成发夹结构,在目标miRNA-21的存在下会催化两个发夹探针装配成双链,形成双链的探针会将杂交成双链的probe1探针和probe2探针分开。
本发明提供一种检测miRNA-21的试剂盒,包括如上所述探针组。
特别地,本发明通过如下实现:
一种荧光壳聚糖纤维的制备方法,所制备的罗丹明B-壳聚糖粉末与中等分子量的壳聚糖粉末以质量比为1:1溶解于三氟乙酸中,机械搅拌均匀,制得粘度很高的罗丹明B-壳聚糖凝胶,可以通过手工拉丝的方法制出纤维,再置于碱性环境中除酸,完成荧光壳聚糖纤维的制备。
一种检测miRNA-21的方法,包括如下步骤:
步骤1、称取0.8g罗丹明-B溶于60ml乙腈,0.2g N-羟基琥珀酰亚胺(NHS)溶于20ml乙腈,二者于锥形瓶中混合均匀,45℃加热,磁子搅拌。称取0.37g 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)溶于50ml乙腈,溶解完全后用滴管缓慢加入前述锥形瓶中,45℃反应1h,室温搅拌过夜,旋干,真空干燥。该反应使罗丹明-B羧基活化,得到活化酯。
步骤2、称取0.53g碳酸钠固体,溶于500ml水配成0.01mol/L的Na
步骤3、称取0.6g步骤2制得的罗丹明B-壳聚糖粉末和0.6g中等质量的壳聚糖粉末,混合均匀,再溶于14ml三氟乙酸中,机械搅拌10h,使其完全溶解得到流动性均匀的凝胶,溶解过程中控制在25-30℃之间。
步骤4、取下盛有凝胶的锥形瓶,室温下放置于通风橱中8h,使三氟乙酸充分挥发,得到粘度较高的荧光壳聚糖凝胶,可通过是否能拉出细丝来判断。利用针管和U型玻璃槽手工制备粗细均匀(30-40微米)的纤维,将生产出的纤维干燥12-18h,去除大部分三氟乙酸。称取5.3gNa
步骤5、将probe1修饰到罗丹明B-壳聚糖纤维上。把经碳酸钠溶液浸泡的荧光壳聚糖纤维浸没在乙二醇二缩水甘油醚溶液中,室温下反应12h。用大量1*TAE缓冲液(PH约为7.2-8.4之间)冲洗,TAE缓冲液(TAE Buffer)是由三羟甲基氨基甲烷(Tris base)、乙酸(acetic acid)和乙二胺四乙酸(EDTA)组成的缓冲液,得到双环氧基团修饰的荧光壳聚糖纤维。再将5’端氨基修饰的probe1探针(60μL,10μM)与接有双环氧基团的罗丹明B-壳聚糖纤维37℃反应6h,得到probe1修饰的荧光壳聚糖纤维。
步骤6、根据碱基互补配对原则,将5’端修饰有BHQ2淬灭基团的probe2探针(60μL,10μM)与probe1修饰的荧光壳聚糖纤维于95℃加热10min,再自然冷却至37℃杂交反应4h,通过荧光共振能量转移(FRET)使罗丹明B-壳聚糖纤维上的红色荧光淬灭。步骤5、6中,都需要用1*TAE缓冲液反复冲洗荧光壳聚糖纤维,将表面黏附的DNA分子清除。
步骤7、通过CHA(催化发夹自组装)循环放大反应进行淬灭荧光壳聚糖纤维的荧光恢复。将放大探针H1和H2分别配置成溶液后先置于95℃反应10分钟再自然冷却至37℃,反应形成发夹结构。配置含有100nM H1、400nM H2的溶液,并向该溶液中加入不同浓度的目标microRNA-21,37℃反应1小时,随后将制备好的BHQ2@罗丹明B-壳聚糖纤维平铺于玻片表面,滴加含H1,H2,microRNA-21的溶液,反应4h。在此过程中,miRNA-21作为CHA反应的催化剂,可提高罗丹明-B荧光壳聚糖纤维传感器检测目标分子的灵敏度,降低反应极限。
步骤8、通过光波导平台检测罗丹明B-壳聚糖纤维端头荧光强度的变化。以miRNA-21浓度为横坐标,以纤维端头光波导荧光亮度增强为纵坐标作图。
步骤9、分别用相同浓度(500fM)的miRNA-21、单碱基突变的miRNA-21、三碱基突变的miRNA-21、miRNA-198加入含有100nM的H1、400nM的H2的溶液中进行CHA循坏放大反应,以及不加任何miRNA做对照,发现只有加入miRNA-21时罗丹明B-壳聚糖纤维端头光波导荧光恢复程度高,说明荧光壳聚糖纤维对miRNA-21具有高特异性。
与现有技术相比,本发明具有如下优点和效果:
高效检测微量miRNA-21,检测过程简便、灵敏、快速,检测结果准确,检测手段简单。本发明和其他基于罗丹明B-壳聚糖纤维的CHA循环放大方法检测miRNA-21都将被保护起来。
附图说明
图1实施例1,罗丹明-B壳聚糖粉末的制备原理与过程。a为两个反应步骤方程式;b为通过检测不同浓度的罗丹明-B溶液(0.02mg/ml、0.04mg/ml、0.06mg/ml、0.08mg/ml、0.1mg/ml)和固定浓度的罗丹明B-壳聚糖粉末酸溶液(3.4mg/ml)的紫外吸收值,计算出所制备的罗丹明B-壳聚糖粉末的罗丹明-B接枝率约为1%;c为不同质量比混合的罗丹明B-壳聚糖粉末和无色壳聚糖粉末(2:1、3:1、1:2、1:1,以及纯染色壳聚糖)溶于酸后涂膜测荧光强度,确定最合适质量比为1:1。
图2实施例1,罗丹明B-壳聚糖纤维生产制备的过程。荧光壳聚糖纤维的表征图如下,a为罗丹明B-壳聚糖纤维的荧光显微镜图;b为SEM图,可见纤维直径大约在30微米左右;c为罗丹明B-壳聚糖纤维的光波导图;d为罗丹明B-壳聚糖纤维的紫外吸收图,从图中可见该材料的吸收峰在554nm左右;e、f为罗丹明B-壳聚糖纤维的发射光谱,激发波长分别为445nm和532nm。
图3实施例2,probe1修饰到罗丹明B-壳聚糖纤维上。a为probe1修饰到荧光壳聚糖纤维上的简易图示过程;b为修饰上环氧后接入DNA探针probe1的罗丹明B-壳聚糖纤维的红外光谱与未接probe1罗丹明B-壳聚糖纤维的红外光谱图。前者在1038、1263、1386、1390cm
图4实施例3,BHQ2-probe2修饰罗丹明B-壳聚糖纤维后的荧光光波导变化。a为probe2修饰到纤维上简易图示;b为probe2修饰前后荧光显微镜图;c为在445nm激光下,纤维端头荧光光波导明显减弱;d为,BHQ2-probe2修饰前后的荧光光谱图,激发波长为532nm。
图5实施例4,图5为CHA循环放大反应的简易图示,在已修饰上BHQ2-probe2探针的罗丹明B-壳聚糖纤维体系中,445nm蓝光激发,纤维端头荧光微弱,当靶标miRNA-21存在时,催化形成H1-H2杂交双链,取代一部分带淬灭基团的probe2,端头荧光恢复。
图6实施例4,将已淬灭的罗丹明B-壳聚糖纤维固定于干净玻片上,滴加含有H1、H2以及不同浓度的miRNA-21混合液,通过光波导平台检测纤维端头荧光恢复情况,以miRNA-21浓度的对数值为横坐标,荧光强度变化为纵坐标作图。a为实验发现,在该纤维体系中,加入从80fM到1000fM浓度范围内的miRNA-21,纤维端头荧光逐渐恢复,且端头荧光变化与miRNA-21的浓度成比例关系;b为加入1000fM miRNA-21反应前后同一根纤维端头荧光强度对比,可以看到,反应后荧光有所恢复;c为,反应液中含有1000fM miRNA-21时,滴在8根铺平的罗丹明B-壳聚糖纤维上进行CHA循环放大反应,通过光波导平台检测纤维端头荧光,以反应前后平均灰度值的差值为纵坐标绘图,相对标准偏差(RSD)为7.9%。
图7实施例4,分别用500fM的miRNA-21、单碱基错配miRNA-21、三碱基错配miRNA-21、miRNA-198作靶标,混合100nM H1、400nM H2进行CHA反应,以及只有H1、H2,无miRNA的情况作对比,可以总结出该体系对检测miRNA-21的特异性和专一性较强。
具体实施方式
下面结合附图及具体实施例详细介绍本发明。但以下的实施例仅限于解释本发明,本发明的保护范围应包括权利要求的全部内容,而且通过以下实施例的叙述,本领域的技术人员是可以完全实现本发明权利要求的全部内容。
本发明以下实施例中,所使用的原料如下:
壳聚糖粉末为购自aldrich公司的中等分子量的壳聚糖。
本发明所有DNA探针都是从上海生工生物公司购得。
实施例1
称取0.8g罗丹明-B溶于60ml乙腈,0.2g N-羟基琥珀酰亚胺(NHS)溶于20ml乙腈,二者于锥形瓶中混合均匀,45℃加热,磁子搅拌。称取0.37g 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)溶于50ml乙腈,溶解完全后用滴管缓慢加入前述锥形瓶中,45℃反应1h,室温搅拌过夜,旋干,真空干燥。该反应使罗丹明-B羧基活化,得到活化酯。称取0.53g碳酸钠固体,溶于500ml水配成0.01mol/L的Na
称取0.6g所述的罗丹明B-壳聚糖粉末和0.6g壳聚糖粉末,混合均匀,再溶于14ml三氟乙酸中,机械搅拌10h,使其完全溶解得到流动性均匀的凝胶,溶解过程中控制在25-30℃之间。取下盛有凝胶的锥形瓶,室温下放置于通风橱中8h,使三氟乙酸充分挥发,得到粘度较高的荧光壳聚糖凝胶,可通过是否能拉出细丝来判断。利用针管和U型玻璃槽手工制备粗细均匀(30-40微米)的纤维,将生产出的纤维干燥12h,去除大部分三氟乙酸。称取5.3gNa
如图2所示,罗丹明B-壳聚糖纤维的表征图如下。a为罗丹明B-壳聚糖纤维的荧光显微镜图;b为SEM图,可见纤维直径大约在30微米左右;c为罗丹明B-壳聚糖纤维的光波导图;d为罗丹明B-壳聚糖纤维的紫外吸收图,从图中可见该材料的吸收峰在554nm左右;e、f为罗丹明B-壳聚糖纤维的发射光谱,激发波长分别为445nm和532nm,发射波长为595nm。
实施例2
将实施例1制备的经碳酸钠溶液浸泡的荧光壳聚糖纤维捞出,然后浸没在乙二醇二缩水甘油醚溶液中,室温下反应12小时。用大量1*TAE缓冲液(PH约为7.2-8.4之间)冲洗,得到双环氧基团修饰的荧光壳聚糖纤维。再将5’端氨基修饰的probe1探针(60μL,10μM)与双环氧基团修饰的罗丹明B-壳聚糖纤维37℃反应6h,得到probe1修饰的荧光壳聚糖纤维。
如图3所示,probe1修饰到罗丹明B-壳聚糖纤维上。a为probe1修饰到荧光壳聚糖纤维上的简易图示过程;b为修饰上环氧后接入DNA探针probe1和未接probe1的罗丹明B-壳聚糖纤维的红外光谱。前者多出来的1038cm
以上所有的DNA探针都是从上海生工生物公司购得。
实施例3
根据碱基互补配对原则,将5’端修饰有BHQ2淬灭基团的probe2探针(60μL,10μM)与实施例2制得的probe1修饰的荧光壳聚糖纤维于95℃加热10min,再自然冷却至37℃杂交反应4h。杂交所使用的缓冲溶液为TAE缓冲溶液。反应完成后,用针管从溶液中挑出淬灭后的荧光壳聚糖纤维,用1*TAE缓冲溶液轻轻地冲洗纤维数次,除去吸附的BHQ2-probe2。杂交后probe2的5’端的BHQ2淬灭基团的距离缩至10nm以下,通过荧光共振能量转移(FRET)使荧光壳聚糖纤维上的红色荧光淬灭。
如图4所示,BHQ2-probe2修饰罗丹明B-壳聚糖纤维后的荧光光波导变化。a为probe2修饰到纤维上简易图示;b为probe2修饰前后荧光显微镜图,同一根纤维在淬灭基团修饰后荧光强度明显衰弱;c为,在445nm激光下,同一根纤维端头荧光光波导明显减弱;d为BHQ2-probe2修饰前后的荧光光谱图,激发波长为532nm。
实施例4
将实施例3所制备的BHQ2-probe2修饰的罗丹明B-壳聚糖纤维固定在玻片上,然后滴加含有100nM H1、400nM H2以及不同浓度microRNA-21(80fM-1000fM),室温反应6h,然后进行光波导荧光变化的检测,见图6。在BHQ2-荧光壳聚糖纤维体系中,由445nm光激发后,纤维端头荧光微弱,当加入检测的miRNA-21以及CHA循环放大体系以后,微米管端头荧光增强,原理图见图5。
如图6所示,以miRNA-21浓度的对数值为横坐标,荧光强度变化为纵坐标作图,并计算检测极限。实验发现,在该纤维体系中,加入从80fM到1000fM浓度范围内的miRNA-21,纤维端头荧光逐渐恢复,且端头荧光变化与miRNA-21的浓度成比例关系。
分别用500fM的miRNA-21、单碱基错配miRNA-21、三碱基错配miRNA-21、miRNA-198作靶标,混合100nM H1、400nM H2进行CHA反应,以及只有H1、H2,无miRNA的情况作对比,五种情况下,只有将500fM microRNA-21作靶标时,才可以进行CHA循环放大反应,显示出较强的端头荧光恢复。以端头荧光平均灰度值I-I0作纵坐标作图,如图7所示,可以总结出该体系对检测miRNA-21的特异性和专一性较强。
SEQUENCE LISTING
需要说明的是,按照本发明上述各实施例,本领域技术人员是完全可以实现本发明独立权利要求及从属权利的全部范围的,实现过程及方法同上述各实施例;且本发明未详细阐述部分属于本领域公知技术。
以上所述,仅为本发明部分具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本领域的人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
