一种褐藻胶裂解酶突变体Pl7AaM及其应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明属于蛋白质理性设计及酶工程领域,具体涉及一种褐藻胶裂解酶突变体Pl7AaM及其应用。
背景技术
褐藻胶作为一种海洋酸性多糖,主要存在于褐藻细胞壁及细胞间质。褐藻胶主要由β-D-甘露糖醛酸及其C5差向异构体和α-L-古洛糖醛酸两种糖醛酸单体通过1,4糖苷键随机聚合而成。褐藻胶进一步分解便形成褐藻胶寡糖,研究表明褐藻胶寡糖具有多种生物活性如:抗氧化、抗衰老、抗肿瘤等。随着褐藻胶寡糖在农业种植领域的推广和应用发现其可以促进植物的生长,提高植物对病害的抵抗力,增强植物对环境的适应能力,提高作物产量和品质。
目前褐藻胶寡糖的制备方式主要包括化学法和酶法,其中化学法由于快速、简便以及低成本使其成为主流技术应用于褐藻胶寡糖的制备。但是化学法加工过程中所用的强酸强碱容易带来环境污染问题,此外容易破坏褐藻胶寡糖的天然结构,降低其生物活性。酶法作为一种新型技术目前越来越受到行业的重视,其具有反应条件温和、产物结构完好等优势。作为酶法加工的核心,褐藻胶裂解酶能够水解褐藻胶制备褐藻胶寡糖。在前期的研究中我们通过基因克隆获得了褐藻胶裂解酶Pl7Aa,其在褐藻胶寡糖制备领域具有很好的应用潜力,但是该酶热稳定性很差,不利于其产业化。因此提升褐藻胶裂解酶Pl7Aa的热稳定性具有重要意义。
发明内容
针对现有技术存在的缺陷,本发明提供了一种热稳定性提升的褐藻胶裂解酶突变体Pl7AaM,以褐藻胶裂解酶Pl7Aa为出发模板,通过结合二硫键和自由能优化两种蛋白质理性设计策略,获得了热稳定性提升的褐藻胶裂解酶突变体Pl7AaM,其核苷酸序列如SEQ IDNO.2所示;进一步对本发明获得的褐藻胶裂解酶突变体Pl7AaM进行表征分析,分析了褐藻胶裂解酶突变体Pl7AaM的特性发现,其在40℃和45℃的水浴处理1小时后的剩余酶活分别是Pl7Aa的2.2倍和8.2倍,有效地提高了褐藻胶裂解酶的热稳定性。
为了达到上述目的,本发明采用以下技术方案:
本发明的第一个目的是提供一种褐藻胶裂解酶突变体Pl7AaM,所述褐藻胶裂解酶突变体Pl7AaM的氨基酸序列如SEQ ID NO.1所示。
LDFYRWSLSIQTDDNGDGKADSIKEDELNAGFEDSRFFYTANDGGMTFFSEIDGYKTSTNTSYTRIELREMCRAGDTSIDTSGVNENNWVFSSAPSAAQNAACGVDGNMKATVAVNHVTSTGDSGQVGRVIIGQIHASSDEPVRLYYRLLPGHDKMSIYFAHEPANGNGEQWYDMIGSRSSSASEPSDGIALNEVFSYEIDVQGDTLTVKILREGKATVTETVDMSNSGYDVADEYMYFKAGVSKQNKTGDGDEYVQGTFYTLDATHD(SEQ ID NO.1)
优选的,编码所述氨基酸的序列为多聚核苷酸序列,所述多聚核苷酸序列如SEQID NO.2所示。
TTAGATTTTTATCGCTGGTCTTTGAGTATTCAAACTGATGACAATGGCGATGGTAAAGCTGACTCAATTAAAGAAGATGAACTTAATGCTGGCTTTGAAGATAGCCGATTCTTTTATACGGCAAATGATGGTGGCATGACGTTTTTCAGTGAAATTGATGGTTATAAAACGTCTACCAACACGAGTTATACACGCATCGAATTACGTGAAATGTGTAGAGCAGGCGATACCTCAATTGATACCTCTGGCGTGAATGAAAATAACTGGGTATTCAGTTCCGCGCCTAGCGCTGCACAAAATGCAGCGTGTGGAGTAGACGGAAATATGAAAGCCACTGTGGCGGTAAATCACGTGACGTCTACGGGTGACAGTGGACAAGTTGGCCGCGTCATTATTGGTCAAATTCATGCTTCTAGCGATGAGCCAGTGCGCTTGTATTACCGTTTGCTCCCTGGTCATGACAAAATGTCTATTTACTTTGCTCACGAGCCGGCCAATGGAAATGGAGAACAATGGTATGATATGATTGGATCTCGCTCAAGCTCGGCCTCTGAACCCTCTGACGGCATTGCGCTAAATGAAGTATTTAGCTACGAAATTGACGTTCAAGGCGATACGCTCACCGTGAAGATTCTTCGCGAAGGCAAAGCCACTGTAACCGAAACCGTAGACATGAGTAACAGCGGTTACGATGTTGCCGACGAGTACATGTACTTCAAAGCCGGTGTGTCCAAGCAGAACAAAACTGGTGATGGCGACGAATATGTGCAAGGCACATTTTATACACTAGATGCTACTCACGACTAA(SEQ ID NO.2)
本发明的第二个目的是提供一种重组表达载体pPICZαA-pl7aam,包含如上述所述的多聚核苷酸序列。
本发明的第三个目的是提供一种重组菌,包含如上述所述的重组表达载体pPICZαA-pl7aam。
优选的,所述重组菌以毕赤酵母工程菌作为宿主,所述毕赤酵母工程菌包括毕赤酵母X33。
本发明的另一个目的是提供一种如上述所述的褐藻胶裂解酶突变体Pl7AaM在制备褐藻胶寡糖中的应用。
优选的,所述褐藻胶寡糖通过采用褐藻胶裂解酶突变体Pl7AaM水解褐藻胶制备获得。
与现有技术相比,本发明具有以下有益效果:
本发明公开了褐藻胶裂解酶突变体Pl7AaM及其应用。本发明提供了一种热稳定性提升的褐藻胶裂解酶突变体Pl7AaM,核苷酸序列如SEQ ID NO.2所示,其在40℃和45℃的水浴处理1小时后的剩余酶活分别是Pl7Aa的2.2倍和8.2倍,有效地提高了褐藻胶裂解酶的热稳定性。本发明提供的褐藻胶裂解酶突变体Pl7AaM还可用于制备重组载体、重组菌株,以毕赤酵母为重组表达宿主,实现了褐藻胶裂解酶Pl7AaM的高效表达,可用于制备褐藻胶寡糖,进一步为其广泛应用奠定基础。
附图说明
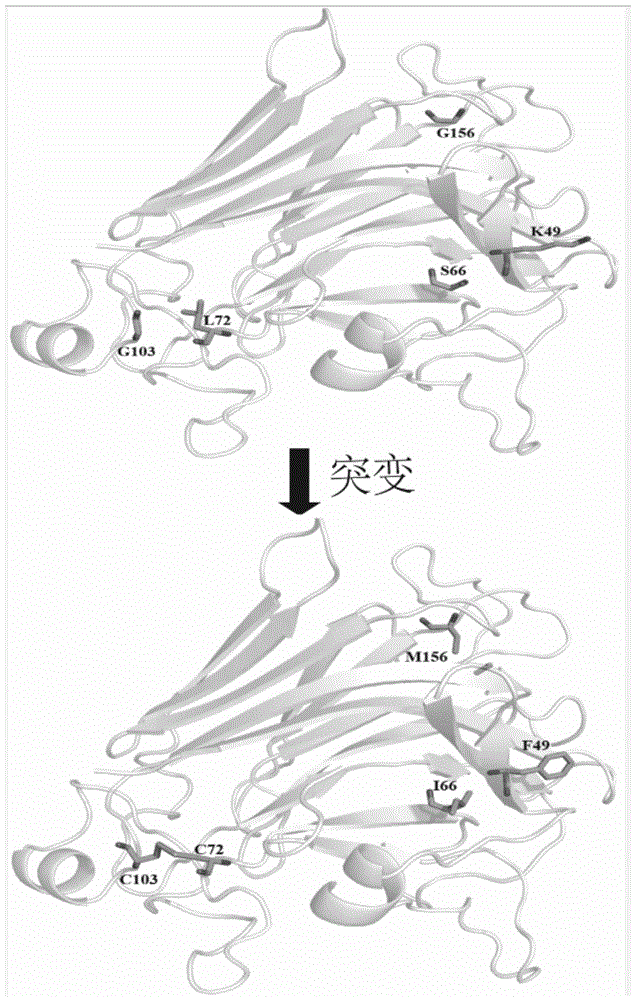
图1为褐藻胶裂解酶Pl7Aa及突变体Pl7AaM三维构象图;
图2为褐藻胶裂解酶Pl7Aa及突变体Pl7AaM蛋白电泳图;
图3为褐藻胶裂解酶Pl7Aa及突变体Pl7AaM最适反应温度及热稳定性图;
图4为褐藻胶裂解酶Pl7Aa及突变体Pl7AaM最适反应pH图。
具体实施方式
以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下实施例。
以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)J.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行;所述试剂和生物材料,如无特殊说明,均可从商业途径获得。本发明中涉及到的实验材料和试剂:
1、菌株与载体
毕赤酵母X33、大肠杆菌菌株Top10以及表达载体pPICZαA均从商业途径购买获得。表达载体pPICZαA-pl7aa由前期实验构建,构建过程大致如下:
(1)将前期获得的解脂交替单胞菌R1(购自中国普通微生物菌种保藏管理中心,菌种编号为CGMCC1.15735)接入LB液体培养基,20℃,200rpm培养3天;(2)取培养好的菌液1mL,在95℃,热处理10分钟后作为PCR扩增模板;(3)以热处理后的菌液为模板,通过引物pl-fw和引物pl-rev进行PCR扩增,获得基因pl7aa,所述引物pl-fw和引物pl-rev的序列信息如下SEQ ID NO.3和SEQ ID NO.4所示;(4)分别用限制性内切酶EcoRI和NotI酶切基因pl7aa和表达载体pPICZαA,将酶切好的pl7aa和表达载体pPICZαA纯化回收;(5)将酶切好的基因pl7aa和表达载体pPICZαA进行连接反应,转入大肠杆菌top10,通过筛选和测序鉴定最终获得表达载体pPICZαA-pl7aa。
引物pl-fw的序列信息:5'-ACGAATTCTTAGATTTTTATCGCTGGTCT-3'(SEQ ID NO.3);
引物pl-rev的序列信息:5'-ATAGCGGCCGCTTAGTCGTGAGTAGCATCTAG-3'(SEQ IDNO.4)。
其中,载体pPICZαA的基因序列信息可参见网址:https://www.thermofisher.cn/order/catalog/product/V19520?ICID=search-product,表达载体pPICZαA-pl7aa的基因序列信息如SEQ ID NO.5所示。其中,双直线下划线的为启动子5’AOX1序列信息,虚线下划线的为α信号肽序列信息,划波浪线部分为pl7aa的基因的序列信息,直线下划线的为Zeocin抗性基因序列信息。
/>
/>
2、酶与试剂盒
高保真Taq酶
3、培养基
大肠杆菌培养基为LB(1%(w/v)蛋白胨,0.5%(w/v)酵母提取物,1%(w/v)NaCl,pH7.0)。LBZ为LB培养基加25μg/mL Zeocin(博莱霉素)。
酵母培养基为YPD(1%(w/v)酵母提取物,2%(w/v)蛋白胨,2%(w/v)葡萄糖)。酵母筛选培养基为YPDZ(YPD+不同浓度zeocin)。
酵母诱导培养基BMGY(1%(w/v)酵母提取物、2%(w/v)蛋白胨、1.34%(w/v)YNB、0.00004%(w/v)Biotin、1%甘油(V/V))和BMMY培养基(除以0.5%(v/v)甲醇代替甘油,其余成份相与BMGY相同)。
注:YNB为酵母氮源基础(Yeast Nitrogen Base);Biotin为生物素。
4、褐藻胶裂解酶活性测定所用试剂
采用DNS法测定褐藻胶裂解酶活性,主要的试剂包括底物海藻酸钠(浓度为0.5%,m/v)和显色剂DNS试剂(6.3‰(w/v)3,5-二硝基水杨酸;18.2%(w/v)四水酒石酸钾钠;5‰(w/v)苯酚;5‰(w/v)无水亚硫酸钠)。
实施例1褐藻胶裂解酶Pl7Aa三维建模及分子动力学分析
通过在线软件SWISS-MODEL(参见网址:https://swissmodel.expasy.org/)对褐藻胶裂解酶Pl7Aa进行同源建模。过程大致如下:(1)同源比对寻找建模模板,通过比对分析发现褐藻胶裂解酶Pl7Aa与来源于克雷白氏菌的褐藻胶裂解酶(PDB蛋白登录号:4ozx.1.A)相似性最高;(2)以克雷白氏菌褐藻胶裂解酶为模板,进行三维同源建模,获得褐藻胶裂解酶Pl7Aa三维构象;(3)通过在线软件SAVES v6.0(参见网址:https://saves.mbi.ucla.edu/)的拉式图和SWISS-MODEL在线网站的QMEANDisCo Global对Pl7Aa三维构象进行质量评估,通过分析发现Pl7Aa三维构象结构合理,可以用于下一步实验分析。
在进行分子动力学模拟前,先通过软件Swiss-PdbViewer对褐藻胶裂解酶Pl7Aa三维构象进行能量最小化处理。将能量最小化后的褐藻胶裂解酶Pl7Aa进行分子动力学模拟,从而获得其蛋白柔性区域,为热稳定性改造提供技术参考。通过分子动力学模拟软件Gromacs 2019.06对褐藻胶裂解酶Pl7Aa进行分析,模拟过程中,蛋白质使用amber_ff14SB力场,小分子配体使用GAFF力场,GAFF力场中使用RESP电势,其中RESP电势的拟合是使用Multiwfn 3.6软件配合Gaussian 16.0软件完成的。将蛋白质/配体模型置于立方体盒子中,蛋白质距离盒子的最小距离为1.1nm,进行50ns的模拟,模拟步长为2fs,每10ps贮存1次数据。通过分析模拟结果发现,褐藻胶裂解酶Pl7Aa存在多个蛋白柔性区域,如第10位异亮氨酸至第23位异亮氨酸区域、第72位亮氨酸至第80位天冬氨酸区域、第183位丙氨酸至195位缬氨酸区域和第229位甘氨酸至第237位甲硫氨酸等区域。
褐藻胶裂解酶Pl7Aa三维构象中由于柔性区域较多,当温度大于35℃,其柔性区域的结构容易发生变化,从而引起褐藻胶裂解酶Pl7Aa变性失活。因此定向提高这些区域的刚性,可以提升褐藻胶裂解酶Pl7Aa的热稳定性。
实施例2二硫键理性设计提升褐藻胶裂解酶Pl7Aa热稳定性
通过在线二硫键设计软件Disulfide by Design(参见网址:http://cptweb.cpt.wayne.edu/DbD2/index.php)定向的对褐藻胶裂解酶Pl7Aa设计二硫键。通过预测分析褐藻胶裂解酶Pl7Aa三维构象,发现其潜在的二硫键有34对。结合软件Pymol分析褐藻胶裂解酶Pl7Aa三维构象,最终选择了7对二硫键进行实验,这7对二硫键分别为I10C-F37C、Q11C-T64C、D13C-Y55C、A20C-Y55C、L72C-G103C、R73C-N87C和M225C-S228C。根据不同二硫键设计相应的扩增引物,7对二硫键扩增引物序列如下表1SEQ ID NO.6~31所示。
表1二硫键突变体引物序列表
/>
不同二硫键突变体构建过程,主要包括PCR产物扩增和转化大肠杆菌两部分。本专利涉及的7对二硫键构建方法相同,只是扩增引物不同。以二硫键I10C-F37C为例,首先构建突变体I10C表达载体。
(以突变体I10C为例,其他以此类推)突变体I10C表达载体PCR产物扩增过程如下:(1)以表达载体pPICZαA-pl7aa为模板,通过引物I10C-fw和I10C-rev进行PCR扩增,扩增体系如表2所示,扩增条件大致如下:98℃,预变性30秒,98℃变性5秒,50℃退火20秒,72℃延伸20秒,扩增33个循环;(2)将获得的PCR扩增产物,通过琼脂糖电泳进行分析,通过纯化试剂盒将目标PCR产物进行纯化;(3)将限制性内切酶DpnI加入纯化后的PCR产物,酶解反应2小时后,纯化回收,用于转化实验。纯化回收过程大致如下:(1)将目标产物进行切胶放入2mL离心管;(2)加入溶胶液,在60℃条件下反应10分钟;(3)将第二步的溶胶液体加入收集管,10000rpm离心1分钟;(4)用75%乙醇洗两次后晾干;(5)加入50μL水,离心3分钟。
表2二硫键突变体PCR扩增体系
将纯化后的PCR产物转入大肠杆菌Top10,实验过程大致如下:(1)从-60℃冰箱取出大肠杆菌Top10感受态细胞,在冰上放置20分钟;(2)加入10微升PCR产物,冰上放置10分钟,42℃热激90秒,继续在冰上放置3分钟后加入500微升LB培养基,37℃,200rpm培养1小时;(3)将培养1小时后的菌液均匀涂布于LBZ固体平板,37℃,培养18小时后进行菌液PCR,菌液PCR反应体系如表3所示,反应条件如下:94℃,预变性4分钟,94℃变性30秒,50℃退火30秒,72℃延伸90秒,扩增33个循环;其中,菌液PCR所用引物为5’AOX-fw和3’AOX-rev,其中,引物5’AOX-fw的序列信息如SEQ ID NO.32所示,引物3’AOX-rev的序列信息如SEQ IDNO.33所示;(4)根据菌液PCR结果确定阳性转化子,提取阳性转化子的质粒进行测序,从而成功构建突变体I10C所对应的表达载体pPICZαA-i10c。
表3菌液PCR扩增体系
引物5’AOX-fw的序列信息:GACTGGTTCCAATTGACAAGC(SEQ ID NO.32)
引物3’AOX-rev的序列信息:GGCACCTGGCATTCTGACATCC(SEQ ID NO.33)
以突变体I10C所对应的表达载体pPICZαA-i10c为模板构建二硫键突变体I10C-F37C所对应的表达载体pPICZαA-i10c-f37c,实验过程和表达载体pPICZαA-i10c一致,只是将扩增引物换成F37C-fw和F37C-rev,最终获得二硫键突变体I10C-F37C所对应的表达载体pPICZαA-i10c/f37c。通过相同的方法分别获得表达载体pPICZαA-q11c/t64c(突变体Q11C-T64C)、pPICZαA-d13c/y55c(突变体D13C-Y55C)、pPICZαA-a20c/y55c(突变体A20C-Y55C)、pPICZαA-l72c/g103c(突变体L72C-G103C)、pPICZαA-r73c/n87c(突变体R73C-N87C)和pPICZαA-m225c/s228c(突变体M225C-S228C)。
分别用限制性内切酶SacI将7对二硫键所对应的表达载体(pPICZαA-i10c/f37c、pPICZαA-q11c/t64c、pPICZαA-d13c/y55c、pPICZαA-a20c/y55c、pPICZαA-l72c/g103c、pPICZαA-r73c/n87c和pPICZαA-m225c/s228c)线性化后,转入毕赤酵母X33,转化子均匀涂布于YPDZ固体平板,30℃,静置培养3至5天后进行筛选实验。其中,电转过程大致如下:(1)将酵母感受态细胞置于冰上放置20分钟;(2)加入100ng线性化后的表达载体,混匀冰上放置5分钟后进行电转化,电转化条件为1.5千伏,400欧姆;(3)电击完后立即加入0.6mL预冷的1M山梨醇至杯中,将内容物转移至灭菌离心管中;(4)30℃,静止放置2小时后涂布于YPDZ平板,培养2~3天后观察转化子的情况。
采用24孔板法筛选不同二硫键所对应的重组转化子,具体过程大致如下:将YPDZ平板上的重组转化子用牙签逐个挑至每孔含有2mL BMGY培养基的24孔板,30℃,200rpm过夜培养24小时后,4000rpm离心去掉上清,加入2mL的BMMY培养基,30℃,200rpm培养24小时,测定重组转化子褐藻胶裂解酶活性。根据酶活结果,进一步测定酶热稳定性。
褐藻胶裂解酶活性测定方法如下:(1)将海藻酸钠和稀释好的酶液在40℃分别预热5分钟;(2)分别取预热好的酶液50μL加入2mL离心管,然后再加入350μL海藻酸钠溶液(浓度为0.5%,m/v),40℃反应30分钟;(3)将600μL DNS显色剂加入反应溶液后,在100℃沸水浴10分钟进行显色;(4)待显色后的溶液冷却至室温,20分钟后,离心,取上清在在540nm下测定吸光值,整个测定过程以失活的酶液作为对照。褐藻胶裂解酶活性定义为:每30分钟生成1μmol葡萄糖当量的褐藻胶寡糖,所需要的酶量定义为一个活力单位。
热稳定性测试方法如下:将稀释好的酶液在40℃水浴保温60分钟后进行残留酶活测定,以没有热处理的样品作为对照。
通过筛选测定获得7对不同二硫键突变体所对应重组菌的酶活及热稳定性,测定结果如下表4所示。由表4可知,7对二硫键突变体中,有2对二硫键突变体能够提升出发模板Pl7Aa的热稳定性,其中突变体I10C-F37C效果最好,其次为L72C-G103C。突变体I10C-F37C和L72C-G103C在40℃水浴保温60分钟后剩余酶活分别为75.2%和62.5%,分别是对照PL7Aa(41.2%)的1.82倍和1.52倍。此外,突变体I10C-F37C虽然稳定性提升最明显,但是由于酶活太低,不具备产业化价值。
表4不同二硫键突变体重组菌发酵酶活及热稳定性
实施例3三维构象自由能优化提升热稳定性
以二硫键突变体L72C-G103C为模板,通过三维构象自由能优化进一步提升热稳定性。通过结合构象自由能优化在线软件PoPMuSiC2.1(参见网址:https://soft.dezyme.com/)、DeepDDG(参见网址:http://protein.org.cn/ddg.html)和FireProt(参见网址:https://loschmidt.chemi.muni.cz/fireprot/)的预测结果,最终挑选12个突变体进行实验,这12个突变体及其对应的自由能分别为D21P(-0.87kcal/mol)、K24P(-0.67kcal/mol)、K49F(-1.32kcal/mol)、K56W(-0.41kcal/mol)、S66I(-1.41kcal/mol)、N88P(-0.55kcal/mol)、A111I(-0.65kcal/mol)、G133F(-0.65kcal/mol)、Q134L(-0.83kcal/mol)、G156M(-1.17kcal/mol)、H162I(-0.94kcal/mol)和K240Y(-0.84kcal/mol)。
单点突变所用的引物如表5SEQ ID NO.34~57所示,单点突变体表达载体构建过程同实施列2中二硫键突变体构建过程一致,只是将扩增模板换成pPICZαA-l72c/g103c,扩增引物换成每个单点突变体所对应的引物。通过实验最终获得12个单点突变体所对应的表达载体,pPICZαA-l72c/g103c-d21p、pPICZαA-l72c/g103c-k24p、pPICZαA-l72c/g103c-k49f、pPICZαA-l72c/g103c-k56w、pPICZαA-l72c/g103c-s66i、pPICZαA-l72c/g103c-n88p、pPICZαA-l72c/g103c-a111i、pPICZαA-l72c/g103c-g133f、pPICZαA-l72c/g103c-q134l、pPICZαA-l72c/g103c-g156m、pPICZαA-l72c/g103c-h162i和pPICZαA-l72c/g103c-k240y。
表5自由能优化突变体引物序列表
分别用限制性内切酶SacI将12个单点突变体所对应的表达载体(pPICZαA-l72c/g103c-d21p、pPICZαA-l72c/g103c-k24p、pPICZαA-l72c/g103c-k49f、pPICZαA-l72c/g103c-k56w、pPICZαA-l72c/g103c-s66i、pPICZαA-l72c/g103c-n88p、pPICZαA-l72c/g103c-a111i、pPICZαA-l72c/g103c-g133f、pPICZαA-l72c/g103c-q134l、pPICZαA-l72c/g103c-g156m、pPICZαA-l72c/g103c-h162i和pPICZαA-l72c/g103c-k240y)线性化后,转入毕赤酵母X33,转化子均匀涂布于YPDZ固体平板,30℃,静置培养3至5天后进行筛选实验。重组转化子的筛选实验同实施列2一致。
通过筛选测定,12个单点突变体所对应重组菌的酶活及热稳定性如表6所示,由表6可知,在二硫键L72C-G103C的基础上叠加点突变K49F、S66I和G156M可进一步提升热稳定性。其中突变体L72C-G103C-K49F效果最好,其次分别为突变体L72C-G103C-G156M和突变体L72C-G103C-S66I。
表6不同单点突变体重组菌发酵酶活及热稳定性
以突变体L72C-G103C-K49F为模板,所用引物信息如上表5所示,将有效突变体进行进一步突变,实验过程同前面突变体构建一致,通过实验最终获得突变体L72C-G103C-K49F-S66I、L72C-G103C-K49F-G156M和L72C-G103C-K49F-S66I-G156M。分别构建这些突变体所对应重组酵母工程菌,并对这些重组工程菌进行筛选实验,实验过程同实施列2提供的方法一致。4个组合突变体的实验结果如表7所示,由表7可知,通过组合突变能够进一步提升热稳定性,其中突变体L72C-G103C-K49F-S66I-G156M效果最好,其在40℃水浴处理60分钟后,剩余酶活为95.8%,分别是突变体Pl7Aa、突变体L72C-G103C以及突变体L72C-G103C-K49F的2.32倍,1.52倍和1.34倍。为了便于书写,将最优突变体L72C-G103C-K49F-S66I-G156M命名为Pl7AaM,其对应的表达载体pPICZαA-l72c/g103c-k49f-s66i-g156m命名为pPICZαA-pl7aam。
表7不同单点突变体重组菌发酵酶活及热稳定性
实施例4 Pl7Aa及突变体Pl7AaM纯化及酶动力学参数测定
Pl7Aa及突变体Pl7AaM纯化过程如下:(1)首先将摇瓶培养发酵液离心收集上清液;(2)用10kDa超滤管将收集的上清发酵液进行浓缩;(3)将浓缩好的Pl7Aa及突变体Pl7AaM参照Ni-IDA蛋白纯化试剂盒(生工生物工程(上海)股份有限公司)进行纯化,从而分别获得纯化后的Pl7Aa及突变体Pl7AaM,蛋白电泳显示Pl7Aa及突变体Pl7AaM大小均为28kDa左右,Pl7Aa及突变体Pl7AaM蛋白电泳图如图2所示。
Pl7Aa及突变体Pl7AaM酶特性参数测定包括酶比活、米氏常数K
表8 Pl7Aa及突变体Pl7AaM酶特性参数
实施列5 Pl7Aa及突变体Pl7AaM最适反应温度及热稳定性
在pH8.0条件下测定Pl7Aa及突变体Pl7AaM在30℃-50℃不同温度下的酶活,以测定酶活最高温度下的酶活为100%,计算其他温度下的相对酶活。实验结果如图3A所示。
由图3A可知,Pl7Aa最适反应温度为40℃,在35℃至45℃范围内相对酶活大于60%;相比Pl7Aa,突变体Pl7AaM在高温条件下具有更好的活性,其最适反应温度为45℃。
在pH8.0条件下,分别将Pl7Aa及突变体Pl7AaM在30℃-50℃不同温度下水浴处理1小时后,测定剩余酶活,将没有处理样品的酶活设置为100%,实验结果如图3B所示。
由图3B可知,在30℃-35℃范围内,Pl7Aa及突变体Pl7AaM均具有良好的热稳定性,剩余酶活均大于95.2%。当处理温度变为40℃-50℃,Pl7Aa的热稳定性则急剧下降,其在40℃、45℃和50℃水浴处理1小时后,剩余酶活分别为43.6%、5.2%和0.5%。而突变体Pl7AaM在40℃、45℃和50℃水浴处理1小时后,剩余酶活分别为95.2%、42.6%和13.3%,分别是Pl7Aa的2.2倍、8.2倍和26.6倍。
实施例6 Pl7Aa及突变体Pl7AaM最适反应pH
在40℃和45℃条件下分别测定Pl7Aa及突变体Pl7AaM在pH4-9下的酶活,以测定酶活最高pH下的酶活为100%,计算其他pH下的相对酶活,实验结果如图4所示。
由图4可知,Pl7Aa及突变体Pl7AaM最适反应pH均为8.0,并且在在pH6-9范围内相对酶活均大于60.3%。此外当反应pH低于6.0,Pl7Aa及突变体Pl7AaM相对酶活均急剧下降,当反应pH为5.0,Pl7Aa及突变体Pl7AaM相对酶活分别仅为18.9%和16.2%。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 一种新型褐藻胶裂解酶、其制备方法及应用
- 褐藻胶裂解酶突变基因、褐藻胶裂解酶突变体、含该突变体的工程菌及构建方法和应用
- 褐藻胶裂解酶突变基因、褐藻胶裂解酶突变体、含该突变体的工程菌及构建方法和应用
