一种免疫组合物、其制备方法及应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及动物疫病防控领域,特别涉及一种免疫组合物、其制备方法及应用。
技术背景
羊梭菌病,是由梭状芽孢杆菌属中多种梭菌病原体感染引起羊的梭菌性传染病的总称。其中包括:羔羊痢疾、猝狙、肠毒血症、快疫、黑疫、破伤风和肉毒毒素中毒症等。其中,B型产气荚膜梭菌感染引起羔羊痢疾,C型产气荚膜梭菌感染引起羊猝狙,D型产气荚膜梭菌感染引起羊肠毒血症;腐败梭菌感染引起羊快疫;B型诺维氏梭菌感染引起羊黑疫;破伤风和肉毒毒素中毒症分别是由破伤风梭菌和肉毒梭菌感染引起的。
在众多梭菌病中,羊快疫、猝狙、羔羊痢疾和肠毒血症最常见,且常呈混合感染。其中,6~18月龄羊最易发生羊快疫,集中高发于秋冬和早春季节气温剧变时;6~24月龄羊最易发生羊猝狙,多呈散发性或地方流行性,主要集中于早春和秋冬季节的低洼或沼泽牧场;1月龄内羔羊最易发生羔羊痢疾,多在哺乳羊营养不良、产羔季节严寒或炎热时高发;2~12月龄绵羊最易发生羊肠毒血症,多散发,常发于春夏或秋冬换季时。羊梭菌病具有发病急、病程短、死亡率高、往往来不及治疗就已致死的特点。因此,疫苗免疫是预防本病的最有效手段,广大养殖户十分重视该类疫病的免疫防控。
目前使用最广的羊快疫、猝狙、羔羊痢疾、肠毒血症三联四防灭活疫苗,根据梭菌病原在繁殖过程中产生的外毒素蛋白具有良好的免疫原性,使用B或C型产气荚膜梭菌、D型产气荚膜梭菌和腐败梭菌的培养物经甲醛溶液灭活脱毒后,加以佐剂配制成苗。但由于配苗抗原中混有大量培养基,有效抗原含量较低,且生产工艺较繁杂、批间产毒不稳定、免疫剂量大,致使本疫苗在使用过程中存在免疫应激较大、保护效力欠佳等不足。中国兽医药品监察所运用血清中和法分别抽检了2006~2016年间生产的羊三联四防类疫苗,结果表明,B、C、D型产气荚膜梭菌效检不合格率分别为55.56%(15/27)、63.64%(21/33)和39.39%(13/33),综合不合格率为72.73%(24/33);腐败梭菌效检不合格率为45.45%(15/33)。由此可见,市售羊三联四防灭活疫苗不合格率较高。因此,提高疫苗有效抗原含量,或应用基因工程方法制备无生物毒性的重组产气荚膜梭菌α、β、ε毒素蛋白和腐败梭菌α毒素蛋白,以及提高培养基产毒稳定性、优化生产工艺、研制新型佐剂或改良铝胶佐剂稳定性、增加免疫次数等都将有助于提高该类疫苗的免疫效力。
发明内容
为了弥补现有技术的不足,解决现有技术中市售羊三联四防灭活疫苗中不合格率较高、培养基质量不易控制、有效抗原含量较低、免疫剂量大、免疫副反应较严重等问题,本发明提供了一种免疫组合物、其制备方法及应用。
为实现上述目的,本发明提出了如下方案:
本发明提供了一种免疫组合物,包括重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白和重组产气荚膜梭菌ε毒素蛋白;
所述重组腐败梭菌α毒素蛋白氨基酸序列如SEQ ID NO:2所示;
所述重组产气荚膜梭菌β1毒素蛋白氨基酸序列如SEQ ID NO:4所示;
所述重组产气荚膜梭菌ε毒素蛋白氨基酸序列如SEQ ID NO:6所示。
优选的,所述免疫组合物中包含重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白、重组产气荚膜梭菌ε毒素蛋白的质量比为1:2:2。
优选的,本发明所述的免疫组合物还包括药学上可接受的佐剂,所述佐剂为SP 01佐剂、MONTANIDETM ISA201VG佐剂和MONTANIDETM ISA 206VG佐剂中的至少一种,所述佐剂更优选为MONTANIDE
优选的,所述佐剂与所述免疫组合物的体积比为1:1。
优选的,所述编码重组腐败梭菌α毒素蛋白的基因序列如SEQ ID NO:1所示;所述编码重组产气荚膜梭菌β1毒素蛋白的基因序列如SEQ ID NO:3所示;所述编码重组产气荚膜梭菌ε毒素蛋白的基因序列如SEQ ID NO:5所示。
本发明还提供了所述免疫组合物的制备方法,包括:
1)将各目的基因分别克隆至真核表达载体上,得到重组表达载体;所述目的基因包括重组腐败梭菌α毒素蛋白的编码基因、重组产气荚膜梭菌β1毒素蛋白的编码基因和重组产气荚膜梭菌ε毒素蛋白的编码基因;
2)将所述步骤1)得到的重组载体分别转染CHO细胞,并分别经培养、筛选获得高表达工程细胞;
3)将所述步骤2)得到的工程细胞分别进行发酵培养得到目的蛋白,所述目的蛋白分别为重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白和重组产气荚膜梭菌ε毒素蛋白;
4)将所述步骤3)得到的重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白和重组产气荚膜梭菌ε毒素蛋白按比例混匀后,再与免疫佐剂乳化,得到所述免疫组合物。
优选的,所述真核表达载体为pcDNA3.1、pEE 6.4、pEE 12.4和pKS001中的至少一种。
优选的,所述宿主细胞包括DG44、DXB11、CHO-K1和CHO-S细胞中的至少一种。
本发明还提供了所述免疫组合物在制备用于预防羊梭菌病感染的药物中的应用。
本发明还提供了所述免疫组合物在制备羊梭菌病三联四防基因工程亚单位疫苗中的应用。
本发明公开了以下技术效果:
本发明分别将野生型腐败梭菌CSA基因、产气荚膜梭菌CPB基因以及产气荚膜梭菌ETX基因进行定点突变以及密码子优化后,致使表达重组蛋白的细胞毒性和生物毒性得以完全抑制,但仍保留与各野生型毒素蛋白相一致的免疫原性,使得各重组蛋白与野生型腐败梭菌α毒素蛋白、产气荚膜梭菌β1毒素蛋白或/和产气荚膜梭菌ε毒素蛋白均具有相一致的免疫原性。
本发明构建并筛选的三株工程细胞,表达目的蛋白产量高、易于纯化和工业化生产。所表达的重组蛋白可诱导试验动物产生高水平的中和抗体,免疫原性良好。按本发明生产的羊梭菌病三联四防基因工程亚单位疫苗,具有以下优势:①使用安全;②质量稳定、免疫原性好;③产量高、生产成本较低;④工艺简单、可实现反应器生产。
按本发明生产的羊梭菌病三联四防基因工程亚单位疫苗,分别以超剂量(家兔3.0ml/剂;羔羊6.0ml/剂)注射试验动物后均安全,且免疫接种(家兔1.8ml/剂;山羊3.0ml/剂)21日后,同时对1MLD的B、C、D型产气荚膜梭菌和腐败梭菌毒素的攻毒保护率均为100%,免疫血清对应中和抗体效价分别为2、4、4和4,免疫保护效力良好。
此外,本发明还提供了一种可在生物反应器中进行无血清、高密度、悬浮培养生产重组蛋白的方法,具有生产成本较低、产量高、工艺简单、免疫原性好等优点。
附图说明
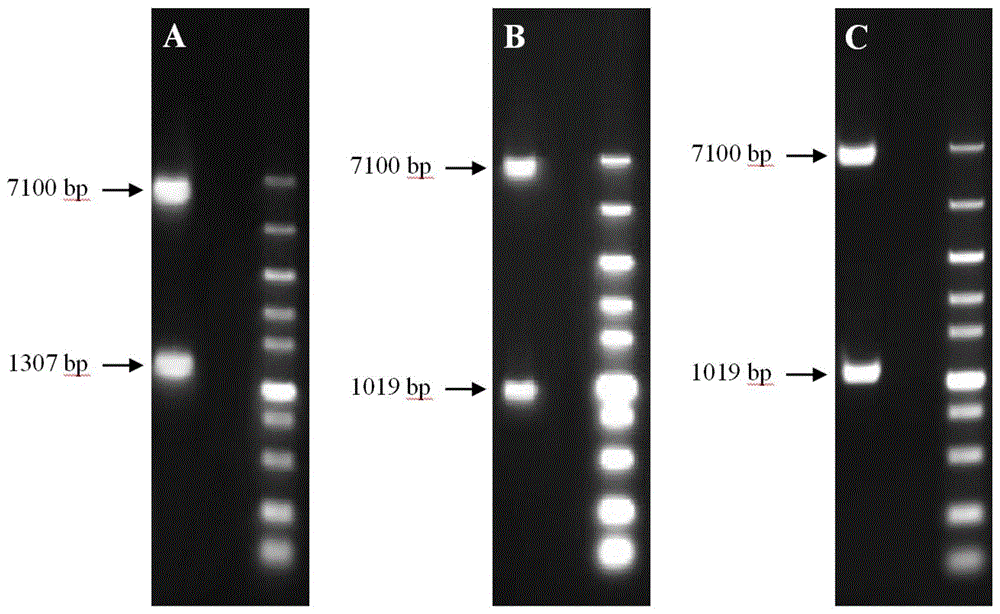
图1是各重组质粒双酶切检验结果;其中,图1-A是重组质粒CSA-pKS001双酶切检验结果;图1-B是重组质粒CPB-pKS001双酶切检验结果;图1-C是重组质粒ETX-pKS001双酶切检验结果。
图2是各工程细胞3L摇瓶培养上清SDS-PAGE检测结果;其中,图2-A是CSA-pKS001-CHO株细胞培养上清结果;图2-B是CPB-pKS001-CHO株细胞培养上清结果;图2-C是ETX-pKS001-CHO株细胞培养上清结果。
图3是各工程细胞3L摇瓶培养上清Western Blot检测结果;其中,图3-A是CSA-pKS001-CHO株细胞培养上清结果;图3-B是CPB-pKS001-CHO株细胞培养上清结果;图3-C是ETX-pKS001-CHO株细胞培养上清结果。
图4是实验室试制疫苗超剂量接种试验动物平均体温监测结果;其中,图4-A是试制疫苗超剂量接种家兔体温监测结果;图4-B是试制疫苗超剂量接种羔羊体温监测结果。
具体实施方式
本发明提供了一种免疫组合物,包括重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白和重组产气荚膜梭菌ε毒素蛋白;
所述重组腐败梭菌α毒素蛋白氨基酸序列如SEQ ID NO:2所示;
所述重组产气荚膜梭菌β1毒素蛋白氨基酸序列如SEQ ID NO:4所示;
所述重组产气荚膜梭菌ε毒素蛋白氨基酸序列如SEQ ID NO:6所示。
在本发明中,所述免疫组合物中重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白、重组产气荚膜梭菌ε毒素蛋白的质量比为1:2:2。
本发明所述免疫组合物还包括药学上可接受的免疫佐剂。在本发明中,所述佐剂优选为SP01佐剂、MONTANIDE
在本发明中,所述佐剂与所述免疫组合物的体积比为1:1。
本发明优选通过定向突变技术,将野生型腐败梭菌α毒素蛋白的原始氨基酸序列(NCBI登录号:AFB82980.2)中第1~31位信号肽序列人工替换成CHO细胞外泌肽序列(第1~25位),同时还删除了原始氨基酸序列“尾肽”前端富含碱性氨基酸的“KKRRGKR”序列(第392~398位),得到突变后的氨基酸。
本发明优选通过对野生型腐败梭菌CSA基因(NCBI登录号:JN793989.2)根据本发明所述野生型腐败梭菌α毒素蛋白的突变氨基酸序列进行鼠类密码子偏好优化而获得编码重组腐败梭菌α毒素蛋白的基因序列如SEQ ID NO:1所示。
在本发明中,所述重组腐败梭菌α毒素蛋白的基因序列所编码的氨基酸序列如SEQID NO:2所示,通过该氨基酸序列组成的重组腐败梭菌α毒素蛋白已失去细胞毒性和生物毒性,但仍保留野生型腐败梭菌α毒素蛋白的免疫原性。
本发明优选通过定向突变技术,将野生型产气荚膜梭菌β1毒素蛋白的原始氨基酸序列(NCBI登录号:AJI77135.1)经定点突变(第239位:精氨酸→谷氨酸),同时人为将信号肽序列(第1~27位)替换为CHO细胞外泌肽序列(第1~25位),得到突变氨基酸序列。
本发明优选将野生型产气荚膜梭菌CPB基因(NCBI登录号:KP064405.1)根据本发明所述野生型产气荚膜梭菌β1毒素蛋白的突变氨基酸序列进行鼠类密码子偏好优化而获得编码重组产气荚膜梭菌β1毒素蛋白的基因序列如SEQ ID NO:3所示。
在本发明中,所述重组产气荚膜梭菌β1毒素蛋白的基因序列编码的氨基酸序列如SEQ ID NO:4所示,通过该氨基酸序列组成的重组产气荚膜梭菌β1毒素蛋白已失去细胞毒性和生物毒性,但仍保留野生型产气荚膜梭菌β1毒素蛋白的免疫原性。
本发明优选通过定向突变技术,将野生型产气荚膜梭菌ε毒素蛋白的原始氨基酸序列(NCBI登录号:AML79725.1)中的前肽序列经定点突变(第33位:赖氨酸→丙氨酸;第45位:赖氨酸→丙氨酸),并在前肽序列(第33~45位)前串联了一个重复的前肽序列“AEISNTVSNEMSA”,同时人工将原始氨基酸中的信号肽序列(第1~32位)替换为CHO细胞外泌肽序列(第1~25位),以及将原始氨基酸序列中第321位的“丝氨酸”定点突变为“酪氨酸”,得到突变氨基酸序列。
本发明优选将野生型产气荚膜梭菌ETX基因(NCBI登录号:KU726256.1)根据野生型产气荚膜梭菌ε毒素蛋白突变氨基酸序列进行鼠类密码子偏好优化而获得编码重组产气荚膜梭菌ε毒素蛋白的基因序列如SEQ ID NO:5所示。
在本发明中所述重组产气荚膜梭菌ε毒素蛋白基因编码的氨基酸序列如SEQ IDNO:6所示,通过该氨基酸序列所组成的重组产气荚膜梭菌ε毒素蛋白已失去细胞毒性和生物毒性,但仍保留野生型产气荚膜梭菌ε毒素蛋白的免疫原性。
本发明还提供了所述免疫组合物的制备方法,包括:
1)将各目的基因分别克隆至真核表达载体上,得到重组表达载体;所述目的基因分别为重组腐败梭菌α毒素蛋白的编码基因、重组产气荚膜梭菌β1毒素蛋白的编码基因,以及重组产气荚膜梭菌ε毒素蛋白的编码基因;
2)将所述步骤1)得到的重组质粒分别转染CHO细胞,再分别经培养、筛选后获得高表达工程细胞株;
3)将所述步骤2)得到的高表达工程细胞分别进行发酵培养得到目的蛋白,所述目的蛋白分别为重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白以及重组产气荚膜梭菌ε毒素蛋白;
4)将所述步骤3)得到的重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白和重组产气荚膜梭菌ε毒素蛋白按比例混匀后,然后再与免疫佐剂乳化,得到所述免疫组合物。
本发明将各目的基因分别克隆至真核表达载体上,得到重组质粒;所述目的基因分别为重组腐败梭菌α毒素蛋白的编码基因、重组产气荚膜梭菌β1毒素蛋白的编码基因以及重组产气荚膜梭菌ε毒素蛋白的编码基因。
在本发明中,所述表达载体优选为pcDNA3.1、pEE 6.4、pEE 12.4和pKS001中的至少一种,更优选为pKS001。
得到重组质粒后,本发明分别将各重组质粒分别转染CHO细胞,并分别经培养、筛选后获得高表达工程细胞株。
在本发明中,所述宿主细胞优选包括DG44、DXB11、CHO-K1和CHO-S细胞中的至少一种,更优选为CHO-K1株。本发明所述CHO-K1细胞为可高密度悬浮培养、稳定分泌表达异源蛋白的宿主细胞。
获得高表达工程细胞后,本发明将得到的高表达工程细胞分别进行发酵培养并收获目的蛋白,所述目的蛋白分别为重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白以及重组产气荚膜梭菌ε毒素蛋白。
本发明所述重组蛋白还包括对所得发酵培养物进行纯化。在本发明中,所述纯化方法优选采用离子交换层析法;所述离子交换层析介质优选为SP Sephrose FF层析介质和Q Sephrose FF层析介质中的至少一种。
收获目的蛋白后,本发明将所述重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白以及重组产气荚膜梭菌ε毒素蛋白进行混合,然后再与免疫佐剂乳化,得到所述免疫组合物。
本发明还提供了所述免疫组合物在制备用于预防羊梭菌病感染的药物中的应用。
本发明还提供了所述免疫组合物在制备羊梭菌病三联四防基因工程亚单位疫苗中的应用。
以下将结合附图和实施例对本发明作进一步说明,本发明实施例仅用于描述本发明的技术方案,并非限定于本发明。本发明实施例中所使用的悬浮培养基、克隆质粒和试剂、药品等均为市售产品。
本发明试剂及药品来源如下:
CHO-K1细胞源自中国科学院典型培养物保藏委员会细胞库中国科学院上海生命科学研究所;
检验用强毒菌种购自中国兽医药品监察所,包括:B型产气荚膜梭菌C58-2株,保藏号为CVCC60082;C型产气荚膜梭菌C59-2株,保藏号为CVCC60102;D型产气荚膜梭菌C60-2株,保藏号为CVCC60201;腐败梭菌C55-1株,保藏号为CVCC60021;
CHO CD04培养基、CHO Feed 02培养基购自中山康天晟合生物技术有限公司;
pKS001真核表达载体系军事科学院军事医学研究院微生物流行病研究所免疫室构建;
DPBS购自Gibco公司;EBEL电转缓冲液购自苏州壹达生物科技有限公司;甲硫氨酸亚砜亚铵(L-Methioninesulfoximine,MSX)购自Sigma公司;
DNA凝胶快速纯化试剂盒和质粒大提试剂盒均购自北京全式金生物技术股份有限公司;
BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;
MONTANIDE
实施例1
一、基因合成
1、重组腐败梭菌α毒素蛋白基因序列的合成
(1)本发明通过定向突变技术,将野生型腐败梭菌α毒素蛋白的原始氨基酸序列(NCBI登录号:AFB82980.2)中第1~31位的信号肽序列人工替换为CHO细胞外泌肽序列(第1~25位),同时还删除了原始氨基酸序列“尾肽”前端第392~398位富含碱性氨基酸的“KKRRGKR”序列,得到突变后的氨基酸序列;
(2)将野生型腐败梭菌CSA基因(NCBI登录号:JN793989.2)根据步骤(1)得到的突变氨基酸序列进行鼠类密码子偏好优化,获得如SEQ ID NO:1所示的重组腐败梭菌α毒素蛋白的基因序列,由该基因编码的重组腐败梭菌α毒素蛋白的氨基酸序列如SEQ ID NO:2所示,通过该氨基酸序列组成的重组腐败梭菌α毒素蛋白已失去细胞毒性和生物毒性,但仍保留野生型腐败梭菌α毒素蛋白的免疫原性。
2、重组产气荚膜梭菌β1毒素蛋白基因序列的合成
(1)本发明先通过定向突变技术,将野生型产气荚膜梭菌β1毒素蛋白的原始氨基酸序列(NCBI登录号:AJI77135.1)经定点突变(第239位:精氨酸→谷氨酸),同时人为将信号肽序列(第1~27位)替换为CHO细胞外泌肽序列(第1~25位),得到突变后的氨基酸序列;
(2)将野生型产气荚膜梭菌CPB基因(NCBI登录号:KP064405.1)根据步骤(1)得到的突变氨基酸序列进行鼠类密码子偏好优化,获得如SEQ ID NO:3所示的重组产气荚膜梭菌β1毒素蛋白的基因序列,由该基因编码的重组产气荚膜梭菌β1毒素蛋白氨基酸序列如SEQ ID NO:4所示,通过该氨基酸序列组成的重组产气荚膜梭菌β1毒素蛋白已失去细胞毒性和生物毒性,但仍保留野生型产气荚膜梭菌β1毒素蛋白的免疫原性。
3、重组产气荚膜梭菌ε毒素蛋白基因序列的合成
(1)本发明通过定向突变技术将野生型产气荚膜梭菌ε毒素蛋白的原始氨基酸序列(NCBI登录号:Aml79725.1)中的前肽序列经定点突变(第33位:赖氨酸→丙氨酸;第45位:赖氨酸→丙氨酸)后,并在前肽序列(第33~45位)后串联了一个重复的前肽序列“AEISNTVSNEMSA”,同时人为将原始氨基酸中的信号肽序列(第1~32位)替换为CHO细胞外泌肽序列(第1~25位),以及将原始氨基酸序列中第321位的丝氨酸定点突变为酪氨酸,得到突变后的氨基酸序列;
(2)将野生型产气荚膜梭菌ETX基因(NCBI登录号:KU726256.1)根据步骤(1)得到的突变氨基酸序列进行鼠类密码子偏好优化,获得如SEQ ID NO:5所示的重组产气荚膜梭菌ε毒素蛋白的基因序列,由该基因编码的重组产气荚膜梭菌ε毒素蛋白的氨基酸序列如SEQ ID NO:6所示,通过该氨基酸序列所组成的重组产气荚膜梭菌ε毒素蛋白已失去细胞毒性和生物毒性,但仍保留野生型产气荚膜梭菌ε毒素蛋白的免疫原性。
二、CSA-pKS001/CPB-pKS001/ETX-pKS001重组质粒的构建
1、CSA-pUC57/CPB-pUC57/ETX-pUC57重组质粒的合成
取经密码子优化后的重组腐败梭菌α毒素蛋白的编码基因(如SEQ ID NO:1所示)、重组重组产气荚膜梭菌β1毒素蛋白的编码基因(如SEQ ID NO:3所示)、重组产气荚膜梭菌ε毒素蛋白的编码基因(如SEQ ID NO:5所示),分别在各序列的N端引入HindⅢ酶识别位点、C端引入NotⅠ酶识别位点,并分别构建于pUC57克隆载体上,构建CSA-pUC57/CPB-pUC57/ETX-pUC57克隆质粒,委托南京金斯瑞生物科技有限公司合成。
2、CSA-pUC57/CPB-pUC57/ETX-pUC57重组质粒分别转化Trans 5a感受态细胞
(1)取50μl冰浴融化的感受态细胞,加入10μl重组质粒,轻轻吸吹混匀后置冰浴中放置30min;
(2)取出样品管,置42℃水浴中热激45s,然后立即转移至冰浴中静置2min,该过程不能晃动样品管;
(3)取出样品管,在超净台内向样品管中加入500μl新鲜的LB培养基(不含抗生素),轻轻吸吹后置37℃恒温摇床中,200rpm培养1小时使菌体复苏;
(4)取出样品管,以8000rpm离心1min,吸弃300μl上清液,吸吹混匀管内菌体,接入50μl菌液至Amp
(5)将平板置37℃温箱孵育1小时后,倒置平板继续培养12~16小时;
(6)观察平板中生长的单克隆菌落。
3、CSA-pUC57/CPB-pUC57/ETX-pUC57重组质粒的抽提
(1)用接种环挑取平板中生长的单克隆菌落接入至5ml Amp
(2)吸取1ml培养菌液至EP管中,10000g离心1min收集菌体,吸尽上清液,并向管中加入250μl RB溶液(含RNase A)重悬菌体;
(3)充分混匀后,再向管中加入250μl LB溶液,5min内温和上下翻转混合5~6次,使菌体充分裂解,形成蓝色透亮溶液;
(4)再向管中加入350μl NB溶液,轻轻混合5~6次,直至形成紧实的黄色凝集块,室温静置2min,12000g离心5min;
(5)小心吸取上清液转移至吸附柱中,12000g离心1min,弃流出液,将吸附柱重新放回至收集管中;
(6)再向吸附柱中加入650μl WB溶液,12000g离心1min,弃流出液;
(7)将吸附柱放回至收集管中,12000g空离2min,除尽残留的WB溶液;
(8)取出吸附柱套入一洁净的离心管中,置通风橱内自然干燥3~5min,再向膜中央加入50μl经70℃预热的EB溶液,静置1min后,10000g离心1min,洗脱质粒;再重复洗脱1次,洗脱质粒置-20℃保存备用。
4、CSA-pUC57/CPB-pUC57/ETX-pUC57重组质粒、pKS001空载双酶切
将各重组质粒、pKS001空载分别经HindⅢ酶和NotⅠ酶在37℃水浴中酶切3小时,酶切反应体系如下表1所示。
表1.酶切反应体系
5、胶回收纯化酶切产物
(1)酶切产物凝胶电泳结束后,切胶仪上切取凝胶中目的DNA条带放入洁净EP管中称重;
(2)向上述EP管中加入3倍体积GSB溶液,置55℃水浴中融胶6~10min,期间上下温和翻转EP管3~5次使凝胶完全融化,且融化后凝胶颜色与GSB颜色相同;
(3)待温度降至室温后,全部加入至吸附柱中,静置1min,10000g离心1min,弃管底液体,并将吸附柱重新套回至收集管中;
(4)向吸附柱中加入650μl WB洗液,10000g离心1min,弃管底液体,并将吸附柱重新套回至收集管中;
(5)空离吸附柱,10000g离心2min,除尽WB溶液后将吸附柱彻底晾干;
(6)将吸附柱套入一洁净的EP管中,并向膜中央悬空滴加50μl EB溶液(经70℃预热),静置1min,10000g离心1min,回收纯化的DNA片段;
(7)重复洗脱1次,得到纯化的CSA/CPB/ETX基因片段和纯化的线性化pKS001空载,置4℃保存备用。
6、连接反应
将上述步骤5纯化的线性化pKS001空载,分别与CSA/CPB/ETX基因片段用T4连接酶进行4℃过夜连接,连接反应体系如下表2所示。
表2.连接反应体系
7、将CSA-pKS001/CPB-pKS001/ETX-pKS001重组质粒分别转化Trans 5a
感受态细胞,方法同步骤2。
8、CSA-pKS001/CPB-pKS001/ETX-pKS001重组质粒大提
(1)用接种环挑取平板中生长的单克隆菌落接入至5ml Amp
(2)取培养菌液按12000g离心2min收集菌体,吸尽上清液,并加入15ml RB溶液(含RNase A),震荡悬浮菌体;
(3)充分混匀后,再加入15ml LB溶液,5min内温和上下翻转混合5~6次,使菌体充分裂解,形成蓝色透亮溶液;
(4)再加入21ml NB溶液,轻轻混合5~6次,直至形成紧实的黄色凝集块,室温静置2min,12000g离心15min;
(5)小心吸取上清液转移至离心柱中,8000g离心2min,弃流出液,将离心柱重放回至收集管中;
(6)再向离心柱中加入5ml TB溶液,室温静置10min,8000g离心2min,弃流出液;
(7)再向离心柱中加入5ml WB溶液,8000g离心2min,弃流出液;重复洗涤一次;
(8)将离心柱放回至收集管中,8000g空离5min,彻底去除残留的WB溶液,再将离心柱置通风橱内自然干燥10min,使离心柱中的乙醇挥发完全;
(9)将离心柱套入至一洁净的50ml离心管中,向膜中央加入2ml经70℃预热的EB溶液,室温静置5min后以8000g离心2min,洗脱质粒;重复洗脱1次,置-20℃保存备用,各重组质粒均应≥1000ng/μl。
9、CSA-pKS001/CPB-pKS001/ETX-pKS001重组质粒双酶切验证
将各重组质粒分别经HindⅢ酶和NotⅠ酶在37℃水浴中酶切3小时,酶切反应体系如下表3所示。
表3.酶切反应体系
酶切结束后,分别取样进行琼脂糖凝胶电泳检测,检查插入片段大小是否正确,如图1所示为各重组质粒双酶切检验结果,结果显示酶切鉴定均正确;其中如图1-A为重组质粒CSA-pKS001的酶切结果,结果显示同时出现7100bp和1307bp的DNA条带,所述1307bp的DNA条带包含1296bp的重组腐败梭菌α毒素蛋白的编码基因序列(如SEQ ID NO:1所示)以及共11bp残基数所述重组腐败梭菌α毒素蛋白编码基因序列N端引入的HindⅢ酶切残基和C端引入的NotⅠ酶切残基,双酶切时Hind III酶前端的腺嘌呤(A)被切除、Not I酶前端的鸟嘌呤(G)和胞嘧啶(C)被切除;
其中如图1-B为重组质粒CPB-pKS001的酶切结果,结果显示同时出现7100bp和1019bp的DNA条带,所述1019bp的DNA条带包含1008bp的重组产气荚膜梭菌β1毒素蛋白的编码基因序列(如SEQ ID NO:3所示)以及共11bp残基数所述重组产气荚膜梭菌β1毒素蛋白编码基因序列N端引入的HindⅢ酶切残基和C端引入的NotⅠ酶切残基,双酶切时Hind III酶前端的腺嘌呤(A)被切除、Not I酶前端的鸟嘌呤(G)和胞嘧啶(C)被切除;
其中如图1-C为重组质粒ETX-pKS001的酶切结果,结果显示同时出现7100bp和1019bp的DNA条带,所述1019bp的DNA条带包含1008bp的重组产气荚膜梭菌ε毒素蛋白的编码基因序列(如SEQ ID NO:5所示)以及共11bp残基数所述重组产气荚膜梭菌ε毒素蛋白编码基因序列N端引入的HindⅢ酶切残基和C端引入的NotⅠ酶切残基,双酶切时Hind III酶前端的腺嘌呤(A)被切除、Not I酶前端的鸟嘌呤(G)和胞嘧啶(C)被切除。
实施例2CSA-pKS001/CPB-pKS001/ETX-pKS001重组质粒转染CHO-K1细胞及单克隆保种
1、CSA-pKS001/CPB-pKS001/ETX-pKS001重组质粒转染CHO-K1细胞提前将电转Buffer(壹达生物科技,H10305)、CHO CD04培养基(QUACELL,A11004;+80mM谷氨酰胺)、D-PBS(Gibco,14190-144)取出回复至室温。
(1)计数:CO
(2)离心:吸取约6×10
(3)D-PBS清洗:弃上清培养基获得细胞沉淀,加入10ml D-PBS吸吹重悬细胞,1000rpm、离心5min,收集细胞沉淀;
(4)预加质粒:在一无菌EP管内加入总含量为240μg的重组质粒;
(5)质粒DNA、细胞和电转液混匀:步骤3)离心结束后,弃D-PBS,加入300μl电转缓冲液,轻轻吸吹混匀后全部转移至步骤4)EP管中,再次吸吹混匀,随后立即电击;
(6)电转:吸取200μl重组质粒、细胞混悬液沿壁加入至H1电转杯中(切勿产生气泡),随即将电转杯正确插入至电转仪基座内进行电击,电击参数如下表4所示;
表4.电击参数
(7)培养:电击结束后,立即吸取电转杯中细胞悬液吹入至T75瓶中;
(8)重复:步骤6)、7)重复2次,完成电击;
(9)培养:将T75瓶盖好水平摇匀后置37℃、5% CO
2、CSA-pKS001-CHO/CPB-pKS001-CHO/ETX-pKS001-CHO工程细胞保种
(1)离心:培养箱中取出加压培养1代后的各工程细胞,全部转移至一无菌50ml离心管中,1000rpm离心5min,收集细胞沉淀;
(2)细胞计数:向管中细胞沉淀加入10ml CHO CD04培养基(+25M MSX),充分吸吹分散后吸取100μl细胞悬液置EP管中,台盼蓝染色后经Count Star细胞计数仪计数;
(3)稀释:分别将各工程细胞连续进行10倍系列倍比稀释至1cell/ml,并分别选取1cell/ml、10cells/ml和100cells/ml铺板;
(4)铺板:分别将各工程细胞的三个稀释度铺板至96孔板,200μl/孔,每个稀释度各铺一板(同时设4孔CHO-K1阴性细胞作为对照,2000cells/孔),随即放入培养箱中静置培养6~8小时后进行观察、标记;
(5)标记:倒置显微镜下仔细观察,标记出每板中的单细胞孔;
(6)培养:将细胞板置37℃、5% CO
(7)亚克隆纯化:筛选生长良好的单克隆细胞孔再次重复上述步骤,以筛选出表达效果良好的亚克隆株进行扩培;
(8)扩培:将生长的亚克隆轻轻吹散后全部转移至24孔细胞板,补加1ml CHO CD04培养基(+25M MSX),置37℃、5% CO
(9)培养皿扩培:将步骤8)扩培的克隆株轻轻吹散后全部转移至10cm培养皿中,并补加10ml CHO CD04培养基(+25M MSX),置37℃、5% CO
(10)细胞摇瓶培养:分别从上述步骤9)中各挑选出4~5株生长良好的亚克隆细胞全部转移至一洁净的50ml离心管中,1000rpm离心5min,弃上清并补加25~30ml CHO CD04培养基(+25M MSX),吸吹分散后转移至125ml细胞摇瓶中进行悬浮培养(37℃、5%CO
(11)保种:待摇瓶中细胞密度增殖至5~7.5×10
实施例3细胞摇瓶发酵培养
(1)接种:将待放大培养的基础种子增殖至5~8×10
(2)计数:每日取样计数监测细胞密度及活率,并留样;
(3)补料培养:当瓶中细胞密度达到5×10
(4)补糖:当瓶中细胞密度达到5×10
(5)表达培养:待瓶中细胞密度增至1×10
SDS-PAGE检测结果如图2所示;其中,图2-A是CSA-pKS001-CHO株培养上清SDS-PAGE检测结果,所述重组腐败梭菌α毒素蛋白分子量约为48KDa,图中标识处为表达的目的蛋白条带;图2-B是CPB-pKS001-CHO株培养上清SDS-PAGE检测结果,所述重组产气荚膜梭菌β1毒素蛋白分子量约为37KDa,图中标识处为表达的目的蛋白条带;图2-C是ETX-pKS001-CHO株培养上清SDS-PAGE检测结果,所述重组产气荚膜梭菌ε毒素蛋白分子量约为35KDa,图中标识处为表达的目的蛋白条带;阴性对照均未见对应大小的蛋白条带。
Western Blot检测结果如图3所示,其中图3-A是CSA-pKS001-CHO株培养上清Western Blot检测结果,标识处有且仅有一条大小约为48KDa的特异性条带,即为重组腐败梭菌α毒素蛋白;图3-B是CPB-pKS001-CHO株培养上清Western Blot检测结果,标识处有且仅有一条大小约为37KDa的特异性条带,即为重组产气荚膜梭菌β1毒素蛋白;图3-C是ETX-pKS001-CHO株培养上清Western Blot检测结果,标识处有且仅有一条大小约为35KDa的特异性条带,即为重组产气荚膜梭菌ε毒素蛋白;阴性对照均未见对应大小的蛋白条带,表明各目的抗原蛋白在重组CHO-K1细胞中均得以正确表达。
(6)收获:表达培养7日后,逐日取样进行Count Star细胞计数仪计数,当细胞活率逐渐下降至50%及以下时,收获细胞培养物,并以此作为三株工程细胞表达培养的收获标准。
实施例4目的蛋白纯化
(1)离心:收获细胞培养物,4℃、8000g离心20min收获培养上清经0.45μm低蛋白吸附滤膜过滤备用;
(2)离子交换层析介质选择:根据重组腐败梭菌α毒素蛋白氨基酸等电点pI=7.61,选用SP Sephrose FF离子交换层析介质(
(3)装柱:分别将1L的离子交换层析琼脂分别倒入至层析柱中,按压缩系数1.05~1.10进行装柱,先低流速恒流装柱,后大流速恒压装柱;
(4)平衡:装柱完毕后,先使用0.3M NaOH溶液以40~50ml/min流速对层析柱进行彻底消毒(约2~3倍柱体积),并使其pH值稳定于13.5上下。然后再使用4~6倍柱体积去离子水冲洗层析柱至pH和UV值保持恒定。最后使用对应pH、0.01M PB缓冲液平衡柱体(pH对应为:6.5、7.0、7.5和8.0),均以20ml/min流速平衡过夜,最终使pH和UV值保持恒定;
(5)上样:分别运用对应pH值的PB缓冲液稀释预纯蛋白液(等体积稀释后平衡2小时),然后再以20~30ml/min流速加载至层析柱中,同时监测流穿样品UV值至恒定;
(6)洗杂:上样结束后,以20~30ml/min流速加载2~3倍柱体积0.02M Tris-HCl、0.01M NaCl洗杂一次,同时监测流穿样品UV值至基线平衡;然后再用0.02M Tris-HCl、0.05M NaCl洗杂液以20~30ml/min流速洗杂至基线平衡(约3~4倍柱体积);
(7)洗脱:分别使用对应pH值、不同NaCl浓度的PB溶液洗脱目的蛋白(重组腐败梭菌α毒素蛋白、重组产气荚膜梭菌β1毒素蛋白、重组产气荚膜梭菌ε毒素蛋白分别对应为:7.0和0.3M、7.5和0.5M、7.5和0.5M),分别以10~20ml/min流速洗脱目的蛋白,同时监测、收集紫外吸收峰滤过蛋白;
(8)含量与浓度测定:各纯化蛋白液分别经0.22μm低蛋白吸附滤膜过滤除菌后,分别取样进行BCA蛋白浓度测定试剂盒检测各纯化蛋白的总蛋白含量,同时结合SDS-PAGE凝胶电泳分析以及BandScan软件分析各目的蛋白的含量及纯度;
(9)保存:经检测,各纯化蛋白含量均不低于800μg/ml,纯度均不低于90%,标识后置-80℃冰箱保存备用。
实施例5疫苗试制
(1)抗原稀释:用无菌PBS(pH=7.2)将重组产气荚膜梭菌β1毒素蛋白、ε毒素蛋白以及重组腐败梭菌α毒素蛋白分别稀释至120μg/ml、120μg/ml和60μg/ml,等体积混合均匀各组分抗原(重组腐败梭菌α毒素蛋白配苗前终浓度为20μg/ml、重组产气荚膜梭菌β1毒素蛋白和ε毒素蛋白均为40μg/ml);
(2)乳化:根据MONTANIDE
(3)性状检验:取一洁净吸管吸取约0.5ml疫苗,悬空滴于冷水表面,第1滴呈云雾状快速扩散;吸取10ml疫苗于15ml刻度离心管中,以3000rpm离心15min,管底无水相析出;检验结果如下表5所示,试制疫苗为乳白色均匀混悬液,剂型呈云雾状扩散,不分层;
(4)黏度检验:根据《中国兽药典》(2020版,三部)附录15进行,检验结果如下表5所示,黏度分别为20.1mPa.s、20.4mPa.s和20.2mPa.s;
(5)无菌检验:根据《中国兽药典》(2020版,三部)附录28进行,检验结果如下表5所示,均无菌生长;
表5.实验室试制疫苗性状及无菌检验结果
(6)保存:将检验合格的试制疫苗置4℃冰箱保存备用。
实施例6安全检验
(1)用兔检验:参考《中国兽药典》(2020版,三部)中“羊快疫、猝狙、羔羊痢疾、肠毒血症三联四防灭活疫苗”安全检验方法,取试制疫苗分别用体重1.5~2.0kg家兔5只,各颈部肌肉注射疫苗3.0ml(超剂量,羊免疫剂量),5只对照组家兔注射相同体积PBS,注射后连续观察7日。试验家兔一次超剂量接种试验结果如下表6所示。
表6.试验家兔一次超剂量接种试验结果
注:“Y”示注射疫苗家兔;“P”示注射PBS家兔。
结果表明:受试家兔观察期内均健活、精神状态良好、采食饮水正常,注射部位均未见肿胀和坏死,监测注苗组家兔体温呈一过性升高,体温监测结果还如图4-A所示,体温升高不超过基础体温1.3℃,注苗后第3日逐渐恢复至正常,亦未见其他全身性不良反应或异常等,体温恢复后其食欲、精神及活力与PBS对照组家兔无可见差异,由此表明该试制疫苗对家兔的安全性良好。
(2)用羊检验:参考《中国兽药典》(2020版,三部)中“羊快疫、猝狙、羔羊痢疾、肠毒血症三联四防灭活疫苗”安全检验方法,取试制疫苗分别用1月龄山羊羔5只,各颈部肌肉注射疫苗6.0ml(超剂量,羊2倍免疫剂量),5只对照组羔羊注射相同体积PBS,注射后连续观察7日。试验羔羊一次超剂量接种试验结果如下表7所示。
表7.试验羔羊一次超剂量接种试验结果
注:“R”示注射疫苗羔羊,红色耳号标识;“G”示注射PBS羔羊,绿色耳号标识。
结果表明:所有受试羔羊观察期内均健活、注射部位均未见肿胀和坏死,偶见1只疫苗接种组羔羊出现精神稍委顿和食欲略下降,监测体温呈一过性升高(不高于40.8℃,均不超过基础体温1.5℃),注苗后第3日逐渐恢复至正常,体温监测结果还如图4-B所示,体温恢复后其食欲、精神及活力与PBS对照组羔羊无可见差异,由此表明试制疫苗对羔羊的安全性良好。
实施例7效力检验
(1)免疫接种:参考《中国兽药典》(2020版,三部)中“羊快疫、猝狙、羔羊痢疾、肠毒血症三联四防灭活疫苗”效力检验方法,分别选用体重1.5~2.0kg家兔和8~12月龄青年山羊各20只(采集免前血清混合后同时对四种毒素的中和抗体效价均为阴性),每只动物颈部肌肉注射接种疫苗,兔1.8ml/只,羊3.0ml/只,免疫后21日采血分离血清进行中和抗体效价检测和免疫攻毒试验。
(2)血清中和法:分别采集疫苗免疫组家兔和山羊血清,将同组5支免疫血清等量混合,取混合血清0.4ml分别与0.8ml的B型产气荚膜梭菌毒素(含8小鼠MLD)、C型产气荚膜梭菌毒素(含16小鼠MLD)、D型产气荚膜梭菌毒素(含16小鼠MLD),以及腐败梭菌毒素(含16小鼠MLD)混合均匀,置37℃温箱中和40min,然后尾静脉注射18~20g小鼠各2只,0.3ml/只。同时各用同批对照小鼠2只,分别注射小鼠1MLD的四种毒素作为对照。中和B、C、D型产气荚膜梭菌毒素组小鼠观察1日、中和腐败梭菌毒素组小鼠观察3日,统计中和保护小鼠数量。试制疫苗免疫血清中和试验结果如下表8所示。
表8.试制疫苗免疫血清中和试验结果
注:“Y”示接种疫苗家兔;“B”示接种疫苗山羊,蓝色耳号标识。
结果表明:四种毒素对照组小鼠观察期内均2/2致死,表明四种毒素毒力均合格;疫苗免疫组家兔血清和山羊血清同时对B型产气荚膜梭菌毒素均达到2(0.1ml免疫血清中和2MLD毒素攻毒小鼠均2/2健活),同时对C、D型产气荚膜梭菌毒素以及腐败梭菌毒素均达到4(0.1ml免疫血清分别中和4MLD毒素攻毒小鼠均2/2健活),表明试制疫苗免疫血清中和抗体效价均合格,且略高于灭活疫苗效力检验标准。
(3)免疫攻毒法:疫苗免疫后21日,运用家兔和山羊毒力合格的四种毒素分别进行毒素攻毒试验。分别运用兔1MLD和山羊1MLD的B、C、D型产气荚膜梭菌毒素和腐败梭菌毒素进行耳/颈静脉注射攻毒(家兔注射2.0ml,各含兔1MLD毒素;山羊注射6.0ml,各含山羊1MLD毒素),5只/毒素;同时各用同批对照家兔和对照山羊各2只,分别注射兔1MLD和山羊1MLD的四种毒素作为对照,攻毒后观察5日,统计免疫攻毒保护动物数量。试制疫苗免疫攻毒试验结果如下表9所示。
表9.试制疫苗免疫攻毒试验结果
/>
注:“Y”示接种疫苗家兔;“W”示毒素对照山羊,白色耳号标识;“B”示接种疫苗山羊,蓝色耳号标识。
结果表明,同种毒素攻毒对照组家兔和山羊均0/2健活,表明四种毒素同时对家兔和山羊的毒力均合格;同种毒素攻毒疫苗免疫组家兔和山羊均5/5健活,表明本疫苗同时对四种毒素的攻毒保护率均为100%,免疫保护效力良好。
综上实施例仅用于说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,熟悉本领域的技术人员可以轻松理解,并可对前述各实施例所述的技术方案进行修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节或所描述的实施例。
- 一种增强人体免疫力的中药组合物及其制备方法和应用
- 一种免疫层析用封闭剂组合物、用途、及免疫层析试剂盒的制备方法
- 一种金属氧化物标记的免疫复合物及其制备方法和其在均相电化学免疫分析中的应用
- 提高免疫力的中药提取物组合物、其制备方法及其在制备提高免疫力药物中的应用
- 提高免疫力的中药提取物组合物、其制备方法及其在制备提高免疫力药物中的应用
