一种针对表皮生长因子受体双特异性抗体的Protein A纯化保存方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及抗体分离纯化领域,尤其涉及一种针对表皮生长因子受体双特异性抗体的Protein A纯化保存方法。
背景技术
PD-L1称为程序性死亡受体配体-1,参与免疫逃逸,能够与PD-1结合,抑制T细胞增殖以及细胞因子分泌,负调控淋巴细胞的激活。PD-1的全称是程序性死亡受体-1,属于CD28超家族成员,是由268个氨基酸组成的I型跨膜蛋白,可在T细胞、B细胞等免疫细胞表面表达。不过在T细胞未活化时,几乎不表达PD-1,仅在T细胞活化之后,PD-1才在T细胞表面表达。如前所述,PD-1可与PD-L1结合,二者互为受体与配体。正常情形下免疫系统会对聚集在淋巴结或脾脏的外来抗原产生反应,促发具抗原特异性的细胞毒杀性T细胞(CD8+Tcell增生)。而细胞程序性死亡受体-1(PD-1)与细胞程序性死亡-配体1(PD-L1)结合,可以传导抑制性的信号,减低淋巴结CD8+T细胞的增生。aPD-L1是一种单克隆抗体,可与PD-L1结合并阻断其与PD-1受体的相互作用。这释放PD-L1/PD-1介导的免疫应答抑制,包括激活抗肿瘤免疫应答而不诱导抗体依赖性细胞毒性。在同系小鼠肿瘤模型中,阻断PD-L1活性导致肿瘤生长减少。
EGFR(Epidermal Growth Factor Receptor)是上皮生长因子(EGF)细胞增殖和信号传导的受体。研究表明在许多实体肿瘤中存在EGFR的高表达或异常表达,包括头颈癌、乳腺癌、膀胱癌、卵巢癌、肾癌、结肠癌以及非小细胞肺癌等,尤其是肺癌,亚裔肺癌人群中EGFR突变率可达到50%。EGFR与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关。EGFR是肿瘤临床治疗中的一个重要的靶点。
双特异性抗体(bispecific monoclonal antibody,BsAb)是一种人工制作出来的可以同时结合两种不同抗原的特殊抗体。研究双特异性抗体,对于癌症的免疫治疗有着重大的意义,目前已经发展为肿瘤临床的治疗的一大热点。双特异性抗体相比单抗的优势主要在于可介导时序或空间效应,但技术门槛和研发成本较高,构建阶段可能会遇到表达量低、稳定性差的问题。
Protein A是一种从金黄色葡萄球菌中分离出来的细菌细胞壁蛋白,主要通过Fc区域与哺乳动物的IgG结合。Protein A有五个IgG结合结构域。在抗体相关蛋白的纯化过程中,首选Protein A resin作为抗体捕获的亲和层析介质。通常情况下,抗体或者含有Fc区域的融合蛋白在中性条件下与Protein A结合,在酸性条件下进行蛋白洗脱。绝大多是单克隆抗体采用pH2.5-pH3.0的0.1mol/L甘氨酸洗脱溶液,在该条件下,单克隆抗体具有较高的纯度和回收率。但是对于一些性质不稳定双特异性抗体,如由表皮生长因子受体抗体和细胞程序性死亡-配体1抗体融合而成的表皮生长因子受体双特异性抗体,使用上述溶液进行蛋白洗脱后,蛋白容易产生沉淀,从而导致蛋白的回收率和纯度下降。因此,仍然需要寻找一种能够使蛋白稳定的表皮生长因子受体双特异性抗体的纯化方法。
发明内容
为解决上述技术问题,本发明公开了一种针对表皮生长因子受体双特异性抗体的Protein A纯化保存方法,对蛋白贮存液进行了改进,解决了蛋白回收率低以及贮存过程中蛋白不稳定的问题。
本发明公开了一种针对表皮生长因子受体双特异性抗体的Protein A纯化保存方法,以Protein A为亲和填料,用蛋白洗脱液洗脱表皮生长因子受体双特异性抗体,将纯化后的表皮生长因子受体双特异性抗体换液保存于蛋白贮存液中,
蛋白洗脱液的组成为:
0.08~0.15M柠檬酸钠、0.1M~0.2M氯化钠和240~260mM蔗糖,pH3.0;
或0.08~0.15M柠檬酸钠、0.1M~0.2M氯化钠和240~260mM蔗糖,pH3.5。
蛋白贮存液的组成为:
0.08~0.15M醋酸钠和0.1M~0.2M氯化钠,pH 6.0;
或0.08~0.15M醋酸钠、0.1M~0.2M氯化钠和240~260mM蔗糖,pH 6.0;
或0.08~0.15M醋酸钠和0.1M~0.2M氯化钠,pH 5.0;
或0.08~0.15M醋酸钠、0.1M~0.2M氯化钠和240~260mM蔗糖,pH 5.0。
本发明中,除特殊说明外,表皮生长因子受体双特异性抗体均指由表皮生长因子受体抗体和细胞程序性死亡-配体1抗体融合而成的抗体。
进一步地,蛋白贮存液的组成优选为:
0.1M醋酸钠和0.1M~0.2M氯化钠,pH 6.0;
或0.1M醋酸钠、0.1M~0.2M氯化钠和250mM蔗糖,pH 6.0;
或0.1M醋酸钠和0.1M~0.2M氯化钠,pH 5.0;
或0.1M醋酸钠、0.1M~0.2M氯化钠和250mM蔗糖,pH 5.0。
进一步地,蛋白洗脱液的组成优选为:
0.1M柠檬酸钠、0.1M~0.2M氯化钠和250mM蔗糖,pH3.0;
或0.1M柠檬酸钠、0.1M~0.2M氯化钠和250mM蔗糖,pH3.5。
进一步地,蛋白洗脱液洗脱表皮生长因子受体双特异性抗体后,用中和液进行中和,中和液为1M Tris-HCl,pH8.9。
进一步地,加入蛋白洗脱液后于20-30℃孵育5-10min。
进一步地,蛋白洗脱液洗脱表皮生长因子受体双特异性抗体时,表皮生长因子受体双特异性抗体溶液与蛋白洗脱液的体积比为20-40:1。
进一步地,换液保存于蛋白贮存液中时,3500-4500rpm离心浓缩。
进一步地,浓缩后所得表皮生长因子受体双特异性抗体浓缩液与蛋白贮存液的体积比为1:50-100。
具体地,表皮生长因子受体双特异性抗体aEGFR-aPDL1 BsAb的Protein A纯化保存方法包括以下步骤:
(1)用磷酸盐缓冲液(DPBS,pH7.5)清洗Protein A亲和填料;
(2)向层析柱中缓慢加入待纯化的蛋白上清液,重复多次后再次用磷酸盐缓冲液(DPBS,pH7.5)清洗Protein A亲和填料;
(3)向层析柱中加入蛋白洗脱液,20-30℃孵育5-10min后,洗脱蛋白,重复多次至蛋白完全洗脱;
(4)向洗脱后的蛋白中加入中和液(1M Tris-HCl,pH8.9);
(5)3500-4500rpm离心得到蛋白浓缩液,加入蛋白贮存液,继续离心,使蛋白处于蛋白贮存液中。
借由上述方案,本发明至少具有以下优点:
发明人在实验过程中发现,表皮生长因子受体双特异性抗体aEGFR-aPDL1 BsAb在使用Protein A纯化方法进行传统洗脱过程中,产生了沉淀,并出现了明显的二聚体和多聚体,蛋白在纯化的过程中稳定性很差。因此在使用Protein A进行蛋白纯化过程中,发明人主要针对表皮生长因子受体双特异性抗体aEGFR-aPDL1 BsAb的洗脱液和贮存液进行了优化,找到了一类稳定的缓冲液组成成分,使用该类缓冲液进行洗脱纯化以及贮存的蛋白并没有沉淀产生,能够显著提高蛋白回收率和纯度。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
图1为使用EB1洗脱蛋白后FPLC检测峰图;
图2为使用EB2洗脱蛋白后FPLC检测峰图;
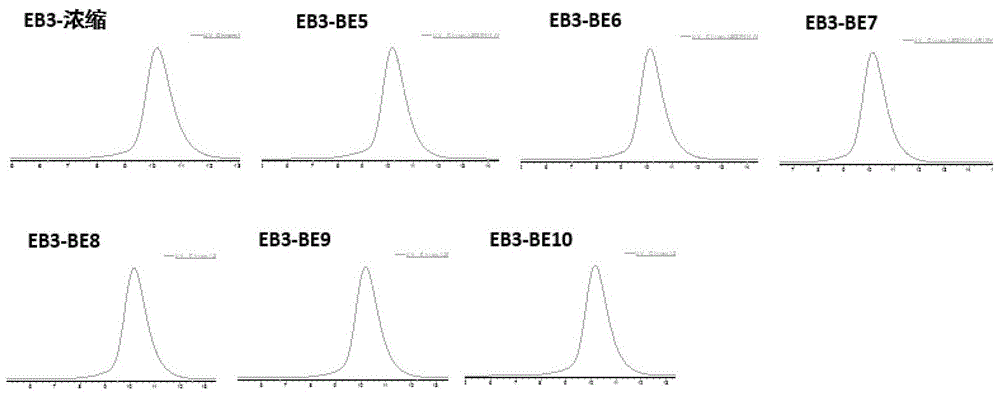
图3为使用EB3洗脱蛋白后FPLC检测峰图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
实施例1Freestyle293细胞瞬时转染
以下涉及的细胞转染过程中,涉及的数据和体积为30mL细胞体系的转染量,当转染体系大于30mL时,试剂的使用和使用量进行按比例扩大。
1.Freestyle 293细胞生长速度约为24h一代,扩增培养细胞,确保转染当天细胞密度达到2.5^10
2.细胞转染当天,将细胞培养基更换为新鲜培养基(义翘神州,SMM 293-TII无血清培养基),并确保细胞在培养基下稳定至少2h;
3.转染
1)准备15mL无菌离心管两个,编号为1、2,每管加入1mL转染专用培养基Opti-MEMmedium;
2)1号离心管:加入PEI(100μM)60μL,轻柔混匀,室温静置5min,获得PEI-Opti-MEM混合物;
3)2号离心管:加入30μg质粒(0.22μm过滤),轻柔混匀,获得DNA-Opti-MEM混合物;
4)将第1号离心管混合物缓慢加入到2号管中,轻柔混匀,室温静置15-20min,得2mL PEI-DNA混合液;
5)将PEI-DNA混合液轻柔加入到30mL Freestyle293细胞培养体系中;
从转染后第3天开始检测细胞死亡率,待细胞死亡率达到30~35%(不可超过40%)进行下一步的蛋白纯化,10000-11000rpm离心15min收集上清,进行蛋白纯化。
实施例2
本实施例中使用的表皮生长因子受体双特异性抗体aEGFR-aPDL1 BsAb的编号为AB110-YF221,使用的亲和填料为偶联于4%琼脂糖的Protein A。
1.收集细胞,11000rpm离心15min收集得到蛋白上清液;
2.用10倍柱体积磷酸盐缓冲液(DPBS,pH7.5)清洗Protein A亲和填料;
3.重复步骤2,以除去Protein A中的贮存溶液;
4.向层析柱中缓慢加入离心所得的蛋白上清液,使蛋白样品在重力作用下与填料结合,蛋白上清液重复添加3次;
5.用10倍柱体积磷酸盐缓冲液(DPBS,pH7.5)漂洗Protein A亲和填料;
6.重复步骤5,除去结合较弱的杂质;
7.向层析柱中加入3倍柱体积蛋白洗脱液(Elution buffer,EB),室温下孵育5-10min后,洗脱蛋白;本发明中使用洗脱液1(EB1)、洗脱液2(EB2)、洗脱液3(EB3)3种洗脱液分别对蛋白进行洗脱,配方详情见表1;
8.重复步骤7,至蛋白完全洗脱;
9.向EB1、EB2和EB3洗脱下的蛋白中分别加入中和液NB(1M Tris-HCl,pH8.9)700μL、800μL和750μL,使得蛋白溶液的最终pH分别为7.0~7.5、5~5.5、5~5.5。
表1蛋白洗脱液的配置
测定蛋白浓度,计算蛋白纯化产量如表3所示。
实施例3
1.使用浓缩管进行蛋白浓缩,离心转速4000rpm,蛋白体积浓缩到小于100μL时,加入待更换的蛋白贮存液,相同转速继续离心,重复该步骤3次,使蛋白最终处于待更换的蛋白贮存液中;
2.使用浓缩管浓缩蛋白并更换蛋白贮存液如表2所示:
表2蛋白贮存液的配置
更换蛋白贮存液后结果如表3所示。
表3纯化回收结果
/>
由上表可见:
传统洗脱液洗脱的蛋白产量在30mg/L左右,而本发明改进的洗脱液洗脱的蛋白产量在40mg/L以上,蛋白均无沉淀产生。
将传统洗脱液EB1洗脱的蛋白进行浓缩并更换贮存液为BEX1、BEX2、BEX3和BEX4。蛋白在浓缩换液为BEX1和BEX2过程中出现不同程度的沉淀。虽然在BEX3和BEX4换液过程中未出现沉淀,但是蛋白在两种贮存液中进行-20℃进行冻融以后,蛋白产生大量沉淀。可见,蛋白更换为这四种贮存液后的回收率比较低。将传统洗脱液EB1洗脱的蛋白进行浓缩并更换贮存液为BEX5-BEX10。在浓缩换液过程中,蛋白均无沉淀产生,换液后经-20℃进行冻融,所有蛋白均产生了大量沉淀。
将优化后的洗脱液EB2和EB3洗脱的蛋白进行浓缩并更换贮存液为BEX5、BEX6、BEX7、BEX8、BEX9、BEX10(经实验证明,贮存液更换为BEX1-BEX4时出现大量沉淀,此结果未在表3中体现)。蛋白回收率较高,均大于95%。在浓缩换液过程中,蛋白均无沉淀产生。蛋白EB2洗脱的蛋白在换液后经-20℃进行冻融,所有蛋白均产生了少量沉淀。而EB3洗脱的蛋白在过程中均未产生沉淀。
对浓缩换液后的蛋白进行FPLC分析(图1和图2中,P1为蛋白二聚体或者多聚体,P2为蛋白单体),可见:传统洗脱液EB1洗脱的蛋白在更换贮存液后,蛋白FPLC分析后峰面积占比仅为20%左右,蛋白大部分为二聚体或者多聚体(见图1);优化后的洗脱液EB2洗脱的蛋白在更换贮存液后进行FPLC分析,蛋白单体峰面积比例可分别提高至80%左右(图2);优化后的洗脱液EB3洗脱的蛋白更换贮存液后进行FPLC分析,蛋白为单峰,几乎没有二聚体和多聚体的存在(图3)。
因此,通过以上的蛋白纯化和分析结果可以看出,本专利中传统的洗脱液EB1洗脱的AB110-YF221蛋白性质不稳定,蛋白中二聚体和多聚体占80%左右;对洗脱液以及贮存液进行优化以后,蛋白的回收率显著提高,蛋白中的二聚体和多聚体所占的比例大大降低。
实施例4
将蛋白贮存液更换为0.08M醋酸钠、0.1M~0.2M氯化钠和240mM蔗糖,pH5.0,其余步骤同实施例3。
实施例5
将蛋白贮存液更换为0.08M醋酸钠、0.1M~0.2M氯化钠和240mM蔗糖,pH6.0,其余步骤同实施例3。
实施例6
将蛋白贮存液更换为0.08M醋酸钠、0.1M~0.2M氯化钠和260mM蔗糖,pH6.0,其余步骤同实施例3。
实施例7
将蛋白贮存液更换为0.15M醋酸钠、0.1M~0.2M氯化钠和240mM蔗糖,pH5.0,其余步骤同实施例3。
实施例8
将蛋白贮存液更换为0.15M醋酸钠、0.1M~0.2M氯化钠和260mM蔗糖,pH6.0,其余步骤同实施例3。
实施例9
将蛋白贮存液更换为0.15M醋酸钠、0.1M~0.2M氯化钠和240mM蔗糖,pH6.0,其余步骤同实施例3。
实施例10
将蛋白洗脱液更换为0.15M柠檬酸钠、0.1M~0.2M氯化钠和240mM蔗糖,pH3.0,将蛋白贮存液更换为BEX8,其余步骤同实施例3。
实施例11
将蛋白洗脱液更换为0.08M柠檬酸钠、0.1M~0.2M氯化钠和260mM蔗糖,pH3.5,将蛋白贮存液更换为BEX8,其余步骤同实施例3。结果显示实施例4-11均可得到与上述类似的实验结果。
表4纯化回收结果
对比例1
将蛋白贮存液更换为0.2M醋酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 5.0,其余同实施例3。
对比例2
将蛋白贮存液更换为0.05M醋酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 5.0,其余同实施例3。
对比例3
将蛋白贮存液更换为0.1M醋酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 4.5,其余同实施例3。
对比例4
将蛋白贮存液更换为0.1M醋酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 6.5,其余同实施例3。
对比例5
将蛋白贮存液更换为0.1M醋酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 7.5,其余同实施例3。
对比例6
将蛋白贮存液更换为0.1M醋酸钠,0.1M~0.2M氯化钠,pH 7.5,其余同实施例3。
对比例7
将蛋白洗脱液更换为0.1M柠檬酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 2.5,蛋白贮存液为BEX8,其余同实施例3。
对比例8
将蛋白洗脱液更换为0.1M柠檬酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 4.0,蛋白贮存液为BEX8,其余同实施例3。
对比例9
将蛋白洗脱液更换为0.05M柠檬酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 3.0,蛋白贮存液为BEX8,其余同实施例3。
对比例10
将蛋白洗脱液更换为0.2M柠檬酸钠,0.1M~0.2M氯化钠,250mM蔗糖,pH 3.0,蛋白贮存液为BEX8,其余同实施例3。
结果显示,将洗脱液EB2和EB3洗脱的蛋白进行浓缩并更换贮存液为对比例1-6的蛋白贮存液,蛋白回收率均低于90%,在换液过程中即出现不同程度的沉淀。将洗脱液替换为对比例7-10的蛋白洗脱液,蛋白出现不同程度的沉淀,且洗脱液pH较高的情况下,蛋白产量有所降低,浓缩换液过程中,蛋白出现不同程度的沉淀,换液后经-20℃进行冻融,所有蛋白均产生了沉淀。
表5纯化回收结果
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 针对表皮生长因子受体变体III和CD3的单特异性和双特异性抗体及其用途
- 针对表皮生长因子受体变体III和CD3的单特异性和双特异性抗体及其用途
