一株玉米根际双向伯克霍尔德氏菌MLR-H8及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于植物病害生物防治技术领域,具体涉及一株玉米根际双向伯克霍尔德氏菌MLR-H8及其应用。
背景技术
玉米茎基腐病是世界玉米产区普遍发生的一种系统侵染的土传病害,在中国导致玉米茎基腐病的病原菌主要为镰孢菌属(Fusarium spp.)和腐霉菌属(Pythium spp.)。禾谷镰孢(F.graminearum)是引起我国玉米茎基腐病的主要病原真菌,能够侵染玉米等禾谷类作物的茎、茎基部和根部等部位。由禾谷镰孢引起的玉米茎基腐病不仅会导致玉米产量下降,还会产生大量毒素威胁人畜健康,严重影响玉米产业的发展。
农业生产上通过种子处理也可以在一定程度上减轻玉米茎基腐病的发生,但现有化学种衣剂活性成分种类较少、持效期较短等原因,导致植株生长后期土传病害防治效果不佳,因而有待开发新的防治措施。根际是受植物影响最为强烈的微域环境,为植物根系和微生物之间的互作提供了一个有效的生态位。根际作为植物根系与土壤间进行物质和能量交换的直接界面,对植物健康极其重要。存在于植物根际且对于植物起到有益作用的细菌被称为植物促生根际细菌(PGPR),这些根际细菌通过直接或间接的机制改善植物抗病性,是重要的生物防治资源。
芽孢杆菌(Bacillus spp.)和假单胞菌(Pseudomonas spp.)已经被广泛用做农用生物菌剂,在生物防治和促生方面具有显著的效果。然而,在实际应用过程中,土壤中的农药残留以及植物致病菌产生的有害代谢物可能会抑制生防、促生菌的定殖,进而限制微生物菌剂的效果。伯克霍尔德氏菌具有一定的药物耐受性,同时具有降解多种有害物质的特性。
目前对于伯克霍尔德氏菌株(Burkholderia spp.)的生物防治研究已有一定成果,王琪等人发现伯克霍尔德氏菌GD17可有效促进黄瓜幼苗生长以及耐旱性;王俊凯等人发现绿木霉ZT05与双向伯克霍尔德氏菌ZB155互作对立枯丝核菌的拮抗作用显著增强;章嘉会等人研究发现洋葱伯克霍尔德氏菌JK-1和越南伯克霍尔德氏菌JK-4可显著促进小麦、黄瓜的生长。由于菌株作为纯培养体,个体的特异性比较强,受环境的影响较大,因此,不断地挖掘新的菌株资源,进行植物病害的生物防治十分必要。
发明内容
本发明要解决的技术问题是克服现有技术中针对于玉米土传病害镰孢茎基腐病(由禾谷镰孢引起的)生物防治方法的空缺,提供一株玉米根际双向伯克霍尔德氏菌MLR-H8及其应用。该菌株MLR-H8分离自抗性玉米品种GZL455根际,对病原菌禾谷镰孢具有显著的抑制作用,同时具有高效、广谱的抑菌活性。
本发明的双向伯克霍尔德氏菌(Burkholderia ambifaria)MLR-H8采集自吉林省公主岭市吉林省农业科学院公主岭试验基地玉米抗性品种GZL455根际土壤,经分离纯化后获得。
本发明实验结果表明,双向伯克霍尔德氏菌(Burkholderia ambifaria)MLR-H8对玉米镰孢茎基腐病病原菌禾谷镰孢(Fusarium graminearum)的分生孢子萌发、菌丝生长有很强的抑制作用;该菌株的无菌发酵液以及挥发性物质中含有的次生代谢产物也能够显著抑制禾谷镰孢的菌丝生长扩散;同时该菌株对于葵菌核病病原菌核盘菌(Sclerotiniasclerotiorum)、花生白绢病病原菌齐整小核菌(Sclerotium rolfsii)、玉米穗腐病病原菌拟轮枝镰孢(Fusarium verticillioides)、玉米小斑病病原菌玉蜀黍平脐蠕孢菌(Bipolaris maydis)、稻瘟病病原菌稻梨孢(Pyricularia oryzae)、北方炭疽病病原菌玉蜀黍球梗孢(Kabatiella zeae)、强雄腐霉(Pythium arrhenomanes)、终极腐霉(Pythiumultimum)等多种病原真菌有较强拮抗效果,抑制率为37.81%-63.14%。菌株MLR-H8对于植物真菌病害的防治具有高效和广谱性,同时对玉米植株生长具有促进能力,在植物真菌病害生物防治方面有一定应用价值与潜力。
本发明的目的在于提供一株玉米根际双向伯克霍尔德氏菌(Burkholderiaambifaria)MLR-H8;提供双向伯克霍尔德氏菌(Burkholderia ambifaria)MLR-H8在植物真菌病害中的防治作用,尤其在玉米镰孢茎基腐病中的防治作用;提供双向伯克霍尔德氏菌(Burkholderia ambifaria)MLR-H8在制备对玉米镰孢茎基腐病具有生物防治效果的生物制剂方面的应用。利用含有双向伯克霍尔德氏菌(Burkholderia ambifaria)MLR-H8生物制剂防治植物真菌病害的方法也在本发明的保护范围之内。
因此,本发明的第一个目的是提供一株双向伯克霍尔德氏菌(Burkholderiaambifaria)MLR-H8,其保藏编号为CGMCC No.25903。
本发明的第二个目的是提供一种生物制剂,其含有所述的双向伯克霍尔德氏菌MLR-H8、所述的双向伯克霍尔德氏菌MLR-H8的培养物和/或培养所述的双向伯克霍尔德氏菌MLR-H8所得代谢产物作为活性成分。
优选,所述的双向伯克霍尔德氏菌MLR-H8的培养物是通过如下方法制备得到的:将双向伯克霍尔德氏菌MLR-H8接种到pH 7.2的LB液体培养基培养,得到双向伯克霍尔德氏菌MLR-H8的培养物。
优选,所述的LB液体培养基培养,其培养条件为28℃、180-220rpm条件下培养18-36h。
本发明的第三个目的是提供所述的双向伯克霍尔德氏菌MLR-H8或所述的生物制剂在如下(1)-(2)中至少一种中的应用:
(1)防治植物真菌病害;
(2)促进植物生长。
优选,所述的植物真菌病害为葵菌核病、花生白绢病、玉米穗腐病、玉米小斑病、稻瘟病、北方炭疽病和/或玉米茎基腐病。
优选,所述的植物真菌病害,为由核盘菌(Sclerotinia sclerotiorum)、齐整小核菌(Sclerotium rolfsii)、拟轮枝镰孢(Fusarium verticillioides)、玉蜀黍平脐蠕孢菌(Bipolaris maydis)、稻梨孢(Pyricularia oryzae)、玉蜀黍球梗孢(Kabatiella zeae)、禾谷镰孢(Fusarium graminearum)、强雄腐霉(Pythium arrhenomanes)和/或终极腐霉(Pythium ultimum)引起的植物真菌病害。
优选,所述的玉米茎基腐病为玉米镰孢茎基腐病。玉米镰孢茎基腐病即由禾谷镰孢引起的玉米茎基腐病。
优选,所述的植物为玉米。
本发明的第四个目的是提供一种防治玉米真菌病害和促进玉米生长的方法,包括以下步骤:向玉米种子或玉米植株施用所述的生物制剂。
优选,所述的方法,对于玉米种子,其施用的方式为用所述的生物制剂浸种;对于玉米植株,其施用的方式为用所述的生物制剂灌根。
相比现有技术,本发明具有以下有益效果:
本发明的双向伯克霍尔德氏菌MLR-H8抑菌谱广泛,对为害玉米作物的多种植物病原真菌均具有抑菌活性,是具有良好开发应用前景的广谱性生物菌剂、生物菌肥以及种子处理剂,对玉米真菌病害的生物防治具有重要意义。
本发明的双向伯克霍尔德氏菌MLR-H8生物制剂制备简单易行,便于大范围推广应用。
本发明的双向伯克霍尔德氏菌MLR-H8是从高抗玉米茎基腐病玉米品种GZL455根际分离纯化获得,菌株本身安全无毒、稳定性好、对环境友好。
保藏说明:
本发明的双向伯克霍尔德氏菌(Burkholderia ambifaria)MLR-H8于2022年10月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏编号为CGMCCNo.25903,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
附图说明
图1是双向伯克霍尔德氏菌MLR-H8菌落形态照片。
图2是双向伯克霍尔德氏菌MLR-H8菌落革兰氏染色照片。
图3是双向伯克霍尔德氏菌MLR-H8的16S rDNA系统发育进化树。
图4是双向伯克霍尔德氏菌MLR-H8对多种植物病原真菌的抑制。
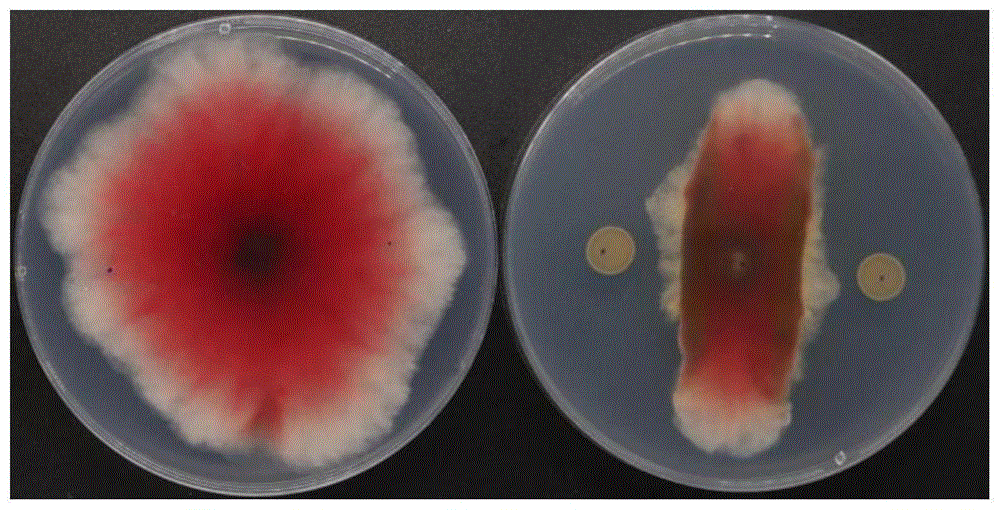
图5是双向伯克霍尔德氏菌MLR-H8对禾谷镰孢的抑制。
图6是双向伯克霍尔德氏菌MLR-H8无菌发酵液对禾谷镰孢的抑制。
图7是双向伯克霍尔德氏菌MLR-H8挥发性物质对禾谷镰孢的抑制。
图8是双向伯克霍尔德氏菌MLR-H8对禾谷镰孢分生孢子萌发的抑制。
图9是双向伯克霍尔德氏菌MLR-H8对玉米茎基腐病的抑制效果;其中CK对应A组处理,Fg对应B组处理,Fg+H8对应C组处理。
图10是双向伯克霍尔德氏菌MLR-H8对玉米植株生长的促进效果;其中CK对应A组处理,H8对应B组处理。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:玉米根际双向伯克霍尔德氏菌MLR-H8的分离、纯化、鉴定及对禾谷镰孢抑菌活性测定
1.1培养基配制
TSB培养基:胰酪胨17g,葡萄糖1.5g,大豆胨3g,磷酸氢二甲2.5g,氯化钠5g,加水定容至1L;高压蒸汽灭菌121℃、15min。
LB培养基:蛋白胨10g,氯化钠5g,酵母提取物10g,琼脂粉15g,加水定容至1L;高压蒸汽灭菌121℃、15min。
PDA培养基:Difco
1.2根际细菌分离纯化
从吉林省公主岭市吉林省农业科学院公主岭试验基地采集玉米茎基腐病高抗品种GZL455根际土壤。取3g土壤溶解于40mL无菌水中充分振荡;取4mL溶液加入36mL无菌水,重复操作5次;取10mL溶液于90mL TSB培养基中,充分混匀;排枪吸取150μL溶液于96孔板中,28℃培养4d;挑取浑浊孔口在LB培养基上划线进一步纯化,获得纯化根际细菌,包括菌株MLR-H8,保存待用。
1.3供试菌株
禾谷镰孢(Fusarium graminearum)菌株GZL19,由吉林省农业科学院公主岭市实验基地提供。
1.4根际细菌对禾谷镰孢抑菌活性测定
将纯化的根际细菌接种至LB液体培养基中,28℃、200rpm,过夜摇培,获得活化菌液。
采用对峙培养法测定筛选得到的根际细菌菌株对靶标菌株的拮抗效果。将供试靶标菌株打5mm菌饼接入PDA平板中心,左右距离25mm处接入10μL活化菌液,每个根际细菌活化菌液各接三个重复,空白对照仅接入供试靶标菌株。
抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100
结果表明:根际细菌MLR-H8菌株对禾谷镰孢GZL19菌丝生长抑制效果明显,产生明显抑菌圈,抑制率达到55.97%(图5)。
1.5根际细菌MLR-H8鉴定
1.5.1形态学鉴定
将纯化的根际细菌菌株MLR-H8划线接种至LB固体平板上,28℃、24h,观察单菌落形态;并利用革兰氏染色试剂盒(北京索莱宝科技有限公司)对菌株进行革兰氏染色,观察菌株形态及染色结果。
结果表明:根际细菌MLR-H8菌株菌落呈淡黄色、圆形、较小、边缘光滑,稍凸起(图1);革兰氏阴性菌,染色呈红色(图2);细胞形态为直或微弯曲杆菌,单个或成对排列。
1.5.2分子鉴定
使用细菌基因组DNA提取试剂盒(北京索莱宝科技有限公司)从活化菌液中提取根际细菌MLR-H8基因组DNA为模板,使用细菌16S rDNA基因通用引物27F/1492R进行PCR扩增。引物序列:27F(5’-AGAGTTTGAT CCTGGCTCA-3’)和1492R(5’-GGTTACCTTG TTACGACTT-3’)。
PCR扩增的16S rDNA序列(其核苷酸序列如SEQ ID NO.1所示)使用NCBI进行Blast序列比对分析,MEGA11构建系统发育进化树(图3),根际细菌MLR-H8与伯克霍尔德氏菌属双向伯克霍尔德氏菌位于同一分支。结果表明:菌株MLR-H8为双向伯克霍尔德氏菌(Burkholderia ambifaria),因此命名为双向伯克霍尔德氏菌(Burkholderia ambifaria)MLR-H8。
实施例2:玉米根际双向伯克霍尔德氏菌MLR-H8对多种病原菌抑菌活性测定
2.1培养基配制
燕麦培养基:燕麦30g破碎,琼脂粉15g,加水定容至1L,高压蒸汽灭菌121℃、15min。
其余培养基同实施例1中1.1。
2.2供试菌株
葵菌核病病原菌核盘菌(Sclerotinia sclerotiorum)、花生白绢病病原菌齐整小核菌(Sclerotium rolfsii)、玉米穗腐病病原菌拟轮枝镰孢(Fusariumverticillioides)、玉米小斑病病原菌玉蜀黍平脐蠕孢菌(Bipolaris maydis)、稻瘟病菌病原菌稻梨孢(Pyricularia oryzae)、北方炭疽病病原菌玉蜀黍球梗孢(Kabatiellazeae)、玉米茎基腐病禾谷镰孢(Fusarium graminearum)、强雄腐霉(Pythiumarrhenomanes)、终极腐霉(Pythium ultimum),由中国农业科学院植物保护研究所玉米病害研究组提供。
2.3根际细菌MLR-H8对多种病原菌抑菌活性测定
玉米小斑病病原菌玉蜀黍平脐蠕孢菌(Bipolaris maydis)、稻瘟病菌病原菌稻梨孢(Pyricularia oryzae)接种至燕麦培养基,其余菌株接种至PDA培养基活化进行平板拮抗试验。抑菌活性测定方法同实施例1中1.4。
结果表明:根际细菌MLR-H8具有广谱抑菌性(表1、图4)。
表1根际细菌MLR-H8对多种病原菌的抑菌活性
实施例3:玉米根际双向伯克霍尔德氏菌MLR-H8分泌物对禾谷镰孢抑菌活性测定
3.1培养基配制
同实施例1中1.1。
3.2供试菌株
同实施例1中1.3。
3.3根际细菌MLR-H8无菌发酵液对禾谷镰孢抑菌活性测定
将根际细菌MLR-H8接种至LB液体培养基,28℃、200rpm摇培24h,使OD
结果表明:根际细菌MLR-H8无菌发酵液对禾谷镰孢菌丝生长显著抑制,菌丝生长缓慢,无法继续向外扩展(图6),抑制率达到73.45%。
3.4根际细菌MLR-H8挥发性物质对禾谷镰孢抑菌活性测定
将根际细菌MLR-H8接种至LB液体培养基,28℃、200rpm摇培24h;取活化细菌MLR-H8菌液100μL均匀涂布在LB固体培养基上,供试靶标菌株禾谷镰孢GZL19接种至PDA平板中央,两皿倒扣封口,使菌株MLR-H8与禾谷镰孢GZL19不直接接触,空白对照为LB液体培养基100μL均匀涂布后倒扣封口,28℃、5d,观察靶标菌株禾谷镰孢GZL19生长情况。
结果表明:根际细菌MLR-H8产生的挥发性物质显著抑制禾谷镰孢菌丝生长扩展(图7),抑制率达到55.83%,且抑制禾谷镰孢产生水溶性红色色素。
实施例4:玉米根际双向伯克霍尔德氏菌MLR-H8对禾谷镰孢分生孢子萌发影响测定
4.1培养基配制
绿豆汤培养基:绿豆10g,沸水煮20min,过滤取液体,加水定容至1L,高压蒸汽灭菌121℃、15min。
PDB培养基:马铃薯液体培养基(HB0233-8)26.1g,加水定容至1L,高压蒸汽灭菌121℃、15min。
4.2供试菌株
同实施例1中1.3
4.3凹玻片观察根际细菌MLR-H8对禾谷镰孢分生孢子萌发影响
根际细菌MLR-H8接种于LB液体培养基中,28℃、200rpm摇培24h,调节OD
结果表明,恒温保湿培养8h后,A组供试菌株禾谷镰孢GZL19分生孢子正常萌发,菌丝生长旺盛;B组供试菌株禾谷镰孢GZL19分生孢子萌发显著抑制,仅少数分生孢子萌发,菌丝生长受到显著抑制(图8)。
实施例5:玉米根际双向伯克霍尔德氏菌MLR-H8对玉米镰孢茎基腐病防效测定
5.1培养基配制
绿豆汤培养基:绿豆10g,沸水煮20min,过滤取液体,加水定容至1L,高压蒸汽灭菌121℃、15min。
其余培养基同实施例1中1.1。
5.2供试菌株
同实施例1中1.3。
5.3盆栽试验验证根际细菌MLR-H8对玉米镰孢茎基腐病防效
取营养土与蛭石以体积比3:1混合,干热灭菌121℃、3h,备用;玉米种子播种前进行表面消毒处理,75%酒精浸泡1min,无菌水冲洗三次,备用。每个花盆栽种3粒玉米种子,每15盆作为一组处理,共设A、B、C三组处理,A-空白对照、B-接种供试菌株禾谷镰孢GZL19孢子悬浮液、C-接种根际细菌MLR-H8菌液和供试菌株禾谷镰孢GZL19孢子悬浮液。根际细菌MLR-H8接种于LB液体培养基中,28℃、200rpm摇培24h,备用;供试菌株禾谷镰孢GZL19接种至产孢培养基绿豆汤中,25℃、150rpm摇培7d,备用。待玉米生长7d,取备用细菌MLR-H8菌液室温8000rpm离心10min,无菌水洗涤三次,调节OD
结果表明:观察三组玉米植株生长情况发现,B组玉米植株受供试菌株禾谷镰孢GZL19侵染茎秆外侧枯萎,A组与C组植株茎秆外侧呈现健康紫红色性状。与A组空白对照相比,B组玉米植株地上部鲜重下降17.79%,地上部株高下降2.45%;C组玉米植株地上部鲜重上升16.58%,地上部株高上升11.81%(图9)。
实施例6:玉米根际双向伯克霍尔德氏菌MLR-H8对玉米植株促生能力测定
6.1培养基配制
同实施例1中1.1。
6.2供试菌株
同实施例1中1.3。
6.3盆栽试验验证根际细菌MLR-H8对玉米植株生长促进能力
取营养土与蛭石以体积比3:1混合,干热灭菌121℃、3h,备用;玉米种子播种前进行表面消毒处理,75%酒精浸泡1min,无菌水冲洗三次,备用。每个花盆栽种3粒玉米种子,每15盆作为一组处理,共设A、B两组处理,A-空白对照、B-接种根际细菌MLR-H8菌液。根际细菌MLR-H8接种于LB液体培养基中,28℃、200rpm摇培24h,备用。待玉米生长7d,取备用细菌MLR-H8菌液室温8000rpm离心10min,无菌水洗涤三次,调节OD
结果表明:观察两组玉米植株生长情况发现,与A组空白对照相比,B组玉米植株地上部鲜重上升4.20%,地上部株高上升5.07%(图10)。
实施例7:玉米根际双向伯克霍尔德氏菌MLR-H8对玉米种子萌发影响测定
7.1培养基配制
同实施例1中1.1。
7.2供试菌株
同实施例1中1.3。
7.3菌液浸种观察根际细菌MLR-H8对玉米种子萌发影响
玉米种子播种前进行表面消毒处理,75%酒精浸泡1min,无菌水冲洗三次,备用;每30粒玉米种子作为一组处理,设A、B、C、D四组处理,A-空白对照、B-接种根际细菌MLR-H8菌液、C-接种供试菌株禾谷镰孢GZL19孢子悬浮液、D-接种根际细菌MLR-H8菌液和供试菌株禾谷镰孢GZL19孢子悬浮液。根际细菌MLR-H8接种于LB液体培养基中,28℃、200rpm摇培24h,室温8000rpm离心10min,无菌水洗涤三次,调节OD
结果表明:种子萌发率分别为A组为91%,B组为93%,C组62%,D组为87%,对比A组和B组结果表明MLR-H8对种子萌发无抑制作用,同时对比C组和D组结果表明MLR-H8可以缓解病原菌对玉米种子萌发的抑制作用。
7.4菌液浸种观察根际细菌MLR-H8对玉米植株生长影响
取营养土与蛭石以体积比3:1混合,干热灭菌121℃、3h,备用;玉米种子播种前进行表面消毒处理,75%酒精浸泡1min,无菌水冲洗三次,每个培养皿50粒玉米种子作为一组处理,设A、B、C、D四组处理,A-空白对照、B-接种根际细菌MLR-H8菌液、C-接种供试菌株禾谷镰孢GZL19孢子悬浮液、D-接种根际细菌MLR-H8菌液和供试菌株禾谷镰孢GZL19孢子悬浮液。根际细菌MLR-H8接种于LB液体培养基中,28℃、200rpm摇培24h,室温8000rpm离心10min,无菌水洗涤三次,调节OD
结果表明:观察4组玉米植株生长情况发现,与A组空白对照相比,B组玉米植株地上部鲜重上升2.10%,地上部株高上升3.12%;与C组相比,D组玉米植株地上部鲜重上升15.20%,地上部株高上升16.50%
综上,根际细菌MLR-H8为一株玉米根际双向伯克霍尔德氏菌,为革兰氏阴性菌,对于多种植物病原真菌具有广泛且高效的抑菌活性。菌株MLR-H8菌悬液、无菌发酵液及菌株产生的挥发性物质均能够显著抑制禾谷镰孢菌丝生长扩展,具有较高拮抗活性。盆栽实验表明,根际菌株MLR-H8菌悬液能够起到防治玉米镰孢茎基腐病作用;根际菌株MLR-H8通过灌根施加的方式,能够促进玉米植株生长;根际菌株MLR-H8通过浸种作为种子处理剂的方式,能够促进玉米植株生长。应用根际菌株MLR-H8通过生物防治预防茎基腐病这类土传病害的发生,避免了化学防治造成的生态环境污染等问题,更加环保高效。
