用于预测、预防或治疗心力衰竭的标志物、方法及系统
文献发布时间:2023-06-19 19:28:50
本申请为中国专利申请202211106641.6的分案申请,原申请的申请日为2022年9月13日,发明名称为“用于预测、预防或治疗心力衰竭的标志物、方法及系统”,其全部内容通过引用整体并入本文。
技术领域
本发明涉及生物医药领域,具体涉及用于预测、预防或治疗心力衰竭的标志物、方法及系统。
背景技术
心力衰竭(heart failure,HF)简称心衰,是指由于心脏的收缩功能和/或舒张功能发生障碍,不能将静脉回心血量充分排出心脏,导致静脉系统血液淤积,动脉系统血液灌注不足,从而引起心脏循环障碍症候群,此种障碍症候群集中表现为肺淤血、腔静脉淤血。心力衰竭是一种常见的临床综合征,是诸多心血管疾病的终末期状态,同时也是全球各国共同面临的一项严重的社会公共健康问题。随着人口老龄化的进程加剧,HF的患病率仍是逐年攀升,给公共卫生保健系统和个人家庭带来沉重负担。生物标志物在HF临床实践及患者管理的各个方面都发挥着至关重要的作用,生物标志物的应用提供了一种快速、客观、低成本的定量工具,可用于HF的诊断,评估疾病的严重程度,识别具有重大风险意义的个体并预测HF患者的预后。
根据心力衰竭发生的缓急,临床可分为急性心力衰竭和慢性心力衰竭。根据心力衰竭发生的部位可分为左心、右心和全心衰竭。还有收缩性或舒张性心力衰竭之分。针对心力衰竭的诊断,可根据患者病史以及临床症状体征,例如是否存在心腔扩大、第三心音、心脏杂音、超声心动图异常、利钠肽(BNP/NT-proBNP)水平升高等心脏结构或功能异常的客观证据作为临床诊断依据。
心力衰竭的发生与发现具有十分复杂的机制,有研究表明肥大与凋亡失调中,其中IL-6-gp130-JAK-STAT3在这个过程发挥重要作用。也有研究表明,能量代谢障碍同样可导致心衰。例如,WO2020168247A1公开了一种治疗心力衰竭的方法,该方法包括将治疗有效量的包含分离的线粒体或组合的线粒体试剂的组合物施用于受试者。另外也有研究者发现,心肌细胞内钙离子减少,兴奋收缩失偶联在心衰中起到重要作用。
在心力衰竭发展的不同时期涉及很多小分子代谢物的改变,从外周血或者粪便检测心力衰竭特异性分子标志物的变化,具有简便、快捷、痛苦小、易复查等优点,对心力衰竭的临床诊治具有重要意义,具有广阔的应用前景。但是迄今为止,对于心力衰竭仍缺乏的可靠的生物标志物以及有效的药物,同时在防治心力衰竭的分子机制方面也需进一步深入研究。
发明内容
为了解决现有技术中存在的技术问题,本发明人构建了心力衰竭大鼠模型,确定了与心力衰竭机制相关的关键因素。本发明通过靶向定量分析确定了心力衰竭显著增加了本发明生物标志物的含量,并进一步通过16S rRNA基因测序分析以及宏基因组测序分析对心力衰竭相关的肠道菌群的多样性以及物种组成进行了分析,确定了与心力衰竭相关的肠道菌群标志物。同时本发明还对肠道菌群和苯乙酸及其代谢产物生物标志物进行了相关性分析以及临床验证。具体地,本发明包括以下内容。
本发明的第一方面,提供用于显示苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量的试剂在制备用于预测、检测或诊断心力衰竭中的用途。
本发明的第二方面,提供一种抑制剂在制备用于预防和/或治疗心力衰竭的药物中的用途,其中,所述抑制剂包括能够抑制苯乙酸及其代谢产物或抑制其产生的试剂,或抑制肠道苏黎世菌属或源自该属的物种活性的试剂。
在某些实施方案中,根据本发明所述的用途,其中,所述预防和/或治疗是指治愈、缓解、减轻、防止心力衰竭的发生和发展。
在某些实施方案中,根据本发明所述的用途,其中,所述苯乙酸及其代谢产物的产生由肠道微生物菌群介导,其中所述肠道微生物菌群包括肠道苏黎世菌属Turicibacter。
在某些实施方案中,根据本发明所述的用途,其中,所述肠道苏黎世菌属的物种包括但不限于:Turicibacter sanguinis、Turicibacter sp.TS3、Turicibacter sp.H121。
在某些实施方案中,根据本发明所述的用途,其中,抑制苯乙酸及其代谢产物产生的试剂包括天冬氨酸氨基转移酶抑制剂、芳香族氨基酸转氨酶抑制剂和/或醛脱氢酶抑制剂。
本发明的第三方面,提供一种生物标志物在制备诊断或预测心力衰竭或评价心力衰竭药物的诊断产品中的用途,其特征在于,所述产品以苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量作为评价指标,其中所述诊断产品选自试剂盒、诊断装置和/或计算机系统。
在某些实施方案中,根据本发明所述的用途,其中,所述诊断或预测包括以下步骤:
(1)利用试剂测量从受试者采集的样品中的苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量,得到测量值的步骤;
(2)将所述测量值与标准值进行比较的步骤;和
(3)当所述测量值高于所述标准值时,则将所述受试者预测为患有心力衰竭,或者将所述受试者预测为患有心力衰竭的风险;当所述测量值低于所述标准值时,则将所述受试者预测为未患心力衰竭,或者将所述受试者预测为未处于患有心力衰竭的风险。
在某些实施方案中,根据本发明所述的用途,其中,所述标准值为从与受试者的年龄相当的正常对象的生物样本获得的值。
本发明的第四方面,提供一种筛选对于治疗心力衰竭有用的化合物的方法,其包括:
a.利用试剂测量从患有心力衰竭的受试者采集的样品中苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量得到第一测量值的步骤;
b.将所述化合物施用至患有患有心力衰竭的受试者的步骤;
c.测量从施用所述化合物后的患有心力衰竭的受试者采集的样品中苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量得到第二测量值的步骤;
d.比较所述第一测量值和第二测量值的步骤;和
e.当所述第二测量值小于或等于所述第一测量值时,将所述化合物筛选为对治疗或减缓心力衰竭有用的化合物,当所述第二测量值大于所述第一测量值时,将所述化合物筛选为对治疗或减缓心力衰竭无用的化合物。
本发明的第五方面,提供一种预测心力衰竭发生风险的系统,其包括:
数据获取单元,其用于获取至少来自受试者的苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量数据;和
判断单元,其用于根据所述苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量与预设阈值比较结果,将受试者分类为属于心力衰竭发生风险高或低患者。
本发明的第六方面,提供一种预防和/或治疗心力衰竭的方法,其包括向有需要的受试者施用治疗有效量的抑制剂或抗微生物剂,其中所述抑制剂包括抑制苯乙酸及其代谢产物或其产生的试剂,所述抗微生物剂包括至少杀死部分肠道苏黎世菌属Turicibacter,或者抑制肠道苏黎世菌属Turicibacter生长,或者抑制肠道苏黎世菌属Turicibacter的量或活性的任何抗微生物剂。
本发明通过研究发现心衰疾病通过上调Turicibacter菌属的相对丰度来增加血清中苯乙酸及其代谢产物的量,基于此,提出了肠道苏黎世菌-苯乙酸及其代谢产物轴用于防治心力衰竭的新靶点的分子机制。此外,进一步对苯乙酸及其代谢产物影响心力衰竭疾病进行了验证。本发明为心力衰竭的诊断、分子分型、预后评估以及新的代谢途径提供了新的见解,不仅提出了对心力衰竭病理机制新的理解,而且也为新药的研发提供新的靶点和思路。
附图说明
图1为造模28天后各组缺血性心力衰竭大鼠心功能指标比较。(A)左心室射血分数(EF)(B)左心室缩短分数(FS)(各组n=8-13)。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图2示出了造模一个月各组缺血性心力衰竭大鼠血流动力学指标。(A)左室舒张末压(LVEDP)(B)左室收缩压(LVSP)(C)±dp/dtmin(D)±dp/dtmax。(各组n=8-13)与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图3为造模一个月后缺血性心力衰竭大鼠血清B型钠尿肽(BNP)和神经末端前体脑利钠肽(NT-proBNP)检测结果(各组n=8-13)。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图4示出了心力衰竭大鼠血清中苯乙酸及其代谢产物变化趋势(A)造模一个月后缺血性心力衰竭大鼠血清中苯乙酸及其代谢产物变化趋势(B)大鼠心衰过程中不同时间段的苯乙酸及其代谢产物变化趋势(各组n=8-13)。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图5示出了苯乙酸及其代谢产物定量曲线。
图6为造模一个月后心力衰竭大鼠血清中苯乙酸及其代谢产物定量检测结果(各组n=8-13)。
图7为各组患者血清中PAGln的测定,数据表示为平均值±SEM表示,数据使用student's t检验进行分析(每组n=37)。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图8为苯乙酸标准曲线(左图)以及心衰大鼠空白组、假手术组、模型组粪便中苯乙酸含量的定量测定结果(右图)。
图9为液相色谱质谱联用法测定造模一个月后心力衰竭大鼠血清中苯乙酸及其代谢产物的多反应监测(MRM)色谱图;(A)空白对照组;(B)假手术组;(C)模型组;(D)标准品。
图10为空白组、假手术组和模型组中大鼠肠道菌群OUT分类的Venn图(重叠部分的数字代表多个分组中共有的物种数目,非重叠部分的数字代表对应分组所特有的物种数目)。Control:空白组;Sham:假手术组;Model:模型组。
图11示出了空白组、假手术组和模型组之间大鼠肠道菌群属水平的ace指数。Control:空白组;Sham:假手术组;Model:模型组。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图12示出了空白组、假手术组和模型组之间大鼠肠道菌群在属水平上的主坐标分析(PCoA)图。Control:空白组;Sham:假手术组;Model:模型组。
图13为空白组、假手术组和模型组的大鼠肠道菌群在属水平上的相对丰度分布。Control:空白组;Sham:假手术组;Model:模型组。
图14示出了假手术组和模型组大鼠肠道微生物群中属水平差异丰富物种的LEfSe分析(若LDA>2,显著)。左侧柱为Model:模型组,右侧柱为Sham:假手术组。
图15为心力衰竭大鼠血清苯乙酰谷氨酰胺及粪便中苯乙酸与差异菌群的斯皮尔曼相关性热图。
图16为空白组、假手术组和模型组中大鼠肠道菌群NR物种分类Venn图。Control:空白组;Sham:假手术组;Model:模型组。
图17为空白组、假手术组和模型组之间大鼠肠道菌群在NR物种水平上的主坐标分析(PCoA)图。Control:空白组;Sham:假手术组;Model:模型组。
图18血清苯乙酰谷氨酰胺含量与Turicibacter sp.TS3菌种相对丰度的相关性。
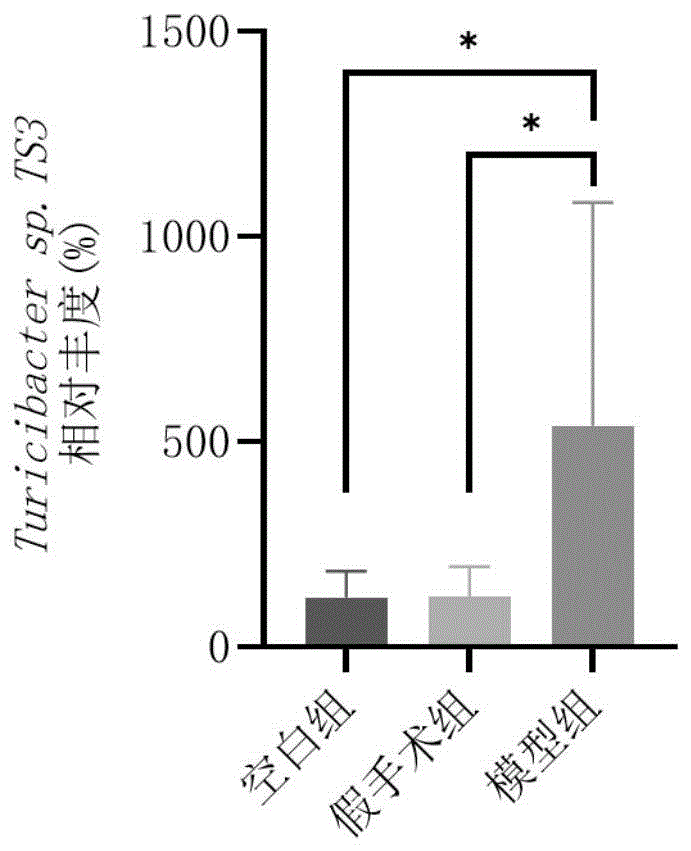
图19心力衰竭大鼠肠道菌群中Turicibacter sp.TS3相对丰度变化趋势。
图20为空白组、假手术组和模型组之间大鼠肠道菌群在功能水平上的主坐标分析(PCoA)图。Control:空白组;Sham:假手术组;Model:模型组。
图21为假手术组和模型组大鼠肠道菌群中差异功能富集的LEfSe图。(计算线性判别分析(LDA)得分;得分越高,表明效应大小越大,log10 LDA得分>2.0)。左侧柱为Model:模型组,右侧柱为Sham:假手术组。
图22显示了苯乙酸及其代谢产物的体内合成途径。
图23显示出了宏基因组测定空白组、假手术组和模型组大鼠肠道菌群苯乙酸及其代谢产物合成途径中的天冬氨酸氨基转移酶(AST)、芳香族氨基酸转氨酶(AAAT)和醛脱氢酶(ALDH)相对变化。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图24显示出了造模28天后各组缺血性心力衰竭大鼠心功能指标比较。(A)左心室射血分数(EF)(B)左心室缩短分数(FS)(各组n=6-9)。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图25为造模一个月各组缺血性心力衰竭大鼠血流动力学指标。(A)左室舒张末压(LVEDP)(B)左室收缩压(LVSP)(C)±dp/dtmin(D)±dp/dtmax。(各组n=6-9)。
图26为造模28天后各组缺血性心力衰竭大鼠心功能指标比较。(A)左心室射血分数(EF)(B)左心室缩短分数(FS)。(各组n=8-13)与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001
图27为造模一个月各组缺血性心力衰竭大鼠血流动力学指标。(A)左室舒张末压(LVEDP)(B)左室收缩压(LVSP)(C)±dp/dtmin(D)±dp/dtmax(各组n=8-13)。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图28为造模一个月后缺血性心力衰竭大鼠血清B型钠尿肽(BNP)和神经末端前体脑利钠肽(NT-proBNP)检测结果(各组n=8-13)。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图29为造模一个月后心力衰竭大鼠各组血清中苯乙酸及其代谢产物变化趋势(各组n=8-13)。与模型组相比,*P<0.05;与模型组相比,**P<0.01;与模型组相比,***P<0.001。
图30为心衰大鼠空白组、假手术组、模型组、给药组和阳性药组粪便中苯乙酸含量的定量测定结果。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。除非另有说明,否则“%”为基于重量的百分数。
下面详细说明本发明。
本发明中,术语“量”的含义包含含量、水平,绝对量、相对量等。
本文所用术语“心力衰竭”、“HF”和“心衰”可互换使用,其是指由于心脏的收缩功能和/或舒张功能发生障碍,不能将静脉回心血量充分排出心脏,导致静脉系统血液淤积,动脉系统血液灌注不足,从而引起心脏循环障碍症候群。
本发明提供抑制剂在制备用于预测、预防和/或治疗心力衰竭的药物中的用途,其中所述抑制剂包括能够抑制苯乙酸及其代谢产物或抑制其产生的试剂。抑制苯乙酸及其代谢产物的试剂包括能够结合苯乙酸及其代谢产物的小分子或大分子物质。用于苯乙酸及其代谢产物的产生抑制剂包括但不限于能够抑制、降低、减少苯乙酸及其代谢产物产生的化合物、试剂或制剂。优选地,所述苯乙酸及其代谢产物的产生由肠道微生物菌群介导。进一步优选地,所述苯乙酸及其代谢产物为肠道苏黎世菌属Turicibacter或源自该属的物种的相关代谢产物。
本发明中,抑制苯乙酸及其代谢产物产生的试剂包括天冬氨酸氨基转移酶抑制剂、芳香族氨基酸转氨酶抑制剂和/或醛脱氢酶抑制剂。
苯乙酸及其代谢产物的产生可以体现在其水平的改变,例如苯乙酸及其代谢产物的量的增加或减少。可以理解的是,苯乙酸及其代谢产物功能与其物理量相关。苯乙酸及其代谢产物水平可以通过本领域已知的任何方式进行检测和定量。例如,可以使用质谱如UPLC-ES1-MS/MS或NMR谱如
本领域可以理解的是,抑制剂除上述试剂外,进一步包括抗微生物剂,本文所用“抗微生物剂”是指能够杀死微生物、抑制微生物生长或抑制微生物活性的化学物质。在某些实施方案中,抗微生物剂是指能够杀死肠道苏黎世菌属Turicibacter、抑制肠道苏黎世菌属Turicibacter生长或抑制肠道苏黎世菌属Turicibacter活性的任何化学物质。在某些实施方案中,所述肠道苏黎世菌属包括但不限于该属的下述物种:Turicibactersanguinis、Turicibacter sp.TS3、Turicibacter sp.H121。优选地,本发明的抗微生物剂包括广谱抗生素。
在某些实施方案,苯乙酸的代谢产物包括苯乙酰谷氨酰胺,本文有时也简称为“PAGln”。
本发明进一步提供苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter在制备用于诊断或预测心力衰竭发生风险的诊断产品中的用途,其中所述诊断产品选自试剂盒、诊断装置和/或计算机系统。所述诊断或预测至少包括:
(1)利用试剂测量从受试者采集的样品中的苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量,得到测量值的步骤;
(2)将所述测量值与标准值进行比较的步骤;和
(3)当所述测量值高于所述标准值时,则将所述受试者预测为患有心力衰竭,或者将所述受试者预测为患有心力衰竭的风险;当所述测量值低于所述标准值时,则将所述受试者预测为未患心力衰竭,或者将所述受试者预测为未处于患有心力衰竭的风险。
步骤(1)
本发明的步骤(1)为用于获得受试者样品中苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量得到测量值的步骤。其中样品的类型不限定,其实例包括但不限于组织样品或流体样品。组织样品包括体细胞样品,流体样品包括血液或其成分例如血浆、血清等。生物样品可以是任何哺乳动物来源的样品,优选为来源于人的样品。可用于本发明的生物样品类型的实例包括但不限于以下的一种或多种:尿、粪便、泪液、全血、血清、血浆、血液成分、骨髓、细胞、组织、器官、体液、唾液、脸颊拭子、淋巴液、脑脊髓液、病变渗出物和由身体产生的其他流体。生物样品也可以是冷冻、固定、石蜡包埋或新鲜的活检样品。
本发明中,所述试剂是指能够被用于显示待测苯乙酸及其代谢产物和/或肠道苏黎世菌Turicibacter量或水平的任何试剂。本发明的试剂还可包括其它成分。其它成分的实例包括但不限于LC-MS/MS、扩增子测序以及流式细胞术相关测定试剂。在某些实施方案中,任何上述物质之一可以与其他物质分离的状态单独存在分别存放于不同的容器(例如,小瓶)中,只要在使用时它们能够相互接触即可。另外,优选地,任何两种以上的上述物质可混合作为混合物存在。
在某些实施方案中,其它成分可分别以干燥粉末的形式提供,或以溶液形式提供,例如水溶液的状态存在。在以水溶液状态存在的情况下,这些物质的浓度或量是本领域技术人员能够根据不同需求而方便地确定的。例如,用于储存的目的时,物质的浓度可以较高的形式存在,当处于工作状态或使用时,可通过例如稀释上述较高浓度的溶液来将浓度降低至工作浓度。
本发明中的试剂可被进一步制备为用于检测受试者心力衰竭的诊断剂。该诊断剂的形式或为诊断组合物、诊断试剂盒,或者多种单独存在的试剂组合使用的其他任何形式。
步骤(2)
本发明的步骤(2)为将测量值与标准值进行比较的步骤。其中标准值可以是具体的数值,也可以是数值范围。
在某些实施方案中,标准值可以是来自正常受试者的样品检测数值。优选来自于与待检测的受试者的年龄相当的正常对象的样品的数值,还优选地,标准值和测量值均通过相同的方法获得。
在某些实施方案中,标准值还可以来自于同一受试者的不同时间段。例如,测量在第一时间点从所述受试者采集的样品T1中的量作为所述标准值,测量在第二时间点从同一受试者采集的样品T2的量作为测量值。其中第一时间点T1优选为未显示或未出现心力衰竭任何征兆之前的时间点,第二时间点T2检测时的时间点优选为出现心力衰竭任何征兆之后的时间点。
在某些实施方案中,本发明的标准值为数值范围,例如,苯乙酸及其代谢产物的标准值为0.01-100ng/mL,还优选为10-60ng/mL,进一步优选为10-50ng/mL。
步骤(3)
本发明的步骤(3)为结果判定步骤。具体地,当所述测量值高于所述标准值时,则将所述受试者预测为患有心力衰竭,或者将所述受试者预测为患有心力衰竭的风险;当所述测量值低于所述标准值时,则将所述受试者预测为未患心力衰竭,或者将所述受试者预测为未处于患有心力衰竭的风险。
本发明还提供一种用于筛选对治疗或减缓心力衰竭有用的化合物的方法,本文有时简称为“筛选方法”。优选地,该方法包括:
a.利用试剂测量从患有心力衰竭的受试者采集的样品中苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量得到第一测量值的步骤;
b.将所述化合物施用至患有患有心力衰竭的受试者的步骤;
c.测量从施用所述化合物后的患有心力衰竭的受试者采集的样品中苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量得到第二测量值的步骤;
d.比较所述第一测量值和第二测量值的步骤;
e.当所述第二测量值小于或等于所述第一测量值时,将所述化合物筛选为对治疗或减缓心力衰竭有用的化合物,当所述第二测量值大于所述第一测量值时,将所述化合物筛选为对治疗或减缓心力衰竭无用的化合物。
本发明的筛选方法中,受试者优选为患有心力衰竭的动物模型,例如,大鼠、小鼠、狗、猪、猴、猩猩等。此类动物可通过人工方式诱导从而患有心力衰竭。
本发明进一步提供预测心力衰竭发生风险的系统,其包括:
数据获取单元,其用于获取至少来自受试者的苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量数据;和
判断单元,其用于根据所述苯乙酸及其代谢产物和/或肠道苏黎世菌属Turicibacter的量与预设阈值比较结果,将受试者分类为属于心力衰竭发生风险高或低患者。
本发明的数据获取单元的数据可以是通过医院实验室检查得到的数据,也可以来源于各种可能的采集途径进行采集,例如血液检测仪器、基于质谱、液质联用、扩增子测序仪等并具有一定数据处理和存储能力的检测设备。此类检测设备包括但不限于液相色谱质谱联用、测序系统或平台等。
本领域技术人员应理解,只要能够实现本发明的目的,在涉及方法的步骤前后,或步骤之间还可包含其他步骤或操作,例如进一步优化和/或改善本发明所述的方法。
实施例
1、构建心力衰竭大鼠模型
1.1大鼠左冠状动脉前降支结扎(LAD)模型制备
35只SPF级雄性SD大鼠(购于北京华阜康生物科技股份有限公司),体重240±10g,大鼠适应环境3天后,于造模前12h禁食。随机分为空白组(control)、假手术组(Sham)和模型组(Model)。模型组使用无菌生理盐水配置3%戊巴比妥钠溶液,按0.2mL/100g的剂量进行腹腔麻醉。大鼠胸部去毛备皮,消毒,在无菌条件下沿左胸骨左缘1cm出纵行切开皮肤约2cm,在第四或第五助骨间钝性分离肌肉组织,打开胸腔并剪开心包膜,用钝性拉钩勾出心脏,在左心耳与肺动脉圆锥之间穿线,结扎左冠状动脉前降支,然后迅速将心脏放回胸腔,缝合胸腔及皮肤。左冠状动脉前降支行结扎术后观察每只大鼠的心电图,保留ST段弓背抬高≥0.1mV,即有心肌缺血症状的大鼠。假手术组除不结扎冠状动脉外,其余操作与造模动物相同。
造模后半个月及1个月时的血液样本,血清冰浴静置30min,4℃、3000rpm条件下离心10min,上清液分装后冻存于-80℃冰箱备用。采用腹部按摩法采集大鼠新鲜粪便,用于肠道菌群分析,在-80℃超低温冰箱中保存备用。
1.2大鼠心力衰竭模型确认
在造模28天后进行心功能检测、血流动力学检测以及生化指标检测。
应用小动物超声系统进行测定,心功能检测结果如图1所示,与假手术组和空白组相比,冠状动脉结扎诱导急性心肌梗死后第28天,大鼠左心室射血分数(EF)和左心室缩短分数(FS)显著降低,表明大鼠可能发生心力衰竭。
采用颈动脉心室内插管法评估各组大鼠心脏血流动力学指标。血流动力学检测结果如图2所示,血流动力学评估表明,模型组的左心室舒张末压(LVEDP)高于假手术组和空白组;相反,与假手术组和空白组相比,接受冠状动脉结扎的大鼠的左心室收缩压(LVSP)、±dp/dtmin和±dp/dtmax显著降低。
取大鼠造模一个月后血清进行大鼠B型钠尿肽(BNP)和神经末端前体脑利钠肽(NT-proBNP)检测(采用THERMO全自动酶标仪MK3按照ELISA试剂盒进行)。生化指标检测显示模型大鼠的BNP和NT-proBNP浓度明显高于空白组和假手术大鼠(如图3所示)。
1.3结论:上述结果提示大鼠心力衰竭模型制作成功。
1.4心力衰竭患者(图标)
本发明中,心力衰竭患者来自聊城市人民医院,选择37例心力衰竭患者(年龄35-90岁),对照组为健康人群。研究参与者提供了有关其年龄、性别、心脏危险因素和既往心脏病的详细信息,并接受了血液学和生化检查。
2、基于液相色谱-质谱联用技术的心力衰竭大鼠血清拟靶向代谢组学研究
2.1、标准品溶液的配制
精密称取对照品1mg置离心管中,溶解得到1mg/mL的标准溶液母液,摇匀,放入4℃冰箱备用。
2.1、样本制备
配制含内标的甲醇提取液,内标浓度如下:苯丙氨酸-d5(26.67ng/mL)、TMAO-d9(16.67ng/mL)、去甲肾上腺素-d6(166.67ng/mL)、烟酸-d4(10ng/mL)、D-Glusone-
取20uL血清样本,10倍量预冷甲醇沉淀,涡旋1min,4℃离心,转速12000rpm,离心10min,取上清待测。
2.2、色谱条件
仪器为ACQUITY UPLC系统,Waters公司;流动相为A:0.1%甲酸-乙腈,B:含1nM甲酸铵的0.1%甲酸-水;色谱柱为ACQUITY BEH Amide,100mm×2.1mm,1.7μm,Waters公司;流速为0.3mL/min;柱温为40温;进样体积为1μL。
流动相梯度为:
2.3、质谱条件
仪器为三重四级杆质谱仪,Waters公司;检测时间0-20min;毛细管电压2kV;锥孔电压20V;洗脱温度400℃;洗脱气流速800L/h;锥孔气流量150L/h;离子源温度100℃;采集模式为正负离子模式;检测所有小分子代谢物离子对信息见下表。
表1内源性小分子种类与锥孔电压、碰撞能量、母离子、子离子的对应关系表
/>
2.4结果:
基于UPLC-MS的空白组(control)、假手术组(Sham)和模型组(Model)样本中代谢物谱图的评估,对目标内源性小分子的靶向化合物进行了T检验。其中,在假手术组和模型组具有显著性变化的差异代谢物之一的苯乙酸及其代谢产物趋势变化如图4所示。结果显示,相对于空白组和假手术组,造模一个月后的大鼠血清中PAGln水平显著升高,并在大鼠心衰过程中,苯乙酸及其代谢产物存在时间依赖效应而呈现递增趋势。
3、靶向定量分析心力衰竭大鼠以及患者中苯乙酸及其代谢产物检测结果
3.1标准溶液的配制
精密称取苯乙酸及其代谢产物和相应的标准品1mg至离心管中,适量超纯水超声、涡旋至全部溶解,得到1mg/mL的储备液。所有工作溶液均使用乙腈:水(85:15,v/v)稀释储备液得到,放于4℃冰箱备用。
3.2样本制备
配制含标准品(1ng/mL)的甲醇提取液,提取液置于-20℃冰箱内预冻。取20uL血清样本,10倍量预冷甲醇沉淀,涡旋1min,4℃离心,转速12000rpm,离心10min,取上清待测。
3.3色谱条件
仪器为ACQUITY UPLC系统,Waters公司;流动相为A:0.2%甲酸-乙腈,B:0.1%甲酸-水;色谱柱为ACQUITY BEH Amide,100mm×2.1mm,1.7μm,Waters公司;流速为0.3mL/min;柱温为40℃;进样体积为1μL。
流动相梯度为:
3.3质谱条件
仪器为三重四级杆质谱仪,Waters公司;检测时间0-8min;毛细管电压2.5kV;锥孔电压20V;洗脱温度400℃;洗脱气流速800L/h;锥孔气流量150L/h;离子源温度100℃;采集模式为正离子模式;检测苯乙酸及其代谢产物离子对信息见表2
表2 苯乙酸及其代谢产物与锥孔电压、碰撞能量、母离子、子离子的对应关系表
3.4粪便苯乙酸的测定
3.4.1标准溶液的配制
精密称取苯乙酸和Phe-d5标准品1mg至离心管中,适量超纯水超声、涡旋至全部溶解,得到1mg/mL的储备液。所有工作溶液均使用含1%甲酸的乙腈:水(85:15;v/v)稀释储备液得到,放于4℃冰箱备用。
3.4.2样本制备
配制含Phe-d5(10ng/mL)的甲醇提取液,提取液置于-20℃冰箱内预冻。取20mg粪便样本,400uL提取液提取,涡旋1min,超声3min,4℃离心,转速12000rpm,离心10min,取上清氮吹,100μL复溶,4℃离心,转速12000rpm,离心10min,取上清液进样。
3.4.3色谱条件
仪器为ACQUITY UPLC系统,Waters公司;流动相为A:0.2%甲酸-乙腈,B:0.1%甲酸-水;色谱柱为ACQUITY BEH Amide,100mm×2.1mm,1.7μm,Waters公司;流速为0.3mL/min;柱温为40℃;进样体积为1μL。
流动相梯度为:
3.4.4质谱条件
仪器为三重四级杆质谱仪,Waters公司;检测时间0-5.5min;毛细管电压1.8kV;锥孔电压20V;洗脱温度400℃;洗脱气流速800L/h;锥孔气流量150L/h;离子源温度100℃;采集模式为负离子模式;检测苯乙酸离子对信息下表:
苯乙酸与锥孔电压、碰撞能量、母离子、子离子的对应关系表
3.5结果
苯乙酸及其代谢产物浓度以标准品为内标,用标准曲线法计算得到。其中,纵坐标为苯乙酸及其代谢产物峰面积,横坐标为苯乙酸及其代谢产物浓度,如图5所示,其标准曲线为y=64783x+244.05,线性范围为0.0125-3.2ng/mL,相关性系数为r=0.9999,线性良好。各组苯乙酸及其代谢产物及内标色谱图、保留时间和峰响应见图9。定量结果显示苯乙酸及其代谢产物含量在模型组中显著升高,假手术组与空白组无显著差异。说明心力衰竭能显著增加大鼠苯乙酸及其代谢产物的含量(如图6所示)。
在心力衰竭患者血清的苯乙酸及其代谢产物测定中,结果如图7所示。其标准曲线为y=0.673782x+1.34276,线性范围为1.5625-800ng/mL,相关性系数为r=0.998,线性良好。定量结果显示,与健康组相比,PAGln含量在心衰患者中显著升高。说明心力衰竭能显著增加人体内PAGln的含量。
苯乙酸浓度以苯丙氨酸-d5为内标,用标准曲线法计算得到。其中,纵坐标为苯乙酸峰面积,横坐标为苯乙酸浓度,其标准曲线为y=14.001x+40.549,线性范围为3.90625-1000ug/mL,相关性系数为r=0.9998,线性良好(如图8左图所示)。定量结果显示,与空白对照组和假手术组相比,苯乙酸含量在模型组中显著升高(如图8右图所示)。说明心力衰竭大鼠体内苯乙酸显著升高,在后续进行宏基因功能富集后,发现该结果与宏基因功能富集结果相符。
4、16S rRNA基因测序分析
4.1粪便样品DNA的提取及PCR扩增
采用
表3 细菌16S rRNA基因测序PCR扩增引物信息
扩增体系(20μL):5×TransStart FastPfu缓冲液4μL,2.5mM dNTPs 2μL,上游引物(5uM)0.8μL,下游引物(5uM)0.8μL,TransStart FastPfu DNA聚合酶0.4μL,模板DNA10ng,ddH
扩增参数:95℃预变性3min,27个循环(95℃变性30s,55℃退火30s,72℃延伸30s),然后72℃稳定延10min,最后在4℃进行保存(PCR仪:ABI
4.2Illumina Miseq测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNAGel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus
4.3数据处理
(1)使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH(http://www.cbcb.umd.edu/software/flash,version1.2.7)软件进行拼接:(1)过滤reads尾部质量值20以下的碱基,设置50bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50bp以下的reads,去除含N碱基的reads;
(2)根据PE reads之间的overlap关系,将成对reads拼接(merge)成一条序列,最小overlap长度为10bp;
(3)拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列;
(4)根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2。
使用UPARSE软件(http://drive5.com/uparse/,version 7.1),根据97%的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(version 138),设置比对阈值为70%。
4.4生物信息学分析
4.4.1心力衰竭大鼠肠道菌群OTU划分
拼接优化后的Tags在97%相似度下聚类为用于物种分类的OTU。空白组(control)、假手术组(Sham)和模型组(Model)的OTU总数分别为:1255、1227和1288。Venn图结果显示空白组(control)、假手术组(Sham)和模型组(Model)有1044个重叠OTU,空白组(control)、假手术组(Sham)和模型组(Model)各自特有的OTU数量分别为:55、60和81。如图10所示,模型组特有的OTU数明显上升。
4.4.2心力衰竭大鼠肠道菌群Alpha多样性分析
采用秩和检验对Alpha多样性指数进行差异分析检验。如图11所示,与空白组和假手术组相比,模型组ACE丰富度显著上升,显示造模后大鼠肠道菌群物种数显著上调,表明心力衰竭疾病显著增加大鼠肠道菌群多样性。
4.4.3心力衰竭大鼠肠道菌群Beta多样性分析
运用加权UniFrac方法计算β多样性,利用主坐标分析(principal co-ordinatesanalysis,PCoA)对Beta多样性进行可视化展示。从图12中可以看出,各组之间的分布存在显著差异,模型组与空白组及假手术组完全分开,表明单独心力衰竭大鼠的肠道菌群结构发生了明显变化。上述结果提示,模型组与空白组和假手术组相比具有独特的多样性。
4.4.4心力衰竭大鼠肠道菌群物种组成分析
对属水平含量前20的菌进行比较分析,如图13所示,可以得到,在三组中丰度最高的都是norank_f__Muribaculaceae属、模型组中norank_f__Muribaculaceae属、Lactobacillus属等丰度增加,unclassified_f__Lachnospiraceae属、Lachnospiraceae_NK4A136_group属等丰度下降。
4.4.5心力衰竭大鼠肠道菌群组间显著性差异物种分析
为了识别假手术组和模型组中差异丰富的分类群,基于16S rRNA基因测序,对模型组和假手术组之间的粪便微生物群组成进行了线性判别分析和多级物种差异判别分析(LEfSe)。LDA值分布直方图显示,与假手术组相比,模型组大鼠具有更高的Turicibacter相对丰度(图14)。LEfSe分析表明,HF显著改变肠道微生物群的组成和分布,而Turicibacter菌可能作为心力衰竭疾病的生物标志物。
4.4.6心力衰竭大鼠肠道菌群相对丰度与血清中苯乙酸及其代谢产物含量之间的相关性分析
采用Spearman相关性分析,基于LefSe分析结果,分析了模型组中差异菌属相对丰度与血清中苯乙酸及其代谢产物含量之间的相关性。其中,差异菌群包括g__Lactobacillus、g__norank_f__norank_o__Clostridia_UCG-014、g__UCG-005、g__unclassified_f__Oscillospiraceae、g__Lachnospiraceae_UCG-006、g__unclassified_p__Firmicutes、g__Erysipelatoclostridium、g__Akkermansia、g__Eubacterium_brachy_group、g__norank_f__Desulfovibrionaceae、g__Flavonifractor、g__Parabacteroides、g__Dielma、g__Turicibacter、g__Clostridium_sensu_stricto_1、g__Holdemania、g__Oscillospira、g__norank_f__norank_o__norank_c__norank_p__Firmicutes。如图15所示,Spearman相关性分析结果显示Turicibacter菌属与血清中苯乙酸以及苯乙酰谷氨酰胺(PAGln)含量呈强正相关。
4.6结论:心衰疾病通过上调Turicibacter菌属的相对丰度来增加苯乙酸及其代谢产物的含量。
5、宏基因组测序分析
5.1 DNA提取、文库构建和宏基因组测序
根据制造商的说明,使用E.Z.N.A.土壤DNA试剂盒(Omega Bio-tek,Norcross,GA,U.S.)从大鼠粪便样本中提取总基因组DNA。提取的DNA的浓度和纯度分别用TBS-380和NanoDrop2000测定。在1%琼脂糖凝胶上检查DNA提取物质量。使用Covaris M220(中国基因有限公司)将DNA提取物片段化至平均大小约400bp,用于成对末端文库构建。使用NEXTflexTM快速DNA序列(美国德克萨斯州奥斯汀Bioo Scientific)构建配对末端文库。将含有全套测序引物杂交位点的接头连接到片段的钝端。根据制造商的说明(www.Illumina.com),在Majorbio Bio Pharm Technology Co.,Ltd.(中国上海)使用NovaSeq试剂盒/Hiseq X试剂盒对Illumina Novasek/Hiseq Xten(美国加利福尼亚州圣地亚哥IllumnaInc.)进行配对末端测序。
5.2序列质量控制与基因组组装
使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)对reads 3'端和5'端的adapter序列进行质量剪切;使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)去除剪切后长度小于50bp、平均碱基质量值低于20以及含N碱基的reads,保留高质量的pair-end reads和single-end reads;使用基于succinct de Bruijngraphs原理的拼接软件MEGAHIT(https://github.com/voutcn/megahit,version 1.1.2)对优化序列进行拼接组装。在拼接结果中筛选≥优化序bp的contigs作为最终的组装结果。
5.3基因预测、分类和功能注释
使用MetaGene鉴定重叠群中的开放阅读框(ORF)(http://metagene.cb.k.u-tokyo.ac.jp/),检索长度为或超过100bp的预测ORF,并使用NCBI翻译表将其翻译成氨基酸序列(http://www.ncbi.nlm.nih.gov/Taxonomy/taxonomyhome.html/index.cgi?chapter=tgencodes#SG1)。
使用CD-HIT构建了一个非冗余基因目录(http://www.bioinformatics.org/cd-hit/4.6.1),具有90%的序列同一性和90%的覆盖率。使用SOAPaligner将质量控制后的读数映射到具有95%同一性的非冗余基因目录(http://www.bioinformatics.org/cd-hit/,version 4.6.1)和每个样本中的基因丰度进行评估。
5.4物种与功能注释
5.4.1物种分类学注释
使用Diamond(http://www.diamondsearch.org/index.php,version 0.8.35)将非冗余基因集的氨基酸序列与NR数据库进行比对(BLASTP比对参数设置期望值e-value为1e-5),并通过NR库对应的分类学信息数据库获得物种注释,然后使用物种对应的基因丰度总和计算该物种的丰度。
5.4.2KEGG功能注释
使用Diamond(http://www.diamondsearch.org/index.php,version 0.8.35)将非冗余基因集的氨基酸序列与KEGG数据库(version 94.2)进行比对(BLASTP比对参数设置期望值e-value为1e-5)。获得基因对应的KEGG功能。使用KO、Pathway、EC、Module对应的基因丰度总和计算对应功能类别的丰度。
5.5生物信息学分析
5.5.1心力衰竭大鼠肠道菌群物种分类
空白组(control)、假手术组(Sham)和模型组(Model)的物种总数分别为:19444、19419和18949。Venn图结果显示空白组(control)、假手术组(Sham)和模型组(Model)有16066个重叠物种,空白组(control)、假手术组(Sham)和模型组(Model)各自特有的OTU数量分别为:1010、956和804。如图16所示,在种的水平上各组之间的肠道菌群存在差异。
5.5.2大鼠肠道菌群物种多样性分析
使用加权UniFrac方法计算β多样性,并进行主坐标分析(PCoA)。PCoA显示三组之间的微生物群组成存在差异。使用排列多变量方差分析(PERMANOVA)分析,结果显示模型组与假手术组和空白组的分布存在显著差异(如图17所示)。
5.5.3相关性分析
为了确定Turicibacter菌种与苯乙酸及其代谢产物之间的关系,本发明进行了相关分析,结果如图18所示。苯乙酸及其代谢产物与Turicibacter sp.TS3之间存在显著的正相关。随后,本发明比较了各组Turicibacter sp.TS3菌种的趋势。如图19所示,相较于假手术组和空白组,模型组种Turicibacter sp.TS3显著增加。
5.5.4心力衰竭大鼠肠道菌群功能分类
利用KEGG数据库预测HF大鼠肠道微生物群的功能变化。HF可能导致代谢通路、次级代谢产物的生物合成、不同环境中的微生物代谢、氨基酸生物合成等方面的功能变化。
5.5.5大鼠肠道菌群功能多样性分析
使用主坐标分析(PCoA)分析了三组之间的功能差异,如图20所示,空白组和假手术组与模型组均易于分离。
5.5.6心力衰竭大鼠肠道菌群组间功能显著差异分析
根据LEfSe分析的LDA值分布直方图显示(如图21所示),假手术组富含苯丙氨酸、赖氨酸和色氨酸的生物合成途径,模型组富含甲烷代谢途径。通过查阅kegg数据库,本发明推测了苯乙酸及其代谢产物的体内生成途径,如图22所示。
5.5.7心力衰竭大鼠肠道菌群代谢通路组间差异分析
基于kegg注释结果,使用宏基因组测序技术对苯丙氨酸代谢途径进行了差异酶测试。对参与该代谢途径的多组酶的成对样本进行t检验,以测试各组之间差异的显著性。结果表明,天冬氨酸氨基转移酶(AST)、芳香族氨基酸转氨酶(AAAT)和醛脱氢酶(ALDH)在模型组升高,如图23所示。
5.6结论:大鼠心力衰竭疾病通过影响Turicibacter sp.TS3菌种调节苯乙酸及其代谢产物合成途径中相关酶含量上调苯乙酸及其代谢产物的量发挥致心衰的作用。
6、苯乙酸及其代谢产物影响心力衰竭疾病的验证研究
6.1大鼠左冠状动脉前降支结扎(LAD)模型制备
45只SPF级雄性SD大鼠(购于北京华阜康生物科技股份有限公司),体重240±10g,大鼠适应环境3天后,于造模前12h禁食。随机分为空白组、假手术组、模型组、低剂量组、高剂量组。通过对实验动物进行左冠状动脉前降支行结扎术(LAD)进行心衰模型构建,左冠状动脉前降支结扎术后观察每只大鼠的心电图,保留ST段弓背抬高≥0.1mV,即有心肌缺血症状的大鼠。假手术组除不结扎冠状动脉外,其余操作与造模动物相同。
造模后,即对大鼠进行注射给药,其中低剂量组单次皮下注射PAGln(25mg/mL),高剂量组单次单次皮下注射PAGln(50mg/mL),空白组、假手术组、模型组给予相应的生理盐水溶液,给药28天后眼眶取血,给药过程持续一个月。
6.2超声心动检测
步骤同1.2。结果如图24所示,与假手术组和空白组相比,冠状动脉结扎诱导急性心肌梗死后第28天,大鼠左心室射血分数(EF)和左心室缩短分数(FS)显著降低;与模型组比较,低剂量组大鼠左心室射血分数和左心室缩短分数呈现下调趋势,而高剂量组大鼠显著降低,呈现剂量依赖。表明大鼠可能发生心力衰竭,苯乙酸及其代谢产物可能加重心力衰竭的严重程度。
6.3血流动力学检测
步骤同1.2。结果如图25所示,血流动力学评估表明,模型组的LVEDP(左室舒张末压)高于假手术组和空白对照组(均P<0.01),与模型组比较,低剂量组和高剂量组大鼠左室舒张末压水平显著上升;相反,与假手术组和空白组相比,接受冠状动脉结扎的大鼠的LVSP(左室收缩压)、±dp/dtmin和±dp/dtmax显著降低(分别为P<0.01和P<0.001);低剂量组和高剂量组显著低于模型组。
6.4结论:苯乙酸及其代谢产物具有加重心衰的作用,可以作为一种新的心力衰竭的生物标志物。
7.苯乙酸及其代谢产物作为心力衰竭标志物探究灯盏生脉治疗心力衰竭的药效
7.1大鼠左冠状动脉前降支结扎(LAD)模型制备
步骤同1.1。行LAD术前将大鼠随机分出空白组和假手术组。LAD术后观察每只大鼠的心电图,保留ST段弓背抬高≥0.1mV,即有MI症状的大鼠,随机分入模型组、灯盏生脉给药组和曲美他嗪给药组。其中空白组9只大鼠,假手术组、模型组、灯盏生脉给药组和曲美他嗪给药组各13只大鼠。造模结束后,即对大鼠进行灌胃给药,其中空白组、假手术组、模型组给予相应的CMCNa溶液,灯盏生脉给药组和曲美他嗪给药组分别给予灯盏生脉给药物及阳性药溶液,给药过程持续一个月。
7.2超声心动检测
步骤同1.2。结果如图26所示,与假手术组和空白组相比,冠状动脉结扎诱导急性心肌梗死后第28天,大鼠左心室射血分数(EF)和左心室缩短分数(FS)显著降低;与模型组比较,灯盏生脉给药组和曲美他嗪给药组大鼠左心室射血分数和左心室缩短分数呈现显著回调趋势。上述结果提示大鼠心衰模型制作成功,曲美他嗪和灯盏生脉给药均表现出对心衰模型大鼠的缓解作用。
7.3血流动力学检测
步骤同1.2。结果如图27所示,血流动力学评估表明,模型组的LVEDP(左室舒张末压)高于假手术组和空白组,与模型组比较,灯盏生脉给药组和曲美他嗪给药组大鼠左室舒张末压水平显著下降;相反,与假手术组和空白组相比,接受冠状动脉结扎的大鼠的LVSP(左室收缩压)、±dp/dtmin和±dp/dtmin显著降低;灯盏生脉给药组和曲美他嗪给药组显著高于模型组。
7.4生化指标检测
步骤同1.2。结果如图28所示,与假手术组和空白组相比,模型大鼠的BNP和NT-proBNP浓度显著升高。与模型组比较,灯盏生脉给药组和曲美他嗪给药组大鼠血清BNP和NT-proBNP水平下调。灯盏生脉组与曲美他嗪组无显著性变化。
7.5基于液相色谱-质谱联用技术拟靶向定量分析心力衰竭大鼠血清中苯乙酸及其代谢产物检测、标准品溶液的配制、样本制备、色谱条件、质谱条件步骤同2.1-2.3。
结果如图29和图30所示,相比于空白组和假手术组,模型组苯乙酸及其代谢产物水平显著升高,灯盏生脉给药组和曲美他嗪给药组较模型组不同程度下降,灯盏生脉给药组下降最为显著。结果提示心衰大鼠模型造模成功,灯盏生脉给和曲美他嗪均能有效降低大鼠苯乙酸及其代谢产物水平,以灯盏生脉效果最为显著。
通过检测心衰标志物苯乙酸及其代谢产物在灯盏生脉组大鼠血清以及粪便中的含量下降,提示灯盏生脉具有治疗心力衰竭的功效。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本申请说明书和实施例仅是示例性的。
