一种生产透明质酸的基因工程菌及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物工程技术领域,涉及一种生产透明质酸的基因工程菌及其应用。
背景技术
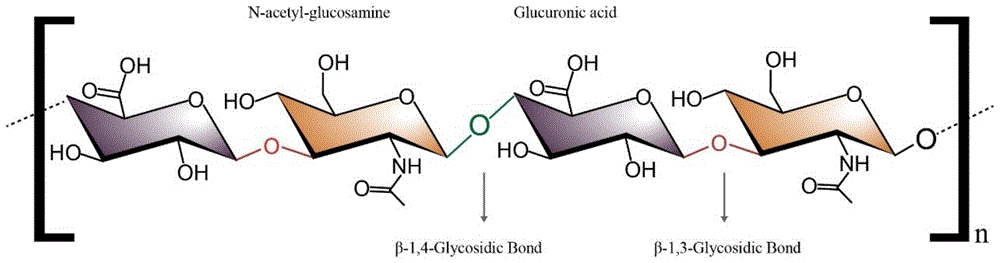
透明质酸(Hyaluronic acid,HA),又称玻尿酸,是由D-葡萄糖醛酸(GlcA)与N-乙酰葡糖胺(GlcNAC)以β-1,3和β-1,4糖苷键交替连接而成的线性、无支链糖胺聚糖(图1)。因透明质酸具有独特的黏弹性、吸湿性、非免疫原性和生物相容性,使其在医药领域、食品及化妆品等领域已具有广泛的应用。
在过去相当长的时间内,透明质酸的工业化生产主要依靠从动物组织(例如鸡冠)中提取,由于受到原料品质和数量限制,透明质酸生产成本一直较高,再加上动物疫源交叉感染风险的事件频发导致面临越来越高的卫生安全关注,限制了透明质酸在生物医药和临床的应用。而当前HA的获取已经由传统的动物组织提法转变为微生物发酵法。其中应用最广的微生物宿主是致病性弱的溶血性Streptococcus species C族,发酵透明质酸的最高产量可达到6~7g/L,然而由于Streptococcus存在潜在的致病性和遗传操作困难等因素大大限制了该宿主系统性改造及透明质酸的生物合成。得益于合成生物学技术的迅速发展,利用安全级微生物发酵合成透明质酸是近年来新兴的一类多糖合成技术。虽然一些安全级微生物宿主如枯草芽孢杆菌和谷氨酸棒杆菌已成功被开发用于透明质酸的合成,但所使用重组的HA合成酶主要来源于潜在风险的链球菌属I类酶和致病菌多杀性巴氏杆菌(Pasteurella multocida)的Ⅱ类酶。因此,寻找挖掘高效天然来源且具有食源安全属性的新型HA合成酶,并开发相应的生产工艺,对解决透明质酸的绿色生物制造尤为重要。
嗜热链球菌是传统上常用于制备乳制品一类益生菌,通常被认为是食品安全级的微生物菌株且具有产生透明质酸的能力。当前报道的生产工艺主要利用嗜热链球菌进行发酵,最大透明质酸产量为260mg/L,其合成的透明质酸产率低,不能满足大规模培养和工业化生产(202110884758.6)。
发明内容
本发明所要解决的技术问题是针对现有技术的不足,提供一种食源安全属性的新型HA合成酶和生产透明质酸的基因工程菌。
本发明还要解决的技术问题是提供上述生产透明质酸的基因工程菌的构建方法。
本发明最后要解决的技术问题是提供上述生产透明质酸的基因工程菌的应用。
发明思路:探索利用高效天然来源且具有食源安全性的新型HA合成酶建立透明质酸的工业化生产工艺的方法,来解决透明质酸的绿色生物制造难题。因此,本发明基于合成生物学技术对安全级微生物解淀粉芽孢杆菌(Bacillus amyloliquefaciens)进行遗传改造,构建高产菌株并用于透明质酸的生产。
为了解决上述技术问题,本发明公开的技术方案如下:
本发明提供了一种生产透明质酸的基因工程菌,以解淀粉芽孢杆菌NF为宿主,利用组成型强启动子pHpaⅡ表达了透明质酸合成酶编码基因sthasA;同时异源表达了UDP-葡萄糖脱氢酶编码基因cghasB;敲除了多糖合成操纵子基因epsA-O和低聚果糖(Levan)合成酶编码基因sacB。
其中,所述的解淀粉芽孢杆菌NF宿主是解淀粉芽孢杆菌NX-2S(该菌株详细的构建过程已公开在专利CN106047780B中)的改造菌株,即在原始菌株的基础上敲除了γ-聚谷氨酸合成酶编码基因PgsBCA。
其中,所述的基因工程菌,其表达载体为pMA5(购买自BioVector NTCC质粒载体菌株细胞蛋白抗体基因保藏中心)。
其中,所述的透明质酸合成酶编码基因sthasA来源于嗜热链球菌Streptococcusthermophiles SMQ-301,经过密码子优化后的编码序列如SEQ ID NO.1所示。
其中,所述的UDP-葡萄糖脱氢酶编码基因cghasB来源于谷氨酸棒杆菌Corynebacterium glutamacium,菌株号ATCC 13032,编码序列如SEQ ID NO.2所示。
本发明还提供了上述生产透明质酸的基因工程菌的构建方法,包括如下步骤:
(a)解淀粉芽孢杆菌CF菌株的构建:通过敲除解淀粉芽孢杆菌NF的epsA-O和sacB基因,获得解淀粉芽孢杆菌CF菌株;
(b)重组解淀粉芽孢杆菌的构建:将sthasA基因序列和cghasB基因经密码子优化后的序列克隆到表达载体pMA5中,并验证,得到重组质粒pMA5-sthasA-cghasB,将重组质粒pMA5-sthasA-cghasB转化入利用步骤(a)获得的解淀粉芽孢杆菌CF制备的感受态细胞中,构建重组解淀粉芽孢杆菌。
其中,步骤(a)中,所述的解淀粉芽孢杆菌CF菌株的构建,具体操作步骤如下:
1)敲除质粒构建
解淀粉芽孢杆菌的基因敲除采用课题组自主开发的CRISPR-Cas9n系统,pNX用来表达Cas9n蛋白,PDR温敏型质粒用于sgRNA的转录和提供同源修复模板DNA的供体。本实验所使用的Cas9n蛋白是以梭菌CRISPR工作质粒pNICKclos 2.0为模板,委托上海生物工程股份有限公司全基因合成后使用Cas9n-F/Cas9n-R引物进行cas9n基因的扩增。该基因大小约为4107bp。而Pgrac强启动子从枯草芽孢杆菌表达载体pHT01(购买自BioVector NTCC质粒载体菌株细胞蛋白抗体基因保藏中心)上利用Pgrac-F/Pgrac-R引物进行扩增,另外,选取解淀粉芽孢杆菌来源的淀粉酶Tamy,利用Tamy-F/Tamy-R引物进行扩增作为Cas9n基因的转录终止子。通过胶回收试剂盒对强启动子Pgrac、Cas9n和Tamy片段进行回收后,采用重叠PCR利用Pgrac-F/Tamy-R引物对三个片段融合得到Cas9n蛋白表达框。融合后的片段Pgrac-Cas9n-Tamy采用一部克隆通过Sma I和Xba I酶切连接至表达载体pNX01(该表达载体详细的构建过程已公开在专利中CN108624546A)上,得到重组质粒pNX-Cas9n。
sgRNA的表达以PDR(购买自BioVector NTCC质粒载体菌株细胞蛋白抗体基因保藏中心)为载体,根据靶基因设计的引物SgsacB-F/SgsacB-R、SgespA-O-F/SgespA-O-R分别获得sacB和espA-O基因的sgRNA,以敲出基因的上下游各800bp用作同源臂修复,其中用引物SacBL-F/SacBL-R扩增得到sacB基因上游arm,引物SacBR-F/SacBR-R扩增得到sacB基因下游arm,三片段重叠得到sacBsgRNA-SacBL-SacBR。以同样的方法获得espsgRNA-EspL-EspR。将扩增得到的sacBsgRNA-SacBL-SacBR和espsgRNA-EspL-EspR分别插入到PDR质粒的Sal I和Xho I位点之间。分别得到pDR-sacBsgupp和pDR-espA-Osgupp质粒。
2)副产物途径的CRISPR-Cas9n敲除
为了敲除解淀粉芽孢杆菌NF的epsA-O和sacB基因。利用基于CRISPR方法的Cas9n表达和sgRNA双质粒系统,将转化细胞涂布于含1mM IPTG的壮观霉素和氯霉素双抗LB琼脂平板上,30℃孵育12h,挑取转化子,然后用引物SacBOut-F/SacBOut-R和EspA-OOut-F/EspA-OOut-R进行基因敲除验证。为了去除编辑细胞中Cas9n和sgRNA的表达质粒,选择编辑细胞的单个菌落接种于5mL LB培养基中,并在42℃不含抗生素的条件下培养12h,连续传代2次后,在LB固体培养基上进行稀释涂布。当在壮观霉素和氯霉素上均未观察到生长的情况下,将菌种保存。将敲除epsA-O和sacB基因的菌株命名为CF。
其中,步骤(b)中,所述的重组解淀粉芽孢杆菌的构建,具体操作步骤如下:
1)透明质酸合成酶StHAS密码子优化
一种透明质酸合成酶StHAS,来源于嗜热链球菌(Streptococcus thermophilus),其核苷酸序列如SEQ ID NO.1所示。按照解淀粉芽孢杆菌(Bacillus amyloliquefaciensCF)的密码子偏好性将该N-乙酰氨基葡萄糖转移酶优化后全基因合成,其核苷酸序列如SEQID NO.2所示,目的基因密码子优化和全基因合成交由通用生物系统(安徽)有限公司完成。
2)重组解淀粉芽孢杆菌构建
将SEQ ID NO.1和SEQ ID NO.2所示的核苷酸序列分别单独扩增,经过重叠PCR后克隆到表达载体pMA5中,得到重组质粒pMA5-sthasA-cghasB。连接后的重组质粒pMA5-sthasA-cghasB通过化学转化方法转化至大肠杆菌GM2163菌株中,对验证正确的阳性转化子进行质粒提取,将验证成功的重组质粒pMA5-sthasA-cghasB采用电击转化法转化到制备好的解淀粉芽孢杆菌CF(Bacillus amyloliquefaciens CF)感受态细胞中,将复苏转化液涂布到含有硫酸卡那霉素(25μg/mL)的LB琼脂平板平板,37℃,静置培养12h。从平板上挑取长出来的单菌落观察重组菌菌株菌落形态与菌落PCR验证阳性菌株,即为基因工程菌。
上述生产透明质酸的基因工程菌在发酵制备透明质酸中的应用也在本发明所保护的范围之内。
其中,在发酵制备透明质酸中的应用,包括如下步骤:
(1)将所述的基因工程菌于28~37℃下活化后,接种到种子培养基中进行培养,得到含基因工程菌的种子液。
(2)将步骤(1)中获得的种子液以1%~10%的接种量分别接种于发酵培养基进行发酵罐发酵。
其中,步骤(1)中,所述的培养,其条件为:摇床转速220rpm,37℃下培养10~16h至OD
其中,步骤(1)中,所述的种子培养基为:酵母粉5g/L,蛋白胨10g/L,NaCl 10g/L,其余为水,pH 6.0~8.0。
其中,步骤(2)中,所述的种子液1%~10%的接种量,优选的接种量为4%。
其中,步骤(2)中,所述的发酵,其条件为:28~37℃,pH 5.0~8.0,摇床转速220rpm条件下发酵48h。优选的条件为:37℃,pH 7.0,摇床转速220rpm条件下发酵48h。
其中,步骤(2)中所述的发酵培养基由碳源、氮源、无机盐、渗透调节剂和水组成;其中,所述的碳源为菊粉、菊粉粗提液、菊糖、葡萄糖、果糖、蔗糖、麦芽糖、木糖、阿拉伯糖、糖蜜、甘油中的任意一种或几种的组合,浓度为20~60g/L;所述的氮源为酵母粉、蛋白胨、豆粕粉、牛肉膏、鱼粉蛋白胨、硫酸铵、尿素中的任意一种或几种的组合,浓度为5~20g/L;所述的无机盐为MgSO
相比于现有技术,本发明的有益效果为:
(1)为挖掘食源安全性的HA合成酶用于透明质酸的生产,本发明以嗜热链球菌(Streptococcus thermophilus)来源的透明质酸合成酶StHAS在解淀粉芽孢杆菌通过合成途径重构,提供了一种微生物发酵生产透明质酸的新方法。
(2)本发明所使用的解淀粉芽孢杆菌为食品安全级新宿主,同时展现出了较高的透明质酸合成能力。
(3)本发明所述的一株稳定高效生产透明质酸的基因工程菌在7.5L发酵罐中培养48h,透明质酸的产量可达到5.59g/L。该工艺发酵生产透明质酸的水平高,具有巨大的应用价值和工业化潜力。
附图说明
图1为透明质酸结构示意图;
图2为透明质酸在解淀粉芽孢杆菌中的合成途径示意图;
图3分别是CRISPR-Cas9n双质粒工具(A)和CRISPR-Cas9n敲除胞外多糖合成操纵子基因epsA-O和低聚果糖(Levan)合成酶编码基因sacB后PCR电泳检测示意图(B),注:泳道1:DL 15000Marker;泳道2:基因敲除前对照菌株的PCR结果;泳道3:基因敲除后的PCR结果;
图4为重组质粒pMA5-sthasA-cghasB质粒构建图(图中pMA5-hasA-cghasB与pMA5-sthasA-cghasB所表述的意思相同);
图5为重组质粒pMA5-sthasA-cghasB的电泳检测示意图,注:泳道1:DL15000Marker;泳道2:pMA5-sthasA-cghasB的Nde I和BamH I双酶切(目的条带1208和1320bp,cghasB前存在Nde I酶切位点);
图6为HA发酵培养条件及培养组分优化结果。(A)温度对HA合成的影响;(B)pH对HA合成的影响;(C)接种量对HA合成的影响;(D)接种种龄对HA合成的影响;(E)菊糖浓度对HA合成的影响;(F)氮源种类对HA合成的影响;(G)氮源浓度对HA合成的影响;(H)不同无机盐对发酵合成HA的影响;
图7为发酵时间与透明质酸产生量、生物量(干重DCW)关系图;
图8为发酵液检测透明质酸的液相色谱结果图。
具体实施方式
下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
下面结合具体实施例对本发明进一步进行描述。
下述实施例中所用实验材料和试剂盒
表1主要实验材料
下述实施例中,发酵液中透明质酸(HA)产量检测方法
发酵液经适当稀释后,离心除去菌体,用0.22μm滤膜过滤发酵液上清,并收集滤液用于凝胶渗透色谱(GPC)测定HA产量。色谱柱为Shodex Ohpak SB-806M HQ,流动相为0.1MNa
实施例1:CRISPR-Cas9n系统敲除多糖副产物途径
(1)敲除质粒构建
解淀粉芽孢杆菌的基因敲除采用课题组自主开发的CRISPR-Cas9n系统,pNX用来表达Cas9n蛋白,PDR温敏型质粒用于sgRNA的转录和提供同源修复模板DNA的供体。本实验所使用的Cas9n蛋白是以梭菌CRISPR工作质粒pNICKclos 2.0为模板,委托上海生物工程股份有限公司全基因合成后使用Cas9n-F/Cas9n-R引物进行cas9n基因的扩增。该基因大小约为4107bp。而Pgrac强启动子从枯草芽孢杆菌表达质粒pHT01(购买自BioVector NTCC质粒载体菌株细胞蛋白抗体基因保藏中心)上利用Pgrac-F/Pgrac-R引物进行扩增,另外,选取解淀粉芽孢杆菌来源的淀粉酶Tamy,利用Tamy-F/Tamy-R引物进行扩增作为Cas9n基因的转录终止子。通过胶回收试剂盒对强启动子Pgrac、Cas9n和Tamy片段进行回收后,采用重叠PCR利用Pgrac-F/Tamy-R引物对三个片段融合得到Cas9n蛋白表达框。融合后的片段Pgrac-Cas9n-Tamy采用一部克隆通过Sma I和Xba I酶切连接至表达载体pNX01(该表达载体详细的构建过程已公开在专利中CN108624546B)上,得到重组质粒pNX-Cas9n。
sgRNA的表达以PDR(购买自BioVector NTCC质粒载体菌株细胞蛋白抗体基因保藏中心)为载体,根据靶基因设计的引物SgsacB-F/SgsacB-R、SgespA-O-F/SgespA-O-R分别获得sacB和espA-O基因的sgRNA,以敲出基因的上下游各800bp用作同源臂修复,其中用引物SacBL-F/SacBL-R扩增得到sacB基因上游arm,引物SacBR-F/SacBR-R扩增得到sacB基因下游arm,三片段重叠得到sacBsgRNA-SacBL-SacBR。以同样的方法获得espsgRNA-EspL-EspR。将扩增得到的sacBsgRNA-SacBL-SacBR和espsgRNA-EspL-EspR分别插入到PDR质粒的Sal I和Xho I位点之间。分别得到pDR-sacBsgupp和pDR-espA-Osgupp质粒。
表2敲除质粒构建所用引物序列
PCR反应体系为:模板DNA2μL,上游引物2μL,下游引物2μL,2×mix DNA聚合酶12.5μL,ddH
PCR反应参数为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸1min,循环30次;72℃最终延伸10min,4℃终止。
重叠PCR反应体系为:模板DNA1 2μL,模板DNA2 2μL,上游引物2μL,下游引物2μL,2×mix DNA聚合酶25μL,ddH
重叠PCR反应参数为:94℃预变性5min;94℃变性30s,55℃退火1min,72℃延伸2min,循环30次;72℃最终延伸10min,4℃终止;反应结束后用琼脂糖凝胶电泳检测产物,并用试剂盒回收目的DNA片段。
(2)副产物途径的CRISPR-Cas9n敲除(图3)
为了敲除解淀粉芽孢杆菌NF的epsA-O和sacB基因。利用基于CRISPR方法的Cas9n表达和sgRNA双质粒系统,将转化细胞涂布于含1mM IPTG的壮观霉素和氯霉素双抗LB琼脂平板上,30℃孵育12h,挑取转化子,然后用引物SacBOut-F/SacBOut-R和EspA-OOut-F/EspA-OOut-R进行基因敲除验证。为了去除编辑细胞中Cas9n和sgRNA的表达质粒,选择编辑细胞的单个菌落接种于5mL LB培养基中,并在42℃不含抗生素的条件下培养12h,连续传代2次后,在LB固体培养基上进行稀释涂布。当在壮观霉素和氯霉素上均未观察到生长的情况下,将菌种保存。将敲除epsA-O和sacB基因的菌株命名为CF。
表3副产物途径的CRISPR-Cas9n敲除所用引物序列
实施例2:重组解淀粉芽孢杆菌的构建
(1)透明质酸合成酶StHAS密码子优化
一种透明质酸合成酶StHAS,来源于嗜热链球菌(Streptococcus thermophilus),其核苷酸序列如SEQ ID NO.1所示。按照解淀粉芽孢杆菌(Bacillus amyloliquefaciensCF)的密码子偏好性将该N-乙酰氨基葡萄糖转移酶优化后全基因合成,其核苷酸序列如SEQID NO.2所示,目的基因密码子优化和全基因合成交由通用生物系统(安徽)有限公司完成。
(2)重组解淀粉芽孢杆菌构建
将SEQ ID NO.1和SEQ ID NO.2所示的核苷酸序列分别单独扩增,经过重叠PCR后克隆到表达质粒pMA5(购买自BioVector NTCC质粒载体菌株细胞蛋白抗体基因保藏中心)中得到重组质粒pMA5-sthasA-cghasB,再将重组质粒pMA5-sthasA-cghasB通过电转化法转化至解淀粉芽孢杆菌中,得到能够发酵合成透明质酸的工程菌株,具体过程如下:
1)利用引物F1和引物R1扩增SEQ ID NO.1所示的透明质酸合成酶编码基因SthasA的核苷酸序列,利用引物F2和引物R2扩增SEQ ID NO.2所示的UDP-葡萄糖脱氢酶编码基因CgHasB的核苷酸序列。
表4扩增编码基因SthasA和CgHasB所用引物序列
PCR扩增体系为:模板质粒pUC57-sthasA(sthasA由安徽通用股份有限生物全基因合成):DNA 2μL,引物F1和引物R1:各2μL,PrimeSTAR高保真酶:12.5μL,ddH
PCR反应程序为:94℃预变性4min,94℃变性2min;然后55℃退火30s,72℃延伸1min,循环30次;
回收PCR扩增产物,进行重叠PCR反应。PCR扩增体系为:模板1 sthasA克隆产物和模板2 cghasB克隆产物:各2μL引物F1和引物R2:各2μL,PrimeSTAR高保真酶:12.5μL,ddH
重叠PCR反应程序为:94℃预变性4min,94℃变性2min;然后55℃退火1min,72℃延伸2min,循环30次;
回收重叠PCR扩增产物,与经过限制性内切酶Nde I和BamH I双酶切后的质粒pMA5,使用一步克隆法在ExnaseⅡ作用下进行连接,得到重组质粒pMA5-sthasA-cghasB(图4);
2)将重组质粒pMA5-sthasA-cghasB转化至大肠杆菌GM2163中,涂布含有100μg/mL氨苄青霉素的LB固体培养基上,37℃恒温培养10~12h得到初步阳性克隆;分别挑取初步阳性克隆于5mL含有100μg/mL氨苄青霉素的LB液体培养基中,37℃、200rpm培养过夜,提取质粒,经限制性内切酶Nde I和BamH I双酶切质粒,根据电泳结果判断具有序列表SEQ ID NO:1和SEQ IDNO:2的DNA片段的质粒为重组质粒pMA5-sthasA-cghasB,具有该质粒的菌落为阳性克隆菌株(图5)。
3)电击转化感受态制备
将由甘油管保存的B.amyloliquefaciens在LB平板上划线,37℃过夜培养。挑取单菌落于5mL感受态制备培养基中,作为种子液于37℃培养12h。取2mL种子液接种到装有100mL感受态培养基的500mL摇瓶中,37℃培养震荡至OD
2mm的电转杯用75%酒精清洗,在无菌环境下晾干,电转前于冰上预冷。向100μL感受态细胞中加入100ng重组质粒,混匀后转移至预冷的电转杯中电转化,电压设置为2.5kV,电阻200Ω,电击时间设为4ms进行电击。
3)将验证成功后重组质粒pMA5-sthasA-cghasB采用电击转化法转化到解淀粉芽孢杆菌(Bacillus amyloliquefaciens CF)菌株中,将复苏转化液涂布到含有硫酸卡那霉素(25μg/mL)的LB琼脂平板平板,37℃,静置培养12h。从平板上挑取长出来的单菌落观察重组菌菌株菌落形态与菌落PCR验证阳性菌株,即为基因工程菌。
实施例3:基因工程菌株发酵生产透明质酸(HA)
(1)将实施例2得到的基因工程菌在28~37℃培养温度下活化后,将菌株接种到种子培养基中,摇床转速220rpm,37℃下培养10~16h至OD
(2)将获得的种子液以1%~10%的接种量分别接种于发酵培养基,在28~37℃,pH 5.0~8.0,摇床转速220rpm条件下,进行发酵罐发酵48h。
种子培养基组分为:酵母粉5g/L,蛋白胨10g/L,NaCl 10g/L,其余为水,pH 6.0~8.0。
发酵初始培养基组分为:碳源(菊粉)30g/L,氮源10g/L,K
通过考察发酵温度、pH、种子液接种量和接种种龄、发酵培养基碳源浓度、氮源种类和浓度、不同金属离子的无机盐对HA产量的影响,优化发酵生产透明质酸的发酵工艺。
1、温度对HA产量的影响
选择28℃、30℃、32℃、37℃作为不同的发酵温度进行摇瓶发酵,在pH7.0和200rpm条件下发酵48h后测量不同温度下HA产物积累量。发酵温度对菌体生物量和HA合成有显著影响。如图6A所示,重组菌株的HA产量随着培养温度的升高而同步增加,从28℃升高到32℃时,HA产量显著增加,在32℃发酵条件下,HA的最高产量为3.2g/L±0.05g/L,因此,选择32℃作为重组菌株发酵制备HA的发酵温度。
2、pH对HA产量的影响
接种前调整发酵培养基的pH值分别为5.0、6.0、6.5、7.0、7.5、8.0。培养基组成同上,发酵温度为32℃,转速为200rpm。考察了不同pH值对该菌株HA合成的影响。在最佳温度下,考察了不同培养基初始pH对HA合成的影响,如图6 B所示。在pH 7.0的条件下,菌体生长良好,目标产物产率最高,达到3.37±0.02g/L,而明显在碱性环境严重抑制了HA的合成,由此可见发酵pH是影响细胞生长和产物合成的重要因素之一。
3、接种量和接种种龄对HA产量的影响
在培养基组成不变的情况下,在pH 7.0、32℃、200rpm的条件下,选择不同生长时期的种子液分别以接种量为1、2、4、6、8、10%的种子液接种至发酵培养基中,考察不同接种量对HA合成的影响。从图6C可以看出,当接种量高于4%时,细胞生长繁殖迅速,导致发酵初期抑制性副产物过量产生,影响正常发酵而不利于HA产物的积累。当接种量为4%时,细胞生长良好,透明质酸产量最高。另一方面,种子培养期应选取种子生长的对数期为宜,种子过嫩或过老,不但会延长发酵周期还会降低产量。图6 D数据表明,种子液培养的不同时长对HA后续发酵生产有显著影响。种子液培养10h时,接种至发酵培养基能最大程度的促进HA的合成。
4、碳源浓度对HA产量的影响
分别选取不同碳源浓度(g/L):20、30、40、50、60,其他培养基成分浓度和培养条件同上在32℃,200rpm条件下发酵48h,发酵48h后比较不同碳源浓度对HA产量的影响。如图6E所示,不同浓度的碳源对透明质酸的产量有显著差异。当碳源浓度为40g/L时,HA的合成量最大,达到4.12±0.04g/L。因此,菊粉的选择浓度为40g/L对微生物的生长和目标产物的积累有重要影响。
5、氮源种类和浓度对HA产量的影响
分别选取酵母粉、蛋白胨、豆粕粉、牛肉膏、鱼粉蛋白胨、硫酸铵、尿素作为发酵培养基的氮源,浓度为10g/L,其余培养基浓度与发酵初始培养基相同。在32℃,200rpm条件下发酵48h,测定不同氮源对HA产量的影响。如图6F,与其他氮源相比,酵母粉和蛋白胨在生产HA方面具有显著优势。重组菌株对有机氮源有很高的选择性,在以酵母粉为氮源时,HA合成产率较高,细胞生长良好。选定氮源后,分别选取不同氮源浓度(g/L):5、10、15、20,其他培养基成分浓度和培养条件同上,发酵48h后比较不氮源浓度对HA产量的影响。如图6G,基于不同浓度的酵母粉发酵生产HA,结果表明酵母粉浓度在10~15g/L为宜,此时HA积累量最高为4.4g/L,后续优化以10g/L酵母粉为基础进行。
6、不同金属离子的无机盐对HA产量的影响
将发酵初始培养基中的MgSO
(3)最后以7.5L发酵罐进行分批发酵,考察重组菌株用于工业化生产HA的潜力。根据步骤(1)和步骤(2)中实验结果,种子液培养10h后,以4%的接种量接种至装液量为3L的7.5L发酵罐,进行分批发酵,初始转速设置为400r/min,通气量为2vvm。接种的同时加入硫酸卡那霉素和碳源菊粉,使硫酸卡那霉素浓度为25mg/L,菊粉终浓度为45g/L。发酵过程中通过溶氧和pH电极对发酵液中溶氧和pH情况进行实时检测,其中氨水用于发酵过程中pH的控制。发酵过程中溶氧的控制主要通过通气量和转速的协调改变实现,将溶氧控制在30%左右。发酵过程中每隔6h取样并对发酵液中的碳源含量、OD及HA产量进行检测。实验结果如图7所示,HA在发酵液中的含量最终稳定在48h的5.59±0.07g/L。
(4)为检测该基因工程菌合成的透明质酸分子量水平,取步骤(2)中发酵液过滤后,用于凝胶渗透色谱(GPC)测定。
发酵液中透明质酸检测方法:发酵液经适当稀释后,离心除去菌体,用0.22μm滤膜过滤发酵液上清,并收集滤液用于凝胶渗透色谱(GPC)测定HA产量。色谱柱为Shodex OhpakSB-806M HQ,流动相为0.1M Na
色谱柱为Shodex Ohpak SB-806M HQ,流动相为0.1M Na
本发明提供了一种生产透明质酸的基因工程菌及其应用的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
