猪轮状病毒重组腺病毒及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于动物疫苗技术领域,具体涉及一种猪轮状病毒重组腺病毒及其应用。
背景技术
猪轮状病毒(PoRV)又称猪轮状病毒性腹泻病,是一种人兽共患病,其感染动物范围广泛,包括各类哺乳动物与禽类。该病是以消化道机能紊乱的一种急性肠道传染性疾病,此病主要危害哺乳仔猪及断奶仔猪,临床上主要以腹泻、脱水、呕吐为主要特征,剖检病变主要集中在消化道,胃肠消化道内含有未消化乳汁或凝乳块。临床上将该病毒分成10个毒株群,其中分布最广泛的是A群,多种动物和人都能够感染,包括猪也易感。另外,猪也可感染B群、C群以及E群。目前在我国生猪养殖群体当中,猪轮状病毒病还没有呈现大规模流行的态势,常常呈地方流行或散发流行。猪轮状病毒一年四季均可发生,但秋天温差大,冬天天气较冷时更容易诱发该病的发生。
目前该病在猪群中感染率较高,直接或间接的影响猪群的生产力,制约了我国养猪业的健康发展,造成巨大的经济损失。至今尚缺乏治疗轮状病毒感染的特效药物,疫苗仍然是预防和控制轮状病毒感染,减少重症死亡病例的最有效途径。国内外普遍使用的常规疫苗主要是强毒灭活苗和弱毒活疫苗。由于选用的毒株不同,加之不同地区自然条件及母乳中可能存在的抗体等因素使活疫苗的有效性受到一定程度影响。因此,现在的疫苗在控制本病的发生与流行中并不十分理想。
综上,一种预防和/或治疗猪轮状病毒的疫苗及其制备是必要的。。
发明内容
针对以上问题,本发明目的之一在于提供一种猪轮状病毒重组腺病毒,该猪轮状病毒重组腺病毒可以刺激机体在体内产生大量的抗体。
为了达到上述目的,可以采用以下技术方案:
本发明一方面提供了一种猪轮状病毒重组腺病毒,包括如Sequence NO:1或Sequence NO:2所示的序列。具体地,Sequence NO:1所示的序列是中国流行株G9P的VP4基因序列片段,Sequence NO:2所示的序列是中国流行株G3P I5的VP7基因序列片段。
进一步地,猪轮状病毒重组腺病毒还可以包括腺病毒载体。具体地,腺病毒载体目前是作为疫苗和作为抗原呈递载体的热点,具有转染效率较高、广泛的亲和性、可同时诱导特异性体液免疫和细胞免疫反应、较为安全、易于制备、被广泛应用于各种预防性或治疗性疫苗的优点。
进一步地,腺病毒载体可以为pAdTrack-CMV。
本发明另一方面提供了一种组合物,其包括上述的猪轮状病毒重组腺病毒和佐剂。
进一步地,佐剂可以选择弗氏佐剂。应当理解的是,除了弗氏佐剂外,还可以是本领域技术人员所已知的其他疫苗佐剂。
本发明再一方面提供了一种上述的猪轮状病毒重组腺病毒在制备猪轮状病毒疫苗中的应用。
本发明再一方面提供了一种Sequence NO:1或Sequence NO:2所示的序列在制备猪轮状病毒重组腺病毒疫苗中的应用。具体地,猪轮状病毒重组腺病毒疫苗可以是预防性疫苗,也可以治疗性疫苗。
本发明再一方面提供了上述的猪轮状病毒重组腺病毒的制备方法,该方法包括:将Sequence NO:1使用用限制性内切酶BglII和XhoI进行酶切,纯化的酶切产物用连接酶进行连接得到猪轮状病毒重组腺病毒;或将Sequence NO:1使用用限制性内切酶EcoRI和HindIII进行酶切,纯化的酶切产物用连接酶进行连接得到猪轮状病毒重组腺病毒。
具体地,对构建的阳性重组腺病毒穿梭载体pAdTrack-CMV-VP4用BglII和XhoI酶进行酶切,得到得到大约在9240bp和2343bp的条带;构建成功的阳性重组腺病毒穿梭载体pAdTrack-CMV-VP7,由于载体较大,目的基因较小,EcoRI和HindIII包含目的基因和腺病毒载体,故用EcoRI和HindIII进行酶切鉴定,得到大约在3887bp的条带和6318bp的条带,与预期大小一致。
进一步地,上述猪轮状病毒重组腺病毒的制备方法中,连接酶可以选择本领域已知的连接酶,比如T4DNA。
本发明有益效果至少包括:本发明提供的猪轮状病毒重组腺病毒可以刺激机体在体内产生大量的抗体;从第21天开始,猪轮状病毒重组腺病毒在机体产生的抗体水平显著高于商品化三联疫苗。
附图说明
图1为阳性重组腺病毒穿梭载体pAdTrack-CMV-VP4PCR结果;
图2为阳性重组腺病毒穿梭载体pAdTrack-CMV-VP7PCR结果;
图3为阳性重组腺病毒穿梭载体pAdTrack-CMV-VP4酶切鉴定;
图4为阳性重组腺病毒穿梭载体pAdTrack-CMV-VP7酶切鉴定;
图5为重组质粒pAdTrack-CMV-VP4PacI酶切鉴定;
图6为重组质粒pAdTrack-CMV-VP7PACI酶切结果;
图7为重组质粒pAdTrack-CMV-VP4转入DH5α感受态细胞PCR产物;
图8为重组质粒pAdTrack-CMV-VP7转入DH5α感受态细胞PCR产物;
图9为重组腺病毒转染293A的细胞病变及荧光的表达情况;
图10为蛋白酶K处理的PCR产物;
图11为蛋白酶K处理的PCR产物;
图12为第3、5、7代Ad-VP4PCR检测;
图13为第7代Ad-VP7PCR检测;
图14为westernblotting鉴定;
图15为D、E、F和G组抗体水平变化;
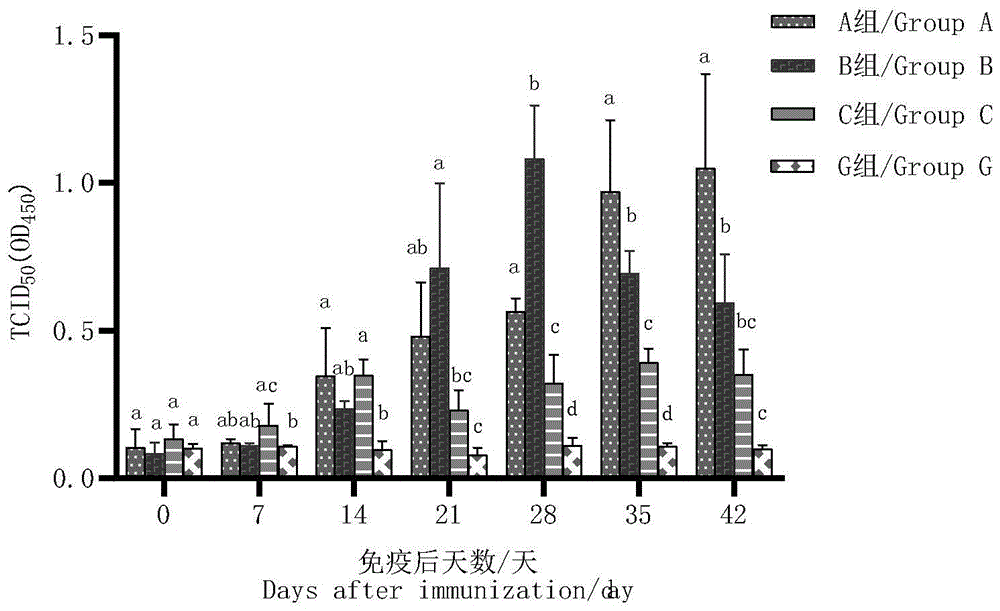
图16为A、B、C和G组抗体水平变化;
图17为A、E和G组抗体水平变化;
图18为E、F和G组抗体水平变化。
其中,图1中,M:DL5000DNAMarker,1:pAdTrack-CMV-VP4PCR产物,2:阴性对照;图2中,M:DL5000DNAMarker1:pAdTrack-CMV-VP7PCR产物,2:阴性对照;图3中,M:1kbDNALadder1:pAdTrack-CMV-VP4酶切产物;图4中,M:1kbDNALadder,1:pAdTrack-CMV-VP7酶切产物;图5中,M:SuperMarker,1:pAdTrack-CMV-VP4酶切产物,2:阴性对照;图6中,M:SuperMarker,1:pAdTrack-CMV-VP7酶切产物,2:阴性对照;图7中,M:DL5000DNAMarker,1-6:pAdTrack-CMV-VP47:阴性对照;图8中,M:DL5000DNAMarker,1:pAdTrack-CMV-DH5α-VP7,2:阴性结果;图9中,A:Ad-VP4第四代的细胞病变,B:Ad-VP4第四代的细胞荧光的表达情况,C:Ad-VP7第六代的细胞病变,D:Ad-VP7第六代的细胞荧光的表达情况,E:正常293A细胞形态,F:正常293A细胞荧光观察;图10中,M:DL5000DNAMarker,1-2:第5代rAd-VP4,3:阴性对照;图11中,M:DL5000DNAMarker,1-2:第5代rAd-VP7,3:阴性对照;图12中,M:DL5000DNAMarker,1:第3代Ad-VP4,3:第5代Ad-VP4,5:第5代AD-VP4,2,4,6:阴性对照;图13中,M:DL5000DNAMarker,1:Ad-VP7,2:阴性对照;图14中,M:proteinladder,1和3:293A细胞空白对照2:Ad-VP4和PoRV阳性血清反应4:Ad-VP7和PoRV阳性血清反应;图15中,*表示与G组数据比较差异显著性,不标注表示差异不显著(P>0.05),*表示差异显著(0.01<P<0.05),**表示差异极显著(P<0.01),#表示与D组数据比较差异显著性,不标注表示差异不显著,#表示差异显著(0.01<P<0.05),##表示差异极显著(P<0.01);图16中,数据肩标不同字母的表示差异显著(P<0.05),肩标相同字母标注表示差异不显著(P>0.05);图17中,数据肩标不同字母的表示差异显著(P<0.05),肩标相同字母标注表示差异不显著(P>0.05);图18中,数据肩标不同字母的表示差异显著(P<0.05),肩标相同字母标注表示差异不显著(P>0.05)。
具体实施方式
所举实施例是为了更好地对本发明进行说明,但并不是本发明的内容仅局限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
本文中使用的术语仅用于描述特定实施例,并且无意于限制本公开。除非在上下文中具有明显不同的含义,否则单数形式的表达包括复数形式的表达。如本文所使用的,应当理解,诸如“包括”、“具有”、“包含”之类的术语旨在指示特征、数字、操作、组件、零件、元件、材料或组合的存在。在说明书中公开了本发明的术语,并且不旨在排除可能存在或可以添加一个或多个其他特征、数字、操作、组件、部件、元件、材料或其组合的可能性。如在此使用的,根据情况,“/”可以被解释为“和”或“或”。
为了更好地理解本发明,下面结合具体示例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的示例。
以下实施例中,使用的菌株、载体的情况如下表1所示。
表1实施例中使用菌株、载体情况
以下实施例中,主要使用的试剂情况如下表2所示。
表2实施例中使用主要试剂情况
以下实施例中,使用的主要仪器情况如下表3所示。
表3实施例中使用的主要仪器情况
以下实施例中,PoRV中国流行株G3P I5(GenBank:MH320797.1)的VP7基因序列的特异性引物,如小表4所示。
表4 PoRV-VP7引物设计
以下实施例中,PoRV中国流行株基G9P(GenBank:MH898990.1)的VP4基因序列的特异性引物,如下表5所示。
表5 PoRV-VP4引物设计
以下实施例中,使用的引物由上海生工生物工程股份有限公司合成。
以下实施例中,PoRV VP7基因与pAdTrack-CMV载体的连接PCR反应条件如下表6所示。
表6 PCR反应条件
以下实施例中,PoRV VP4基因与pAdTrack-CMV载体的连接PCR反应条件如下表7所示。
表7 PCR反应条件
以下实施例中,质粒小提按照以下步骤进行:
(1)柱平衡步骤:向吸附柱CP3中(吸附柱放入收集管中)加入500μl的平衡液BL,12,000rpm(-13,400×g)离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中;
(2)取1-5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm(-13,400×g)离心1min,尽量吸除上清(菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中);
(3)向留有菌体沉淀的离心管中加入250μl溶液P1(请先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀;
(4)向离心管中加入250μl溶液P2,温和地上下翻转6-8次使菌体充分裂解;(注意:温和地混合,不要剧烈震荡,以免打断基因组DNA,造成提取的质粒中混有基因组DNA片断。此时菌液应变得清亮粘稠,所用时间不应超过5min,以免质粒受到破坏。如果未变得清亮,可能由于菌体过多,裂解不彻底,应减少菌体量。)
(5)向离心管中加入350μl溶液P3,立即温和地上下翻转6-8次,充分混匀,此时将出现白色絮状沉淀;12,000rpm(-13,400×g)离心10min;(注意:P3加入后应立即混合,避免产生局部沉淀。如果上清中还有微小白色沉淀,可再次离心后取上清。)
(6)将上一步收集的上清液用移液器转移到吸附柱CP3中(吸附柱放入收集管中,尽量不要吸出沉淀);12,000rpm(-13,400×g)离心30-60sec,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(7)向吸附柱CP3中加入600μl漂洗液PW(先检查是否已加入无水乙醇),12,000rpm(-13,400×g)离心30-60sec,倒掉收集管中的度液,将吸附桂CP3放入收集管中;
(8)向吸附柱CP3中加入600μl漂洗液PW,12,000rpm离心30-60sec,倒掉收集管中的废液体,将吸附柱CP3放入收集管中;
(9)重复操作步骤(8);
(10)将吸附柱CP3放入收集管中,12,000rpm(-13,400×g)离心2min,目的是将吸附柱中残余的漂洗液去除。注意:漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。为确保下游实验不受残留乙醇的影响,建议将吸附柱CP3开盖,置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;
(11)将吸附柱CP3置于一个干净的离心管中,向吸附膜的中问部位滴加50-100μl洗脱缓冲液EB,室温放置2min,12,000rpm(-13,400×g)离心2min将质粒溶液收集到离心管中。
以下实施例中,PmeI酶切反应体系如下表8所示。
表8 PmeI酶切反应体系
以下实施例中,BJ5183感受态细胞的制备按照如下步骤进行:
(1)取甘油管保存的BJ5183菌液20μl接种至20mlLB氨苄抗性液体培养基,37℃200rpm摇床震荡培养过夜;
(2)取2ml过夜菌体接种至200mlLB液体培养基中1:100活化,继续振荡培养至OD值约为0.4-0.6左右;
(3)取出培养物,放冰上冰浴3-5min;
(4)取LB菌液40ml置于50ml离心管中,8000rpm,4℃离心5min,收集菌体,取出后置于冰上;
(5)弃去上清,重复步骤(4);
(6)弃去上清,菌体用20ml冰盒预冷的CaCl2溶液重悬细菌,加入CaCl2至40ml,8000rpm,4℃离心5min,收集菌体;
(7)重复步骤(6)
(8)加入5-8mld10%CaCl2-甘油,重悬菌体,置于冰上分装于1.5mlEP管中,每分装100μl感受态细胞,置于-80℃保存备用。
以下实施例中,BJ5183感受态细胞的转化按照如下步骤进行:
(1)加入10μl连接产物于100μlBJ5183感受态细胞中,混匀,冰浴30min;
(2)42℃水浴热击90s,冰上放置3-5min;
(3)加人800-1000μl无抗性的LB液体培养基,37℃,180rpm摇床培养60min;
(4)8000rpm,离心2min,弃去上清,剩80-100μl菌液;
(5)将其加入到含卡那抗性平板,涂匀,37℃倒置培养箱过夜。
以下实施例中,重组质粒的小量提取按照如下步骤进行:
(1)挑菌:从转化平血中挑取较小的单菌落,利用记号笔进行做标记1、2、3;将20uL的卡那加人总的20mL的LB培养基中,准各相应的菌落的1.5mLEP管800uL的氨茶抗性的LB液体;用镊子夫枪头去挑菌落,把带有苗落的枪头一起放入EP菅中;加一个EP菅做对照,每个EP管800uL培养液,把无茵枪头放入其中,EP管封膜,放到37℃、200rpm摇床培养3-4h;
(2)质粒小提:按照上述质粒小提的方法进行。
以下实施例中,重组质粒PacI酶切反应体系如下表9所示。
表9 PacI酶切反应体系
以下实施例中,大肠杆菌DH5α感受态细胞的制备按照以下步骤进行:
(1)取甘油管保存的DH5α菌液20μl接种至20mlLB无抗性液体培养基,37℃200rpm摇床震荡培养过夜;
(2)取2ml过夜菌体接种至200mlLB液体培养基中1:100活化,继续振荡培养至OD值约为0.4-0.6左右;
(3)取出培养物,放冰上冰浴3-5min;
(4)取LB菌液40ml置于50ml离心管中,8000rpm,4℃离心5min,收集菌体,取出后置于冰上;
(5)弃去上清,重复步骤(4);
(6)弃去上清,菌体用20ml冰盒预冷的CaCl2溶液重悬细菌,加入CaCl2至40ml,8000rpm,4℃离心5min,收集菌体;
(7)重复步骤(6);
(8)加入5-8mld10%CaCl2-甘油,重悬菌体,置于冰上分装于1.5mlEP管中,每分装100μl感受态细胞,置于-80℃保存备用。
以下实施例中,大肠杆菌DH5α感受态细胞的转化按照以下步骤进行:
(1)加入10μl连接产物于100μlDH5α感受态细胞中,混匀,冰浴30min;
(2)42℃水浴热击90s,冰上放置3-5min;
(3)加人800-1000μl无抗性的LB液体培养基,37℃,180rpm摇床培养60min;
(4)8000rpm,离心2min,弃去上清,剩80-100μl菌液;
(5)将其加入到含卡那抗性平板,涂匀,37℃倒置培养箱过夜。
以下实施例中,重组质粒大量提取按照以下步骤进行:
(1)取过夜培养的菌液40ml加入50ml离心管中,8,000rpm(-8,228×g)离心3min收集细菌,弃去上清,重复次过次3-4次,最终留下菌体沉淀;(注意:切勿收集过多菌液,可能会导致菌液过多使得裂解不充分,而降低质粒的浓度)
(2)用移液器或者是吸水纸将离心管管壁上残留的菌液稀释干净,减少对实验的误差;
(3)取8mlP1溶液(已加入RNaseA)加入到含菌体沉淀的50ml离心管中,先使用移液器将其混匀,在使用震荡仪短暂震荡,使菌体沉淀彻底悬浮;
(4)离心管中加入8ml的P2,立即温柔的上下颠倒6-8次,使其充分裂解,放置超净台中5min;
(5)再像离心管中加入8ml的P4溶液,马上温和的上下翻转6-8次,此时会出现白色絮状沉淀,放置于超净台10min;随后8,000rpm(-8,228×g)离心5-10min,如果白色沉淀未完全沉入底部,则可以增加离心的时间,将上清全部导入过滤器CS1中,底部的上清可拿移液器进行吸取,避免将白色沉淀吸入,导致过滤器堵塞;准备一个新的50ml离心管,缓慢推动过滤器,将液体全部收集到新的离心管中;P 4加入后应马上翻转,否则可能导致出现白色沉淀;如果过滤器CS1中的液体纯在少量絮状白色沉淀对过滤器CS1的影响不大;
(6)再向过滤器中加入是溶液体积0.3倍(大约为8ml右)的异丙醇(因CP6虽然最大能加15ml的溶液,但是再离心过程中离心机中转角倾斜可能导致液体露出,所以可分为两次过柱子每次不超过10ml),上下翻转混匀,如果异丙醇加入的过多可能对RNA造成污染,如不翻转混合菌液会导致在冷冻过程中出现结冰现象再;将50ml离心管放入-20℃2h,或者是-80℃冰箱30min;取出后溶液一般不会结冰,放室温数分钟后倒入至于50ml收集管中上的吸附柱CP6中;
(7)8000rpm(-8,228×g)离心2min,将收集管中的废液弃去,吸附柱再放回50ml收集管中;(由于第六步实验是分为2次过柱子,所以每次实验都按以上条件操作)
(8)加入10ml的洗涤液PW(已加无水乙醇)进吸附柱CP6中,8,000rpm(-8,228×g)离心2min,倒掉收集管中的废液,将吸附柱CP6置于收集管中;
(9)重复步骤8一次;
(10)向吸附柱中间部分加入3ml的无水乙醇,8000rpm(-8,228×g)离心2min,将收集管中的废液弃去;
(11)将空管吸附柱CP6置于空管收集管中,8,000rpm(-8,228×g)离心5min,使吸附柱中剩余的PW全部除去,避免产生实验误差;
(12)提前准备一个干净的15ml离心管,将吸附柱置于其中,再吸附柱中间部位的白膜上垂直悬空滴加2ml的洗脱液,注意不要将枪头碰到白膜。室温静置5min后8,000rpm(-8,228×g)离心2min。此时提取的质粒已全部集中于收集管中,准备一个新的2ml的EP管,将提取的质粒全部转移进2mlEP管中,使用微量蛋白核酸检测仪对提起的质粒测定浓度,放入-20℃进行保存。
以下实施例中,TRIzol裂解法提取RNA按照以下步骤进行:取300μl病毒上清于2ml离心管中,加入700μlTRIzol,用移液器吹吸均匀,静置5min;加入200以L氯仿,立即旋涡震荡,冰浴5min;4℃,10000rpm/min,离心10min;吸取600,μl上清加入等体积的昇丙醇,上下颠倒混匀,将其置于-20℃冰箱中静置30min;4℃,10000rpm/min,离心10min;弃去上清,加入1ml无水乙醇,上下颠倒混匀;4℃,7500rpm/min,离心5min;弃去上清,静置5min;加入10-20μlDEPC水洗脱,放置-80℃冰箱备用。
以下实施例中,RNA反转录反应体系如下表10所示。
表10反转录反应体系
以下实施例中,反转录按照以下步骤在上述RNA反转录反应体系中进行:
(1)涡旋震荡混匀,短暂离心,使管壁上的溶液收集到管底;
(2)cDNA合成反应条件:42℃孵育30-50分钟,85℃孵育5分钟;
(3)反应结束后,短暂离心,置于冰上冷却;
(4)反转录产物可直接用于PCR反应和荧光定量PCR反应,或置于-20℃长期保存。
以下实施例中,westernblotting鉴定按照以下步骤进行:
(1)样品的处理:将20μl的蛋白上样缓冲液加入到80μl重组腺病毒上清中,金属浴100℃煮沸5min,取出放室温冷却5min;
(2)聚丙烯酰胺凝胶的配置:清洗烘干板后,将斜插玻璃板向内,平玻璃板向外,两边放置胶室密封条胶条,置于胶架上,检查胶垫与脚架底部是否密封好,组装完成可加入蒸馏水,检测是否密封;按照表10制备12%的分离胶,制备完成后,用移液器将其从玻璃板的边缘缓慢注入,注入到插入梳子还剩1-2cm左右的高度即可,加入1-2ml的异丙醇(异丙醇将分离胶的页面压平)等到30-40分钟,分离胶凝固后,倒掉异丙醇,用滤纸吸出残留的异丙醇,按照表11制备5%浓缩胶,用移液器缓慢滑动的将浓缩胶转入玻璃板中,直到注满溢出为止,立刻插入1.5mm的梳子,等待其凝固,凝固后拔出梳子,制胶完成;
(3)电泳:将板胶放于电泳槽内,加入盖过板胶一半的电泳液,进行上样样,蛋白marker加入10μl,阳性样品加入20μl,阴性对照为正常细胞,经过三融三冻后过滤得到,同样点20μl;上样完成后,盖上电泳盖,正极与电泳仪正极相连,负极与电泳仪负极相连,80V恒压,待漠酚蓝从浓缩胶至分离胶的分界线时,可将电压改为120恒压,待所需目的条带电泳分开后,切断电源,电泳结束;
(4)转膜:电泳结束后立即开始转膜,拆下胶板,拿记号笔画出目的蛋白的位置,切下所需的胶条,NC膜大于胶条0.5cm的大小进行裁剪,裁剪6片大于胶体1cm的滤纸,将胶体、滤纸、转膜仪、海绵放置于转膜液中5min,将NC膜置于异丙醇中5min,目的是活化NC膜;负极向下时,以海绵-滤纸-胶条-NC膜-滤纸-海绵的顺序对其进行放置,在放置每一层时,每一层不能有气泡,否则会影响转膜结果;浸入转膜液中,300mA恒流,转膜时间根据蛋白大小决定;
(5)免疫印迹实验:转膜完成后,将NC膜放置于5%的脱脂奶粉-TBST中4℃过夜封闭或在50rpm摇床上缓慢震荡孵育2-4小时,用抗体稀释液配置PoRV阳性血清1;500的一抗和HRP标记羊抗猪IGg抗体1;2000的二抗,将NC膜从奶粉中取出,用1×TBST在摇床上200rpm左右震荡10min,清洗三次,将NC膜放入一抗中孵育4-6h或放入4℃过夜孵育,再用1×TBST在摇床上200rpm左右震荡冲洗,清洗三次后放入二抗内,摇床孵育2h,孵育结束后用1×TBST清洗三次;
(6)化学显影:取ECL显色液按照1:1的比例将A液与B液进行混合,滴加在NC膜上,在成像仪中进行发光显色。
上述westernblotting鉴定步骤中,使用的12%分离胶制备体系和5%浓缩胶制备体系分别如下表11和表12所示。
表11 12%分离胶制备体系
表12 5%浓缩胶制备体系
以下实施中,重组质粒转染293A细胞按照以下步骤进行:
(1)转染的前一天,取出培养箱中生长形态良好密集的293A细胞培养板,用2ml的PBS清洗细胞,弃去PBS,重复2-3次,移液器贴壁加入2ml胰酶,消化15-20s,弃去胰酶,加入2ml的DMEM(含10%的牛血清)将细胞从培养板壁中吹打,使细胞脱落,移液器将脱落再DMEM培养液的细胞移置新的15ml离心管中,1000rpm离心5min,使细胞再离心管底部,倒掉废液,用移液器将残留的废液弃去,加入2ml新的DMEM培养液(含10%牛血清),吹到使细胞重悬,取1ml正常传代,另1ml再六孔板中进行传代;取1ml含有细胞的DMEM移置新的15ml离心管中,再离心管中加入2mlDMEM(含10%牛血清),用移液器吹打均匀,将六孔板中先加入2ml的DMEM(10%),每孔再分别加入500μl吹打均匀含细胞的培养液,“8”字形摇匀,放入37℃恒温箱过夜培养;
(2)转染当天,从-20℃取出大量提取的两个重组质粒,分别进行PACI酶切,酶切体系都为50μl质粒加入的体系根据质粒浓度确定,质粒取30μl,PACI取2.5μl,buffer取5μl,水补齐剩余体系12.5μl,进行混匀后防入37℃恒温箱酶切4h;
(3)酶切结束前半个小时,配置含2%的胎牛血清的DMEM培养液,将前天铺的六孔板取出,观察细胞的形态及密度,待细胞生长到70-80%时,即可用于转染实验;六孔板中2个孔作为阴性对照孔,2个孔作为VP4阳性孔,2个孔作为VP7阳性孔,用马克笔做好标记及备注转染日期;除了2个阴性对照孔不做处理外,六孔板中的剩余4个孔中液体全部弃除,每个孔用1ml的PBS进行清洗,弃去PBS,每孔贴壁缓慢加入1ml无胎牛血清的DMEM,放入培37℃养箱中培养;酶切结束后,将酶切产物放入超净台,取4个干净的2mlEP管,其中1个EP管中加入500μl的不含牛血清的DMEM培养液和50μl的VP4酶切产物,1个EP管中加入500μl的不含牛血清的DMEM培养液和50μl的VP7酶切产物,另外两个管分别加入500μl的不含牛血清的DMEM和12μl的脂质体,4个EP管室温静置5min,随后将含有VP4的DMEM培养液的EP管全部加入到含有脂质体的DMEM培养液的EP管中,将含有VP7的DMEM培养液的EP管与含有脂质体的DMEM培养液的EP管进行混合,均混合均匀后,室温静置25min;取出培养箱中的六孔板,再VP4阳性孔中加入混合的Lipofectamine-VP 4,每孔加入500μl,再VP7的阳性孔中每孔分别加入500μl混合的Lipofectamine-VP 7,阴性孔不进行操作,将六孔板放入培养箱6h;6h后取出六孔板,将4个阳性孔中原来的培养液弃除,每孔加入2ml含有2%的DMEM培养液,如果有大量的细胞漂浮再表面,则不弃除原来的培养液,每孔直接加入2ml含牛血清的DMEM培养液;
(4)在培养的过程中每天观察细胞形态,如果培养液变黄可适当加入一定量的含2%牛血清的DMEM,但并不弃去原来的培养液;
(5)六孔板中80%细胞已脱落时,用移液器吹打少量剩余未脱落的细胞,此时细胞很容易就能被吹打下来,将所以的培养液移置15ml离心管中,在37℃水浴锅和-80℃冰箱(液氮罐)中反复冻融三次,使病毒在培养液中充分裂解,在超净台中用15ml注射器吸取冻融后的培养液,将0.22滤膜置于新的15ml离心管中,将注射器中的培养液经0.22滤膜过滤1-2次,分装于1.5mlEP管中,做到标记,该病毒液为重组腺病毒一代,包装成功的重组腺病毒,分别命名为Ad-VP4、Ad-VP7。
以下实施例中,抗体水平检测使用ELISA检测,具体如下:
(1)通过制作方阵测定PoRVVP4和PoRVVP7抗原蛋白最佳包被浓度、一抗和二抗最佳稀释浓度;
(2)用包被液稀释抗原蛋白至4μl/ml,重复涡旋震荡取100μl加入到酶标板中,放入37℃培养箱中过夜包被14-16h,用1×PBST洗板3-5次,拍干;酶标板中加入用5%的脱脂奶粉100μl,37℃培养箱中封闭1.5h-2h;封闭完成后用×PBST洗板3-5次,取出提前用1×PBST稀释为1:500小鼠血清作为一抗,每孔加入100μL,37℃培养箱孵育1h,再用1×PBST洗板3-5次,拍干后加入100μL用1×PBST稀释至1:10000的羊抗鼠IgG二抗,37℃培养箱孵育1h,用1×PBST洗板3-5次后,加入100μl的显色液于酶标板中,37℃培养箱避光显色15min,显色完成后每孔立即加入50μl的终止液,15min内测定OD值。
实施例1重组腺病毒Ad-VP4和Ad-VP7制备。
(1)目的基因的获得和引物设计
在NCBI上确定PoRV中国流行株G3P I5(GenBank:MH320797.1)的VP7基因序列和中国流行株G9PGenBank:MH898990.1)的VP4基因序列,利用软件进行抗原表位分析,在PoRVVP4该序列的上、下游分别加上BglII和XhoI酶切位点,在PoRV-VP7该序列的上、下游分别加上EcoRI和HindIII酶切位点,上述过程由通用生物系统(安徽)有限公司进行基因合成。根据PoRV中国流行株G3P I5(GenBank:MH320797.1)的VP7基因序列设计一对特异性引物(如上表4所示),根据PoRV中国流行株基G9P(GenBank:MH898990.1)的VP4基因序列设计一对特异性引物(如上表5所示)。
(2)目的基因与pAdTrack-CMV载体的连接反应及鉴定
将PoRVVP4基因与穿梭载体pAdTrack-CMV同时用限制性内切酶BglII和XhoI进行酶切,纯化的酶切产物用T4DNA连接酶进行连接,酶切结果经PCR鉴定及测序结果正确,命名为pAdTrack-CMV-VP4;
将PoRVVP7基因与穿梭载体pAdTrack-CMV同时用限制性内切酶EcoRI和HindIII进行酶切,纯化的酶切产物用T4DNA连接酶进行连接,酶切结果经PCR鉴定及测序结果正确,命名为AdTrack-CMV-VP7;
PCR鉴定结果如图1和图2所示,经PCR鉴定,pAdTrack-CMV-VP4PCR目的条带大约在2342bp(图1),pAdTrack-CMV-VP7PCR目的条带大约在993bp(图2),均与预期大小完全一致,测序结果均正确。
需要说明的是,对构建的阳性重组腺病毒穿梭载体pAdTrack-CMV-VP4用BglII和XhoI酶进行酶切,得到得到大约在9240bp和2343bp的条带,与预期大小一致(图3);构建成功的阳性重组腺病毒穿梭载体pAdTrack-CMV-VP7,由于载体较大,目的基因较小,EcoRI和HindIII包含目的基因和腺病毒载体,故用EcoRI和HindIII进行酶切鉴定,得到大约在3887bp的条带和6318bp的条带,与预期大小一致(图4),证明阳性重组腺病毒穿梭载体均构建成功。
(3)质粒小提
将重组质粒pAdTrack-CMV-VP4和pAdTrack-CMV-VP7溶液进行质粒小提收集到离心管中。
(4)PmeI线性化和纯化
在PmeI酶切反应体系中,将重组质粒pAdTrack-CMV-VP4和pAdTrack-CMV-VP7放入37℃培养箱中酶切4h进行PmeI线性化和纯化。
(5)BJ5183感受态细胞的制备及转化
按照上述BJ5183感受态细胞的制备及转化的方法,将PmeI线性化后的重组质粒pAdTrack-CMV-VP4和pAdTrack-CMV-VP7转入BJ5283(含pAdEasy-l)感受态细胞中。
(6)重组质粒的小量提取
对转化后的重组质粒进行小量提取。
(7)重组质粒PacI酶切及鉴定
将重组质粒在PacI酶切反应体系中,放入37℃培养箱中酶切4h。酶切产物加入10×loadingBuffer,以该酶切产物为模板,进行PCR检测及测序。结果如图如图5和图6所示,鉴定获得的结果与预期的结果一致,且测序结果与基因序列无误;说明pAdTrack-CMV-VP4和pAdTrack-CMV-VP7穿梭腺病毒载体与含有腺病毒骨架pAdEasy-1的大肠杆菌BJ5183感受态细胞已重组成功。
(8)大肠杆菌DH5α感受态细胞的制备和转化
将含有腺病毒骨架的重组质粒pAdTrack-CMV-VP4和pAdTrack-CMV-VP7,转入DH5α感受态细胞中。
(9)重组质粒的大量提取及鉴定
从上述DH5α感受态细胞菌液中提取重组质粒,并已大量提取的质粒为模板,进行PCR鉴定及测序,经PCR鉴定,pAdTrack-CMV-VP4PCR产物大小约为2343bp(图7),pAdTrack-CMV-VP7PCR产物大小约为993bp(图8),目的蛋白均正确,将PCR产物送测序,测序结果与基因序列一致。
(10)重组质粒转染293A细胞
按照上述重组质粒转染293A细胞的方法将重组质粒转染进293A细胞,正常细胞作为阴性对照,10-14d出现细胞病变(CPE),细胞皱缩聚集,最终死亡脱落,荧光显微镜观察可见大量的绿色荧光,如图9所示,此时说明重组腺病毒包装成功,包装成功的重组腺病毒分别命名为Ad-VP4、Ad-VP7。
实施例2重组腺病毒的扩增及病毒滴度测定
将收获的pAd-VP4,pAd-VP7,病毒液接种己长成单层的293A细胞,待80%以上的细胞出现明显的细胞病变效应后收毒,反复冻融3次,-800C保存备用。同时连续传代至15-20代使病毒稳定后大量扩增;测定腺病毒的病毒滴度,按Reed-Muench法计算病毒滴度(50%tissuecultureinfectivedose,TCID50),计算得:Ad-VP4TCID
实施例3重组腺病毒鉴定
(1)蛋白酶KPCR鉴定
取5μl病毒上清加入10μL蛋白酶K,55℃孵育1h,再煮沸5min,离心后取1-2μl为模板,包装的重组腺病毒Ad-VP4和Ad-VP7经PCR检测,Ad-VP4的条带大小约为2343bp(图10),Ad-VP7的条带大小约为993bp(图11),PCR产物的目的条带与预期大小的一致,证明重组腺病毒的包装成功。
(2)RT-PCR鉴定
包装的重组腺病毒Ad-VP4和Ad-VP7经RT-PCR鉴定,电泳结果Ad-VP4的条带大小约为2343bp(图12),Ad-VP7的条带大小约为993bp(图13),均与目的条带大小相同,测序结果正确。
(3)westernblotting鉴定
包装的重组腺病毒Ad-VP4和Ad-VP7经westernblot检测疫反应原性,Ad-VP4泳道出现87ku大小的目的条带,Ad-VP7泳道出现37ku的条带,两者和目的蛋白的大小大致相同(图14),正常的293A细胞作为阴性对照,细胞泳道未出现条带。
实施例4小鼠免疫实验
(1)分组:取49只雌性BALB/c小鼠分为7组(如表13所示);
(2)乳化:-80℃中取出病毒上清放入室温使其溶解,将病毒上清与弗式佐剂按照1:1的比例进行配置(小鼠第一次免疫使用弗式完全佐剂,第二次和第三次免疫使用弗式不完全佐剂)。将待乳化的液体全部移置10ml离心管中,使用乳化仪前,需要用酒精擦拭泵头,在用蒸馏水清洗3次,准备冰盒,将10ml离心管放入冰盒中,因在乳化的过程中会产热。乳化的过程中30-40时暂停数秒,防止乳化仪温度过高,反复乳化后,待乳化完成的液体滴入水中,在水中未散开即可,不可乳化时间过长,乳化完成后用酒精棉球擦拭乳化仪,将乳化完成的重组腺病毒放入-4℃进行保存。
(3)腹腔免疫:将乳化后的重组腺病毒用1ml的注射器吸取,先将小鼠转晕放在饲养笼上,左手大拇指和食指从小鼠的尾巴开始向头部推到颈部耳朵处时,用大拇指和食指捏起小鼠,固定小鼠头部,不可力气过大导致窒息而死,将小鼠的腹部朝向自己,小拇指将尾巴压住,小鼠的头部向下,使腹腔中的器官倒向胸部,注射部位在小鼠后肢根部连线处左右侧1-1.5cm处,缓慢的45度角注射,注射完成轻转针头,缓慢的拔出。注射完成后酒精棉消毒针头,在进行另一只小鼠的注射。
(4)血液的采集及处理:在第0、7、14、21、28、35和42天采集小鼠血液。将待采血的小鼠将在50ml离心管中(50ml离心管使用前需将前后处理一个小口,以便于小鼠呼吸及方便尾巴采血),斜口轻剪小鼠尾巴,将流出的血液收集置1.5ml离心管中,顺着尾巴轻轻滑动按摩,以便于血液的流出,每只小鼠大约取300μl左右的血液,采集完成后用打火机轻烧尾部尖端,血液不在流出即可。将收集好的血液放入37℃恒温箱2-4h或4℃过夜,将血液3000rpm离心10min,收集血清于-20℃保存。
表13小鼠免疫及分组情况
(4)取每个时期的每组小鼠取3个血清,在每一个血清中在做3个平行重复,使用ELISA方法评价重组腺病毒产生抗体水平效果,结果如下:
(1)与商品化三联疫苗相比重组腺病毒产生抗体水平效果的评价
根据图15可知,D组在第7天可检测产生的抗体水平,直至第42天与G组相差异极显著(P<0.01);
E组从第7天开始产生抗体水平,随着天数的增加抗体水平也呈上升趋势;E组第7天与G组存在差异(0.01<P<0.05),从第14天开始与G组差异极显著(P<0.01),在第35天产生的抗体达到最高;E组从第21天开始产生的抗体水平较高于D组,但在35天之前与D组均无显著差异,第35-42天与D组差异极显著(P<0.01);
F组从第14天小鼠产生的抗体水平逐渐增加,在第21天开始直到42天,与G组差异极显著V(P<0.01),在第28天达到组内抗体水平的顶峰,在第35天开始下降,随后在42天保持稳定。
(2)重组腺病毒不同滴度产生抗体水平效果的评价
根据图16可得,在第7天时,C组最先产生抗体,与G组存在差异,在第14天A、B、C组均与G组差异显著(P<0.05),在21天时B组产生的抗体水平最高,B组与C组、D组存在差异(P<0.05),在第28天B组产生的抗体水平达到全组最高,28-35天各组之间均差异显著(P<0.05);
B组从14天开始随着时间的增加产生的抗体也在增高,二免疫后的第一周(28天)达到小鼠产生抗体水平的最高峰,在28天之后抗体水平开始下降;A组随着免疫次数的增加,抗产生的抗体水平也在不断增加,在第三次免疫后的第一周(35天),抗体水平迅速增高,随后在35-42天内在组内保持最高的抗体水平,与其他三个组差异显著(P<0.05);C组虽是在第7天最先产生抗体水平,但在21-42天内抗体产生的效果与A和B组相比较低,与A和B组差异显著(P<0.05),在第21和42天与G组差异不显著(P>0.05)。
(3)重组腺病毒不同免疫次数产生抗体水平效果的评价
根据图17可得,A组与E组在第一次和第二次免疫时(0-28天前)产生的抗体水平基本保持一致,两组差异不显著(P>0.05),A组在第三次小鼠免疫后抗体水平相对E组稍有增高,但二者在28-42天产生的抗体水平差异并不显著(P>0.05)。
(4)不同重组腺病毒产生抗体水平效果评价
根据图18可知,E组产生抗体的水平随着免疫时间不断增高,在第35-42天抗体达到最高并保持稳定,与F组相比较抗体产生水平较高,差异显著(P<0.05)。F组在第28天时,抗体水平达到同组最高值,但与E组相比差异不显著(P>0.05),28天后产生的抗体降低。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围。
