一种增加2-吡咯烷酮合成的方法
文献发布时间:2023-06-19 19:38:38
技术领域
本发明涉及一种增加2-吡咯烷酮合成的方法,属于基因工程技术领域。
背景技术
2-吡咯烷酮(2-Pyrrolidone,2P),又称2-氧代吡咯烷、γ-丁内酰胺,是一类具有一个五元内酰胺环的吡咯烷类化合物,广泛存在于天然产物和各类人工合成的化合物当中。2-吡咯烷酮是生产聚乙烯吡咯烷酮、锦纶-4和脑复康(酰胺吡咯烷酮)的原料,在医药领域和工业领域具有广泛且重要的用途。
2-吡咯烷酮可由化学法或生物法合成。其中化学法合成通常由γ-丁内酯经氨化而得。以丁二醇为原料,在200℃下,在铜催化剂存在下,生成γ-丁内酯,再与氨(或胺)反应,可制得2-吡咯烷酮。另一种化学合成方法为以4-羟基丁酰胺为原料,在高压和高温下脱水进行制备。利用化学法生产2-吡咯烷酮具有高耗能、工艺繁琐、反应条件苛刻、污染严重以及安全性低等的缺陷。
近年来已经有一些国内外的文献报道了关于使用微生物生产2-吡咯烷酮。目前产量最高的是,Tong Un Chae通过对大肠杆菌的改造,产量可达54g/L,但该产量仍无法满足产业化需求。应用谷氨酸棒杆菌等微生物发酵生产2-吡咯烷酮的产量相对比较低,导致成本较高,难以商业应用。
发明内容
针对现有技术存在的上述缺陷,本发明提供一株高产2-吡咯烷酮的谷氨酸棒杆菌工程菌,表达了Butyricicoccus faecihominis来源的CoA转移酶,该菌株可在pH 7.0条件下从葡萄糖一步法生产2-吡咯烷酮。
在一种实施方式中,所述CoA转移酶具有如Genbank登录号:MCQ5130945.1所示的氨基酸序列。
在一种实施方式中,所述工程菌以pCES质粒为表达载体;所述pCES质粒公开于论文《Development of a high-copy-number plasmid via adaptive laboratoryevolution of Corynebacterium glutamicum》。
在一种实施方式中,所述CoA转移酶的编码基因的上游还具有SEQ ID NO.2所示的信号肽NS。
在一种实施方式中,所述CoA转移酶的编码基因由SEQ ID NO.1所示的启动子P
在一种实施方式中,所述工程菌以谷氨酸棒杆菌FF10为宿主,所述谷氨酸棒杆菌FF10公开于公开号为CN114752544B的专利中。
本发明还提供所述谷氨酸棒杆菌工程菌在一步法生产2-吡咯烷酮中的应用。
在一种实施方式中,所述应用是将所述谷氨酸棒杆菌工程菌以谷氨酸棒杆菌可利用的单糖、多糖或其混合物为碳源,在pH 7.0±0.2发酵生产2-吡咯烷酮。
在一种实施方式中,所述碳源包括但不限于葡萄糖、果糖、蔗糖、糖蜜中的一种或多种。
在一种实施方式中,所述应用是将所述工程菌在种子培养基中培养一段时间,收集种子液,再将种子液接种至发酵培养基中,于28~30℃发酵一段时间。
在一种实施方式中,所述发酵是在28~30℃,150~250rpm发酵至少48h。
这一种实施方式中,所述种子培养基为BHIS培养基。
在一种实施方式中,所述种子液是将所述工程菌在BHIS培养基中,于28~30℃培养12小时,获得种子液。
在一种实施方式中,所述种子液以5~10%的接种量接种至发酵培养基中。
在一种实施方式中,所述发酵培养基含有:葡萄糖、(NH
在一种实施方式中,所述发酵培养基含有:葡萄糖50g/L,(NH
本发明还要求保护所述工程菌在生产2-吡咯烷酮或其衍生物方面的应用。
在一种实施方式中,所述衍生物包括但不限于N-甲基吡咯烷酮。
有益效果:
本发明在谷氨酸棒杆菌中表达了Butyricicoccus faecihominis来源的CoA转移酶,并通过P
附图说明
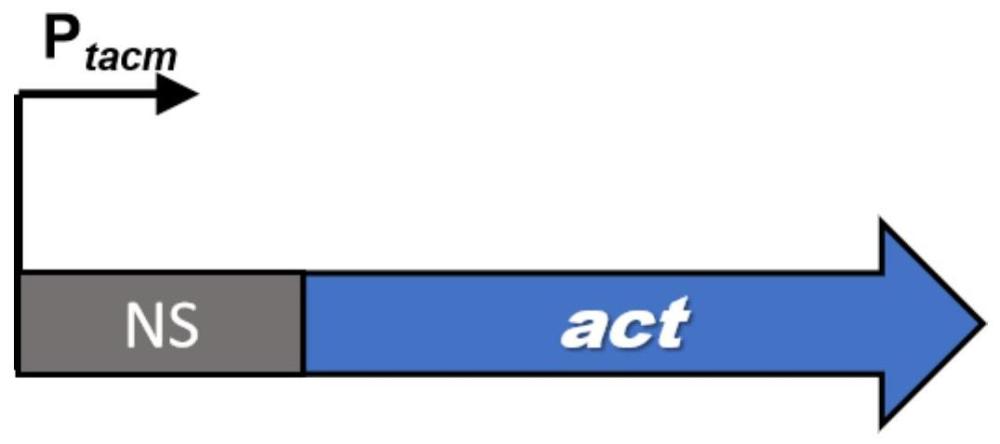
图1为CoA转移酶ACT分泌表达元件的构建示意图。
图2为CoA转移酶ACT是否分泌表达对2-吡咯烷酮产量的影响。
具体实施方式
技术术语:
表达:术语“表达”包括涉及酶或蛋白产生的任何步骤,包括但不限于转录、转录后修饰、翻译、翻译后修饰、以及分泌。
表达载体:术语“表达载体”意指直链或环状DNA分子,所述分子包含编码本发明的谷氨酸脱羧酶突变体的多核苷酸并且可操作地连接至提供用于其表达的控制序列。
宿主细胞:术语“宿主细胞”意指易于用包含本发明的多核苷酸的核酸构建体或表达载体进行转化、转染、转导等的任何细胞类型。术语“宿主细胞”涵盖由于复制期间出现的突变而与亲本细胞不完全相同的任何亲本细胞子代。
发酵液:“发酵液”是指由细胞发酵产生的、未经回收或经过回收和/或纯化的制剂。例如,当微生物培养物在允许蛋白质合成(例如,由宿主细胞表达酶)并且将蛋白质分泌到细胞培养基中的碳限制条件下孵育生长到饱和时,产生发酵液。所述发酵液可以含有在发酵结束时得到的发酵材料的内容物。例如,所述发酵液包含被微生物利用后的培养基成分以及可通过离心去除微生物细胞(例如,丝状真菌细胞)后存在的细胞碎片。
培养基:
CGXII培养基:葡萄糖50g/L,(NH
检测方法:
利用液相色谱检测2-吡咯烷酮产量:安捷伦液相色谱仪1290,配备光电二极管阵列检测器,色谱柱:InfinityLab Poroshell 120EC C18(2.7μm,4.6×100mm,安捷伦);流动相采用95%水-乙腈(含0.1%甲酸)混合溶液:甲醇(90:10)等度洗脱5min;流速0.3mL/min;检测波长210nm;柱温30℃;进样量1μL。
实施例1辅酶A转移酶ACT分泌表达质粒的构建
图1为辅酶A转移酶ACT分泌表达元件的构建示意图,所述表达元件依次包括启动子P
具体步骤如下:
选择来自Butyricicoccus faecihominis菌株的act基因(Genbank登录号为MCQ5130945.1)设计扩增引物:
ACTNSF:GACACCTACATGATCAGGAGCTCTTTATGCGTTCTCTGGAGGGAGTCCG,ACTR:CTACTGCCGCCAGGCAGCGGCCGCTTTAAATCGCACCGCAGGCTGCCAG。
以Gene ID为MCQ5130945.1的基因作为模板,直接合成该基因,再通过PCR进行扩增得到目的片段,经DNA纯化试剂盒纯化后,通过Gibson将PCR扩增产物、合成的启动子P
实施例2利用谷氨酸棒杆菌工程菌株发酵生产2-吡咯烷酮
将实施例1中构建的重组质粒pCES-NS-ACT转化至高产γ-氨基丁酸的底盘菌FF10(公开于公开号为CN114752544B的专利)感受态细胞中,构建得到2-吡咯烷酮生产重组菌FF10pCES-NS-ACT。
将重组菌FF10 pCES-NS-ACT和FF10 pCES-ACT分别用于一步法从葡萄糖发酵生产2-吡咯烷酮,具体步骤为:将菌株FF10 pCES-NS-ACT或FF10 pCES-ACT在BHIS培养基中,于30℃培养12小时,获得种子液;将种子液以10%的接种量接种至装液量50mL CGXII培养基的500mL摇瓶中,于30℃,200rpm发酵96小时。
如图2所示,与2-吡咯烷酮的标准品进行对比,在菌株FF10 pCES-NS-ACT的发酵液中检测到了2-吡咯烷酮的峰,显示构建的菌株能生产2-吡咯烷酮。
图2显示了摇瓶发酵中,ACT是否分泌表达在2-吡咯烷酮生产中的影响。结果显示,FF10pCES-NS-ACT利用分泌表达ACT,摇瓶发酵可以生产12.13g/L 2-吡咯烷酮,是FF10pCES-ACT不分泌表达的1.67倍,进而证明ACT的分泌表达可以提高2-吡咯烷酮的产量。
对比例1:
具体实施方式同实施例1,区别在于,将启动子P
对比例2:
具体实施方式同实施例1,区别在于,将NS信号肽替换为NS2信号肽(核苷酸序列如SEQ ID NO.4所示)。按照实施例2的方法进行发酵,结果显示,制备获得的菌株2-吡咯烷酮的产量为5.13g/L,摇瓶产量比未加信号肽的还低。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 一种吡咯烷酮类化合物的合成方法
- 一种由环氧乙烷和2-吡咯烷酮一步合成N-羟乙基吡咯烷酮的方法
- 一种N-芳基-5-三氟甲基-2-吡咯烷酮和N-芳基-6-三氟甲基-2-吡啶烷酮的合成方法
