压电效应组件的应用及间充质干细胞的改性方法
文献发布时间:2024-04-18 19:53:33
技术领域
本发明属于生物技术领域,尤其涉及压电效应组件的应用及间充质干细胞的改性方法。
背景技术
间充质干细胞(MSCs)是来源于中胚层的多潜能细胞,具有多向分化潜能、旁分泌效应、组织修复、免疫调节、促血管新生等多种生物学功能,以干细胞治疗为代表的再生医学已经成为一种新的、有前途的治疗模式,具有极大的应用价值。
现有技术中也有一些生物压电材料促进MSCs增殖、分化功能研究,例如CN110819588A公开了一种采用超声波激发压电材料(钛酸钡、铌酸锂纳米颗粒)促进干细胞增殖和/或神经分化的应用,但其存在潜在细胞毒性,不适用于体外长期培养。
目前,MSCs由于其强大的自我更新、多向分化、免疫调节等潜能,使其作为细胞产品广泛应用于多种组织器官修复、免疫系统疾病等临床试验中。但MSCs在体外大规模扩增培养的过程中不可避免发生复制性衰老,严重影响干细胞产品的质量。因此,开发一种能安全有效地延缓MSCs体外衰老,维持其增殖分化等生物学功能体外培养体系在细胞治疗及组织工程领域具有重大的的应用价值。
发明内容
针对上述问题,本发明提供压电效应组件的应用及间充质干细胞的改性方法,主要给MSCs的功能性质调节给出了新的方案和调节组件。
为了解决上述问题,本发明采用如下技术方案:
本发明第一方面涉及
1)延缓MSCs复制性衰老,
2)增强MSCs增殖能力,
3)提高MSCs多能干性,
4)促进MSCs成骨分化,抑制成脂分化,
5)增强MSCs促血管新生能力,并可进而增强MSCs促皮肤修复的能力。
所述PVDF压电薄膜为已极化的柔性聚偏氟乙烯压电薄膜,在使用时,其可为具有高稳定性的柔性聚偏氟乙烯(PVDF)压电薄膜材料,厚度为28μm。采用生物相容性良好的PVDF薄膜材料来实现调控MSCs,可避免异源性纳米颗粒、复杂操作等对母体MSCs造成损害及突变风险。在该种应用中,PVDF压电薄膜直接对相应的细胞进行作用,并使得细胞在培养过程中发生变化,其较多的是在体外进行使用,但在保证安全和获得许可的前提下,其也可在体内进行运用,当然该种应用需要保证应用后不易引起其他细胞异变。
主要利用的是PVDF压电薄膜的压电自刺激(如正压电效应,即机械力转化表面电压):当细胞粘附在压电材料上时,细胞自身主动运动而产生收缩的力可以通过黏着斑点接触转移到基质上,材料会产生形变,从而使内部的电荷转移,使偶极子的重新排列,形成不对称结构后具有压电性,从而直接给细胞电刺激。细胞的扩散以及局部粘附的成熟可以影响表面电位并进一步调节细胞行为。PVDF压电薄膜是一面带正电,一面带负电,优选的使用负极面,因为负极面细胞更容易贴壁、增殖。
所述PVDF压电薄膜的压电系数为10~15pC/N,所述PVDF压电薄膜的Zeta点位为-10~-90mv。
所述PVDF压电薄膜的作用表现为提升MSCs中OCT4、SOX2、NANOG、BMP2、RUNX2、OCN、VEGF、HIF-1α中至少一种的表达水平,和/或所述PVDF压电薄膜的作用表现为降低MSCs中P16、P21、P53、FAB4、PPAR-γ、LPL中至少一种的表达水平。只要对MSCs中任一基因具有调节作用就可视为在本发明的范围内。
在应用时,PVDF压电薄膜针对的MSCs种类较多,其中常见的为HUCMSCs。
本发明第二方面涉及
生物模型主要为细胞模型,该细胞模型中的MSCs在复制过程中衰老变化被延缓,进而可以获得质量更好的干细胞产品。
本发明第三方面涉及
本发明第四方面涉及
S1、将PVDF压电薄膜用含血清的DMEM/F12培养基浸泡并转移至CO2细胞培养箱,使PVDF压电薄膜吸附培养基中小分子蛋白(有利于悬浮在培养基中的细胞贴壁黏附在材料上),
S2、将MSCs胰酶消化后制成细胞悬液,并接种在PVDF压电薄膜表面,转移至CO2细胞培养箱中培养;
其中,所述PVDF压电薄膜为已极化的柔性聚偏氟乙烯压电薄膜材料。
该体外延缓间充质干细胞衰老的方法即可在实验中进行使用,已实现对MSCs性质的控制,还可用于制备高质量的MSCs,进而为工业生产高质量的间充质干细胞产品提供了一种快捷有效的培养方法。
所述PVDF压电薄膜由PVDF薄膜经高压电场极化形成。所述PVDF压电薄膜的压电系数为10~15pC/N,所述PVDF压电薄膜的Zeta点位为-10~-90mv;所述MSCs为HUCMSCs。所述PVDF压电薄膜的压电系数为13.5pC/N,所述PVDF压电薄膜的Zeta点位为-54mv。
步骤S1中,PVDF压电薄膜使用前进行消毒灭菌清洗,比如将极化PVDF薄膜放置于细胞培养板中,加入75%医用酒精浸泡48h,在无菌超净台中使用紫外灯照射1-2h进行消毒灭菌,用PBS缓冲液多次清洗干净PVDF薄膜;步骤S2中,CO2细胞培养箱中CO2的含量为5±2%(范围值),且具有35~38℃的培养环境。
在DMEM/F12培养基添加10%新西兰胎牛血清和1%青霉素链霉素溶液。同时,对应不同的MSCs时可根据需要进行培养基的变更。
本发明第五方面涉及
本发明的有益效果是:
本发明发现压电效应可以逆转hUCMSCs复制性衰老,PVDF压电薄膜可减少细胞污染与排异反应。本发明提供的间充质干细胞培养系统能在细胞体外扩增过程中延缓细胞衰老,减少β-gal阳性细胞比例,提高干性(OCT4、SOX2、NANOG)基因及蛋白表达水平,增强其成骨分化,抑制成脂分化,促进伤口愈合等特性,且无细胞毒性,为工业生产高质量的间充质干细胞产品提供了一种快捷有效的培养方法。
附图说明
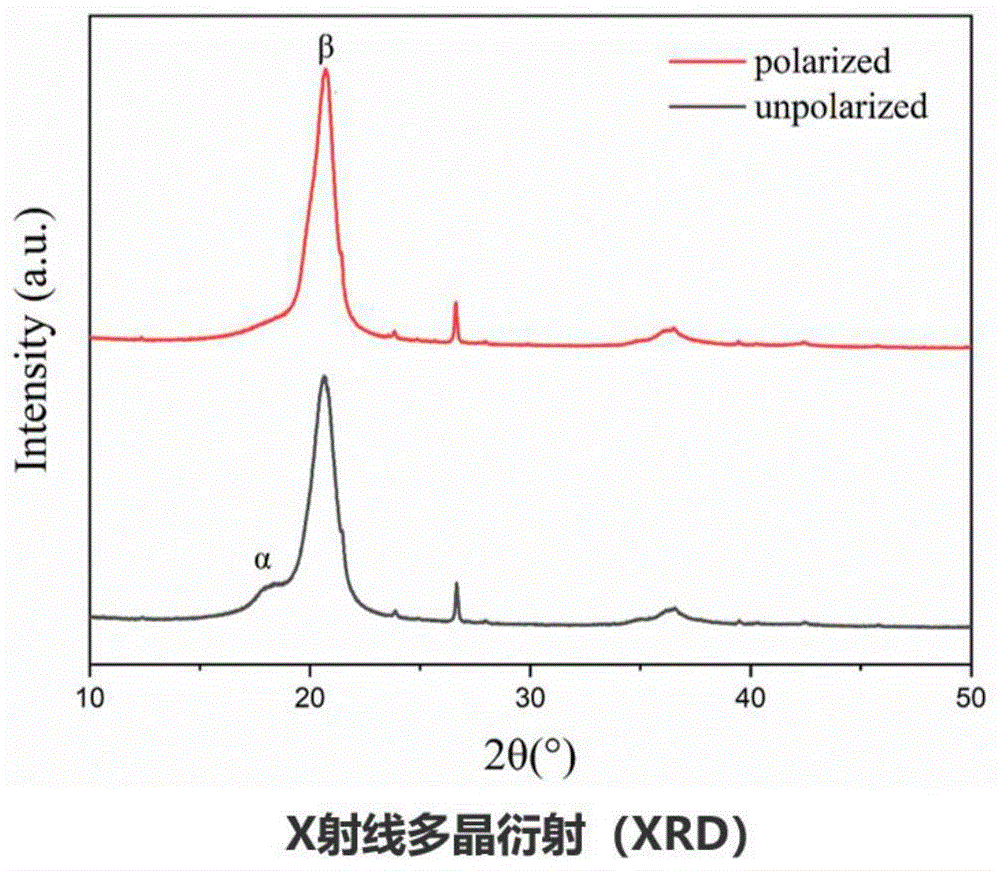
图1为未极化和极化PVDF薄膜的X射线多晶衍射图;
图2为在培养基中浸泡0-4周极化PVDF薄膜的zeta电位和压电系数(d33)检测结果;
图3为流式细胞术检测PVDF薄膜培养的hUCMSCs表面抗原表达情况;
图4为CCK8检测PVDF薄膜预处理3、7、10、14天对hUCMSCs增殖状态的影响;
图5为β-gal染色及qPCR检测PVDF薄膜对hUCMSCs复制性衰老影响;
图6为qPCR检测PVDF薄膜对hUCMSCs干性影响结果;
图7为茜素红及油红O染色检测PVDF薄膜对hUCMSCs成骨成脂分化的影响并进行qPCR验证;
图8为qPCR检测PVDF薄膜对hUCMSCs促血管新生能力的影响;
图9为裸鼠皮肤损伤愈合模型检测PVDF薄膜预处理的hUCMSCs体内损伤修复能力。
具体实施方式
下面结合附图对本发明进一步说明。
实施例1:PVDF薄膜结构及性能测试
将商业化的未极化α相PVDF非压电薄膜和极化β相PVDF压电薄膜采用X射线多晶衍射(XRD)表征薄膜材料的结晶相,其XRD曲线图如图1所示,未极化PVDF薄膜的XRD曲线在2θ=18.2°处显示α相特征峰;而经过极化PVDF薄膜的XRD曲线在20.7°处显示处β相的特征峰,并且α相特征峰消失,表明PVDF经高压电场极化成功,具有压电性能。使用准静态d33测试仪对极化PVDF薄膜压电系数(d33)进行测量;使用固体表面Zeta电位分析仪对极化PVDF薄膜表面电位进行测量。
极化PVDF压电薄膜的电学稳定性检测,步骤如下:
(1)将极化PVDF压电薄膜用去离子水充分浸泡,裁剪为10mm×10mm及10mm×20mm小片备用;
(2)将上诉裁剪后的极化PVDF薄膜放置于细胞培养板中,加入75%医用酒精浸泡48h,在无菌超净台中使用紫外灯照射1-2h进行消毒灭菌,用PBS缓冲液多次清洗干净PVDF薄膜,最后将PVDF薄膜用DMEM/F12培养基覆盖(细胞培养基:DMEM/F12培养基添加10%新西兰胎牛血清和1%青霉素链霉素溶液);
(3)将装有PVDF薄膜的细胞培养板转移至37℃含5%CO2的细胞培养箱中分别浸泡0、1、2、3、4周,在每个时间节点取出PVDF薄膜用PBS缓冲液冲洗3次备用待检;
(4)将上诉浸泡不同时间节点的PVDF压电薄膜通过固体表面Zeta电位分析仪检测表面电位,此外将其进行磁控溅射喷金及安装电极后,通过准静态d33测试仪检测d33,结果如图2所示,未处理的极化PVDF压电薄膜的压电系数为13.5pC/N,表面电位为-54mv,与内源性生物电位微环境相符合,并且处于模拟细胞培养环境下的极化PVDF压电薄膜的电学性能稳定,随着培养时间的延长,其表面zeta电位及压电系数无明显降低。
实施例2:流式细胞术检测干细胞表面抗原
收集在不同材质连续培养14天的hUCMSCs,分别消化为单细胞悬液后250g离心5min,PBS洗涤1次,将各组细胞密度调整为1×10
实施例3:PVDF压电薄膜能显著增强hUCMSCs的增殖能力
将未极化、极化PVDF薄膜作为细胞培养皿底衬应用于促进hUCMSCs增殖,步骤如下:
(1)将两种PVDF薄膜用去离子水充分浸泡洗净后,裁剪成直径为100mm的圆形片备用;
(2)材料预处理:将上诉裁剪后的PVDF薄膜作为细胞培养衬底放置于细胞培养皿中,加入75%医用酒精浸泡48h,同时在无菌超净台中使用紫外灯照射1-2h进行消毒灭菌,用PBS缓冲液多次清洗干净PVDF薄膜,最后将PVDF薄膜用含血清的DMEM/F12培养基浸泡并转移至CO2细胞培养箱中过夜,使材料吸附培养基中小分子蛋白;
(3)细胞接种:将hUCMSCs胰酶消化后制备为细胞悬液,将密度为2×10
(4)将上诉培养在不同材质的hUCMSCs分别在第3、7、10、14天进行胰酶消化,制备为细胞悬液,按2×10^3/ml接种于96孔板培养72小时,使用CCK8试剂盒(诺维赞),每孔加入10ulCCK8工作液,孵育2-3小时后酶标仪检测OD450nm读数。图4结果显示在培养第3天,各组间OD值无显著差异,在连续培养7、10、14天后极化PVDF组细胞增殖速度明显高于未极化PVDF组及TCPs组,并且在连续培养14天后极化PVDF组细胞活性较另外两组升高最为明显,因此后续功能试验优选连续培养14天为最佳培养时间。
实施例4:PVDF压电薄膜能延缓hUCMSCs体外培养中复制性衰老
(1)衰老相关β-半乳糖甘酶染色:在连续培养第14天,将不同材质培养的hUCMSCs按1×10
(2)实时荧光定量PCR(qPCR)检测衰老相关基因表达水平:收集在不同材质连续培养14天的hUCMSCs,各组约5×10
Homo P16-F:GGGTTTTCGTGGTTCACATCC,
Homo P16-R:CTAGACGCTGGCTCCTCAGTA;
Homo P21-F:CCCGTGAGCGATGGAACTT,
Homo P21-R:CGAGGCACAAGGGTACAAGAC;
Homo P53-F:GAGGTTGGCTCTGACTGTACC,
Homo P53-R:TCCGTCCCAGTAGATTACCAC。
结果如图5所示,经极化PVDF压电薄膜培养的hUCMSCs衰老相关基因P16、P21和P53表达水平较TCPs及未极化PVDF组明显降低。
实施例5:PVDF压电薄膜能提高hUCMSCs多能干性
OCT4、SOX2和NANOG被认为在维持干细胞自我更新和多潜能性方面发挥极其重要的作用。我们收集在不同材质连续培养14天的hUCMSCs,各组约5×10
Homo OCT4-F:TCAAAGCAAGCTGGGGAGAG,
Homo OCT4-R:ACATCCAAGGGATGCAGAGC;
Homo SOX2-F:TTTGTCGGAGACGGAGAAGC,
Homo SOX2-R:GACTTGACCACCGAACCCAT;
Homo NANOG-F:CTGCAGAGAAGAGTGTCGCA,
Homo NANOG-R:ACATTAAGGCCTTCCCCAGC。
结果如图6所示,经极化PVDF压电薄膜培养的hUCMSCs干性相关基因OCT4、SOX2和NANOG表达水平较TCPs及未极化PVDF组明显增加。
实施例6:PVDF压电薄膜促进hUCMSCs成骨分化,抑制成脂分化
(1)成骨分化诱导及茜素红染色:加适量0.1%明胶到细胞培养板中,摇匀,使其能均匀覆盖各孔底部,然后将铺有明胶的孔板放置在CO2培养箱30min。吸弃明胶,将不同材质连续培养14天的hUCMSCs按1×10
(2)成脂分化诱导及油红O染色:加适量0.1%明胶到细胞培养板中,摇匀,使其能均匀覆盖各孔底部,然后将铺有明胶的孔板放置在CO2培养箱30min。吸弃明胶,将不同材质连续培养14天的hUCMSCs按1×10
(3)为进一步验证上诉染色结果,我们通过qPCR检测诱导分化14天后hUCMSCs成骨成脂相关基因表达水平:将不同材质连续培养14天的hUCMSCs分别进行成骨成脂诱导分化14天,诱导结束后应用RNA提取试剂盒(诺维赞R701-02)提取细胞总RNA,使用Nanodrop测定RNA浓度和纯度A260/A280,根据上诉步骤测定的RNA浓度,所有样品按1ug总量应用诺维赞逆转录试剂盒R323进行逆转录,最后参照诺维赞qPCR试剂盒Q311进行qPCR反应,其中每孔加入cDNA 1ul,使用StepOnePlus
Homo BMP2-F:CCAGCCGAGCCAACACTGTGC,
Homo BNP2-R:TCTCCGGGTTGTTTTCCCACTCG;
Homo OCN-F:AGCAAAGGTGCAGCCTTTGT,
Homo OCN-R:GCGCCTGGGTCTCTTCACT;
Homo RUNX2-F:AATGGTTAATCTCCGCAGGTC,
Homo RUNX2-R:TTCAGATAGAACTTGTACCCTCTGTT;
Homo FAB4-F:GGCCAGGAATTTGACGAAGT,
Homo FAB4-R:TTTCCATCCCATTTCTGCAC;
Homo PPAR-γ-F:TGCAGTGGGGATGTCTCATA,
Homo PPAR-γ-R:CAGCTGGTCGATATCACTGGA;
Homo LPL-F:CCCTAAGGACCCCTGAAGAC,
Homo LPL-R:GGTTTTGCTGCTGTGATTGA。
结果如7所示,相较TCPs和未极化PVDF,经极化PVDF压电薄膜培养的hUCMSCs成骨分化基因(BMP2、RUNX2、OCN)表达水平明显增加,成脂分化基因(FAB4、PPAR-γ、LPL)表达水平明显降低。
实施例7:PVDF压电薄膜增强hUCMSCs促血管新生能力
VEGF和HIF-1α是干细胞通过旁分泌促进内皮细胞迁移及血管形成的关键效应因子。我们收集在不同材质连续培养14天的hUCMSCs,各组约5×10
Homo VEGF-F:AGGGCAGAATCATCACGAAGT,
Homo VEGF-R:ACATCCAAGGGATGCAGAGC;
Homo HIF-1α-F:TCCATGGTACCATGAGGAAA,
Homo HIF-1α-R:ACCAAGCAGGTCATAGGTGG。
结果如图8所示,经极化PVDF压电薄膜培养的hUCMSCs促血管新生相关基因VEGF和HIF-1α表达水平较TCPs及未极化PVDF组明显增加。
实施例8:裸鼠皮肤损伤愈合模型检测PVDF薄膜预处理的hUCMSCs体内损伤修复能力
①移植细胞的准备:取在不同材质连续培养14天的hUCMSCs,胰酶消化后制备单细胞悬液,调整细胞密度为1×107/ml,置于冰上备用。
②动物模型的构建:裸鼠在建模前于动物中心隔离包适应性喂养1周。按随机数字表法将24只裸鼠随机分为PBS组、TCPs组、未极化PVDF组、极化PVDF组,每组6只。于超净台内,使用异氟烷吸入麻醉裸鼠,待裸鼠进入麻醉状态后,碘伏消毒裸鼠背部皮肤2-3次。无菌直尺量取裸鼠北部皮肤约1×1cm大小,并做好标记。使用无菌眼科剪沿标记剪去皮肤全层(包括表皮、真皮及皮下组织),拍照并在创口处覆盖无菌塑料薄膜记录原始伤口大小。吸取EP管中单细胞悬液及等体积的PBS于1ml注射器中,沿皮肤创缘约0.5cm处行皮下点状注射细胞悬液(2×10
③皮肤创面愈合的大体观察:分别在建模后第6、9、12天麻醉裸鼠,轻柔拆除背部敷料,无菌塑料薄膜覆盖伤口,记号笔勾勒创缘并拍照记录(尽量保持焦距和标尺一致)。使用ImageJ软件测量创面面积,并计算上述各个时间点创面愈合率(%)=(原切口面积-现切口面积)/原切口面积×100%。结果如图9所示:在第6天即显示出极化PVDF组相较PBS、TCPs和PVDF组能明显提高皮肤创口愈合的速度,表明极化PVDF预处理的hUCMSCs具有更强的组织修复能力。
本领域的技术人员可以明确,在不脱离本发明的总体精神以及构思的情形下,可以做出对于以上实施例的各种变型。其均落入本发明的保护范围之内。本发明的保护方案以本发明所附的权利要求书为准。
- 临时设施搭建方法和医院船
- 地震灾区临时搭建抢救伤员的简易临时设施
