一株产黄酮类化合物的工业大麻内生真菌HMY07及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及微生物领域,具体涉及一株产黄酮类化合物的工业大麻内生真菌及其应用。
背景技术
黄酮类化合物是一类具有其独特的结构骨架及理化性质的多酚化合物,并且具有抗肿瘤、抗心脑血管疾病、抗炎镇痛、免疫调节、降血糖等活性作用,是新药研发的活性先导物化合物,在医药、功能食品中具有广阔的应用前景。
黄酮类化合物最初是从药用植物中提取分离得到,但这样的获取方式会严重消耗药用植物资源,并且价格昂贵。化学合成的方式也可以得到黄酮类化合物,但化学合成会造成环境污染,而且工艺复杂,条件难以控制。随着对植物内生菌的深入研究发现,内生菌可产生丰富的次生代谢产物,可作为天然产物资源加以开发利用。
发明内容
本发明是要解决现有获得黄酮类化合物的方法存在严重消耗药用植物资源,污染环境、工艺复杂的问题,提供一株产黄酮类化合物的工业大麻内生真菌及其应用。
本发明提供一株产黄酮类化合物的工业大麻内生真菌HMY07,它为链格孢菌(Alternaria alternata)HMY07,已在中国典型培养物保藏中心保藏,保藏地址为武汉市武汉大学,保藏日期为2023年5月30日,保藏编号为CCTCC NO:M 2023878。
本发明工业大麻内生真菌HMY07,菌落灰粽色,菌丝密集,毡状,基质灰色。
将本发明工业大麻内生真菌HMY07的18S rDNA序列提交至NCBI数据库,进行GenBank分析,使用MEGA7软件对内生真菌HDM07序列同源性较高的菌株序列进行分析,工业大麻内生真菌HMY07与Alternaria alternata(MN995553.1)聚于同一分支,且两者同源性为100%。综合形态学鉴定以及18S rDNA序列分析结果,将工业大麻内生真菌HMY07鉴定为链格孢菌(Alternaria alternata)。
本发明还提供工业大麻内生真菌HMY07在制备抗氧化药物中的应用。
进一步的,大麻内生真菌HMY07对DPPH的半数清除率达到58.727±0.25μg·mL
本发明还提供工业大麻内生真菌HMY07在发酵产黄酮类化合物中的应用。
进一步的,所述黄酮类化合物为槲皮素和山奈酚。
本发明的有益效果:
本发明在工业大麻中分离出一株大麻内生真菌HMY07,经鉴定为链格孢菌(Alternaria alternata)。该菌株具有良好的抗氧化活性,当浓度为100μg·mL
本发明中工业大麻内生真菌HMY07能够发酵产两种黄酮类化合物,分别是槲皮素和山奈酚。采用工业大麻内生真菌发酵法生产黄酮类化合物,能够节省植物资源,同时也为黄酮类化合物的生产提供新的方法,发酵方法反应条件温和,利于规模化生生产。因此,工业大麻内生真菌HMY07具有广阔的应用前景。
附图说明
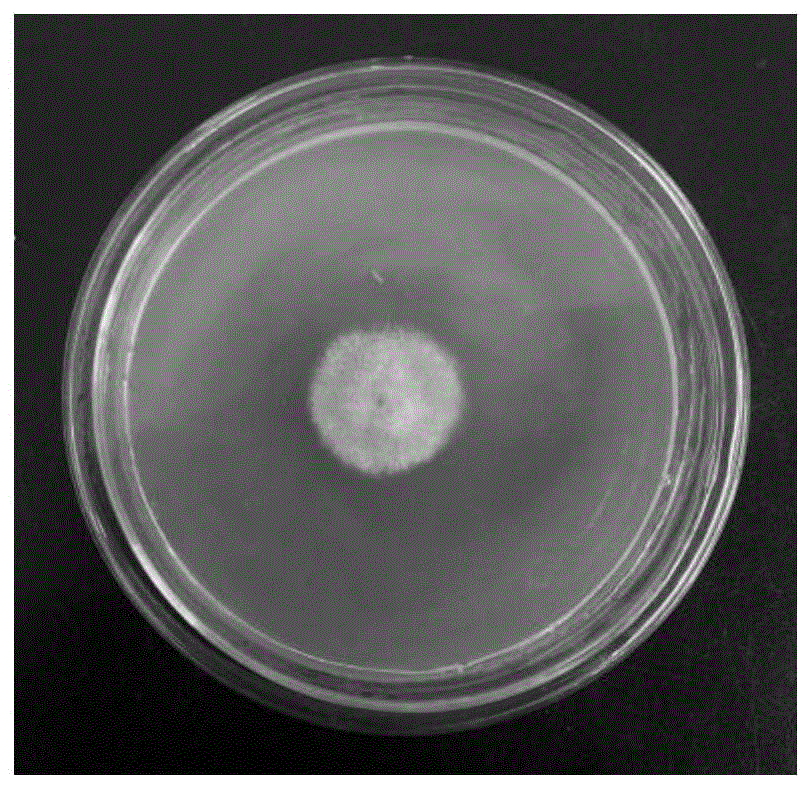
图1为工业大麻内生真菌HMY07的菌落形态;
图2为工业大麻内生真菌HMY07的孢子显微形态;
图3为工业大麻内生真菌HMY07的18S rDNA琼脂糖凝胶电泳检测结果;
图4为工业大麻内生真菌HMY07的系统发育树;
图5为工业大麻内生真菌HMY07对DPPH自由基的清除能力;
图6为大孔树脂柱30%乙醇洗脱部位HPLC图谱;其中A:大孔树脂柱30%乙醇洗脱部位;B:槲皮素对照品;C:山奈酚对照品D:工业大麻叶甲醇提取液;E:PDB空白对照;
图7为化合物A的HPLC图谱;其中A:化合物A;B:化合物A+槲皮素对照品;C:槲皮素对照品;
图8为化合物B的HPLC图谱;其中A:化合物B;B:化合物B+山奈酚对照品;C:山奈酚对照品。
具体实施方式
下面对本发明的实施例做详细说明,以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1:
本实施例产黄酮类化合物的工业大麻内生真菌HMY07为链格孢菌(Alternariaalternata)HMY07,已在中国典型培养物保藏中心保藏,保藏地址为武汉市武汉大学,保藏日期为2023年5月30日,保藏编号为CCTCC NO:M 2023878。
本实施例工业大麻内生真菌HMY07的获取方法为:
(1)材料:健康工业大麻叶(龙麻5号),流水冲洗,置阴凉处晾干,无菌刀切成5cm小块,备用。
(2)表面消毒:将上述材料在75%酒精中浸泡30s,然后置于6%NaClO中漂洗5min,接着用75%酒精浸泡30s,最后用无菌水冲洗3次。
(3)内生真菌分离:将消毒后的实验材料两端各切除1cm后,用无菌手术刀切割成0.5cm的小块,置于PDA培养基中,于28℃与恒温培养箱中培养5-7d;
(4)阴性对照:取最后一次无菌水冲洗液涂布培养平板,或取适量此冲洗液倒入PDA培养基内作对照;另外在相同条件下,将消毒之后的实验材料于培养平板上滚动培养一周,作为对照。从工业大麻叶中分离得到内生真菌HMY07,阴性对照平板和阴性对照液培养基内均无任何菌长出,多次重复均如此,从而证明所分到的菌是工业大麻内生真菌。
实施例2:工业大麻内生真菌HMY07的鉴定
工业大麻内生真菌HMY07的菌落形态图如图1所示,孢子显微形态图如图2所示。菌落灰粽色,菌丝密集,毡状,基质灰色
以工业大麻内生真菌HMY07的基因组DNA为模板,采用18S rDNA序列通用引物NS1和NS6进行PCR扩增,PCR扩增产物经琼脂糖凝胶电泳检测结果见图3。由图3可知,工业大麻内生真菌HMY07的18S rDNA序列长度为1323bp,18S rDNA序列如序列表中SEQ ID NO:1所示。其测序结果如下:
CATTATACCGTGAAACTGCGAATGGCTCATTAAATCAGTTATCGTTTATTTGATAATACCTTACTACTTGGATAACCGTGGTAATTCTAGAGCTAATACATGCTGAAAATCCCGACTTCGGAAGGGATGTGTTTATTAGATAAAAAACCAATGCCCTTCGGGGCTTTTTGGTGATTCATGATAACTTTACGGATCGCATAGCCTTGCGCTGGCGACGGTTCATTCAAATTTCTGCCCTATCAACTTTCGATGGTAAGGTATTGGCTTACCATGGTTTCAACGGGTAACGGGGAATTAGGGTTCGATTCCGGAGAGGGAGCCTGAGAAACGGCTACCACATCCAAGGAAGGCAGCAGGCGCGCAAATTACCCAATCCCGACACGGGGAGGTAGTGACAATAAATACTGATACAGGGCTCTTTTGGGTCTTGTAATTGGAATGAGTACAATTTAAACCTCTTAACGAGGAACAATTGGAGGGCAAGTCTGGTGCCAGCAGCCGCGGTAATTCCAGCTCCAATAGCGTATATTAAAGTTGTTGCAGTTAAAAAGCTCGTAGTTGAAACTTGGGCCTGGCTGGCGGGTCCGCCTCACCGCGTGCACTCGTCCGGCCGGGCCTTCCTTTCTGAAGAACCTCATGCCCTTCACTGGGCGTGCTGGGGAATCAGGACTTTTACTTTGAAAAAATTAGAGTGTTCAAAGCAGGCCTTTGCTCGAATACGTTAGCATGGAATAATAAAATAGGGCGTGCGTTTCTATTTTGTTGGTTTCTAGAGACGCCGCAATGATTAACAGGAACAGTCGGGGGCATCAGTATTCAGTTGTCAGAGGTGAAATTCTTGGATTTACTGAAGACTAACTACTGCGAAAGCATTTGCCAAGGATGTTTTCATTAATCAGTGAACGAAAGTTAGGGGATCGAAGACGATCAGATACCGTCGTAGTCTTAACCGTAAACTATGCCGACTAGGGATCGGGCGATGTTCTTTTTCTGACTCGCTCGGCACCTTACGAGAAATCAAAGTTTTTGGGTTCTGGGGGGATTATGGTCGCAAGGCTGAAACTTAAAGAAATTGACGGAAGGTCACCACCAGGCGTGGAGCCTGCGGCTTAATTTGACTCAACACGGGGAAACTCACCAGGTCCAGATGAAATAAGGATTGACAGATTGAGAGCTCTTTCTTGATTTTTCAGGTGGTGGTGCATGGCCGTTCTTAGTTCGTGGGGTGACTTGTCTGCTTAATTGCGATAACGAGCGAGACCTTACTCTGCTAAATAGCCAGGCTAACTTTGGTTGGTCGCCGGCTTCTTAGAGAGACTATCA
引物NS1和NS6由上海生工生物工程股份有限公司合成,其序列如下:
正向引物为NS1:5’-GTAGTCATATGCTTGTCTC-3’
反向引物为NS6:5’-GCATCACAGACCTGTTATTGCCTC-3’
将测得的大麻内生真菌HMY07的18S rDNA序列提交至NCBI数据库,进行GenBank分析,使用MEGA7软件对大麻内生真菌HDM07序列同源性较高的菌株序列进行分析,建立大麻内生真菌HMY07的系统发育树,如图4所示,大麻内生真菌HMY07与Alternariaalternata(MN995553.1)聚于同一分支,且两者同源性为100%。综合形态学鉴定以及18SrDNA序列分析结果,将工业大麻内生真菌HMY07鉴定为链格孢菌(Alternaria alternata)。
实施例3:工业大麻内生真菌HMY07的抗氧化活性分析
以DPPH清除率为指标,对大麻内生真菌HMY07的抗氧化活性进行测定。
发酵液的制备:无菌条件下,挑取大麻内生真菌HMY07的菌丝体接种于60mL PDB培养基中,28℃、120r/min培养3d,制备种子液(1×10
取11.8mg DPPH溶于甲醇并定容至200mL,即得浓度为0.15mmol·L
将对照品及供试品溶液依次稀释至浓度为100μg/mL、50μg/mL、25μg/mL、12.5μg/mL、6.25μg/mL,分别取上述各浓度溶液2mL至试管中,加入DPPH溶液4mL,以甲醇为空白对照,避光反应30min,在517nm下测量吸光值(n=3)。DPPH自由基清除率计算公式如下:
式中,A
以DPPH自由基的清除能力为指标,对大麻内生真菌HDM07抗氧化活性进行分析,结果见图5。
由图5可知,大麻内生真菌HMY07发酵液在6.25μg·mL
实施例4:工业大麻内生真菌HMY07的发酵液成分分析
取工业大麻内生真菌HMY07的发酵液16L,通过D101大孔树脂柱后以30%乙醇洗脱,收集洗脱液,回收溶剂,随行HPLC分析,结果见图6。
由图6可知,在30%乙醇洗脱部位中,存在与槲皮素对照品和山奈酚对照品保留时间相同的色谱峰,且阴性(空白PDB培养基)无干扰。
取D
对粗品①进行硅胶柱分离,采用石油醚:乙酸乙酯(7:1)为洗脱液进行洗脱,收集洗脱液(10mL/瓶),合并41~92号组分,多次重结晶,得到化合物A;对粗品②进行硅胶柱分离,采用石油醚:乙酸乙酯(4:1)为洗脱液进行洗脱,收集洗脱液(10mL/瓶),合并127~172号组分,多次重结晶,得到化合物B。
单体化合物A(10.750mg),黄色结晶粉末,易溶于乙醇、乙醚等有机溶剂,以槲皮素作为对照品,分别选取3种不同的流动相,采用标准加入法对化合物A进行HPLC分析,结果如图7所示。
由图7可知,化合物A与槲皮素对照品均在保留时间8.495min处出现相同色谱峰,将化合物A与槲皮素对照品进行混合,在保留时间8.495min处仅出现单一色谱峰,因此推测化合物A为槲皮素。且化合物A纯度为98.85%。对化合物A进行MS分析,结果化合物A的m/z:302.98[M+H]
化合物B(11.252mg),黄色结晶粉末,易溶于甲醇、乙酸乙酯等有机溶剂。以山奈酚作为对照品,分别选取3种不同的流动相,采用标准加入法对化合物B进行HPLC分析,结果如图8所示。
由图8可知,化合物B与山奈酚对照品均在保留时间9.798min处出现相同色谱峰,将化合物B与山奈酚对照品进行混合,在保留时间9.798min处仅出现单一色谱峰,因此推测化合物B为山奈酚。且化合物B纯度为98.95%。
对化合物B进行MS分析,结果化合物E的m/z:287.21[M+H]
- 一株产黄酮类化合物的工业大麻内生真菌及其应用
- 一株产CBD的工业大麻内生真菌及其应用
