一种检测T细胞和B细胞免疫组库的建库方法及其引物和试剂盒
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于分子生物学领域,具体涉及一种检测T细胞和B细胞免疫组库的建库方法及其引物和试剂盒。
背景技术
T细胞和B细胞是机体负责特异性免疫的两类细胞,T细胞受体(B cell receptor,TCR)和B细胞受体(B cell receptor,BCR)分别是在T细胞膜表面和B细胞膜表面的一种受体蛋白,可以特异性识别并结合抗原。
T、B细胞基因座上大量的V区、D区、J区基因片段在T细胞和B细胞受体形成中产生各种多样性重组现象,这种V-D-J基因的重组赋予了每一种T、B细胞自己独特的T、B细胞受体,从而使得每一个TCR和BCR的序列能有效的成为一个T、B细胞克隆的唯一生物标志物。通过免疫组库(TCR/BCR)测序,可以检测发现各类T细胞和B细胞克隆分型,揭示肿瘤或感染疾病发生时的免疫微环境变化,寻找免疫治疗的靶点,同时TCR/BCR测序也可用于抗体开发、用药及疫苗评估等方向。
由于TCR和BCR基因的最大特点是V、D、J基因片段的随机重组,因此很难设计一个上游引物用于识别TCR、BCR基因的5’端序列,且存在TCR和BCR在PCR反应后富集的目的片段效率不高,还存在大量的非目的片段。目前较为成熟的T、B细胞免疫组建库技术主要使用国外的10X基因组学有限公司(10X genomics)提供的产品,试剂成本很高,对实验操作的技术稳定性要求很高,不适用于大规模的临床诊断和大健康筛查。
CN107058484B公开了一种应用于高通量测序同时检测T细胞和B细胞免疫组库的引物组合及试剂盒,其通过cDNA接头和单对引物设计,可以同时检测TCR和BCR,但该专利的扩增效率仍有待提高,并且该专利在实验中采用进口试剂,存在测试成本较高的不足。
发明内容
本发明的目的在于提供一种扩增效率高的检测T细胞和B细胞免疫组库的建库方法及其引物和试剂盒。
为达到上述目的,本发明采用的技术方案是:
本发明第一方面提供了一种检测T细胞和B细胞免疫组库的建库方法,包括如下步骤:
(1)提取样本中的总RNA;
(2)以所述总RNA为模板合成全长cDNA;
(3)利用磁珠引物对所述全长cDNA进行PCR扩增,其中,所述磁珠引物为偶联有用于扩增TCR的TCR引物和用于扩增BCR的BCR引物的磁珠,自5’端至3’端,所述TCR引物的序列:ACTCTAAATCCAGTGAC和AAAACGTGTTCCCACCCAAG,所述BCR引物的序列为CCTGGTCCAGGGCTTCTTCC、CAAAGGATAACAGCCCT、GGCCACGGGCTACTTCCC、CCGGTGACGGTGTCGTGGAACTCA、GTGAGAATTCCCCGTCG、TGTGCCTGCTGAATAAC和CTCATAAGTGACTTCTA;
(4)分别利用TCR洗脱液和BCR洗脱液对步骤(3)反应后的体系进行洗脱,以获得TCR扩增产物和BCR扩增产物;
(5)将所述TCR扩增产物和所述BCR扩增产物进行混合建库;
(6)对步骤(5)建立的文库进行高通量测序。
步骤(1)中,提取总RNA的方法可以采用本领域的常规方法。
根据一些具体实施方式,对于全血样本,提取总RNA的方法为:
向1倍体积的新鲜全血中加入2~4倍体积的红细胞裂解液,轻轻涡旋或颠倒混匀,冰上孵育10~20分钟,其间轻轻涡旋混匀多次,离心收集白细胞,小心吸弃上清液;
向以上沉淀中加入1~3倍体积的红细胞裂解液,轻轻涡旋充分重悬白细胞,离心收集白细胞,小心并彻底吸去上清液,加入1×PBS重悬细胞,离心,小心并彻底吸去上清液,加入裂解液震荡混匀,充分裂解细胞;
向裂解的细胞中加入等体积的无水乙醇充分混匀,将液体加入RNA离心柱中,离心后弃滤液,向RNA离心柱中加入清洗液,离心后弃滤液;
将RNA离心柱放到干净的无RNA酶的离心管上,开盖晾干后,在RNA离心柱的膜中心滴加洗脱液,室温静置、离心,可得到全血的总RNA。
根据一些具体实施方式,对于组织样本,提取总RNA的方法为:
取1~25mg的组织小块置于离心管中,加入裂解液,用玻璃研磨器置于冰上研磨成匀浆液,离心,将上清转移至新的离心管中;
向裂解的细胞中加入等体积的无水乙醇充分混匀,将液体加入RNA离心柱中,离心后弃滤液,向RNA离心柱中加入清洗液,离心后弃滤液;
将RNA离心柱放到干净的无RNA酶的离心管上,开盖晾干后,在RNA离心柱的膜中心滴加洗脱液,室温静置,离心,可得到组织的总RNA,质检合格保存在-80℃备用。
根据一些具体实施方式,步骤(2)中,首先以所述总RNA为模板,利用第一引物合成第一链cDNA;然后利用第二引物、第三引物和第四引物对所述第一链cDNA进行扩增得到所述全长cDNA;其中,自5’端至3’端,所述第一引物的序列为TCGTTCATAGTTAATCTAGTTTCTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTVN,所述VN表示n个T,所述n为30~50之间的数;
所述第二引物的序列为TCGTTCATAGTTAATCTAGT;
所述第三引物的序列为CCGTCTGATATGGCCCTTTATG;
所述第四引物的序列为AAGCCCGTCTGATATGGCCCTTTATGTGGG。
进一步地,合成所述第一链cDNA的反应体系包括6.25μL的第一产物、2μL的逆转录反应缓冲液、0.5μL的二硫苏糖醇(DTT)、0.25μL的RNase抑制剂、0.5μL的第四引物以及0.5μL的逆转录酶。
进一步地,合成所述第一链cDNA的程序为:42℃ 90min,70℃ 15min,4℃恒温。
其中,所述第一产物通过如下方法获得:取总RNA样品5μL至PCR管中,加入1μL的样品缓冲液,轻弹管壁混匀,离心收集并于室温孵育5min;取上述RNA样品6μL,所述第一引物2μL,dNTP预混液1μL,经混匀后,在PCR仪器上运行热盖105℃,72℃条件下运行3分钟后立即置于冰上至少2分钟。
进一步地,通过PCR对第一链cDNA合成产物进行全长cDNA扩增的反应体系包括10μL的第一链cDNA、1μL的第三引物、1μL的第二引物以及12μL的2×PCR预混液。
进一步地,通过PCR对第一链cDNA合成产物进行全长cDNA扩增的程序为98℃1min;98℃10s,65℃15s,72℃6min,共11~18个循环;72℃5min;4℃恒温。
根据一些具体实施方式,所述建库方法还包括在步骤(2)之后、步骤(3)之前,对所述全长cDNA进行纯化的步骤。
根据一些具体实施方式,所述磁珠引物中的TCR引物和BCR引物分别通过生物素和链霉亲和素共价偶联至所述磁珠。
根据一些具体实施方式,所述TCR引物和所述BCR引物的5’端固定在所述磁珠上。
进一步地,所述磁珠为表面具有亲水基团的链霉亲和素磁珠,磁珠粒径为1μm~5μm。所述磁珠可以市购获得,例如购自苏州海狸生物医学工程有限公司的货号为22307、22305等的SA磁珠。
进一步地,磁珠引物可以通过如下步骤制备:
步骤一:配置缓冲液
10mM Tris-HCl (pH7.5),1mM EDTA,1M NaCl,0.01%-0.1%吐温-20;
步骤二:固定化核酸
将磁珠瓶置于漩涡振荡器上30s,振荡重悬磁珠,取100μL 磁珠到新的离心管中,置于300μL缓冲液中混匀后,室温孵育5min,置于磁力架上,1min后移除上清;
步骤三:磁珠洗涤
加入1mL 缓冲液到离心管中,盖上离心管盖,涡旋震荡磁珠15s,移去上清液,加入500μL的用缓冲液稀释的生物素化的TCR引物和BCR引物(使磁珠浓度为2mg/mL),充分振荡重悬磁珠,将离心管置于旋转混合仪上,室温旋转混合30min,置于磁力架上,1min后将上清液转移至新的离心管,用缓冲液洗涤磁珠三次;
步骤四:重悬磁珠
加入合适的低盐缓冲液,重悬磁珠配制终浓度为 10mg/mL(链霉亲和素为100μg/mL)磁珠引物,使用前存储在4-8℃中。
根据一些具体实施方式,步骤(3)中的所述PCR扩增还在第三引物的存在下进行,自5’端至3’端,所述第三引物的序列为CCGTCTGATATGGCCCTTTATG。
进一步地,步骤(3)中,所述PCR扩增的反应体系包括XμL的含所述全长cDNA的液体,25μL的高保真酶预混液,2μL的所述第三引物以及(23-X)μL的所述磁珠引物,其中,所述X由含所述全长cDNA的液体中所述全长cDNA的浓度决定,控制所述全长cDNA在所述反应体系中的质量为10~45ng,所述含所述全长cDNA的液体的浓度≥5ng/μL。
其中,含所述全长cDNA的液体为步骤(2)制备得到的反应体系经纯化后得到的含全长cDNA的扩增产物。
进一步地,步骤(3)中,所述PCR扩增的程序为94℃1min;94℃30s,63℃30s,72℃1min,共15~25个循环;72℃5min;4℃恒温。
根据一些具体实施方式,所述BCR洗脱液包括pH7.5~8.5的第一缓冲液,以及占所述第一缓冲液总质量90~100%的甲酰胺;所述第一缓冲液包括5~15mM的Tris-HCl 以及3~8mM的 EDTA。
根据一些具体实施方式,所述TCR洗脱液的pH为8.5~9.5,其包括pH8~9的第二缓冲液,以及25~35mM的醋酸钠;所述第二缓冲液包括10~20mM的Tris-HCl 以及3~8mM的 EDTA。
根据一些具体实施方式,步骤(4)的具体方法为:首先向步骤(3)反应完成后的体系中加入所述TCR洗脱液,经涡旋振荡、孵育、离心,在磁力架中使磁珠和所述TCR扩增产物分离,收集所述TCR扩增产物;然后使所述磁珠干燥至无液体残留;再加入所述BCR洗脱液,经涡旋振荡、孵育、离心,在磁力架中使磁珠和所述BCR扩增产物分离,收集所述BCR扩增产物。
根据一些具体实施方式,步骤(5)中,混合建库时接头连接的反应体系包括65μL的第二产物、25μL的快速连接缓冲液、5μL的快速DNA连接酶以及5μL的DNA接头;将所述接头连接的反应体系混匀离心后,在PCR仪中,20℃运行15分钟后降至4℃。其中,所述第二产物通过如下方法获得:将所述TCR扩增产物和所述BCR扩增产物各取20μL混合,加入15μL末端修复试剂、10ul无核酸酶水,经混匀离心将反应液收集至管底,将PCR管置于PCR仪中,20℃运行15分钟,65℃运行15分钟后降至4℃。
进一步地,所述接头连接的反应体系反应完成后,将20μL的反应产物、5μL的PCR混合引物以及25μL的PCR扩增预混液,混合均匀后,按照如下程序进行扩增:95℃3min;98℃20s,60℃15s,72℃30s,共3~10个循环;72℃5min;4℃恒温。
进一步地,所述混合建库的步骤还包括对接头连接的反应体系反应完成后的产物的纯化步骤。
根据一些具体实施方式,所述建库方法还包括步骤(5)之后、步骤(6)之前,对步骤(5)扩增后的文库进行纯化的步骤。
本发明第二方面提供一种检测T细胞和B细胞免疫组库的引物,所述引物包括TCR引物、BCR引物、第一引物、第二引物、第三引物和第四引物,自5’端至3’端,所述TCR引物的序列:ACTCTAAATCCAGTGAC和AAAACGTGTTCCCACCCAAG,
所述BCR引物的序列为CCTGGTCCAGGGCTTCTTCC、CAAAGGATAACAGCCCT、GGCCACGGGCTACTTCCC、CCGGTGACGGTGTCGTGGAACTCA、GTGAGAATTCCCCGTCG、TGTGCCTGCTGAATAAC和CTCATAAGTGACTTCTA,
所述第一引物的序列为TCGTTCATAGTTAATCTAGTTTCTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTVN,所述VN表示n个T,所述n为30~50之间的数,
所述第二引物的序列为TCGTTCATAGTTAATCTAGT,
所述第三引物的序列为CCGTCTGATATGGCCCTTTATG,
所述第四引物的序列为AAGCCCGTCTGATATGGCCCTTTATGTGGG。
本发明第三方面提供一种检测T细胞和B细胞免疫组库的试剂盒,所述试剂盒包括第一引物、第二引物、第三引物、第四引物以及磁珠引物;所述磁珠引物为偶联有TCR引物和BCR引物的磁珠;自5’端至3’端,所述TCR引物的序列:ACTCTAAATCCAGTGAC和AAAACGTGTTCCCACCCAAG,
所述BCR引物的序列为CCTGGTCCAGGGCTTCTTCC、CAAAGGATAACAGCCCT、GGCCACGGGCTACTTCCC、CCGGTGACGGTGTCGTGGAACTCA、GTGAGAATTCCCCGTCG、TGTGCCTGCTGAATAAC和CTCATAAGTGACTTCTA,
所述第一引物的序列为TCGTTCATAGTTAATCTAGTTTCTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTVN,所述VN表示n个T,所述n为30~50之间的数,
所述第二引物的序列为TCGTTCATAGTTAATCTAGT,
所述第三引物的序列为CCGTCTGATATGGCCCTTTATG,
所述第四引物的序列为AAGCCCGTCTGATATGGCCCTTTATGTGGG。
进一步地,所述试剂盒还包括上述建库方法中用到的商业化试剂,通过将该些商业化试剂与第一引物、第二引物、第三引物、第四引物以及磁珠引物组装成试剂盒,能够便于下游客户使用。
由于上述技术方案运用,本发明与现有技术相比具有下列优点:
本发明通过对TCR引物和BCR引物的设计,并将TCR引物和BCR引物固定在磁珠上来进行PCR扩增,然后通过TCR洗脱液和BCR洗脱液来回收TCR扩增产物和BCR扩增产物,在提高扩增效率的同时,还能够减少非目的片段的产生。本发明的建库方法能够采用国内现有的商品化试剂,具有试剂成本低的优势。此外,本发明的建库方法还具有人工成本低,工作效率高的优势。
附图说明
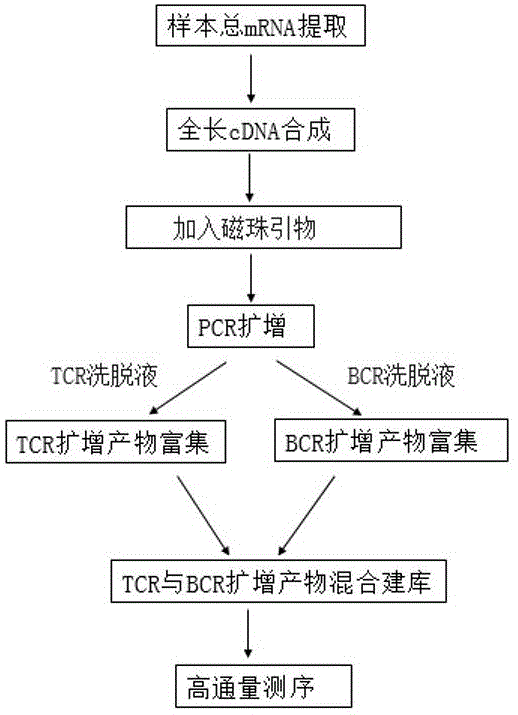
图1为T细胞和B细胞免疫组库的建库流程示意图;
图2为磁珠引物的示意图;
图3为全长cDNA的合成示意图;
图4为基于MGI测序平台构建TCR和BCR扩增产物混合建库流程图;
图5为实施例和对比例的TCR扩增效率对比结果图,其中A为对比例的TCR扩增结果图,B为实施例的TCR的扩增结果图;
图6为实施例和对比例的BCR扩增效率对比结果图,其中A为对比例的BCR扩增结果图,B为实施例的BCR的扩增结果图;
图7为NGS测序原始序列结果图。
具体实施方式
针对现有技术存在的问题,本发明公开了一种基于磁珠引物高效检测血液或组织样本T细胞和B细胞免疫组库的建库方法,通过在一个磁珠上同时固定有TCR、BCR特异性引物,将一定比例的带有引物的磁珠投入到全长cDNA中进行PCR扩增,可同时扩增TCR和BCR目的片段,然后在TCR洗脱液与BCR洗脱液作用下可分别高效地富集TCR扩增产物和BCR扩增产物。同时,本发明还对TCR、BCR特异性引物进行了优化设计,使得PCR扩增后的非目的片段显著降低。
如图1所示,对同一份样本同时构建T细胞和B细胞免疫组库混合文库测序,其技术方案包括以下步骤:步骤一:总RNA提取:血液提取采用新鲜的全血提取总RNA,全血的要求量为2~5ml,对于组织RNA提取,要求新鲜的组织小块1~25mg,优选10~25mg;步骤二:RNA反转录成全长cDNA:首先以总RNA为模板进行第一链cDNA合成,通过PCR对第一链cDNA合成产物进行全长cDNA扩增;步骤三:PCR扩增:将磁珠引物投入到全长cDNA中进行PCR扩增,然后使用TCR和BCR洗脱液分别洗脱TCR与BCR扩增产物;步骤四:TCR与BCR扩增产物混合建库:针对同一份血样或组织样本的TCR与BCR扩增产物各取20ul混合,对其5’端进行磷酸化和3’端加dA尾,再加入相应的DNA接头,磁珠纯化后,文库扩增,质控合格后进行高通量测序,可精确分析它们的克隆的多样性、CDR3核酸长度分布等数据信息,为后续临床诊断、健康筛查提供参考依据。
本发明的建库方法,可以采用国内现有的商品化试剂,从而大大降低试剂成本。此外本发明的建库方法的扩增效率高,非目的片段少,从而可以大大降低人工成本,提高工作效率。
下面结合实施例对本发明作进一步描述。但本发明并不限于以下实施例。实施例中采用的实施条件可以根据具体使用的不同要求做进一步调整,未注明的实施条件为本行业中的常规条件。本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
实施例
所用到的试剂:
红细胞裂解液,购自江苏康为世纪生物科技股份有限公司,货号CW0613S;
裂解液(Lysis Buffer)、洗脱液(Elution Buffer)、清洗液(Wash Buffer)三个组分均购自上海奕衫生物有限公司的RNA快速提取试剂盒,货号RN001;
第一引物的序列为TCGTTCATAGTTAATCTAGTTTCTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTVN(SEQ ID NO.1),所述VN表示n个T,所述n为35;
本发明使用5‘RACE技术对mRNA进行反转录。反转录完成后进行后续磁珠标记和纯化工作。本发明可以使用任一商品化5‘RACE技术试剂盒进行反转录操作。以来自宝生物工程(大连)有限公司的反转录试剂盒(货号634858)为例,使用该试剂盒组分如下:
1)逆转录酶,AMV Reverse Transcriptase,
2)样品缓冲液,5× First-Strand Buffer;
RNase抑制剂,上海碧云天生物技术有限公司,货号R0102-10kU;
dNTP预混液,天根生化科技(北京)有限公司,货号4992932;
逆转录反应缓冲液,翌圣生物科技(上海)股份有限公司,货号15662-A;
2×PCR预混液,海碧云天生物技术有限公司,货号D7228;
第二引物的序列为TCGTTCATAGTTAATCTAGT(SEQ ID NO.2);
第三引物的序列为CCGTCTGATATGGCCCTTTATG(SEQ ID NO.3);
第四引物的序列为AAGCCCGTCTGATATGGCCCTTTATGTGGG(SEQ ID NO.4);
DNA纯化磁珠,购自诺唯赞生物科技股份有限公司牌号N411-02;
高保真酶预混液,购自翌圣生物科技(上海)股份有限公司的货号H0225971的2×Hieff PCR Master Mix;
磁珠引物:由赛默飞世尔科技公司将TCR引物和BCR引物偶联至磁珠上,磁珠选用直径2.0微米的采用定向固定技术将重组中性链霉亲和素共价偶联到形态规整、粒径均匀的磁性微球上,形成单分子固定层,将生物素化的TCR引物和BCR引物偶联至链霉亲和素上。用于磁珠表面的亲水基团不会影响酶促反应的进行,在PCR反应体系中混入该链霉亲和素磁珠也不会对核酸扩增产生明显影响。TCR引物的序列:ACTCTAAATCCAGTGAC(SEQ ID NO.5)和AAAACGTGTTCCCACCCAAG(SEQ ID NO.6),BCR引物的序列为CCTGGTCCAGGGCTTCTTCC(SEQID NO.7)、CAAAGGATAACAGCCCT(SEQ ID NO.8)、GGCCACGGGCTACTTCCC(SEQ ID NO.9)、CCGGTGACGGTGTCGTGGAACTCA(SEQ ID NO.10)、GTGAGAATTCCCCGTCG(SEQ ID NO.11)、TGTGCCTGCTGAATAAC(SEQ ID NO.12)和CTCATAAGTGACTTCTA(SEQ ID NO.13);
以下6个试剂组分均来自诺唯赞生物科技股份有限公司的建库试剂盒,货号NDM607-02:
1)末端修复试剂 End Prep Mix4,
2)快速连接缓冲液Rapid Ligation buffer 2,
3)快速DNA连接酶Rapid DNA ligase,
4)DNA接头 DNA Adapter X,
5)PCR混合引物PCR Primer Mix for MGl,
6)PCR扩增预混液 HiFi Amplification Mix;
该些试剂可组装成试剂盒。
该实施例提供一种T细胞和B细胞免疫组库建库方法,包括以下步骤:
步骤一:血液总RNA提取方法:
取3mL新鲜全血,向其中加入9mL的红细胞裂解液,颠倒混匀,冰上孵育15分钟,其间轻轻涡旋混匀两次,4℃、450×g离心10分钟收集白细胞,小心吸弃上清液;
向以上沉淀中加入6mL红细胞裂解液,轻轻涡旋充分重悬白细胞,4℃、450×g离心10分钟收集白细胞,小心并彻底吸去上清液,加入1mL 1×PBS重悬细胞,4℃、450×g离心10分钟,小心并彻底吸去上清液,加入500 μL的裂解液震荡混匀,充分裂解细胞;
向裂解的细胞中加入500μL的无水乙醇充分混匀,将液体加入RNA离心柱中,12000×g,离心1分钟后弃滤液,向RNA离心柱中加入500μL的清洗液,12000×g,离心1分钟后弃滤液;
将RNA离心柱放到干净的无RNA酶的1.5mL离心管上,开盖晾干2分钟后,在RNA离心柱的膜中心滴加50μL的洗脱液,室温静置2分钟,12000×g,离心2分钟,可得到全血的总RNA,质检合格保存在-80℃备用,其中最终提取的浓度大于8ng/μL,OD260/280比值在1.80~2.2判断总RNA提取合格。
步骤二:RNA反转录成全长cDNA:
以总RNA为模板进行第一链cDNA合成,取总RNA样品5μL至0.2 mL的无RNA酶 PCR管中,加入1μL的样品缓冲液,轻弹管壁混匀短暂离心收集并于室温孵育5min;
配置如下反应体系,取上述RNA样品6μL,第一引物2μL,dNTP预混液1μL,使用移液器轻轻混匀,在PCR仪器上运行热盖105℃,72℃条件下运行3分钟后立即置于冰上至少2分钟,按以下表1的比例配制反应体系:
将上述反应体系使用移液器轻轻混匀,置于PCR仪器中运行以下表2的程序:
完成上述反应后,将通过PCR对第一链cDNA合成产物进行全长cDNA扩增,按以下表3的试剂配制反应体系:
将上述反应体系使用移液器轻轻混匀,置于PCR仪器中运行以下表4的程序:
完成上述反应后,向反应体系中添加26μL无核酸酶水,补至50μL总体系,加入50 μL DNA纯化磁珠到上述cDNA扩增反应体系中,振荡器混匀后室温孵育8 min,使cDNA结合到磁珠上,将反应管短暂离心并置于磁力架上分离磁珠和液体,保持PCR管始终处在磁力架上,待溶液澄清后,保持PCR管始终处在磁力架上,加入200μL新鲜配制的80%乙醇,室温孵育30秒,小心移除上清,再加入200μL新鲜配制的80%乙醇,室温孵育30秒,小心移除上清后开盖室温干燥3至5分钟;
磁珠晾干后,将PCR管从磁力架上取下,加入17μL无核酸酶水覆盖磁珠,使用移液器吹打混匀磁珠,室温孵育2min后,将PCR管短暂离心后置于磁力架中,分离磁珠和液体直到溶液澄清后吸取15μL上清转移到新的低吸附EP管中,cDNA扩增产物质检合格,如图4所示,保存在-20℃备用。其中,cDNA扩增产物质检的方法为:取1μL纯化后的全长cDNA扩增产物进行Qubit定量,浓度大于5ng/μL,取15ng的PCR扩增产物使用Qsep1检测cDNA片段范围在100bp~5000bp且在2000bp左右有明显峰值。
步骤三:磁珠引物准备与PCR扩增:
使用前将磁珠引物震荡混匀并置于室温至少30min,按以下表5的试剂配制反应体系:
将上述反应体系使用移液器轻轻混匀,置于PCR仪器中运行以下表6的程序:
完成上述反应后,加入25μL TCR洗脱液,涡旋振荡,室温孵育5min,PCR管短暂离心并置于磁力架中分离磁珠和TCR产物,收集25μL TCR产物,TCR质检合格,如图5中B所示;保持PCR管始终置于磁力架中,开盖空气干燥磁珠2min至无液体残留,加入25μL BCR洗脱液,涡旋振荡,室温孵育5min,PCR管短暂离心并置于磁力架中分离磁珠和BCR产物,收集25μLBCR产物,BCR质检合格,如图6中B所示。其中,PCR扩增纯化后的取1ul产物进行Qubit定量,浓度大于10ng/μL,取15ng的PCR扩增产物使用Qsep1检测BCR和TCR扩增片段的主峰范围在500bp~650bp。
步骤四:TCR与BCR扩增产物混合建库:
首先对DNA末端补平,并在5’端进行磷酸化和3’端加dA尾,取TCR与BCR扩增产物各取20μL,末端修复试剂投入15μL,无核酸酶水投入10μL,使用移液器轻轻吹打混匀,并短暂离心将反应液收集至管底,将PCR管置于PCR仪中,20℃运行15分钟,65℃运行15分钟后降至4℃,制得第二产物,按以下表7的比例配制接头连接反应体系:
使用移液器轻轻吹打混匀,并短暂离心将反应液收集至管底,将PCR管置于PCR仪中,20℃运行15分钟后降至4℃,完成反应后吸取60μL DNA纯化磁珠至100μL 上述产物中,涡旋振荡,室温孵育5min,将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后移除上清,加入200 μL新鲜配制的80%乙醇漂洗磁珠后移除上清,再重复漂洗一次;
保持PCR管始终置于磁力架中,开盖空气干燥磁珠3min至无乙醇残留,将PCR管从磁力架中取出,加入22μL 无核酸酶水覆盖磁珠,使用移液器吹打混匀磁珠,室温孵育2min后将PCR管短暂离心收集后置于磁力架中,分离磁珠和液体直到溶液澄清后吸取20μL纯化后产物,PCR混合引物投入5μL,PCR扩增预混液投入 25μL,使用移液器轻轻吹打混匀后,置于PCR仪器中运行以下表8的程序:
完成反应后吸取45μL DNA纯化磁珠至50μL上述产物中,涡旋振荡,室温孵育5min,将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后移除上清,加入200μL新鲜配制的80%乙醇漂洗磁珠后移除上清,再重复漂洗一次;
保持PCR管始终置于磁力架中,开盖空气干燥磁珠2min至无乙醇残留,将PCR管从磁力架中取出,加入22μL 无核酸酶水覆盖磁珠,使用移液器吹打混匀磁珠,室温孵育2min后将PCR管短暂离心收集后置于磁力架中,分离磁珠和液体直到溶液澄清后吸取20μL纯化后产物,文库质量控制合格,NGS测序。
测序平台采用华大T7测序平台,采用PE150测序方案,NGS测序原始序列结果参见图7,测序的独段的准确性Q30大于85%,无需拼接即可实现对TCR序列和BCR序列的直接读取,可精确分析它们的克隆的多样性、CDR3核酸长度分布等数据信息,为后续临床诊断、健康筛查提供参考依据。
对比例
对比例与实施例基本相同,不同之处仅在于第三引物以及磁珠引物中的TCR引物和BCR引物不同。
对比例中的第三引物的序列为AGTGGTATCAACGCAGAGTACG(SEQ ID NO.14);
TCR引物的序列为CGGCAGGGTCAGGGTTCTGG(SEQ ID NO.15)和TGGACGTGTTCCCACAGCCT(SEQ ID NO.16);
BCR引物的序列为AGGATGTGACTGTGCCCTG(SEQ ID NO.17)、TACAAATGCGTGGTCCAGCA(SEQ ID NO.18)、AGACTGGGTCGACAACAAAACC(SEQ ID NO.19)、CCGGTGACGGTGTCGTGGAACTCA(SEQ ID NO.20)、GTGAGAATTCCCCGTCG(SEQ ID NO.21)、GACCTTGGGGCTGGTCGGGGAT(SEQ IDNO.22)、ACACATCCGGAGCCTTGGTGGGT(SEQ ID NO.23)、AGACGGATGGGCTCTGTGTGGA(SEQ IDNO.24)和AGGGTTGGGGCGGATGCACTCC(SEQ ID NO.25)。
对比例经步骤三收集到的TCR扩增产物的检测结果如图5中A所示,BCR扩增产物的检测结果如图6中A所示。通过对比图5中A和图5中B可见,实施例的非目的片段明显低于对比例。通过对比图6中A和图6中B可见,实施例的非目的片段也明显低于对比例。
因此,采用本申请特定的引物以及采用磁珠引物的方法进行PCR扩增,不仅可以提高扩增效率,提高工作效率,节约人工成本,而且降低非目的片段的含量。并且,本申请的建库方法可以采用国内现有的商品化试剂,从而降低试剂成本。
以上对本发明做了详尽的描述,其目的在于让熟悉此领域技术的人士能够了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,凡根据本发明的精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围内。
- 多重引物组及利用该引物组基于高通量测序构建人类B细胞免疫组库的方法
- 多重引物组及利用该引物组基于高通量测序构建人类T细胞免疫组库的方法
- 一种基于高通量测序检测小鼠DNA TCR beta链免疫组库的方法及其专用引物组
- 一种基于高通量测序检测人DNA TCR beta链免疫组库的方法及其专用引物组
- 一种基于高通量测序检测人RNA TCR免疫组库的方法及其专用引物组
- 一种应用于高通量测序同时检测T细胞和B细胞免疫组库的引物组合及试剂盒
- 一种应用于高通量测序同时检测T细胞和B细胞免疫组库的引物组合及试剂盒
