一种锚定多肽与光脱羧酶融合蛋白及其制备方法与应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及一种,特别涉及一种锚定多肽与光脱羧酶融合蛋白及其制备方法与应用。
背景技术
多年来因经济发展需要,化石燃料的消耗持续增长。此外,对化石燃料的依赖也带来的一系列不良影响。目前,水能、风能和太阳能得到良好开发,但其受制于地域和气候因素;生物能源具有能够储存和运输的优势,可以作为良好的补充,其制备有赖于生物制造技术和行业的发展。
生物制造通常是在温和条件下,通过细胞或酶作为催化手段,利用可再生的原材料生产包括生物燃料在内的产品。因此生物制造有助于减少对化石资源的依赖,同时减少工业化学污染。虽然目前生物燃料的生产成本仍高于石油精炼,但前者作为一种环保可持续的生产模式,在将来有着不可替代的作用。
早期的生物燃料研究方向,主要包括发酵制取小分子醇类,或将脂肪酸甲酯化、乙酯化成为生物柴油。但以上产品存在燃烧热值低、酯类水解等问题,以致推广应用受到限制。另一种替代的方案是通过生物酶法制备烃类。现已被发现的能够将脂肪酸脱羧化得到末端烯烃的酶,主要有P450细胞色素中的OleT酶和非血红素脱羧酶UndA/B,但以上需要辅因子(NADPH、H
发明内容
本发明的目的在于克服现有技术的缺点与不足,提供一种锚定多肽与光脱羧酶融合蛋白。
本发明的另一目的在于,提供上述融合蛋白的制备方法。
本发明的再一目的在于,提供上述融合蛋白的固定化应用。
本发明的目的通过下述技术方案实现:
一种锚定多肽与光脱羧酶融合蛋白,是将膜蛋白McFAP游离氨基端的类囊体定位多肽替换成来源于枯草芽孢杆菌的锚定多肽LCI得到的。
所述的融合蛋白,其氨基酸序列如SEQ ID NO.2所示。
所述的融合蛋白,其编码基因的核苷酸序列如SEQ ID NO.1所示。
所述的融合蛋白,能够催化脂肪酸脱羧基。
所述的融合蛋白,制备方法包括如下步骤:
以pET28a为出发载体,合成SED ID NO.1所示的核苷酸序列并将其整合到质粒上,将质粒转入大肠杆菌,加入IPTG诱导培养后表达,得到的菌体破碎离心即得到含融合蛋白的细胞裂解液,进一步纯化即得到融合蛋白。
一种PVDF-TiO
(1)用钛酸异丙酯-硝酸-乙醇制备溶胶-凝胶溶液,把PVDF膜浸入并提拉,随后水浴水解,得到氧化钛附着的膜;
(2)把氧化钛附着的膜浸入硅酸四乙酯-乙醇溶液,室温下原位生长氧化硅,得到氧化硅附着的膜;
(3)用4-氯苯磺酸在二氯甲烷溶液中修饰氧化硅附着的膜材料2h,取出洗涤,烘干,得到PVDF-TiO
一种固定化酶,是将上述融合蛋白固定到固定载体上得到。
所述的固定载体为表面具有良好亲水性、具有大表面积的膜材料;以耐受溶剂和光照的PVDF膜为基底开展修饰实验;进一步优选为PVDF-TiO
所述的固定化酶的制备方法包括如下步骤:
将酶液加入固定载体中,避光条件下固定化,得到固定化酶材料。
所述的固定化的条件为3~8℃,1~24h。
所述的融合蛋白或固定化酶在催化脂肪酸脱羧中的应用。
所述的融合蛋白或固定化酶在催化脂肪酸制备烃类中的应用。
所述的脂肪酸为中链或长链脂肪酸;优选为辛酸或软脂酸中的至少一种。
所述的催化的条件为蓝光条件下催化。
本发明相对于现有技术具有如下的优点及效果:
(1)本课题组在之前工作中挖掘了一种来源于Micractinium conductrix的光脱羧酶McFAP,将其成功表达并纯化制备,实验表明其对碳原子数为6~18的直链饱和脂肪酸均具有良好的脱羧效果。可是McFAP对外界环境的耐受性较弱,在纯化和固定化过程中容易失活,不利于应用。因此,为扩大生物燃料的制备规模,需要对McFAP进行适当的工程化改造和固定化技术改进,实现对酶的充分利用。
(2)本发明将膜蛋白McFAP游离氨基端的类囊体定位多肽,替换成来源于枯草芽孢杆菌的锚定多肽LCI,以改变FAP的靶向组装能力,随后在大肠杆菌中异源表达和纯化得到LCI-McFAP融合蛋白;作为比较,在McFAP的游离羧基端插入LCI序列表达纯化得到McFAP-LCI。对比两种融合蛋白和原蛋白McFAP之间的基本酶学性质,可知LCI-McFAP与McFAP酶活力无显著变化,McFAP-LCI活性下降,证实替换McFAP游离氨基端序列的可行性。随后,根据LCI的结构特点,设计、合成固定化用的膜材料。实验证明,即使在粗酶液中,LCI-McFAP仍然可以在无人工干预情况下,被诱导和牢固结合到膜材料表面,实验证实即使经受连续机械搅拌和有机溶剂的反复萃取,仍然能够重复催化利用,因此该技术有效简化了酶蛋白的分离和固定流程,而且有效增强了酶对外界环境变化的耐受能力。最后将固定化酶应用于光反应器试验,实现了催化反应规模的放大。
(3)将McFAP与LCI组合为融合蛋白,对其基本酶学性质进行了探究。设计、合成与之相匹配的固定化膜材料,使得通过诱导LCI的方式,无需预先纯化蛋白的情况下,即可牵引McFAP组装固定到膜表面,实现了酶的分离和固定,达到循环利用的目的。
(4)在基因合成获得McFAP的基础上,将McFAP基因5’端的类囊体膜定位序列替换为源于枯草芽孢杆菌的锚定多肽LCI序列,得到LCI-McFAP;另外,在McFAP的3’端插入LCI序列,得到McFAP-LCI与前面的融合蛋白作对比。以大肠杆菌BL21(DE3)为宿主表达两种融合蛋白,分析了蛋白的基本酶学性质,选出催化能力最佳的一种。分析LCI多肽构型和表面氨基酸残基,合成表面携带负电荷、大比表面积膜材料,无需预先纯化蛋白的情况下,将酶蛋白诱导并牢固结合到材料。随后考察了固定化酶对不同链长脂肪酸的催化偏好性,和最适底物(长链和中链脂肪酸各一种)为实验条件测试催化利用次数,最后利用连续流动光反应装置成功实现了放大催化。
附图说明
图1是融合蛋白表达和富集的SDS-PAGE分析。(a)LCI-McFAP;(b)McFAP-LCI。泳道1:粗细胞提取物;2:离心后的上清细胞裂解液;3:离心后的沉淀物;4:纯化后的(LCI-)McFAP(-LCI);5:纯化后的McFAP;6:使用镍亲和柱纯化的穿过液。
图2是功能化膜的表征。(a-d)膜的扫描电镜SEM图像,(a)PVDF;(b)PVDF表面覆盖氧化钛涂层;(c)诱导SiO
图3是固定化过程中溶液总游离蛋白的变化情况,(a)PVDF、(b)PVDF-TiO
图4是固定化后的激光共聚焦显微镜图像:(a)用不含酶的大肠杆菌提取物浸泡PVDF-TiO
图5是不同固定化材料吸附蛋白后的催化效果。
图6是LCI-McFAP固定化酶对不同脂肪酸的催化比较。
图7是LCI-McFAP固定化酶用于连续多次的催化反应。
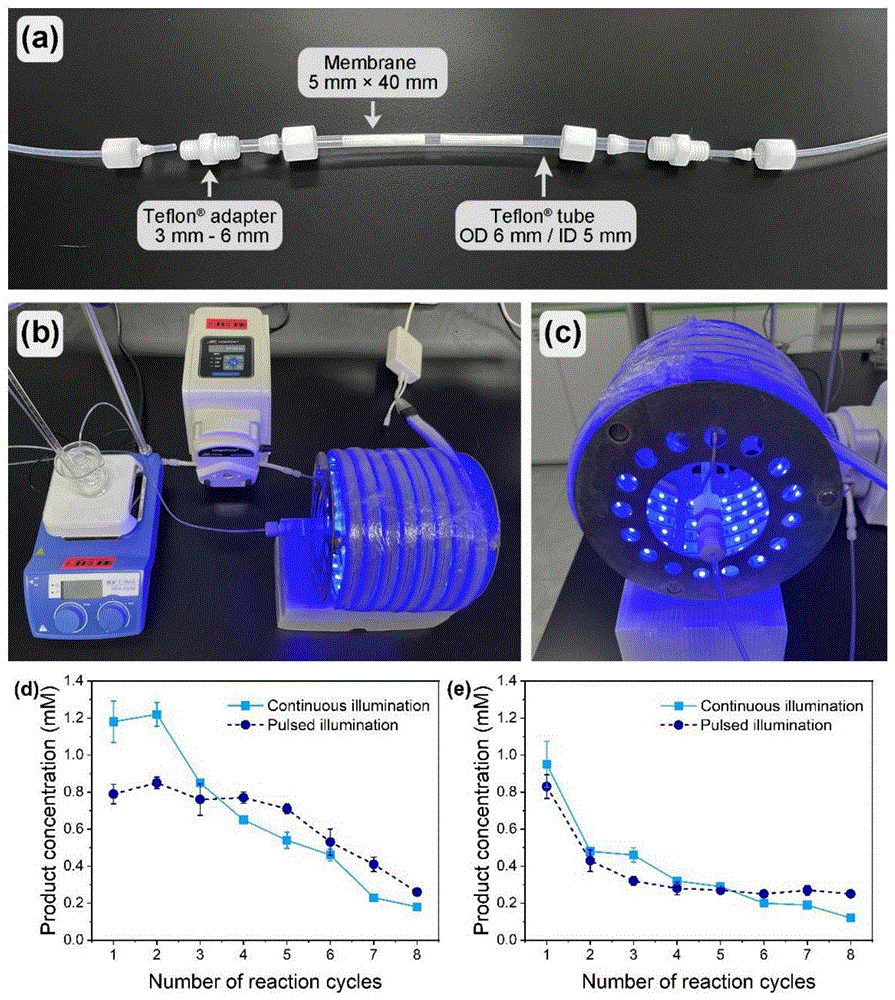
图8是LCI-McFAP固定化酶应用于连续流动光催化装置。(a-c)分别为光反应器装填固定化酶的部分、反应设备的正视图和反应器的侧视图;(d-e)分别以辛酸和软脂酸作为底物,在连续8次的催化中产物浓度变化趋势(实线表示连续光源;虚线表示以50ms为间隔的开/关脉冲光源)。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下面实施方案中若未注明具体试验条件,则通常按照常规试验条件或按照试剂公司所建议的试验条件。所使用的材料、试剂等,若无特殊说明,均为从商业途径得到的试剂和材料。
材料与试剂:质粒pET28a-LCI-McFAP、pET28a-McFAP-S和pET28a-McFAP-LCI由生工生物工程(上海)股份有限公司合成;空载质粒pET28a为商业公司购买得到的载体;大肠杆菌BL21(DE3)感受态细胞,唯地生物科技有限公司;质粒提取试剂盒,生工生物工程(上海)股份有限公司;所有的化学药品均购自Sigma-Aldrich、麦克林或阿拉丁试剂公司,其纯度最高,无需进一步提纯。
实施例1目的蛋白的表达
将膜蛋白McFAP游离氨基端的类囊体定位多肽,替换成来源于枯草芽孢杆菌的锚定多肽LCI,得到LCI-McFAP核苷酸序列(SEQ ID NO.1)。并参照CN114854726A中的方法,以pET28a为出发载体,将LCI-McFAP的核苷酸序列整合到质粒上,得到质粒pET28a-LCI-McFAP,并转入E.coli BL21(DE3)菌株中,得到含质粒pET28a-LCI-McFAP的重组E.coliBL21(DE3)菌株。
将含质粒pET28a-LCI-McFAP的重组E.coli BL21(DE3)菌株于37℃下在含50μg/mL卡那霉素的溶菌肉汤(Luria-Bertani,LB)中培养,当OD600达到0.7-0.8时,加入0.5mM异丙基β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG),并将细胞在18℃下孵育20h。在4℃下,6000g下离心30min收菌,去除培养基得到菌体。
用buffer A缓冲液(Tris-HCl 50mM,pH 7.5,300mM NaCl、10mM咪唑和5%v/v甘油)洗涤,再次离心(11000g,10min,4℃);将湿菌体按1:10(w/v)悬浮于同一缓冲液中,超声破碎和离心(11000g、30min),得到细胞裂解液A,待用。
作为比较,参照上述方法,制备删除类囊体定位多肽的McFAP-S和在McFAP的游离羧基端插入LCI序列得到的McFAP-LCI(SEQ ID NO.3)对应的质粒和重组菌,并进一步得到对应的细胞裂解液A。
McFAP-S和McFAP的核苷酸序列和氨基酸序列可参照发明专利CN114854726A。
实施例2目的蛋白的纯化
纯化LCI-McFAP、McFAP-LCI和McFAP-S纯化所用仪器、层析柱为:GE AKTA
电泳结果如图1所示,两种融合蛋白均能得到表达和富集(红线下标),分子量大于被截短的McFAP-S(蓝线下标)。
实施例3脂肪酸及烷烃的检测方法
脱羧反应前后脂肪酸及烷烃的含量由安捷伦8860气相色谱系统(AgilentTechnologies,Palo Alto,CA,USA)进行检测,色谱分析柱为KB-FFAP(30m×0.25mm,0.25μm),具体色谱分析方法为:进样体积:1μL;进样器温度:250℃;分流比:30:1;检测器温度:280℃;升温程序为:初始温度为110℃,保持3.4min,随后以25℃/min的速率升至190℃,保持2.1min,然后再次以25℃/min的速率升至230℃,保持2min,最后以30℃/min的速率升至250℃,保持12min。各脂肪酸、烷烃标准品和内标正辛醇确定色谱峰保留时间,作定量曲线。
实施例4酶活力测试
酶活定义:30℃、500rpm、蓝光(10W,220V,光合光量子流密度为791.2μmol/s/m
将120μL 170mM辛酸DMSO溶液、30mL DMSO和适量体积的Tris-HCl缓冲液(100mM,pH 8.5)加入到4mL透明反应小瓶,然后加入实施例2中纯化后的纯酶液,使酶含量为12μM,总反应体积为1mL。将反应小瓶置于自制的光催化反应装置中,在500rpm,30℃,蓝光(10W,220V)照射下反应30min。反应结束后,取反应混合物于2mL EP管中,加入含有1mL 5mM正辛醇内标的乙酸乙酯溶液进行萃取,混合液体在11000g下离心3min,取上层有机相,进行气相色谱分析。
实验结果如表1所示,目标蛋白表达量以及酶活比较,LCI-McFAP和McFAP-S的比酶活无明显差异,而McFAP-LCI的酶活下降,因此选择LCI-McFAP用于进一步实验。
表1目的蛋白的纯化富集和酶活力比较
实施例5固定化膜材料的合成
(1)用钛酸异丙酯-硝酸-乙醇按体积比3:1:6制备溶胶-凝胶溶液,把PVDF膜浸入并提拉,随后在80℃水浴中水解12h,得到氧化钛附着的膜,将部分样本50℃烘干得到PVDF-TiO
(2)然后把氧化钛附着的膜浸入硅酸四乙酯-乙醇(4.5%,v/v)溶液,磁转子搅拌(500rpm),室温下原位生长氧化硅3h,得到氧化硅附着的膜,称量膜增加的质量,并将部分样本50℃烘干得到PVDF-TiO
(3)最后用4-氯苯磺酸(3倍于氧化硅的质量)在二氯甲烷溶液中修饰氧化硅附着的膜材料2h,取出分别用无水乙醇和去离子水洗涤,50℃烘干备用,得到PVDF-TiO
使用SEM检测制备得到的PVDF膜表面,结果如图2所示,从a-d可以看出PVDF膜在修饰过程中的表面微观变化;e是PVDF-TiO
实施例6酶蛋白的固定化
(1)将实施例1中收菌得到的细胞用buffer C(Tris-HCl 50mM,pH 7.5,含有100mMNaCl和5%w/v甘油)以1:20(w/v)的比例重悬、破碎,离心(11000g,30min)收集上清液。用滤膜(孔径0.22μm)过滤得到粗酶液C溶液,在4℃下储存。LCI-McFAP粗酶液C的总蛋白浓度为4.4mg/mL,0.39U;McFAP粗酶液C为4.2mg/mL,0.50U。
(2)将含有LCI-McFAP和McFAP的粗酶液C(1.5mL)分别加入实施例5制备的PVDF、PVDF-TiO
(3)将膜材料(1cm
实施例7固定化酶的催化实验
(1)不同固定化酶之间的催化能力比较
往4mL透明烧瓶中加入含有10mM辛酸和15%(v/v)DMSO的缓冲溶液(100mM Tris-HCl,pH 8.5),总体积为1mL,随后加入面积为1cm
(2)以催化能力最佳的一组固定化酶,测试其底物谱
往4mL透明烧瓶中加入含有20mM中链脂肪酸或长链脂肪酸底物和DMSO(中链脂肪酸C6:0~C9:0为底物时,DMSO含量为15%v/v;长链脂肪酸C12:0~C18:1为底物时,DMSO含量为25%v/v)的缓冲溶液(100mM Tris-HCl,pH 8.5),总体积为1mL,随后加入面积为1cm
(3)根据底物谱选取合适的中链和长链脂肪酸,在相同反应条件下进行催化循环测试
参照步骤(2)的方法,将底物替换为辛酸或软脂酸,使用以LCI-McFAP和PVDF-TiO
(4)固定化酶在连续流动光催化的应用
将总面积为8cm
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种利用蛋白酶制备脱脂豆粕贮铁多肽的方法和应用
- 一种具有减肥活性的藜麦蛋白多肽水解产物的制备方法
- 一种蛋白多肽类药物双重微球及其制备方法和胰岛素双重微球
- 一种蛋白酶及其制备低镉大米多肽的方法
- 一种齐考诺肽和TAT肽的融合多肽在制备药物中的应用
- 一种类弹性蛋白多肽与热应激蛋白90α融合蛋白及其制备方法和应用
- 一种类弹性蛋白多肽与热应激蛋白90α融合蛋白及其制备方法和应用
