蛋白质及其编码基因在调控玉米大斑病和小斑病中的应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及生物技术领域,蛋白质及其编码基因在调控玉米大斑病和小斑病中的应用。
背景技术
玉米大斑病和小斑病是一种世界性的玉米叶部真菌性病害。该病害的发生,在玉米叶片上形成坏死病斑,降低了植株的光合作用效率;发病严重时甚至使整个植株枯死,严重影响了玉米的产量和品质。目前,大斑病和小斑病流行于世界上几个主要的玉米产区,包括美国、中国、巴西和南非等地。
研究表明,玉米抗大斑病是一个非常复杂的性状,包括质量抗性和数量抗性。目前已知的质量抗性位点有Ht1、Ht2、Ht3和Htn1。研究人员已经证实Ht2和Ht3是Htn1的等位基因,且Htn1编码一个细胞壁相关的类受体激酶(ZmWAK-RLK1);Ht1编码一个富含亮氨酸的NLR蛋白。质量抗性位点由于其具有小种专化抗性的特点,其抗性容易被病原菌的小种变异所克服,因此限制了其在生产上的应用。在玉米10条染色体上均分布有抗大斑病的数量抗性位点,但是很少有被精细定位甚至克隆其关键抗病基因。
玉米抗小斑病属于一个典型的数量性状,由多个微效或中等效应的位点控制,且以加性遗传效应为主。截止目前,已有少量抗小斑病基因被克隆,其中ZmAPX1正调控玉米对小斑病的抗性,而一个富含亮氨酸的类受体激酶负调控玉米对小斑病的抗性。此外,ZmFUT1和MYBR92也被证实是潜在的抗小斑病基因。挖掘新的数量抗小斑病基因能够有效应对小斑病的发生。
目前,大斑病和小斑病的防治主要有化学防治、耕作管理和抗病品种培育。其中化学防治和耕作管理均会增加生产成本,而且化学杀真菌剂会对生态环境造成严重的污染;最经济有效的防治方法是培育抗病品种。因此,筛选抗大斑病和小斑病的种质资源,挖掘抗病基因,解析抗大斑病和小斑病的遗传基础,结合生物技术进行抗病分子设计育种,可以从根本上防控玉米大斑病和小斑病的危害。
发明内容
本发明所要解决的技术问题是如何提高植物的抗病性。
为解决上述技术问题,本发明首先提供了蛋白质或调控所述蛋白质活性或含量的物质的下述任一应用:
D1)调控植物抗病性;
D2)制备调控植物抗病性产品;
D3)培育抗病性提高植物;
D4)制备培育抗病性提高植物产品;
D5)培育抗病性降低植物;
D6)制备培育抗病性降低植物产品;
所述蛋白质来源于玉米,其为ZmCPK39、ZmDi19或ZmPR10;
所述ZmCPK39为如下A1)-A5)中的任一种或任两种:
A1)序列表中SEQ ID No.2所示的蛋白质;
A2)序列表中SEQ ID No.4所示的蛋白质;
A3)将A1)或A2)所述蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物抗病性相关的蛋白质;
A4)来源于玉米且与A1)或A2)所述蛋白质具有98%以上同一性且与植物抗病性相关的蛋白质;
A5)在A1)或A2)或A3)或A4)所述蛋白质的N端或/和C端连接标签得到的融合蛋白;
所述ZmDi19为如下B1)-B6)中的任一种或任两种或任三种:
B1)序列表中SEQ ID No.7所示的蛋白质;
B2)序列表中SEQ ID No.9所示的蛋白质;
B3)序列表中SEQ ID No.11所示的蛋白质;
B4)将B1)或B2)或B3)所述蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物抗病性相关的蛋白质;
B5)来源于玉米且与B1)或B2)或B3)所述蛋白质具有98%以上同一性且与植物抗病性相关的蛋白质;
B6)在B1)或B2)或B3)或B4)或B5)所述蛋白质的N端或/和C端连接标签得到的融合蛋白;
所述ZmPR10为如下C1)-C4)中的任一种:
C1)序列表中SEQ ID No.14所示的蛋白质;
C2)将C1)所述蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物抗病性相关的蛋白质;
C3)来源于玉米且与C1)所述蛋白质具有98%以上同一性且与植物抗病性相关的蛋白质;
C4)在C1)或C2)或C3)所述蛋白质的N端或/和C端连接标签得到的融合蛋白。
为了使A1)、A2)、B1)、B2)、B3)、C1)中的蛋白质便于纯化,可在由序列表中SEQ IDNo.2、4、7、9、11、14所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如下表所示的标签。
表:标签的序列
上述A3)中的蛋白质,为与SEQ ID No.2或SEQ ID No.4所示蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。上述B4)中的蛋白质,为与SEQ IDNo.7或SEQ ID No.9或SEQ ID No.11所示蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。上述C2)中的蛋白质,为与SEQ ID No.14所示蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。所述具有75%或75%以上同一性为具有75%、具有80%、具有85%、具有90%、具有95%、具有96%、具有97%、具有98%或具有99%的同一性。
上述A3)、A4)、B4)、B5)、C2)、C3)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
上述A3)、A4)中的蛋白质的编码基因可通过将SEQ ID No.3的第56-1624位或SEQIDNo.5的第56-1618位所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上上表所示的标签的编码序列得到。其中,SEQ ID No.3的第56-1624位所示的DNA分子编码SEQ ID No.2所示的蛋白质,SEQ ID No.5的第56-1618位所示的DNA分子编码SEQ ID No.4所示的蛋白质。
上述B4)、B5)中的蛋白质的编码基因可通过将SEQ ID No.8的第448-1137位或SEQIDNo.10的第13-618位或SEQ ID No.12的第1517-2065位所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上上表所示的标签的编码序列得到。其中,SEQ ID No.8的第448-1137位所示的DNA分子编码SEQ ID No.7所示的蛋白质,SEQ ID No.10的第13-618位所示的DNA分子编码SEQ IDNo.9所示的蛋白质,SEQ ID No.12的第1517-2065位所示的DNA分子编码SEQ ID No.11所示的蛋白质。
上述C2)、C3)中的蛋白质的编码基因可通过将SEQ ID No.15的第1-483位所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上上表所示的标签的编码序列得到。其中,SEQ ID No.15的第1-483位所示的DNA分子编码SEQ ID No.14所示的蛋白质。
上述应用中,所述调控所述蛋白质活性或含量的物质可为下述E1)至E9)中的任一种:
E1)编码所述蛋白质的核酸分子;
E2)含有E1)所述核酸分子的表达盒;
E3)含有E1)所述核酸分子的重组载体、或含有E2)所述表达盒的重组载体;
E4)含有E1)所述核酸分子的重组微生物、或含有E2)所述表达盒的重组微生物、或含有E3)所述重组载体的重组微生物;
E5)含有E1)所述核酸分子的转基因植物细胞系、或含有E2)所述表达盒的转基因植物细胞系;
E6)含有E1)所述核酸分子的转基因植物组织、或含有E2)所述表达盒的转基因植物组织;
E7)含有E1)所述核酸分子的转基因植物器官、或含有E2)所述表达盒的转基因植物器官;
E8)降低所述蛋白质表达量的核酸分子;
E9)含有E8)所述核酸分子的表达盒、重组载体、重组微生物、转基因植物细胞系、转基因植物组织或转基因植物器官。
上述应用中,编码ZmCPK39的核酸分子可为如下b1)-b7)中的任一种:
b1)编码序列是序列表中SEQ ID No.3的第56-1624位的DNA分子;
b2)序列表中SEQ ID No.3或其第56-1624位所示的DNA分子;
b3)编码序列是序列表中SEQ ID No.5的第56-1618位的DNA分子;
b4)序列表中SEQ ID No.5或其第56-1618位所示的DNA分子;
b5)序列表中SEQ ID No.1所示的DNA分子;
b6)与b1)-b5)中任一限定的核苷酸序列具有75%或75%以上同一性,且编码所述ZmCPK39的DNA分子;
b7)在严格条件下与b1)-b6)中任一限定的核苷酸序列杂交,且编码所述ZmCPK39的DNA分子;
编码ZmDi19的核酸分子可为如下c1)-c9)中的任一种:
c1)编码序列是序列表中SEQ ID No.8的第448-1137位的DNA分子;
c2)序列表中SEQ ID No.8或其第448-1137位所示的DNA分子;
c3)编码序列是序列表中SEQ ID No.10的第13-618位的DNA分子;
c4)序列表中SEQ ID No.10或其第13-618位所示的DNA分子;
c5)编码序列是序列表中SEQ ID No.12的第1517-2065位的DNA分子;
c6)序列表中SEQ ID No.12或其第1517-2065位所示的DNA分子;
c7)序列表中SEQ ID No.6所示的DNA分子;
c8)与c1)-c7)中任一限定的核苷酸序列具有75%或75%以上同一性,且编码所述ZmDi19的DNA分子;
c9)在严格条件下与c1)-c8)中任一限定的核苷酸序列杂交,且编码所述ZmDi19的DNA分子;
编码ZmPR10的核酸分子可为如下d1)-d5)中的任一种:
d1)编码序列是序列表中SEQ ID No.15的第1-483位的DNA分子;
d2)序列表中SEQ ID No.15或其第1-483位所示的DNA分子;
d3)序列表中SEQ ID No.13所示的DNA分子;
d4)与d1)-d3)中任一限定的核苷酸序列具有75%或75%以上同一性,且编码所述ZmPR10的DNA分子;
d5)在严格条件下与d1)-d4)中任一限定的核苷酸序列杂交,且编码所述ZmPR10的DNA分子;
E8)所述核酸分子为靶向编码ZmCPK39的核酸分子或编码ZmDi19的核酸分子或编码ZmPR10的核酸分子的sgRNA。
其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码ZmCPK39、ZmDi19或ZmPR10蛋白质的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的ZmCPK39、ZmDi19或ZmPR10蛋白质的核苷酸序列75%或者更高同一性的核苷酸,只要编码ZmCPK39、ZmDi19或ZmPR10蛋白质且具有ZmCPK39、ZmDi19或ZmPR10蛋白质功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码SEQ ID No.2、4、7、9、11或14所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
上述应用中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(SDS)、0.5MNaPO
上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
上述应用中,E2)所述的含有编码目的蛋白质的核酸分子的表达盒(目的蛋白质基因表达盒),是指能够在宿主细胞中表达目的蛋白质的DNA,该DNA不但可包括启动目的蛋白质基因转录的启动子,还可包括终止目的蛋白质基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子,组织、器官和发育特异的启动子,和诱导型启动子。启动子的例子包括但不限于:花椰菜花叶病毒的组成型启动子35S;来自西红柿的创伤诱导型启动子,亮氨酸氨基肽酶("LAP",Chao等人(1999)Plant Physiol 120:979-992);来自烟草的化学诱导型启动子,发病机理相关1(PR1)(由水杨酸和BTH(苯并噻二唑-7-硫代羟酸S-甲酯)诱导);西红柿蛋白酶抑制剂II启动子(PIN2)或LAP启动子(均可用茉莉酮酸甲酯诱导);热休克启动子(美国专利5,187,267);四环素诱导型启动子(美国专利5,057,422);种子特异性启动子,如谷子种子特异性启动子pF128(CN101063139B(中国专利200710099169.7)),种子贮存蛋白质特异的启动子(例如,菜豆球蛋白、napin,oleosin和大豆beta conglycin的启动子(Beachy等人(1985)EMBO J.4:3047-3053))。它们可单独使用或与其它的植物启动子结合使用。此处引用的所有参考文献均全文引用。合适的转录终止子包括但不限于:农杆菌胭脂碱合成酶终止子(NOS终止子)、花椰菜花叶病毒CaMV 35S终止子、tml终止子、豌豆rbcS E9终止子和胭脂氨酸和章鱼氨酸合酶终止子(参见,例如:Odell等人(I
可用现有的表达载体构建含有所述表达盒的重组载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。如pAHC25、pBin438、pCAMBIA1302、pCAMBIA2301、pCAMBIA1301、pCAMBIA1300、pBI121、pCAMBIA1391-Xa、PSN1301或pCAMBIA1391-Xb(CAMBIA公司)等。所述植物表达载体还可包含外源基因的3′端非翻译区域,即包含聚腺苷酸信号和任何其它参与mRNA加工或基因表达的DNA片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mRNA前体的3′端,如农杆菌冠瘿瘤诱导(Ti)质粒基因(如胭脂碱合成酶基因Nos)、植物基因(如大豆贮存蛋白基因)3′端转录的非翻译区均具有类似功能。使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是ATG起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(GUS基因、萤光素酶基因等)、抗生素的标记基因(如赋予对卡那霉素和相关抗生素抗性的nptII基因,赋予对除草剂膦丝菌素抗性的bar基因,赋予对抗生素潮霉素抗性的hph基因,和赋予对氨甲喋呤抗性的dhfr基因,赋予对草甘磷抗性的EPSPS基因)或是抗化学试剂标记基因等(如抗除莠剂基因)、提供代谢甘露糖能力的甘露糖-6-磷酸异构酶基因。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以逆境筛选转化植株。
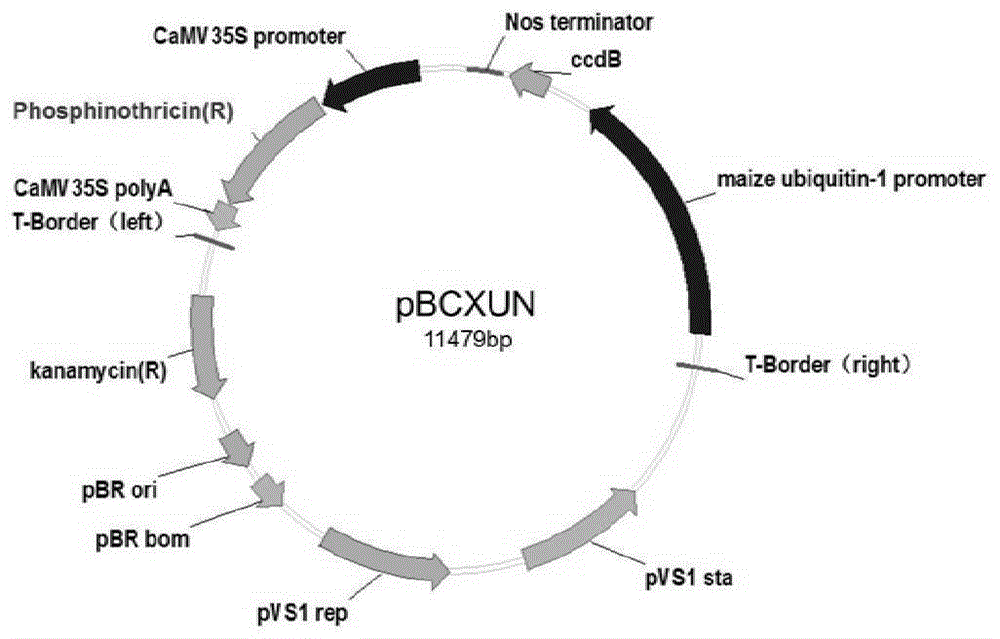
上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。所述质粒具体可为pBCXUN载体。
E3)所述重组载体具体可为pBCXUN-ZmCPK39或pBCXUN-ZmDi19或pBCXUN-ZmPR10。所述pBCXUN-ZmCPK39为在pBCXUN载体的XcmI酶切位点插入了序列表的SEQ ID No.3中第56-1624位核苷酸所示的DNA分子。pBCXUN-ZmCPK39能表达序列表中SEQ ID No.2所示的蛋白质,ZmCPK39的表达由Ubiquitin-1启动子驱动。
所述pBCXUN-ZmDi19为在pBCXUN载体的XcmI酶切位点插入了序列表的SEQ IDNo.8中第448-1137位核苷酸所示的DNA分子。pBCXUN-ZmDi19能表达序列表中SEQ ID No.7所示的蛋白质,ZmDi19的表达由Ubiquitin-1启动子驱动。
所述pBCXUN-ZmPR10为在pBCXUN载体的XcmI酶切位点插入了序列表的SEQ IDNo.15中第1-483位核苷酸所示的DNA分子。pBCXUN-ZmPR10能表达序列表中SEQ ID No.14所示的蛋白质,ZmPR10的表达由Ubiquitin-1启动子驱动。
E9)所述重组载体可为利用CRISPR/cas9系统制备的可以降低ZmCPK39、ZmDi19或ZmPR10含量的重组载体。所述重组载体可表达靶向编码ZmCPK39的核酸分子的sgRNA或靶向编码ZmDi19的核酸分子的sgRNA或靶向编码ZmPR10的核酸分子的sgRNA。
所述靶向编码ZmCPK39的核酸分子的sgRNA的靶序列可为序列表中SEQ ID No.16。
所述靶向编码ZmDi19的核酸分子的sgRNA的靶序列可为序列表中SEQ ID No.18。
上述应用中,所述微生物可为酵母、细菌、藻或真菌。其中,细菌可为农杆菌,如农杆菌EHA105。
上述应用中,所述转基因植物细胞系、转基因植物组织和转基因植物器官均不包括繁殖材料。
本发明还提供了下述任一方法:
X1)培育抗病性增强植物的方法,包括:降低受体植物中所述ZmCPK39的含量或活性,或抑制所述ZmCPK39的编码基因的表达,或敲除所述ZmCPK39的编码基因,得到与所述受体植物相比抗病性增强的目的植物;
X2)增强植物抗病性的方法,包括:降低受体植物中所述ZmCPK39的含量或活性,或抑制所述ZmCPK39的编码基因的表达,或敲除所述ZmCPK39的编码基因,得到与所述受体植物相比抗病性增强的目的植物,实现植物抗病性的增强;
X3)培育抗病性降低植物的方法,包括:使受体植物中表达所述ZmCPK39,或提高受体植物中所述ZmCPK39的含量或活性,得到与所述受体植物相比抗病性降低的目的植物;
X4)降低植物抗病性的方法,包括:使受体植物中表达所述ZmCPK39,或提高受体植物中所述ZmCPK39的含量或活性,得到与所述受体植物相比抗病性降低的目的植物,实现植物抗病性的降低;
X5)培育抗病性增强植物的方法,包括:使受体植物中表达所述ZmDi19,或提高受体植物中所述ZmDi19的含量或活性,得到与所述受体植物相比抗病性增强的目的植物;
X6)增强植物抗病性的方法,包括:使受体植物中表达所述ZmDi19,或提高受体植物中所述ZmDi19的含量或活性,得到与所述受体植物相比抗病性增强的目的植物,实现植物抗病性的增强;
X7)培育抗病性降低植物的方法,包括:降低受体植物中所述ZmDi19的含量或活性,或抑制所述ZmDi19的编码基因的表达,或敲除所述ZmDi19的编码基因,得到与所述受体植物相比抗病性降低的目的植物;
X8)降低植物抗病性的方法,包括:降低受体植物中所述ZmDi19的含量或活性,或抑制所述ZmDi19的编码基因的表达,或敲除所述ZmDi19的编码基因,得到与所述受体植物相比抗病性降低的目的植物,实现植物抗病性的降低;
X9)培育抗病性增强植物的方法,包括:使受体植物中表达所述ZmPR10,或提高受体植物中所述ZmPR10的含量或活性,得到与所述受体植物相比抗病性增强的目的植物;
X10)增强植物抗病性的方法,包括:使受体植物中表达所述ZmPR10,或提高受体植物中所述ZmPR10的含量或活性,得到与所述受体植物相比抗病性增强的目的植物,实现植物抗病性的增强。
上述方法中,X1)与X2)所述方法可通过对所述受体植物中所述ZmCPK39的编码基因(即所述编码ZmCPK39的核酸分子)进行编辑实现;
X3)与X4)所述方法可通过向所述受体植物中导入所述ZmCPK39的编码基因并使所述编码基因得到表达实现;
X5)与X6)所述方法通过向所述受体植物中导入所述ZmDi19的编码基因(即所述编码ZmDi19的核酸分子)并使所述编码基因得到表达实现;
X7)与X8)所述方法通过对所述受体植物中所述ZmDi19的编码基因进行编辑实现;
X9)与X10)所述方法通过向所述受体植物中导入所述ZmPR10的编码基因(即所述编码ZmPR10的核酸分子)并使所述编码基因得到表达实现。
上述方法中,其中目的蛋白质的编码基因可先进行如下修饰,再导入受体植物中,以达到更好的表达效果:
1)根据实际需要进行修饰和优化,以使基因高效表达;例如,可根据受体植物所偏爱的密码子,在保持本发明目的蛋白质的编码基因的氨基酸序列的同时改变其密码子以符合植物偏爱性;优化过程中,最好能使优化后的编码序列中保持一定的GC含量,以最好地实现植物中导入基因的高水平表达,其中GC含量可为35%、多于45%、多于50%或多于约60%;
2)修饰邻近起始甲硫氨酸的基因序列,以使翻译有效起始;例如,利用在植物中已知的有效的序列进行修饰;
3)与各种植物表达的启动子连接,以利于其在植物中的表达;所述启动子可包括组成型、诱导型、时序调节、发育调节、化学调节、组织优选和组织特异性启动子;启动子的选择将随着表达时间和空间需要而变化,而且也取决于靶物种;例如组织或器官的特异性表达启动子,根据需要受体在发育的什么时期而定;尽管证明了来源于双子叶植物的许多启动子在单子叶植物中是可起作用的,反之亦然,但是理想地,选择双子叶植物启动子用于双子叶植物中的表达,单子叶植物的启动子用于单子叶植物中的表达;
4)与适合的转录终止子连接,也可以提高本发明基因的表达效率;例如来源于CaMV的tml,来源于rbcS的E9;任何已知在植物中起作用的可得到的终止子都可以与本发明基因进行连接;
5)引入增强子序列,如内含子序列(例如来源于Adhl和bronzel)和病毒前导序列(例如来源于TMV,MCMV和AMV)。
目的蛋白质的编码基因可利用含有目的蛋白质的编码基因的重组表达载体导入受体植物。所述重组表达载体具体可为所述pBCXUN-ZmCPK39或所述pBCXUN-ZmDi19或所述pBCXUN-ZmPR10。
所述重组表达载体可通过使用Ti质粒,植物病毒载体,直接DNA转化,微注射,电穿孔等常规生物技术方法导入植物细胞(Weissbach,1998,Method for Plant MolecularBiology VIII,Academy Press,New York,pp.411-463;Geiserson and Corey,1998,PlantMolecular Biology(2nd Edition).)。
所述目的植物理解为不仅包含目的蛋白或其编码基因被改变的第一代植物,也包括其子代。对于所述目的植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述目的植物包括种子、愈伤组织、完整植株和细胞。
本发明还提供了具有调控植物抗病性的产品,所述产品含有(或其活性成分为)所述蛋白质或所述调控所述蛋白质活性或含量的物质。
本发明中,所述抗病性可为大斑病和/或小斑病抗性。
本发明中,所述植物可为M1)或M2)或M3):
M1)单子叶植物或双子叶植物;
M2)禾本科植物;
M3)玉米。
所述蛋白质,也属于本发明的保护范围。
所述调控所述蛋白质活性或含量的物质,也属于本发明的保护范围。
本发明的蛋白质ZmCPK39、ZmDi19与ZmPR10及其编码基因可以调控植物的抗病性,转基因过表达和CRISPR敲除实验证明了ZmCPK39和ZmDi19的抗大斑病和/或小斑病功能;转基因过表达实验证明了ZmPR10的抗大斑病和/或小斑病功能;ZmCPK39负调控玉米大斑病和小斑病抗性,ZmDi19和ZmPR10均正调控玉米大斑病和/或小斑病抗病性。本发明对于玉米的抗大斑病和/或小斑病育种具有重大的应用价值。
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
附图说明
图1为pBCXUN载体的结构示意图。
图2为实施例2中基因表达水平鉴定的结果。
图3为实施例2中抗病性鉴定的结果。
图4为实施例3中基因编辑鉴定的结果。
图5为实施例3中抗病性鉴定的结果。
图6为实施例5中基因表达水平鉴定的结果。
图7为实施例5中抗病性鉴定的结果。
图8为实施例6中基因编辑鉴定的结果。
图9为实施例6中抗病性鉴定的结果。
图10为实施例8中基因编辑鉴定的结果。
图11为实施例8中抗病性鉴定的结果。
具体实施方式
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应DNA/RNA的5′末端核苷酸,末位均为相应DNA/RNA的3′末端核苷酸。
pBCXUN载体(pBCXUN vector),记载于如下文献:ZmHAK5 and ZmHAK1 functionin K+uptake and distribution in maize under low K+conditions.Journal ofIntergrative Plant Biology(2018)doi:10.1111/jipb.12756。pBCXUN载体的结构示意图见图1。公众可从申请人处获得该载体,该载体只为重复本发明的相关实验所用,不可作为其它用途使用。
pBUE411载体(pBUE411 vector),记载于如下文献:ZmCCT9 enhances maizeadaptation to higher latitudes.Huang ect.,PNAS(2018)115(2):E334-E341DOI:10.1073/pnas.1718058115。公众可从申请人处获得该载体,该载体只为重复本发明的相关实验所用,不可作为其它用途使用。
大斑病凸脐蠕孢菌(Exserohilumturcicum)记载于如下文献:High-resolutionmapping reveals a Ht3-like locus against northern corn leaf blight,Frontiersin Plant Science(2022)doi:10.3389/fpls.2022.968924.
长蠕孢菌(Cochlibolusheterostrophus)记载于如下文献:Aleucine-richrepeat receptor kinase gene confers quantitative susceptibility to maizesouthern leaf blight,New Phytologist(2023)doi:10.1111/nph.18781.
实施例1、ZmCPK39蛋白及其编码基因的发现
本实施例发现了一个可以调控玉米大斑病和小斑病的蛋白质,其名称为ZmCPK39。在玉米自交系Y32中,ZmCPK39基因如序列表的SEQ ID No.1所示。ZmCPK39基因存在两个转录本,第一个转录本编码序列表的SEQ ID No.2所示的蛋白质,第二个转录本编码序列表的SEQ IDNo.4所示的蛋白质。玉米自交系Y32的cDNA中第一个转录本序列为SEQ ID No.3,对应的开放阅读框(即CDS)如序列表的SEQ ID No.3中第56-1624位核苷酸所示。玉米自交系Y32的cDNA中第二个转录本序列为SEQ ID No.5,对应的开放阅读框(即CDS)如序列表的SEQID No.5中第56-1618位核苷酸所示。
实施例2、ZmCPK39过表达植物的获得和鉴定
一、重组表达载体的构建
1、取玉米自交系Y32的新鲜叶片,提取总RNA,反转录得到cDNA。
2、以步骤1得到的cDNA为模板,采用ZmCPK39-OE-F和ZmCPK39-OE-R组成的引物对进行PCR扩增,得到PCR扩增产物。
ZmCPK39-OE-F:5’-ATGGGCGCTTGCTTCTCCTC-3’;
ZmCPK39-OE-R:5’-TCACAGAGCCTGAGGGTTTGG-3’。
3、取pBCXUN载体(图1),采用限制性内切酶XcmI进行酶切,回收载体骨架。
4、将步骤2得到的PCR扩增产物和步骤3得到的载体骨架连接,将得到的序列正确的重组质粒记为pBCXUN-ZmCPK39。根据重组质粒测序结果,对重组质粒pBCXUN-ZmCPK39进行结构描述如下:在pBCXUN载体的XcmI酶切位点插入了序列表的SEQ ID No.3中第56-1624位核苷酸所示的DNA分子。pBCXUN-ZmCPK39能表达序列表中SEQ ID No.2所示的蛋白质,ZmCPK39的表达由Ubiquitin-1启动子驱动。实际应用中,也可以分别直接合成外源片段然后插入pBCXUN载体的XcmI酶切位点,从而得到重组质粒。
二、过表达植物的获得
1、将重组质粒pBCXUN-ZmCPK39导入农杆菌EHA105,得到重组农杆菌。
2、取步骤1得到的重组农杆菌,采用农杆菌介导法对玉米自交系B73的幼胚进行遗传转化,得到T0代植株。
3、将T0代植株进行PCR鉴定。
PCR鉴定方法:取植株叶片,提取基因组DNA,采用bar-F和bar-R组成的引物对进行PCR扩增,如果得到约262bp的扩增产物、PCR鉴定为阳性、该植株为转基因植株,如果没有得到扩增产物、PCR鉴定为阴性、该植株为非转基因植株。
bar-F:GAAGGCACGCAACGCCTACGA;bar-R:CCAGAAACCCACGTCATGCCA。
对随机取的三个转基因植株进行命名,分别为ZmCPK39-OE#1植株、ZmCPK39-OE#2植株、ZmCPK39-OE#3植株。
三、纯合株系的获得
T0代植株自交,收获籽粒,将籽粒培育为植株,即为T1代植株;从T1代植株中筛选转基因植株,PCR鉴定方法同步骤二的3;将T1代转基因植株自交,收获籽粒,将籽粒培育为植株,即为T2代植株;从T2代植株中筛选转基因植株,PCR鉴定方法步骤二的3,若没有分离,表示该株系已纯合。
T0代植株分别为:ZmCPK39-OE#1植株、ZmCPK39-OE#2植株、ZmCPK39-OE#3植株。
四、植株的抗病性鉴定
供试植株为:ZmCPK39-OE#1植株的T2代纯合转基因植株、ZmCPK39-OE#2植株的T2代纯合转基因植株、ZmCPK39-OE#3植株的T2代纯合转基因植株,利用野生型非转基因玉米自交系B73植株作为对照。
1、基因表达水平鉴定
提取供试植株叶片的总RNA并反转录得到cDNA,以GAPDH基因为内参基因,通过qPCR检测ZmCPK39基因的相对表达水平。结果见图2。
用于检测ZmCPK39基因的引物对:
ZmCPK39-F:GCGTTGCCGTCAAGCGCAT;ZmCPK39-R:GCTCCATCACAATGTACACGT。
用于检测GAPDH基因的引物对:
GAPDH-F:ATCAACGGCTTCGGAAGGAT;GAPDH-R:CCGTGGACGGTGTCGTACTT。
2、抗病性鉴定
抗病性鉴定在中国农业大学实验室内进行。
大斑病致病菌:大斑病凸脐蠕孢菌(Exserohilumturcicum);小斑病致病菌:长蠕孢菌(Cochlibolusheterostrophus)。
正常培养供试植株至3叶期时进行接种实验。大斑病致病菌采用叶面喷施的接种方法。用无菌水悬浮大斑病致病菌的孢子,得到孢子浓度2-4×10
病原菌的积累量检测:选取每株幼苗接种叶相同大小的叶片,提取总RNA并反转录得到cDNA,以玉米GAPDH基因为内参基因,检测病原菌Actin基因的表达水平表示病原菌的积累量。
用于检测大斑病致病菌的引物对:
qNLB-F:ACCCCAAGTCCAACCGTGAG;qNLB-R:CAGAGGCGTACAGGGACAGG。
用于检测小斑病致病菌的引物对:
qSLB-F:ATCACCATTGGAAACGAGCG;qSLB-R:ATGATCTTGACCTTCATCGAG。
结果见图3。图3中A图表示的是接种的大斑病致病菌,B图表示的是接种的小斑病致病菌。
结果表明,与非转基因对照相比,转基因植株中的ZmCPK39基因的表达量显著增高,相应的转基因植株中大斑病致病菌和小斑病致病菌积累量显著增加,即转基因植株对大斑病和小斑病的抗性显著降低。
实施例3、ZmCPK39基因编辑植株的获得和鉴定
一、基因编辑载体的构建
构建基因编辑载体,即如下重组质粒pBUE411-sgRNA-ZmCPK39:在pBUE411载体的BsaI酶切位点插入序列表的SEQ ID No.16所示的双链DNA分子。所得重组质粒已进行测序验证转录一个sgRNA,sgRNA的靶序列结合区如序列表的SEQ ID No.17所示,该重组质粒中具有Cas9基因,并表达得到Cas9蛋白。
二、基因编辑植株的获得
1、将基因编辑载体导入农杆菌EHA105,得到重组农杆菌。
2、取步骤1得到的重组农杆菌,采用农杆菌介导法对玉米自交系B73的幼胚进行遗传转化,得到T0代植株。
3、从T0代植株中筛选目标序列发生变异的植株。
具体方法:取植株叶片,提取基因组DNA,采用F和R组成的引物对进行PCR扩增,回收PCR扩增产物并进行测序,将测序结果与野生型序列进行比较,筛选得到具有差异序列的T0代植株。
F:5’-TTGAGGTCATTGTCTCAGCC-3’;R:5’-AGCAGCTTGGCAGCGTATG-3’。
4、取步骤3筛选的T0代植株,自交并收获籽粒,将籽粒培育为植株,即为T1代植株。
5、从T1代植株中筛选基因编辑植株。
(1)将植株进行以基因编辑载体中的bar基因为靶标的PCR鉴定。PCR鉴定方法:取植株叶片,提取基因组DNA,采用bar-F和bar-R组成的引物对进行PCR扩增,如果没有得到扩增产物、PCR鉴定为阴性。
bar-F:GAAGGCACGCAACGCCTACGA;bar-R:CCAGAAACCCACGTCATGCCA。
(2)将植株进行以基因编辑目标区域为靶标的鉴定。鉴定方法同步骤3。
如果某一植株步骤(1)PCR鉴定为阴性,且步骤(2)的鉴定结果显示与野生型序列具有差异且为纯合型(且两条染色体一致),该植株为基因编辑植株。
获得了三株基因编辑植株,分别命名为ZmCPK39-KO#1植株、ZmCPK39-KO#2植株、ZmCPK39-KO#3植株。
三株基因编辑植株步骤(2)的测序结果见图4。与B73相比,ZmCPK39-KO#1植株中缺失了十四个核苷酸(即缺失SEQ ID No.1的第5430-5443位),ZmCPK39-KO#2植株中缺失了一个核苷酸(即缺失SEQ ID No.1的第5440位),ZmCPK39-KO#3植株中缺失了两个核苷酸(即缺失SEQ ID No.1的第5442-5443位),均造成移码突变。
6、取基因编辑植株,自交,获得后代植株,即为基因编辑株系。
获得了三个基因编辑株系,分别命名为ZmCPK39-KO#1株系、ZmCPK39-KO#2株系、ZmCPK39-KO#3株系。
三、基因编辑植株的抗病性鉴定
供试植株为:ZmCPK39-KO#1株系的T2代植株、ZmCPK39-KO#2株系的T2代植株,、ZmCPK39-KO#3株系的T2代植株,玉米自交系B73植株。
方法同实施例2的步骤四的2。
结果见图5。图5中A图表示的是接种的大斑病致病菌,B图表示的是接种的小斑病致病菌。
相对于玉米自交系B73植株,接种大斑病和小斑病的致病菌,基因编辑植株的病斑数量显著减少,致病菌的积累量显著低于对照。
实施例4、ZmDi19蛋白及其编码基因的发现
为了解析ZmCPK39的抗大斑病和小斑病机理,发明人利用酵母双杂交的方法筛选到与ZmCPK39互作的蛋白ZmDi19,并通过Split-LUC和pull-down实验在体内和体外分别证明了二者之间存在真实的互作关系。
玉米自交系B73的基因组DNA中的ZmDi19基因如序列表的SEQ ID No.6所示。ZmDi19基因存在三个转录本,第一个转录本编码序列表的SEQ ID No.7所示的蛋白质;第二个转录本编码序列表的SEQ ID No.9所示的蛋白质;第三个转录本编码序列表的SEQ IDNo.11所示的蛋白质。玉米自交系B73的cDNA中第一个转录本对应的开放阅读框如序列表的SEQ IDNo.8中第448-1137位核苷酸所示。玉米自交系B73的cDNA中第二个转录本对应的开放阅读框如序列表的SEQ ID No.10中第13-618位核苷酸所示。玉米自交系B73的cDNA中第三个转录本对应的开放阅读框如序列表的SEQ ID No.12中第1517-2065位核苷酸所示。
实施例5、ZmDi19过表达植物的获得和鉴定
一、重组表达载体的构建
1、取玉米自交系B73的新鲜叶片,提取总RNA,反转录得到cDNA。
2、以步骤1得到的cDNA为模板,采用ZmDi19-OE-F和ZmDi19-OE-R组成的引物对进行PCR扩增,得到PCR扩增产物。
ZmDi19-OE-F:5’-ATGGACTCCGAGCACTGGAT-3’;
ZmDi19-OE-R:5’-TCAGTCGCCGAATAGAGTAG-3’。
3、取pBCXUN载体(图1),采用限制性内切酶XcmI进行酶切,回收载体骨架。
4、将步骤2得到的PCR扩增产物和步骤3得到的载体骨架连接,将得到的序列正确的重组质粒记为pBCXUN-ZmDi19。根据重组质粒测序结果,对重组质粒pBCXUN-ZmDi19进行结构描述如下:在pBCXUN载体的XcmI酶切位点插入了序列表的SEQ ID No.8中第448-1137位核苷酸所示的DNA分子。pBCXUN-ZmDi19能表达序列表中SEQ ID No.7所示的蛋白质,ZmDi19的表达由Ubiquitin-1启动子驱动。实际应用中,也可以分别直接合成外源片段然后插入pBCXUN载体的XcmI酶切位点,从而得到重组质粒。
二、过表达植物的获得
1、将重组质粒导入农杆菌EHA105,得到重组农杆菌。
2、取步骤1得到的重组农杆菌,采用农杆菌介导法对玉米自交系B73的幼胚进行遗传转化,得到T
3、将T
PCR鉴定方法:取植株叶片,提取基因组DNA,采用bar-F和bar-R组成的引物对进行PCR扩增,如果得到约262bp的扩增产物、PCR鉴定为阳性、该植株为转基因植株,如果没有得到扩增产物、PCR鉴定为阴性、该植株为非转基因植株。
bar-F:GAAGGCACGCAACGCCTACGA;bar-R:CCAGAAACCCACGTCATGCCA。
采用重组质粒进行步骤二,对随机取的三个转基因植株进行命名,分别为ZmDi19-OE#1植株、ZmDi19-OE#2植株、ZmDi19-OE#3植株。
三、纯合株系的获得
T0代植株自交,收获籽粒,将籽粒培育为植株,即为T1代植株;从T1代植株中筛选转基因植株,PCR鉴定方法同步骤二的3;将T1代转基因植株自交,收获籽粒,将籽粒培育为植株,即为T2代植株;从T2代植株中筛选转基因植株,PCR鉴定方法步骤二的3,若没有分离,表示该株系已纯合。
T0代植株分别为:ZmDi19-OE#1植株、ZmDi19-OE#2植株、ZmDi19-OE#3植株。
四、植株的抗病性鉴定
供试植株为:ZmDi19-OE#1植株的T2代纯合转基因植株、ZmDi19-OE#2植株的T2代纯合转基因植株、ZmDi19-OE#3植株的T2代纯合转基因植株,利用野生型非转基因玉米自交系B73植株作为对照。
1、基因表达水平鉴定
提取供试植株叶片的总RNA并反转录得到cDNA,以GAPDH基因为内参基因,通过qPCR检测ZmDi19基因的相对表达水平。结果见图6。
用于检测ZmDi19基因的引物对:
ZmDi19-F:ATGGACTCCGAGCACTGGAT;ZmDi19-R:AACCATCTCTGAGCAGACAG。
用于检测GAPDH基因的引物对:
GAPDH-F:ATCAACGGCTTCGGAAGGAT;GAPDH-R:CCGTGGACGGTGTCGTACTT。
2、抗病性鉴定
方法同实施例2的步骤四的2。
结果见图7。图7中A图表示的是接种的大斑病致病菌,B图表示的是接种的小斑病致病菌。
相对于玉米自交系B73植株,接种大斑病和小斑病的致病菌,ZmDi19-OE过表达植株的病斑数量显著减少,致病菌的积累量显著低于对照。
实施例6、ZmDi19基因编辑植株的获得和鉴定
一、基因编辑载体的构建
构建基因编辑载体,即如下重组质粒pBUE411-sgRNA-ZmDi19:在pBUE411载体的BsaI酶切位点插入序列表的SEQ ID No.18所示的双链DNA分子。所得重组质粒已进行测序验证转录一个sgRNA,sgRNA的靶序列结合区如序列表的SEQ ID No.19所示,该重组质粒中具有Cas9基因,并表达得到Cas9蛋白。
二、基因编辑植株的获得
1、将基因编辑载体导入农杆菌EHA105,得到重组农杆菌。
2、取步骤1得到的重组农杆菌,采用农杆菌介导法对玉米自交系B73的幼胚进行遗传转化,得到T
3、从T
具体方法:取植株叶片,提取基因组DNA,采用Cas19F和Cas19R组成的引物对进行PCR扩增,回收PCR扩增产物并进行测序,将测序结果与野生型序列进行比较(野生型序列如序列表的SEQ ID No.6中第285-1070位所示),筛选得到具有差异序列的植株。
Cas19F:5’-TCCGATCCGGTGCGACTACTAAC-3’;
Cas19R:5’-TCCCAGGTCAACCAAGCACAA-3’。
4、取步骤3筛选的T
5、从T
(1)将植株进行以基因编辑载体中的bar基因为靶标的PCR鉴定。PCR鉴定方法:取植株叶片,提取基因组DNA,采用bar-F和bar-R组成的引物对进行PCR扩增,如果没有得到扩增产物、PCR鉴定为阴性。
(2)将植株进行以基因编辑目标区域为靶标的鉴定。鉴定方法同步骤3。
如果某一植株步骤(1)PCR鉴定为阴性,且步骤(2)的鉴定结果显示与野生型序列具有差异且为纯合型(且两条染色体一致),该植株为基因编辑植株。
获得了三株基因编辑植株,分别命名为ZmDi19-KO#1植株、ZmDi19-KO#2植株、ZmDi19-KO#3植株。
三株基因编辑植株步骤(2)的测序结果见图8。与B73相比,ZmDi19-KO#1植株中插入了1个核苷酸(A)(即SEQ ID No.6的第752-753位间插入A),ZmDi19-KO#2植株中缺失了25个核苷酸(即缺失SEQ ID No.6的第728-752位),ZmDi19-KO#3植株中插入了1个核苷酸(C)(即SEQ ID No.6的第752-753位间插入C),均造成移码突变。
6、取基因编辑植株,自交,获得后代植株,即为基因编辑株系。
获得了三个基因编辑株系,分别命名为ZmDi19-KO#1株系、ZmDi19-KO#2株系、ZmDi19-KO#3株系。
三、基因编辑植株的抗病性鉴定
供试植株为:ZmDi19-KO#1株系的T
方法同实施例2的步骤四的2。
结果见图9。图9中A图表示的是接种的大斑病致病菌,B图表示的是接种的小斑病致病菌。
相对于玉米自交系B73植株,接种大斑病和小斑病的致病菌,ZmDi19基因编辑植株的病斑数量显著增加,致病菌的积累量显著高于对照。
实施例7、ZmPR10蛋白及其编码基因的获得
鉴于ZmDi19为含有锌指结构域的转录因子,该家族成员可以结合TACA(A/G)T元件从而调控靶标基因的表达。为了鉴定ZmDi19调控的靶标基因,发明人采用了转录组和蛋白组分析方法,筛选ZmDi19过表达后在转录水平和蛋白水平发生变化的候选靶标基因。结合TACA(A/G)T元件分析,共筛选到8个在启动子区域含有该元件且表达发生改变的候选靶标基因。通过酵母单杂交一对一验证,最终鉴定到ZmDi19可以结合编码病程相关蛋白基因ZmPR10的启动子,证明了ZmPR10即为ZmDi19的靶标基因。
玉米自交系B73的基因组DNA中的ZmPR10基因如序列表的SEQ ID No.13所示。ZmPR10有1个转录本,编码序列表的SEQ ID No.14所示的蛋白质。玉米自交系B73的cDNA中ZmPR10转录本的开放阅读框如序列表的SEQ ID No.15中第1-483位核苷酸所示。
实施例8、ZmPR10过表达植株纯系的获得和鉴定
一、重组表达载体的构建
1、取玉米自交系B73的新鲜叶片,提取总RNA,反转录得到cDNA。
2、以步骤1得到的cDNA为模板,采用ZmPR10-OE-F和ZmPR10-OE-R组成的引物对进行PCR扩增,得到PCR扩增产物。
ZmPR10-OE-F:5’-ATGGCCTCCGCCAACAGC-3’;
ZmPR10-OE-R:5’-TTAGTTGTAGGCGTCGGGG-3’。
3、取pBCXUN载体,采用限制性内切酶XcmI进行酶切,回收载体骨架。
4、将步骤2得到的PCR扩增产物和步骤3得到的载体骨架连接,将得到的序列正确的重组质粒记为pBCXUN-ZmPR10。根据重组质粒测序结果,对重组质粒pBCXUN-ZmPR10进行结构描述如下:在pBCXUN载体的XcmI酶切位点插入了序列表的SEQ ID No.15中第1-483位核苷酸所示的DNA分子。pBCXUN-ZmPR10能表达序列表中SEQ ID No.14所示的蛋白质,ZmPR10的表达由Ubiquitin-1启动子驱动。
二、过表达植株纯系的获得
1、将重组质粒导入农杆菌EHA105中,得到重组农杆菌。
2、取步骤1得到的重组农杆菌,采用农杆菌介导法对玉米自交系B73的幼胚进行遗传转化,得到T
3、将T
PCR鉴定方法同实施例2的步骤二的3。
对随机选取的五个转基因植株进行命名,分别为:ZmPR10-OE#1植株、ZmPR10-OE#2植株、ZmPR10-OE#3植株、ZmPR10-OE#4植株、ZmPR10-OE#5植株。
4、T
得到如下纯合的转基因株系:ZmPR10-OE#1株系、ZmPR10-OE#2株系、ZmPR10-OE#3株系、ZmPR10-OE#4株系、ZmPR10-OE#5株系。
三、植株的抗病性鉴定
供试植株为:ZmPR10-OE#1株系的T
1、基因表达水平鉴定
方法同实施例2的步骤四的1。用于检测ZmPR10基因的引物对:
ZmPR10-F:TTCACCTCAGTCATGCCGTT;ZmPR10-R:GGCGGTGACGGACTCCTT。
结果见图10。
2、抗病性鉴定
方法同实施例2的步骤四的2。
结果见图11。图11中A图表示的是接种的大斑病致病菌,B图表示的是接种的小斑病致病菌。
结果表明,与玉米自交系B73植株(对照非转基因植株)相比,转基因植株中ZmPR10基因的表达量显著增高,相应的转基因植株的病斑显著减少,转基因植株中病原菌的积累量显著低于对照材料。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。
- Bcdmt2蛋白质及其编码基因在调控灰霉菌致病力与分生孢子产生中的应用
- WRKY20蛋白质及其编码基因在调控植物抗逆性中的应用
- ZmDRR206蛋白质及其编码基因在调控植物抗病性与生长发育中的应用
- GhTGA9蛋白及其编码基因在调控植物抗大丽轮枝菌黄萎病中的应用
- 一种玉米miRNA及其在调控玉米植株抵抗玉米小斑病中的应用
