一种检测蛋白激酶活性的多功能发光镧系配位聚合物纳米探针及其制备方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及检测蛋白激酶活性,尤其涉及一种检测蛋白激酶活性的多功能发光镧系配位聚合物纳米探针及其制备方法和应用。
背景技术
作为一类极有应用前景的发光传感材料,镧系元素配位聚合物(LanthanideCoordination Polymers, LCPs)具有独特的荧光特性,如荧光寿命长、斯托克斯位移大、f-f发射带窄、量子效率高。在LCPs中,有机配体不仅可以通过“天线效应”敏化镧系离子发光,还可以通过刚性骨架结构的构筑、疏水环境的形成来调控其光谱性能,这些优势为构建性能优越的LCPs荧光探针提供良好的前提。
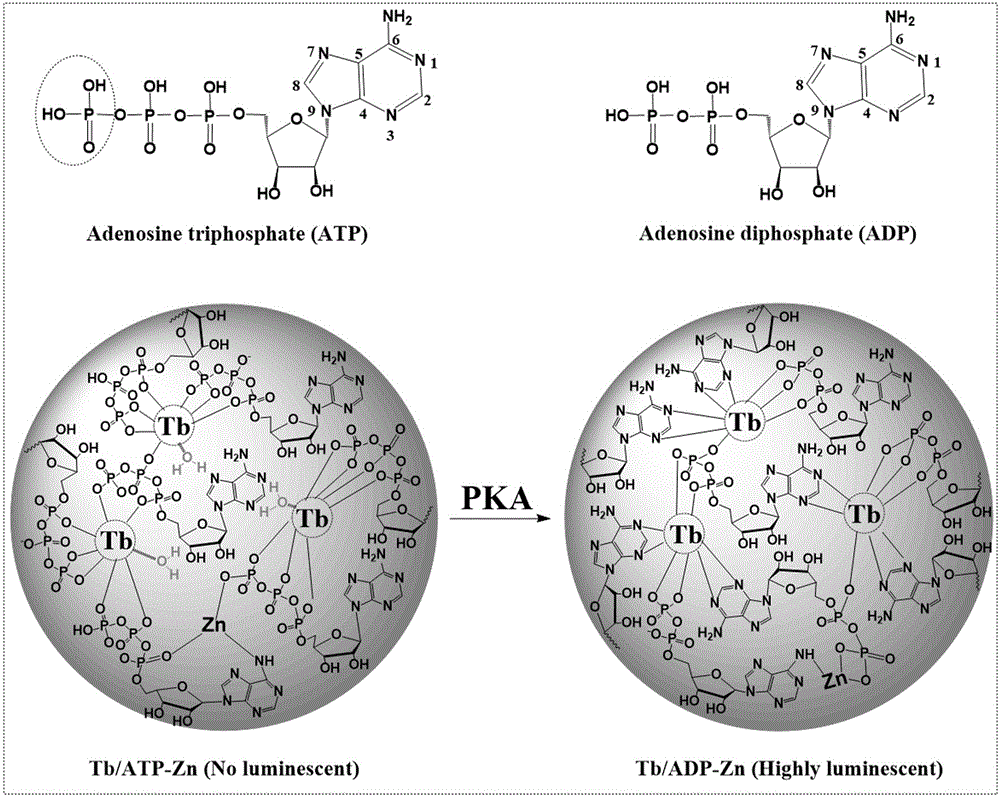
蛋白激酶(PKA)可以通过将腺苷5′-三磷酸(ATP)的γ-磷酸基团转移到含羟基的氨基酸(如Ser、Thr和Tyr)上来催化蛋白质的磷酸化。作为最重要的翻译后修饰之一,蛋白质磷酸化在细胞周期进程、增殖、信号转导、凋亡和免疫反应中起着关键的调节作用。然而,异常的激酶活性和蛋白质磷酸化可以诱发严重的症状和疾病。因此,蛋白激酶已成为一类治疗靶点,许多蛋白激酶抑制剂已被批准或应用于临床试验,用于治疗不同的疾病,包括癌症、炎症和自身免疫性疾病以及神经疾病。因此,开发有效的分析方法来检测蛋白激酶活性和筛选其抑制剂对于基础生化研究、临床诊断和新药研发是非常必要的。迄今为止,人们已经报道了用于检测蛋白激酶活性的各种方法,包括放射测量法、比色法、荧光分析法、表面等离子共振法、电化学分析法、光电化学分析法、电化学发光法与质谱分析法。然而,这些报道的蛋白激酶分析通常需要使用三种独立的成分,即三磷酸腺苷、蛋白底物和信号探针,操作过程也十分繁琐。因此,迫切需要开发简便、经济和通用的传感平台。
发明内容
为解决上述问题,本发明提供一种检测蛋白激酶活性的多功能发光镧系配位聚合物纳米探针及其制备方法和应用,本申请提供的纳米探针检测方便,而且不需要游离的三磷酸腺苷和肽底物。
本发明的目的是以下述方式实现的:一种检测蛋白激酶活性的多功能发光镧系配位聚合物纳米(Lanthanide Coordination Polymer Nanoparticles, LCPNPs)探针,为Tb-ATP-Zn。
检测蛋白激酶活性的多功能发光镧系配位聚合物纳米探针的制备方法,包括以下步骤,在搅拌下向ATP水溶液中滴加Tb
Tb
在搅拌下向ATP水溶液中滴加Tb(NO
离心收集的Tb-ATP-Zn LCPNPs,用乙醇洗涤,然后干燥。
离心收集的Tb-ATP-Zn LCPNPs,用乙醇洗涤至少3-6次,并在真空干燥箱中干燥。
按物质的量比,ATP:Tb
镧系配位聚合物纳米探针的应用,检测蛋白激酶的活性。
使用镧系配位聚合物纳米探针检测蛋白激酶活性的方法,将Tb-ATP-Zn悬浮液与PKA溶液混合,使用缓冲溶液进行调节,然后将混合溶液置于37℃水浴中反应1h,随后用293nm的激发波长检测发射光谱。
镧系配位聚合物纳米探针的应用,蛋白激酶活性的检测与筛选抑制剂。
使用镧系配位聚合物纳米探针筛选抑制剂的方法,分别向同一浓度和体积的磷酸化反应溶液中加入固定含量的蛋白激酶和不同成分的抑制剂或同一成分的不同浓度的抑制剂,检测荧光发射光谱。
相对于现有技术,ATP不仅可以作为PKA介入的水解反应的底物,而且还可以用作开启LCPNPs系统发光的调制器。通过PKA介入的ATP水解为ADP,几乎不发光的Tb-ATP-Zn可以有效地转化为高发光产物Tb-ADP-Zn,从而实现PKA的发光开启传感。因此,不需要游离三磷酸腺苷和肽底物,即可实现蛋白激酶活性的测定。在优化的条件下(ATP、Zn
附图说明
图1是Tb-ATP-Zn和Tb-ADP-Zn的扫描电镜图;(A)图为Tb-ATP-Zn的扫描电镜图;(B)图为经过PKA反应过的Tb-ATP-Zn的扫描电镜图;(C)图为Tb-ADP-Zn的扫描电镜图;所有图表明LCPNPs为直径约800纳米左右的球形颗粒。
图2是对Tb-ATP-Zn、经过PKA反应的Tb-ATP-Zn、Tb-ADP-Zn进行了粉末XRD实验的XRD图谱(图中a为Tb-ATP-Zn、b为PKA反应过的Tb-ATP-Zn、c为Tb-ADP-Zn)。
图3是Tb-ATP-Zn的XPS光谱和FTIR光谱;(A)图为Tb-ATP-Zn的XPS光谱;(B)图为ADP、ATP、Tb-ADP-Zn、Tb-ATP-Zn以及存在PKA条件下Tb-ATP-Zn的FTIR光谱。
图4是ATP、Tb-ATP-Zn、经PKA反应过的Tb-ATP-Zn、Tb-ADP-Zn的吸收光谱和发射光谱;(A)图为吸收光谱,(B)图为发射光谱;其中Tb-ATP-Zn+PKA是表示经PKA反应过的Tb-ATP-Zn;(A)图中a→d表示波峰处的曲线,从下到到上依次为曲线a、b、c、d;(B)图中的发射光谱不包括ATP的。
图5是Tb-ATP-Zn、Tb-ADP-Zn在不同溶剂中的发射图谱;A是在水中的发射图谱,B是在乙醇中的发射图谱。
图6是Tb-ATP-Zn与PKA反应过Tb-ATP-Zn的样品的能谱分析图,A是Tb-ATP-Zn样品的能谱分析图;B是经PKA反应后Tb-ATP-Zn的样品的能谱分析图。
图7是利用Tb-ATP-Zn LCPNPs检测PKA的机理图。
图8 中,A、B、C、D 图分别是ATP浓度、Zn
图9是在不同浓度的PKA {(a〜l)(0,0.001,0.005,0.01,0.05,0.08,0.1,0.5,1.0,1.3,1.7,2.0)的存在下,Tb-ATP-Zn的发光光谱;a→l是指图中四个波峰处的从下到上的12条曲线依次分别对应从小到大的12个PKA的浓度。
图10是Tb-ATP-Zn的发光强度与PKA浓度之间的拟合线性曲线。
图11是不同浓度的鞣花酸{(a〜k)(0,1,2,3,4,6,9,14,20,80,120 uM对Tb(0.1UμL
图12是鞣花酸浓度与抑制效率之间的关系。
图13是不同分析物存在时Tb-ATP-Zn的荧光强度。
图14是以Hela细胞为模型下,在不同浓度的PKA {(a〜n)(浓度依次为0, 0.001,0.005 ,0.01, 0.05, 0.07, 0.1, 0.3, 0.5, 0.7, 0.9, 1.1, 1.3, 1.7 U·uL
图15是与图14对应的是Tb-ATP-Zn的发光强度与PKA浓度之间的拟合线性曲线。
图16是Tb-ATP-Zn对MCF-7细胞裂解液中不同PKA活性的发光响应图,其中插图显示了从1到5的细胞裂解样品的激活剂和抑制剂浓度。
具体实施方式
下面结合具体实施例对本发明进行具体描述,有必要在此指出的是本实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,该领域的技术熟练人员可以根据上述本发明的内容做出一些非本质的改进和调整。
一、技术方案
一种检测蛋白激酶活性的多功能发光镧系配位聚合物纳米探针,为Tb-ATP-Zn。
检测蛋白激酶活性的多功能发光镧系配位聚合物纳米探针的制备方法,包括以下步骤,在搅拌下向ATP水溶液中滴加Tb
Tb
在搅拌下向ATP水溶液中滴加Tb(NO
离心收集的Tb-ATP-Zn LCPNPs,用乙醇洗涤,然后干燥。
离心收集的Tb-ATP-Zn LCPNPs,用乙醇洗涤至少3-6次,并在真空干燥箱中干燥。
按物质的量比,ATP:Tb
镧系配位聚合物纳米探针的应用,检测蛋白激酶A的活性。
使用镧系配位聚合物纳米探针检测蛋白激酶活性的方法,将Tb-ATP-Zn悬浮液与PKA溶液混合,使用缓冲溶液进行调节,然后将混合溶液置于37℃水浴中反应1h,随后用293nm的激发波长检测发射光谱。
镧系配位聚合物纳米探针的应用,筛选抑制剂。
使用镧系配位聚合物纳米探针筛选抑制剂的方法,分别向同一浓度和体积的磷酸化反应溶液中加入固定含量的蛋白激酶和不同成分的抑制剂或同一成分的不同浓度的抑制剂,检测荧光发射光谱。磷酸化反应溶液:在含有探针的HEPES缓冲溶液中加入一定量的PKA,37℃水浴锅中反应1h后的溶液。
下面以蛋白激酶A,抑制剂以鞣花酸为例进行说明。
二、实验
2.1、所使用的化学品和材料
Tb(NO
HEPES缓冲液的制备:采用超纯水溶解HEPES制备HEPES缓冲液,然后用5 M NaOH调节pH值为8.0。pH值用pH计校准(leici,上海,中国)。超纯水(18 MΩcm)是用于所有水溶液的制备。除另有说明外,所有化学试剂均为分析试剂级,无需进一步净化即可使用。
2.2、制备Tb/ATP-Zn镧系配位聚合物纳米粒子
在搅拌下向20mL ATP(10mM)水溶液中滴加Tb(NO
2.2.1、确定Tb-ATP-Zn镧系配位聚合物纳米粒子的合成和表征
材料表征中“经过PKA处理的Tb-ATP-Zn”是指:将10ml 1.0U/uL的PKA加入到30ml的Tb-ATP-Zn悬浮液中,37℃的条件下反应1h,即为PKA处理后的溶液。
Tb-ATP-Zn是由ATP、Tb
结果表明,Tb-ATP-Zn于PKA反应后,其形态没有明显变化。对Tb-ATP-Zn、经过PKA处理过的Tb-ATP-Zn、Tb-ADP-Zn进行了粉末XRD实验。XRD图谱(图2)显示这些LCPNPs在结构上是无定形的,因为没有观察到明显的衍射峰。如图3(A)所示,用x射线光电子能谱(XPS)说明了Tb-ATP-Zn中元素的组成和价态;Tb-ATP-Zn的XPS光谱证实了预期元素的存在:在结合能分别为532.4、401.5、284.0、150.1和133.6 eV时观察到O1s、N1s、C1s、Tb4d和P2p带。如图3(B)所示,记录了ADP、ATP、Tb-ADP-Zn、Tb-ATP-Zn及经PKA反应的Tb-ATP-Zn的傅里叶变换红外光谱(FTIR);对于ATP,1550和911cm
2.2.2、PKA对Tb-ATP-Zn的光谱响应
图4为ATP,Tb-ATP-Zn,经PKA反应过的Tb-ATP-Zn,和Tb-ADP-Zn的吸收光谱和发射光谱。
如图4(A)所示,ATP在260 nm处出现一个吸收峰,这归因于ATP的腺苷基内的π-π*电子跃迁。Tb-ATP-Zn、经PKA处理后的Tb-ATP-Zn和Tb-ADP-Zn显示出与ATP相似的吸收谱,这表明存在腺苷部分。
图4(B)显示了Tb-ATP-Zn、经PKA处理后的Tb-ATP-Zn、Tb-ADP-Zn的发射光谱。Tb-ADP-Zn显示出强烈的绿色发光,峰值分别为492、548、588和624 nm,属于Tb
2.3、蛋白激酶活性检测
为了获得Tb/ATP-Zn的最佳荧光性能,对实验条件进行了优化,包括制备Tb/ATP-Zn的各组分(ATP、Zn
将不同体积的PKA溶液,PKA浓度为0.005u/uL与30μL Tb/ATP-Zn悬浮液(0.4mg·mL−1)混合,随后使用HEPES缓冲溶液(50mM,pH=7.4)将最终体积调节至500μL,使得PKA的浓度分别为0,0.001,0.005,0.01,0.05,0.08,0.1,0.5,1.0,1.3、1.7、2.0,单位为U·μL
2.4、蛋白激酶抑制试验
PKA的异常水平与许多主要疾病如癌症高度相关,它已经成为一个潜在的治疗目标。因此,筛选有效的小分子抑制剂对PKA相关的癌症治疗具有重要意义。随后,将研制的发光传感器用于蛋白激酶抑制剂的筛选。在此,选择鞣花酸作为模型抑制剂,鞣花酸是一种细胞可渗透且有效的PKA抗氧化抑制剂。在不同量的鞣花酸和固定量的PKA(1.7 U·μL
对于蛋白激酶抑制试验,向300μL磷酸化反应溶液中加入不同浓度(0-120μM)的鞣花酸,以检测荧光发射光谱,这里用293nm的激发波长检测发射光谱。磷酸化反应溶液:在含有探针的HEPES缓冲溶液中加入一定量的PKA,37℃水浴锅中反应1h后的溶液。PKA可以催化ATP发生磷酸化反应,反应后的溶液称为磷酸化反应溶液,这里使用磷酸化反应溶液的目的是,先使PKA发生作用,随后才能进行抑制剂实验;HEPES作为缓冲溶液,HEPES缓冲溶液的浓度可以为50mM、pH为7.4;PKA蛋白激酶的目的是去磷酸化。
为了测定蛋白激酶抑制作用,将不同浓度(0、1、2、3、4、6、9、14,20,80,120 uM)的鞣花酸加入到具有固定蛋白激酶浓度(1.7 U·μL-1)的磷酸化反应溶液中。不同浓度鞣花酸下Tb-ATP-Zn的荧光光谱如图11所示,不同浓度的鞣花酸{(a〜k)(0、1、2、3、4、6、9、14,20,80,120 uM)}对Tb(0.1UμL-1)的Tb-ATP-Zn的荧光光谱。抑制效率与鞣花酸浓度之间的关系如图12所示。
图11所示,测定的发光强度随着鞣花酸浓度的增加而降低,表明鞣花酸可以抑制蛋白激酶活性。图12中,抑制效率(E)的计算公式为E =(I
2.5、选择性和再现性
为了研究Tb/ATP-Zn对蛋白激酶的选择性,研究了对其他不同蛋白质或酶的发光反应,如β淀粉样前体蛋白裂解酶1抗体(Anti-BACE1 Ab)、牛血清蛋白(BSA)、葡萄糖氧化酶GOX、抗兔IgG、ALP、ALP+L-Phe。如图13所示,蛋白质/酶添加后的最终浓度都分别为1.0U/uL,与蛋白激酶相比,除ALP外,其他蛋白质/酶均不会引起Tb-ATP-Zn荧光信号的显著变化。由于ATP水解磷酸盐的类似能力,ALP也使得Tb-ATP-Zn荧光光增强。然而通过引入L-苯丙氨酸(一种碱性磷酸酶抑制剂,即L-Phe)可以有效消除该干扰。因此,可以利用Tb/ATP-Zn的高选择性对PKA进行测定。
为了进一步评估所提出的发光方法的再现性,将同一批次和不同批次生产的Tb-ATP-Zn用于检测10 U·mL
2.6、细胞裂解物中蛋白激酶的检测
蛋白激酶是细胞功能的重要调节因子,与许多生理和病理状况密切相关。因此,细胞裂解物中蛋白激酶的测定对于研究蛋白激酶依赖的细胞生理过程和相关疾病的诊断至关重要。以Hela细胞为模型,利用Tb-ATP-Zn检测细胞裂解物中的蛋白激酶活性。
唯一的细胞裂解物没有诱导任何显著的Tb-ATP-Zn发光增强(这里“唯一的细胞裂解物”指的是在纯的细胞裂解物中检测),表明获得的Hela细胞裂解物中的PKA活性水平非常低。为了进一步验证所提出的方法用于实际样品分析的可行性,使用Tb-ATP-Zn测定细胞裂解物中的加标蛋白激酶(图14和图15)。即因商业的细胞裂解物中PKA的含量太低,故使用标准加入法。
将商业获得的HeLa细胞裂解物用水稀释10倍。将稀释的细胞裂解物(1000μL)、Tb-ATP-Zn悬浮液(30μL,0.4mg·mL−1)和一定体积的PKA储存溶液混合,用HEPES缓冲液(50mM,pH=7.4)将最终溶液体积调节至500μL。随后,在37℃孵育1小时后检测发光光谱,这里用293nm的激发波长检测发射光谱。
如图14,测定的发光强度随着蛋白激酶PKA浓度{(a〜n)(浓度依次为0, 0.001,0.005 ,0.01, 0.05, 0.07, 0.1, 0.3, 0.5, 0.7, 0.9, 1.1, 1.3, and 1.7 U·uL
利用加标回收法测细胞裂解液中的PKA,向15%的细胞裂解液中加入不同浓度PKA,在恒温水浴锅中(37℃)孵化1h,随后检测探针的荧光强度。结果细胞裂解物中PKA活性的测量结果如表1。
表1.细胞裂解物中PKA活性的测量结果
为了进一步检验该探针对生物样品中PKA活性测定的可行性,我们测试了不同模型的MCF-7细胞系(图16)。MCF-7细胞在没有激活剂和抑制剂的情况下裂解,表现出相对较低的发光强度。在添加毛喉素(forskolin,简称Fsk)和磷酸二酯酶抑制剂—3-异丁基-1-甲基黄嘌呤(常联合用于用于激活PKA的活性)后,随着其浓度的增加,发光强度进一步升高。相比之下,鞣花酸的加入则导致发光强度的减弱。这些结果表明,所提出的探针可用于测定复杂生物样品中蛋白激酶的活性。图16为Tb-ATP-Zn对MCF-7细胞裂解液中不同PKA活性的发光响应图,其中插图显示了从1到5的细胞裂解样品的激活剂和抑制剂浓度。
结论
综上所述,我们设计并制备了一种新型的Tb-ATP-Zn发光纳米探针,用于传感蛋白激酶。该检测基于探针内由蛋白激酶介导的ATP水解为ADP,以及相应的Tb-ATP-Zn转化为Tb-ADP-Zn,从而实现灵敏的发光开启响应。值得注意的是,设计的可以作为激酶活性的一体化发光分析,可以避免使用底物肽和额外的ATP分子。该方法还显示出高选择性和灵敏度,检测限为0.001U·uL
以上所述的仅是本发明的优选实施方式,但本发明的保护范围并不局限于此,应当指出,对于本领域的及任何熟悉本技术领域的技术人员来说,在不脱离本发明整体构思前提下,根据本发明的技术方案及其发明构思加以等同替换或改变,及作出的若干改变和改进,这些也应该视为本发明的保护范围。
- 一种镧基质的稀土氢氧化物纳米片发光材料及制备方法
- 一种化合物、聚集诱导发光探针及其制备方法与应用
- 一种检测生物体内硒半胱氨酸的生物发光探针及其制备方法和应用
- 一种碳点-金纳米簇复合物的比率荧光探针的制备方法和应用
- 一种用于血浆中唾液酸荧光检测的镧系配位聚合物荧光探针、制法和检测方法
- 一种用于血浆中唾液酸荧光检测的镧系配位聚合物荧光探针、制法和检测方法
