油菜开花关键基因BnaFT.A2作为油菜开花时间改良的分子标记及应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于分子标记技术领域,具体涉及油菜开花关键基因BnaFT.A2作为油菜开花时间改良的分子标记及应用。
背景技术
植物开花是从营养生长到生殖生长非常重要的一个阶段,植物适时开花决定植物的繁衍能力以及适应性,作物开花的早晚深刻影响着作物的高产稳产、品质和区域分布,育种家们将适宜的开花时间作为关键农艺性状之一。甘蓝型油菜是我国最重要的经济作物之一,近几年大力开发冬闲田种植油菜,而开发冬闲田,进行稻油轮作必须严格控制油菜熟期,早熟油菜可以解决与水稻的茬口矛盾,培育优良的早熟油菜是充分利用冬闲田和油菜产能提升的关键。早熟与早花相互联系,因此解析油菜开花调控的分子机制,寻找优良等位基因型,利用生物技术培育适应不同环境下的优良品种极为重要。
植物开花由遗传和环境信号决定,在拟南芥中,FLOWERINGLOCUS(FT)是成花调控网络中成花整合因子,编码磷脂酰乙醇胺结合蛋白,在叶片的韧皮部被光周期途径的CO特异性诱导,在春化途径中,FLC结合在FT的第一个内含子上的CArG盒来抑制FT的表达。FT蛋白产生后运输到顶端分生组织与14-3-3蛋白和FD转录因子结合形成成花素激活复合物FAC,激活下游SOC1、AP1和LFY的表达,进而调控植物开花。由于芸苔属作物经历了一系列的全基因复制,在甘蓝型油菜中出现了多个基因拷贝。明确BnaFT的各个拷贝的功能,对于解析甘蓝型开花调控网络的分子机制,扩大油菜的种植范围,具有重要意义。
发明内容
本发明的目的在于提供了油菜开花关键基因BnaFT.A2,开发甘蓝型油菜开花关键基因BnaFT.A2的特异性标记,并提供一种利用基因特异性标记辅助选择油菜开花时间改良的方法。
本发明提供了甘蓝型油菜BnaFT基因不同拷贝突变在调控油菜开花时间中的应用。
优选的,所述甘蓝型油菜BnaFT.A2基因不同单倍型包括分离自冬性甘蓝型油菜中部分序列如SEQ ID No.1所示的BnaFT.A2基因和分离自春性甘蓝型油菜中的部分序列如SEQ ID No.2所示的BnaFT.A2基因。
本发明提供了一条编辑甘蓝型油菜BnaFT基因所有拷贝型的sgRNA,所述sgRNA的核苷酸序列如SEQ ID No.7所示。
本发明提供一条分离自冬性甘蓝型油菜中的部分序列如SEQ ID No.1所示的BnaFT.A2基因。
本发明提供了一组用于甘蓝型油菜花期推迟的检测用分子标记引物对,所述检测用分子标记引物对以上述BnaFT.A2基因为目标基因。
优选的,包括核苷酸序列如SEQ ID No.5所述的上游引物和SEQ ID No.6所示的下游引物。
本发明提供了一条分离自春性甘蓝型油菜中的部分序列如SEQ ID No.2所示的BnaFT.A2基因。
本发明提供了一组用于甘蓝型油菜花期提前和早熟育种的分子标记引物对,所述分子标记引物对以上述BnaFT.A2基因为目标基因。
优选的,包括核苷酸序列如SEQ ID No.3所示的上游引物和SEQ ID No.4所示的下游引物。
本发明还提供了上述sgRNA、上述BnaFT.A2基因、上述检测用分子标记引物对、上述BnaFT.A2基因或上述分子标记引物对在油菜开花时间改良中的应用。
有益效果:本发明提供了甘蓝型油菜BnaFT基因不同拷贝突变在调控油菜开花时间中的应用,通过考察BnaFT不同拷贝发生突变的材料,发现BnaFT.A2编辑后推迟开花效应最明显,且不同BnaFT拷贝发生编辑的突变体在不同环境条件下具有差异。本发明还比对了从春性甘蓝型油菜和冬性甘蓝型油菜中分离的BnaFT.A2的基因序列,并设计了两种单倍型的特异性分子标记。
本发明还设计了一条敲除BnaFT四个拷贝的sgRNA,通过CRISPR方法转化春性甘蓝型油菜Xiaoyun中,获得编辑苗,T
附图说明
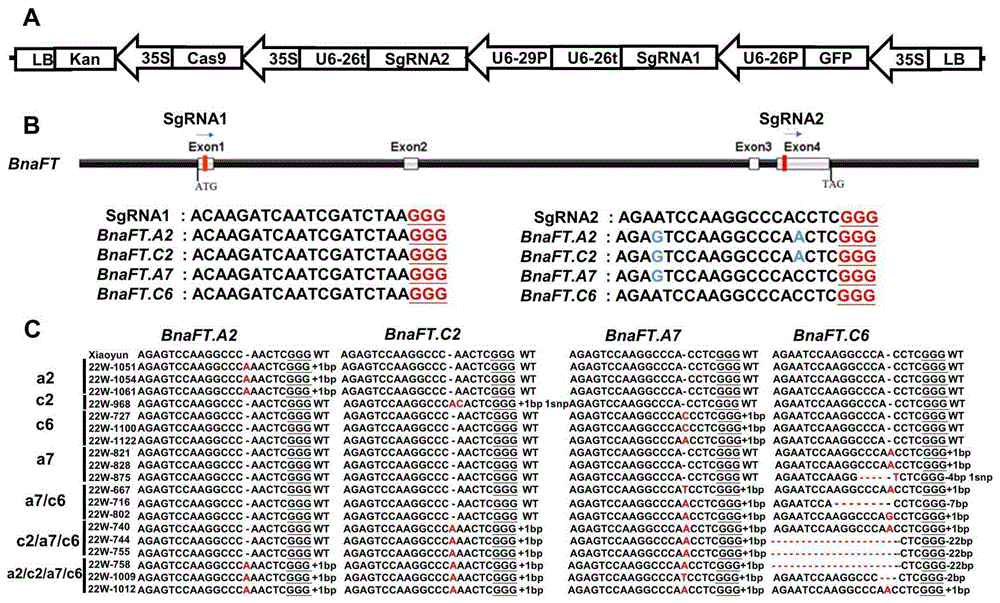
图1为利用CRISPR/Cas9诱导的BnaFT突变体的产生;A是CRSIPR/Cas9载体PKSE401载体元件组成;B为BnaFT基因的结构示意图,红色直线为SgRNA所处位置,箭头方向为SgRNA在基因组方向;C为T
图2为BnaFT突变体在不同环境下的开花时间统计图;A为温室条件下T
图3为不同BnaFT突变体在播种12天后顶端分生组织的形态和对下游花分生组织基因表达图;A为不同BnaFT突变体在播种12天后顶端分生组织的形态;B为不同BnaFT突变体在播种12天后BnaSOC1的表达;C为不同BnaFT突变体在播种12天后BnaAP1的表达;D为不同BnaFT突变体在播种12天后BnaLFY的表达;
图4为BnaFT.A2单倍型分析图;A为BnaFT.A2两种单倍型基因结构示意图;B为BnaFT.A2两种单倍型特异性标记;C为两种单倍型在自然群体中的开花时间统计分析;
图5为近等基因系比较两种BnaFT.A2单倍型的开花时间结果图;A为近等基因系的构建过程;B为两种近等基因系与轮回亲本Xiaoyun的开花时间统计分析。
具体实施方式
本发明提供了甘蓝型油菜BnaFT基因不同拷贝型作为分子标记在调控油菜开花时间中的应用。
本发明所述甘蓝型油菜的BnaFT基因有4个拷贝,其中2个拷贝在A7/C6染色体上,2个拷贝在A2/C2染色体上;而C2由于插入了转座元件而具有一个无活性拷贝。本发明所述甘蓝型油菜BnaFT.A2基因不同单倍型优选包括分离自冬性甘蓝型油菜中部分序列如SEQ IDNo.1所示的BnaFT.A2基因和分离自春性甘蓝型油菜中的部分序列如SEQ ID No.2所示的BnaFT.A2基因。
本发明实施例中下载了春性甘蓝型油菜Xiaoyun的BnaFT.A2的基因序列与冬性晚花材料Darmor-bzh的BnaFT.A2的基因序列,序列比对发现Xiaoyun序列在启动子上有一个2.365kb的大片段插入,同时Xiaoyun的FLC的结合位点CArG盒发生了变异,并且设计了两种单倍型的特异性分子标记,特异的在对应的序列中扩增出。分析这两种单倍型在自然群体中的开花时间,发现含有Xiaoyun-BnaFT.A2的材料开花时间显著早于含有Darmor-BnaFT.A2单倍型的材料。
本发明提供了一条编辑甘蓝型油菜BnaFT基因所有拷贝型的sgRNA,所述sgRNA的核苷酸序列如SEQ ID No.7所示:AGAATCCAAGGCCCACCTC。
本发明实施例中设计了2个敲除BnaFT四个拷贝的sgRNA,通过中间载体DT1DT2与PKSE401载体相连接,构建编辑BnaFT四个拷贝的CRISPR载体并转化Xiaoyun中,获得编辑苗,T
本发明提供一条分离自冬性甘蓝型油菜中的部分序列如SEQ ID No.1所示的BnaFT.A2基因。
本发明所述冬性甘蓝型油菜优选包括冬性晚花材料Darmor-bzh。
本发明提供了一组用于甘蓝型油菜花期推迟的检测用分子标记引物对,所述检测用分子标记引物对以上述BnaFT.A2基因为目标基因。
本发明所述检测用分子标记引物对优选包括:
正向引物FT-A2-HAPⅡ-F(SEQ ID No.5):CTGCTATTCAAATTTTAGGAGTAATAAC
反向引物FT-A2-HAPⅡ-R(SEQ ID No.6):AGTGCTTAGGTATAGCATTCATGTT。
本发明提供了一条分离自春性甘蓝型油菜中的部分序列如SEQ ID No.2所示的BnaFT.A2基因。
本发明所述春性甘蓝型油菜优选包括Xiaoyun。
本发明提供了一组用于甘蓝型油菜花期提前和早熟育种的分子标记引物对,所述分子标记引物对以上述BnaFT.A2基因为目标基因。
本发明所述分子标记引物对优选包括:
正向引物FT-A2-HAPⅠ-F(SEQ ID No.3):CAACCTGCTTCTCTCGCTATAAG
反向引物FT-A2-HAPⅠ-R(SEQ ID No.4):GTGAGGAAGATCGTGAGGAATGA。
本发明实施例中通过上述两对特异性引物进行扩增,结果显示只能在目标DNA中扩增出来,FT-A2-HAPⅠ-F/FT-A2-HAPⅠ-R只能在Xiaoyun中扩增出来,FT-A2-HAPⅡ-F/FT-A2-HAPⅡ-R只能在Darmor-bzh中扩增出来,且含有Xiaoyun-BnaFT.A2的品种的平均开花时间显著早于含有Darmor-BnaFT.A2的品种。
本发明还提供了上述sgRNA、上述BnaFT.A2基因、上述检测用分子标记引物对、上述BnaFT.A2基因或上述分子标记引物对在油菜开花时间改良中的应用。
本发明实施例中,以Darmor-BnaFT.A2的单倍型的材料Darmor-bzh为供体亲本,含有Xiaoyun-BnaFT.A2的单倍型的材料Xiaoyun为轮回亲本,利用分子标记进行选择来构建近等基因系,比较不同BnaFT.A2单倍型在同一背景条件下的开花时间差异,结果显示,Xiaoyun-BnaFT.A2和轮回亲本Xiaoyun的开花时间显著早于Darmor-BnaFT.A2。因此单倍型Xiaoyun-BnaFT.A2相比较于Darmor-BnaFT.A2是一种早花单倍型,具有促进油菜提前开花的作用。利用本发明,既可以保持油菜品种(系)优良的农艺性状,又可以改变开花时间,育种成本低且育种效率大大提高。
为了进一步说明本发明,下面结合实施例对本发明提供的油菜开花关键基因BnaFT.A2作为油菜开花时间的分子标记及应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
本发明实施例中,所用的种质资源Darmor-bzh(Chalhoub B,DenoeudF,Liu S,Parkin IA,Tang H,Wang X,Chiquet J,Belcram H,et al.2014.Plant genetics.Earlyallopolyploid evolution in the post-Neolithic Brassica napus oilseedgenome.Science 345,950-953.)和Xiaoyun(Wang P,SongY,Xie Z,WanM,Xia R,JiaoY,Zhang H,Yang G,Fan Z,Yang QY,Hong D.2023.Xiaoyun,a model accession forfunctional genomics research inBrassicanapus.Plant Commun,100727.)均为公开品种,由华中农业大学分子育种实验室提供。
实施例1
BnaFT突变体的创建和鉴定
(1)从CRISPR-p v2.0(http://crispr.hzau.edu.cn/cgi-bin/CRISPR2/CRISPR)选取两条sgRNA位于甘蓝型油菜的BnaFT基因的外显子上,如图1所示:
sgRNA1(SEQ ID No.8):ACAAGATCAATCGATCTA;
sgRNA2(SEQ ID No.7):AGAATCCAAGGCCCACCTCGGG;
设计四条引物进行CRISPR载体构建。引物序列如下:
FT-3-DT1-BsF(SEQ ID No.9):ATATATGGTCTCGATTGACAAGATCAAT CGATCTAAGTT;
FT-3-DT1-F0(SEQ ID No.10):TGACAAGATCAATCGATCTAAGTTTTA GAGCTAGAAATAGC;
FT-3-DT2-R0(SEQ ID No.11):AACGAGGTGGGCCTTGGATTCTCAATCTCTTAGTCGACTCTAC;
FT-3-DT2-BsR(SEQ ID No.12):ATTATTGGTCTCGAAACGAGGTGGGC CTTGGATTCTCAA。
(2)用中间载体DT1DT2(Xing,H.L.,Dong,L.,Wang,Z.P.,Zhang,H.Y.,Han,C.Y.,Liu,B.,Wang,X.C.,&Chen,Q.J.(2014).A CRISPR/Cas9 toolkit for multiplex genomeediting inplants.BMC plantbiology,14,327.)做模板和四条引物进行扩增,基因扩增采用Vazyme高保真酶试剂盒,50μl PCR反应体系包括:10ng中间质粒模板、25μL 2×PhantaMax Buffer、1μL dNTP Mix、1μL Phanta Max Super-Fidelity DNA Polymerase、4.4μLPCR primers(FT-3-DT1-BsF/FT-3-DT2-BsR:2μL;FT-3-DT1-F0/FT-3-DT2-R0:0.2μL浓度各为10μM)补充ddH
(3)PCR反应程序:95℃预变性3min;95℃变性30sec,55℃复性30sec,72℃延伸4min,共35个循环;72℃延伸10min,20℃20S;4℃保存。
(4)中间产物采用上海生工PCR产物回收试剂盒,具体步骤请参考试剂盒说明书。
(5)中间产物与PKSE401载体(Xing,H.L.,Dong,L.,Wang,Z.P.,Zhang,H.Y.,Han,C.Y.,Liu,B.,Wang,X.C.,&Chen,Q.J.(2014).A CRISPR/Cas9 toolkit formultiplexgenome editing inplants.BMC plantbiology,14,327.)进行酶切连接,使用NEB的BsaI酶切位点进行酶切,使用NEB的T4连接酶进行连接,连接体系包括:中间产物50ng、PKSE401100ng、1μL 10×NEB T4 ligase Buffer、1μLT4 ligase、1μL 10×BSA、1μLBsaI补充ddH
(6)大肠杆菌转化:将保存于-80℃中的DH5α感受态细胞放于冰上15min,让其融化;使用无菌枪头将10mL连接产物加入100μL的感受态细胞中,用手指轻轻吸打混合液数次,冰上放置20min,让其充分接触;将体系放入42℃水浴中热激90s,迅速取出后于冰水混合物上3min使其充分冷却;加入500μL不加任何抗生素的LB培养基中,37℃摇床复苏50min;将复苏后的感受态细胞于离心机中8000×g离心30s;倒去多数上清,余留100μL液体悬浮菌液,使用折叠过后的枪头将其均匀涂布于添加卡那霉素(浓度为50mg/L)的平板培养基中,吹干后,于37℃培养箱中倒置培养16h。
(7)阳性克隆检测:配置PCR反应,使用Vazyme公司的2×TaqMasterMix试剂盒10μL体系(5μL 2×Taq buffer,2.5μL ddH
U626-F(SEQ ID No.13):TGTCCCAGGATTAGAATGATTAGGC;
U629-R(SEQ ID No.14):AGCCCTCTTCTTTCGATCCATCAAC。
将平板上的单克隆用无菌牙签挑选到含有500μL加Kana抗生素的LB中,随后将牙签对应转移到PCR反应液中,使用94℃预变性3min;94℃变性30sec,60℃复性30sec,72℃延伸1min 40s,共35个循环;72℃延伸5min,20℃20S;4℃保存。随后进行琼脂糖凝胶电泳检测,挑选扩增条带正确的单克隆进行测序。
(9)阳性克隆测序:将阳性克隆的菌液,使用U626-F引物送天一华煜测序公司测序,测序后比对选用的sgRNA是否完全匹配。
(10)质粒提取:采用康为世纪生物科技有限公司的试剂盒,按照说明书上的步骤进行。
(11)农杆菌转化:具体操作步骤如下:用无水乙醇将电转杯清洗3次,置于超净工作台上吹干,放入冰盒中让其冷却;从-80℃冰箱取出感受态细胞置于冰上融化,写好编号,加0.5μL质粒于50μL的感受态中;将体系加入电转杯中,吸打混匀,轻磕使溶液下流;将电转杯擦干,置于电转仪上,1800V电击转化,连续双击pulse;加入200μL无抗液体LB,然后转到新的EP管中;置于28℃200r/min摇床摇菌40min,取100μL菌液涂布于含抗生素(100mL LB+100μLKan+100μL Gen+200μL Rif)的固体LB平板中,吹干,封口。
(12)农杆菌阳性克隆检测:具体操作步骤参考大肠杆菌阳性检测,使用的LB加入抗生素不一致,农杆菌阳性检测中LB的抗生素为(100mL LB+100μLKan+100μL Gen+200μLRif)。阳性克隆用于后续农杆菌的介导的遗传转化。
(13)农杆菌介导的遗传转化:具体步骤请参考油菜的遗传转化方法(Dai,C.,Li,Y.,Li,L.,Du,Z.,Lin,S.,Tian,X.,Li,S.,Yang,B.,Yao,W.,Wang,J.,Guo,L.,&Lu,S.(2020).An efficient Agrobacterium-mediated transformation method usinghypocotyl as explants for Brassica napus.Molecular Breeding,40.),受体材料为华中农业大学分子育种实验室提供的Xiaoyun。
(14)T
针对BnaFT的四个拷贝BnaFT.A2、BnaFT.C2、BnaFT.A7、BnaFT.C6的四对特异性引物为:
FT-A2-sg2-F(SEQ ID No.15):GCAATATCTTAGAAAATTATATGGGTACAC;
FT-A2-sg2-R(SEQ ID No.16):CACTGTTTGCCTACCGAGCTGTC;
FT-C2-sg2-F(SEQ ID No.17):GCAATATCTTAGAGAATTATGTGGGTACTC;
FT-C2-sg2-R(SEQ ID No.18):CACTGTTTGCCTACCGAGCTGTC;
FT-A7-sg2-F(SEQ ID No.19):GGTTGGTACAATATCGTAAAAGTC;
FT-A7-sg2-R(SEQ ID No.20):GAACAATACCAGCACGAGACGA;
FT-C6-sg2-F(SEQ ID No.21):GGTTGGTACAATTTCGTAAAAGGC;
FT-C6-sg2-R(SEQ ID No.22):GAACAACACCAGCACGATACGA。
使用特异性引物扩增阳性植株后送天一华煜测序公司测序,任何一个拷贝在sgRNA处出现双峰则统计为编辑植株。使用本实验室创建的油菜温室环境(Song Yixian,Duan Xingyu,Wang Pengfei,et al.Comprehensive Speed Breeding:a high-throughputand rapid generation system for long-day crops[J].Plant BiotechnologyJournal,2021.),种植编辑植株,收获T
(15)T
实施例2
BnaFT突变体开花时间考察
(1)对武汉田间种植的T
(2)将收获的纯合突变体种植在温室,温室环境同实施例1,如图2中A和C所示,只有a2和a2/c2/a7/c6突变体表现出推迟开花,其余突变体开花时间上没有差异。说明BnaFT.A2在所有BnaFT的拷贝种调控开花时间的功能最强。
实施例3
BnaFT突变对成花转换和下游基因的影响
(1)在温室下种植BnaFT突变体,取所有突变体在播种12天后的顶端分生组织,在体式显微镜下观察成花转换过程,结果如图3中A所示,BnaFT.A2突变后成花转换推迟,BnaFT.A2,BnaFT.C2,BnaFT.A7和BnaFT.C6四个拷贝突变后观察不到SAM点,而其他突变体不影响成花转换这个过程,与野生型Xiaoyun相比较没有差异。
(2)将a2、c2、a7、c6和Xiaoyun播种后12天的顶端分生组织进行RNA提取,每个样品取三个生物学重复,由于样品量小,生物学重复之间混样,RNA提取步骤参考ShanghaiPromega RNA提取试剂盒(货号LS1040),使用南京诺唯赞生物科技股份有限公司的反转录试剂盒(货号R212-02)将提取的RNA合成第一链cDNA,将反转录后的cDNA在-80℃保存进行后续实验。
(3)将稀释3倍后的反转录cDNA当作模板进行qRT-PCR反应。qPCR扩增使用的试剂是南京诺唯赞生物科技股份有限公司定量试剂(货号Q711-02)仪器为美国Bio-Rad公司的CFX96 Real-Time System。BnaSOC1、BnaAP1和BnaLFY的定量引物为:
BnaSOC1-qF(SEQ ID No.23):AGAGAATGCAACAAGCAGACAAG;
BnaSOC1-qR(SEQ ID No.24):TGATCAGAGAAACTTCAGCATCAC;
BnaAP1-qF(SEQ ID No.25):ATGGGAAGGGGAAGGGTTCAG
BnaAP1-qR(SEQ ID No.26):CAGCATCACATAACACTGAGATCTC;
BnaLFY-qF(SEQ ID No.27):GGACGAGGAGCTTGAGGATATG;
BnaLFY-qR(SEQ ID No.28):CGGAGAGTAGCAAATGACGG。
所用的内参基因为EpsinN-terminal homology(ENTH),引物为:
ENTH-qF(SEQ ID No.29):GTTTAGACCCGTTGCTGCTC,
ENTH-qR(SEQ ID No.30):TTGTCCATCTCAGCCATTTG。
qRT-PCR反应体系:cDNA模版2.0μL、0.8μLPCRprimers(正向和反向引物各0.4μL,浓度各为10μM)、10μL 2×ChamQ SYBR color qPCRMaster Mix,补充ddH
(4)以ENTH为内参基因进行BnaSOC1、BnaAP1和BnaLFY基因的相对定量,实验设置三个生物学重复和三个技术重复。结果如图3所示,BnaSOC1、BnaAP1和BnaLFY基因在a2突变体的表达量显著低于野生型,而其他突变体c2、a7和c6的BnaSOC1、BnaAP1和BnaLFY基因的表达与野生型没有差异。
实施例4
甘蓝型油菜BnaFT.A2单倍型的鉴定和特异性标记的开发
(1)下载测序品种Darmor-bzh(https://www.genoscope.cns.fr/brassicanapus/)和Xiaoyun(http://yanglab.hzau.edu.cn/BnGDXY/#/)的BnaFT.A2基因序列,基因ID分别为BnaA02g12130D和BnaA02G0152800XY。
(2)利用MUSCLE(https://www.ebi.ac.uk/Tools/msa/muscle/)对下载得到的以及下载获得的Darmor-bzh和Xiaoyun的BnaFT.A2启动子区以及基因区序列进行比对。
(3)以Darmor-bzh的BnaFT.A2序列为参考,对比结果如图1中A所示,Xiaoyun的BnaFT.A2的启动子比Darmor-bzh的BnaFT.A2的启动子插入了一个2.365kb的片段,同时在BnaFT.A2的第一个内含子FLC的结合区域CArG盒上发生了变异。
(4)针对两个材料上的BnaFT.A2基因的序列差异,设计了两对单倍型特异性引物:
单倍型Ⅰ:FT-A2-HAPⅠ-F(SEQ ID No.3)/FT-A2-HAPⅠ-R(SEQ ID No.4)单倍型Ⅱ:FT-A2-HAPⅡ-F(SEQ ID No.5)/FT-A2-HAPⅡ-R(SEQ ID No.6)。
(5)利用两种单倍型特异性引物对Darmor-bzh、Xiaoyun的DNA进行扩增。
PCR反应体系及程序:PCR体系(5μL2×Taqbuffer、2.5μLddH
PCR程序:94℃预变性3min;94℃变性30sec,60℃复性30sec,72℃延伸45s,共35个循环;72℃延伸5min,20℃20S。
(6)取扩增产物8μL,经过1.5%的琼脂糖凝胶电泳后,凝胶成像系统(Bio-Rad,GelDocTM XR+)照相并观察结果,如图4中B所示。两对特异性引物只能在目标DNA中扩增出来,FT-A2-HAPⅠ-F/FT-A2-HAPⅠ-R只能在Xiaoyun中扩增出来,FT-A2-HAPⅡ-F/FT-A2-HAPⅡ-R只能在Darmor-bzh中扩增出来。
(7)为了评估Xiaoyun-BnaFT.A2和Darmor-BnaFT.A2这两种单倍型在自然群体的开花时间,使用已经公布的甘蓝型油菜重测序数据库(Wu D,Liang Z,Yan T,XuY,Xuan L,Tang J,Zhou G,LohwasserU,Hua S,Wang H,Chen X,Wang Q,Zhu L,MaodzekaA,HussainN,Li Z,Li X,Shamsi IH,Jilani G,Wu L,Zheng H,Zhang G,Chalhoub B,Shen L,Yu H,Jiang L.2019.Whole-Genome Resequencing of a Worldwide Collection of RapeseedAccessions Reveals the Genetic Basis of Ecotype Divergence.MolPlant 12,30-43),对这两种单倍型进行单倍型分型(分析方法参考Yin S,Wan M,Guo C,Wang B,Li H,LiG,TianY,Ge X,King GJ,Liu K,Li Z,Wang J.2020.Transposon insertions withinalleles of BnaFLC.A10 and BnaFLC.A2 are associated with seasonal crop type inrapeseed.J Exp Bot 71,4729-4741.)。结果如图4中C所示,含有Xiaoyun-BnaFT.A2的品种的平均开花时间显著早于含有Darmor-BnaFT.A2的品种。
实施例5
BnaFT.A2近等基因系的构建
(1)根据图5中A所示流程,以含有Darmor-BnaFT.A2的Darmor-bzh为供体亲本,以含有Xiaoyun-BnaFT.A2单倍型的Xiaoyun为轮回亲本。先将供体亲本与轮回亲本进行杂交,所得杂交F
(2)将NIL(Darmor-BnaFT.A2)和NIL(Xiaoyun-BnaFT.A2)以及轮回亲本Xiaoyun种植在温室中,考察开花时间,结果如图5中B所示,NIL(Xiaoyun-BnaFT.A2)和轮回亲本Xiaoyun的开花时间显著早于NIL(Darmor-BnaFT.A2)。因此单倍型Xiaoyun-BnaFT.A2相比较于NIL(Darmor-BnaFT.A2)是一种早花单倍型,具有促进油菜提前开花的作用。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
