用于制备口腔癌微肿瘤模型的专用培养基以及相关的方法产品和应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于生物技术领域,涉及用于制备口腔癌微肿瘤模型的专用培养基以及相关的方法产品和应用。
背景技术
口腔癌具有转移率高、预后差的特点;晚期或转移患者的治愈率低,一线用药少、效果不佳;药物临床有效率不高,患者往往错过最佳治疗时间、并会引起诸多额外毒性副作用,造成医药资源的浪费。
根据病理类型的不同,口腔癌可分为鳞状细胞癌(以下简称鳞癌)和唾液腺腺癌(以下简称腺癌)。其中,口腔鳞癌最为常见。但是,由于早诊率偏低,过半口腔癌患者在就诊时已处在中晚期阶段。从长期治疗过程来看,口腔癌患者也存在局部复发和远处转移的可能。
总的来说,口腔癌的治疗模式复杂,无法依靠单一学科完全解决,其基本治疗原则是以手术为主的综合治疗,其他辅助方案包括放疗、化疗、靶向治疗和免疫治疗等。然而,目前对于口腔癌治疗方案的选择,大多依靠临床医生的经验或参考指南,缺乏更加精准、针对个体化差异的用药指导建议。因此,亟待在体外开发一种能够充分代表患者原始肿瘤组织生物学特征的拟人化模型,以促进口腔癌相关基础研究和转化应用的发展。
截至目前,已有多个体外肿瘤模型被用于评价或预测口腔癌对药物的敏感性。最为前沿的技术包括患者来源的肿瘤异体移植模型(patient-derived xenografts,PDX)和患者来源的肿瘤类器官模型(patient-derived organoids,PDO)。
基于小鼠建立的肿瘤异体移植模型PDX是将患者的肿瘤移植至免疫缺陷的小鼠身上,对活体小鼠进行药敏检测,具有建立简单、成功率高、能够模拟体内水平、可多次传代等特点。PDX小鼠中肿瘤组织与原始患者肿瘤样本能在分子生物学、组织学和病理学水平上保持较好一致性(90%以上),已被广泛用于肿瘤基础研究和转化研究领域。但是仍然有以下几个方面的局限性:第一,建模时间长,甚至需2-4个月以上;第二,传代过程中人的基质细胞会逐渐被小鼠基质细胞替代,导致肿瘤微环境的失真,影响研究结果的准确性;第三,肿瘤在移植和传代的过程中,PDX模型所成瘤会出现新的基因拷贝数变异(Copy numbervariations, CNVs),同时,原始肿瘤组织的CNVs在PDX模型所成瘤中会消失,影响其对抗癌药物的反应。此外,PDX的费用昂贵(5-10万),成功率也不高(50%-80%)。受限于以上问题,PDX无法作为患者实时个性化试药的“替身”,因此PDX模型的价值更多在于临床前阶段评估从而推动药物研发,或是用于探索与肿瘤发生发展和耐药相关的机制及干预策略。
类器官PDO模型是近年来最具代表性的体外肿瘤模型。传统类器官将患者细胞分离后进行诱导,并借助基质胶或支架等手段实现3D培养和药敏检测,同时能够一定程度保留来源组织或器官的特定结构和功能,相比细胞系2D培养更贴近细胞生长、互作和应激的真实情况。PDO可以较大程度的保留原始肿瘤组织的遗传学及表观遗传学特性、基因表达谱以及病理特征(80%以上),可一定程度上再现肿瘤细胞的异质性。但是PDO主要包含上皮细胞,不适合肿瘤与微环境的相互作用研究,在药物敏感性差异的分子机制研究上也存在一定局限性。此外,目前基于基质胶等手段的3D培养,仍然存在初始需求的细胞量大、培养周期较长(1-2个月)、培养成功率总体偏低(60%-80%)、复苏传代损失较大、建立和检测标准不统一、费用较高(需上万元)等问题,不适用于临床紧急用药以及微量样本的情况。
鉴于当前PDX和PDO模型存在的局限,亟待开发具有高通量、自动化、一体化特点的全新细胞模型,从而推动临床前有效性及安全性评价、加速新药研发、带动相关产业发展和患者受益。
发明内容
本发明的目的是提供用于制备口腔癌微肿瘤模型的专用培养基以及相关的方法产品和应用。
PTC:患者来源的类肿瘤细胞簇(Patient-Derived Tumor-like Cell Clusters),也即微肿瘤模型。
PTC可以很好地重现出原肿瘤患者的病理学特征、遗传学特征和细胞组成特征等,具有很高的科学研究价值和临床应用潜力。
第一,本发明保护一种用于制备口腔癌PTC的组合物,命名为PTC组合物。
PTC组合物的组成成分及其配比如下:
人EGF 10×10
具体的,PTC组合物的组成成分及其配比如下:
人EGF 50×10
以上任一所述成分,可以纯物质的形式存在,也可以高倍储备液的形式存在。
储备液具体可为如下储备液:人EGF储备液(1000×)、人bFGF储备液(1000×)、人HGF储备液(1000×)、人FGF-10储备液(1000×)、人Wnt-3a储备液(1000×)、人Noggin储备液(1000×)、人RSPO1储备液(1000×)、人IL-2储备液(1000×)、人IL-15储备液(1000×)、CHIR-99021储备液(10000×)、SB 202190储备液(1000×)、A 83-01储备液(100000×)、N-乙酰基-L-半胱氨酸储备液(1000×)、烟酰胺储备液(1000×)、Y-27632储备液(1000×)、人源胃泌素储备液(1000×)、霍乱毒素储备液(10000×)、L-乳酸储备液(1000×)、HEPES溶液(1M)、MEM非必需氨基酸溶液 (100×)、GlutaMAX添加剂(100×)、N-2(100×)、B-27(50×)、ITS-X(100×)、抗真菌抗生素(100×)、Primocin抗生素。
第二,本发明保护一种用于制备口腔癌PTC的培养基,命名为PTC培养基。
PTC培养基中,包括所述PTC组合物。
PTC培养基中,还包括基础培养基。
具体的,PTC培养基由PTC组合物和基础培养基组成。
PTC培养基含有如下成分:人EGF的浓度为10-100ng/mL、人bFGF的浓度为10-50ng/mL、人HGF的浓度为5-25ng/mL、人FGF-10的浓度为5-25ng/mL、人Wnt-3a的浓度为200-300ng/mL、人Noggin的浓度为100-200ng/mL、人RSPO1的浓度为250-500ng/mL、人IL-2的浓度为10-100ng/mL、人IL-15的浓度为10-100ng/mL、CHIR-99021的浓度为1.5-6μM、SB202190的浓度为5-10μM、A 83-01的浓度为0.25-1.25μM、N-乙酰基-L-半胱氨酸的浓度为0.5-2mM、烟酰胺的浓度为5-10mM、Y-27632的浓度为5-20μM、人源胃泌素的浓度为5-20nM、霍乱毒素的浓度为0.1-1nM、L-乳酸的浓度为1-10nM、HEPES的浓度为8-12mM、甘氨酸的浓度为0.08-0.12mM、L-丙氨酸的浓度为0.08-0.12mM、L-天冬酰胺的浓度为0.08-0.12mM、L-天冬氨酸的浓度为0.08-0.12mM、L-谷氨酸的浓度为0.08-0.12mM、L-脯氨酸的浓度为0.08-0.12mM、L-丝氨酸的浓度为0.08-0.12mM、L-丙氨酰-L-谷氨酰胺浓度为1.6-2.4mM、N-2的浓度为0.8-1.2%(体积百分含量)、B27的浓度为1.5-2.5%(体积百分含量)、ITS-X的浓度为0.8-1.2%(体积百分含量)、青霉素的浓度为100-200U/mL、链霉素的浓度为100-200μg/mL、两性霉素B的浓度为200-250ng/mL、Primocin的浓度为10-100μg/mL。
具体的,PTC培养基含有如下成分:所述用于制备口腔癌PTC的培养基中:人EGF的浓度为50ng/mL、人bFGF的浓度为20ng/mL、人HGF的浓度为20ng/mL、人FGF-10的浓度为20ng/mL、人Wnt-3a的浓度为200ng/mL、人Noggin的浓度为100ng/mL、人RSPO1的浓度为400ng/mL、人IL-2的浓度为20ng/mL、人IL-15的浓度为20ng/mL、CHIR-99021的浓度为3μM、SB 202190的浓度为10μM、A 83-01的浓度为1μM、N-乙酰基-L-半胱氨酸的浓度为1mM、烟酰胺的浓度为10mM、Y-27632的浓度为10μM、人源胃泌素的浓度为10nM、霍乱毒素的浓度为1nM、L-乳酸的浓度为5nM、HEPES的浓度为10mM、甘氨酸的浓度为0.1mM、L-丙氨酸的浓度为0.1mM、L-天冬酰胺的浓度为0.1mM、L-天冬氨酸的浓度为0.1mM、L-谷氨酸的浓度为0.1mM、L-脯氨酸的浓度为0.1mM、L-丝氨酸的浓度为0.1mM、L-丙氨酰-L-谷氨酰胺浓度为2mM、N-2的浓度为1%(体积百分含量)、B-27的浓度为2%(体积百分含量)、ITS-X的浓度为1%(体积百分含量)、青霉素浓度为100U/mL、链霉素浓度为100μg/mL、两性霉素B浓度为250ng/mL、Primocin的浓度为50μg/mL。
所述PTC培养基由人EGF储备液、人bFGF储备液、人HGF储备液、人FGF-10储备液、人Wnt-3a储备液、人Noggin储备液、人RSPO1储备液、人IL-2储备液、人IL-15储备液、CHIR-99021储备液、SB 202190储备液、A 83-01储备液、N-乙酰基-L-半胱氨酸储备液、烟酰胺储备液、Y-27632储备液、人源胃泌素储备液、霍乱毒素储备液、L-乳酸储备液、HEPES溶液、MEM非必需氨基酸溶液、GlutaMAX、N-2、B-27、ITS-X、抗真菌抗生素、Primocin抗生素和基础培养基组成。
具体的,所述基础培养基为Advanced DMEM/F12培养基。
具体的,所述PTC培养基由人EGF储备液(1000×)、人bFGF储备液(1000×)、人HGF储备液(1000×)、人FGF-10储备液(1000×)、人Wnt-3a储备液(1000×)、人Noggin储备液(1000×)、人RSPO1储备液(1000×)、人IL-2储备液(1000×)、人IL-15储备液(1000×)、CHIR-99021储备液(10000×)、SB 202190储备液(1000×)、A 83-01储备液(100000×)、N-乙酰基-L-半胱氨酸储备液(1000×)、烟酰胺储备液(1000×)、Y-27632储备液(1000×)、人源胃泌素储备液(1000×)、霍乱毒素储备液(10000×)、L-乳酸储备液(1000×)、HEPES溶液(1M)、MEM非必需氨基酸溶液 (100×)、GlutaMAX添加剂(100×)、N-2(100×)、B-27(50×)、ITS-X(100×)、抗真菌抗生素(100×)、Primocin抗生素和Advanced DMEM/F12培养基组成。
所述PTC培养基中的各个成分可独立包装,使用时再配制置为PTC培养基。
第三,本发明保护一种用于制备口腔癌PTC的试剂盒。
一种用于制备口腔癌PTC的试剂盒,包括所述PTC组合物。
所述试剂盒还包括样本清洗组合物、样本解离组合物和消化终止组合物。
样本清洗组合物的组成成分及其配比如下:青霉素100×10
样本解离组合物的组成成分及其配比如下:胶原蛋白酶I 150×10
消化终止组合物的组成成分及其配比如下:胎牛血清80-120ml、青霉素100×10
具体的,样本清洗组合物的组成成分及其配比如下:青霉素100×10
具体的,样本解离组合物的组成成分及其配比如下:胶原蛋白酶I 200×10
具体的,消化终止组合物的组成成分及其配比如下:胎牛血清100ml、青霉素100×10
以上任一所述成分,可以纯物质的形式存在,也可以高倍储备液的形式存在。
一种用于制备口腔癌PTC的试剂盒,包括所述PTC培养基。
所述试剂盒还包括样本清洗液、样本解离液和消化终止液。
所述样本清洗液中,含100-200U/mL青霉素、100-200μg/mL链霉素和10-20mMHEPES。
所述样本清洗液中,余量为PBS。
所述样本解离液中,含150-250U/mL胶原蛋白酶I、150-250U/mL胶原蛋白酶II、150-250U/mL胶原蛋白酶IV和0.5-2mM EDTA。
所述样本解离液中中,余量为PBS。
所述消化终止液中,含8-12%(体积百分含量)胎牛血清、100-200U/mL青霉素和100-200μg/mL链霉素。
所述消化终止液中,余量为DMEM培养基。
所述试剂盒还包括样本保存液。
所述试剂盒还包括细胞消化液。
所述试剂盒还包括细胞冻存液。
具体的,样本清洗液中,含100U/mL青霉素、100μg/mL链霉素和10mM HEPES。
具体的,样本清洗液由青霉素-链霉素溶液、HEPES溶液和PBS组成。
具体的,样本清洗液由青霉素-链霉素溶液(100×)、HEPES溶液(1M)和PBS组成。
具体的,样本解离液中,含200U/mL胶原蛋白酶I、200U/mL胶原蛋白酶II、200U/mL胶原蛋白酶IV和1mM EDTA。
具体的,样本解离液由胶原酶I、胶原酶II、胶原酶IV、EDTA溶液和PBS组成。
具体的,消化终止液中,含10%(体积百分含量)胎牛血清、100U/mL青霉素和100μg/mL链霉素。
具体的,消化终止液由胎牛血清、青霉素-链霉素溶液和DMEM培养基组成。
具体的,消化终止液由胎牛血清、青霉素-链霉素溶液(100×)和DMEM培养基组成。
所述样本保存液中,含1%-5%(体积百分含量)胎牛血清、100-200U/mL青霉素、100-200μg/mL链霉素和8-12mM HEPES。
所述样本保存液中,余量为HBSS。
具体的,样本保存液中,含2%(体积百分含量)胎牛血清、100U/mL青霉素、100μg/mL链霉素和10mM HEPES。
具体的,所述样本保存液由胎牛血清、青霉素-链霉素溶液、HEPES溶液和HBSS组成。
具体的,所述样本保存液由胎牛血清、青霉素-链霉素溶液(100×)、HEPES溶液(1M)和HBSS组成。
所述细胞消化液中,StemPro™ Accutase™ 细胞解离试剂的浓度为40%-60%(体积百分含量)、EDTA的浓度5-10mM、TrypLE™ Express酶的浓度为15%-25%(体积百分含量)。
所述细胞消化液中,余量为PBS。
具体的,所述细胞消化液中,StemPro™ Accutase™ 细胞解离试剂的浓度为50%(体积百分含量)、EDTA的浓度5mM、TrypLE™ Express酶的浓度为20%(体积百分含量)。
具体的,所述细胞消化液由 StemPro™ Accutase™ 细胞解离试剂、EDTA溶液、TrypLE™ Express酶和PBS组成。
具体的,所述细胞消化液由 StemPro™ Accutase™ 细胞解离试剂、EDTA溶液、TrypLE™ Express酶 (1×)和PBS组成。
所述细胞冻存液的组成为:15-20体积份Advanced DMEM/F-12培养基、1-3体积份DMSO和0.8-1.2体积份1g/100ml甲基纤维素水溶液。
具体的,所述细胞冻存液的组成为:由20体积份Advanced DMEM/F-12培养基、2体积份DMSO和1体积份1g/100ml甲基纤维素水溶液。
具体的,所述基础培养基为Advanced DMEM/F12培养基。
以上任一所述人EGF储备液(1000×)由人EGF、BSA和PBS组成,人EGF的浓度为50μg/mL,BSA的浓度为0.01g/mL。以上任一所述人bFGF储备液(1000×)由人bFGF、BSA和PBS组成,人bFGF的浓度为20μg/mL,BSA的浓度为0.01g/mL。以上任一所述人HGF储备液(1000×)由人HGF、BSA和PBS组成,人HGF的浓度为20μg/mL,BSA的浓度为0.01g/mL。以上任一所述人FGF-10储备液(1000×)由人FGF-10、BSA和PBS组成,人FGF-10的浓度为20μg/mL,BSA的浓度为0.01g/mL。以上任一所述人Wnt-3a储备液(1000×)由人Wnt-3a、BSA和PBS组成,人Wnt-3a的浓度为200μg/mL,BSA的浓度为0.01g/mL。以上任一所述人Noggin储备液(1000×)由人Noggin、BSA和PBS组成,人Noggin的浓度为100μg/mL,BSA的浓度为0.01g/mL。以上任一所述人RSPO1储备液(1000×)由人RSPO1、BSA和PBS组成,人RSPO1的浓度为400μg/mL,BSA的浓度为0.01g/mL。以上任一所述人IL-2储备液(1000×)由人IL-2、BSA和PBS组成,人IL-2的浓度为20μg/mL,BSA的浓度为0.01g/mL。以上任一所述人IL-15储备液(1000×)由人IL-15、BSA和PBS组成,人IL-15的浓度为20μg/mL,BSA的浓度为0.01g/mL。
以上任一所述CHIR-99021储备液(10000×)由CHIR-99021和DMSO组成,CHIR-99021的浓度为30mM。以上任一所述SB 202190储备液(1000×)由SB 202190和DMSO组成,SB202190的浓度为10mM。以上任一所述A 83-01储备液(100000×)由A 83-01和DMSO组成,A83-01的浓度为100mM。以上任一所述N-乙酰基-L-半胱氨酸储备液(1000×)由N-乙酰基-L-半胱氨酸和超纯水组成,N-乙酰基-L-半胱氨酸的浓度为1M。以上任一所述烟酰胺储备液(1000×)由烟酰胺和超纯水组成,烟酰胺的浓度为10M。以上任一所述Y-27632储备液(1000×)由Y-27632和超纯水组成,Y-27632的浓度为10mM。以上任一所述人源胃泌素储备液(1000×)由人源胃泌素和超纯水组成,人源胃泌素的浓度为10μM。以上任一所述霍乱毒素储备液(10000×)由霍乱毒素和溶解液组成,霍乱毒素的浓度为10μM;溶解液由Tris溶液、NaCl、叠氮化钠、EDTA溶液和超纯水组成,Tris的浓度为0.05M,NaCl的浓度为0.2M,叠氮化钠的浓度为3mM,EDTA的浓度为1mM。以上任一所述L-乳酸储备液(1000×)由L-乳酸和超纯水组成,L-乳酸的浓度为5μM。
人EGF(Recombinant Human EGF):Peprotech产品,货号AF-100-15。人bFGF(Recombinant Human FGF-basic):Peprotech产品,货号AF-100-18B。人HGF(RecombinantHuman HGF):Peprotech产品,货号100-39H。人FGF-10(Recombinant Human FGF-10):Peprotech产品,货号AF-100-26。人Wnt-3a(Recombinant Human Wnt-3a):R&D产品,货号5036-WN-500。人Noggin(Recombinant Human Noggin):近岸蛋白产品,货号CB89。人RSPO1(Recombinant Human RSPO1):近岸蛋白产品,货号CX83。人IL-2(Recombinant Human IL-2):Peprotech产品,货号200-02。人IL-15(Recombinant Human IL-15):Peprotech产品,货号200-15。
CHIR-99021,即Laduviglusib(CHIR-99021)HCl;CAS号为1797989-42-4;Selleck产品,货号S2924。SB 202190,即4-(4-氟苯基)-2-(4-羟基苯基)-5-(4-吡啶基)-1H-咪唑;CAS号为152121-30-7;Sigma产品,货号S7067。A 83-01,即3-(6-Methyl-2-pyridinyl)-N-phenyl-4-(4-quinolinyl)-1H-pyrazole-1-carbothioamide;CAS号为909910-43-6;Tocris产品,货号2939。N-乙酰基-L-半胱氨酸(N-acetyl-L-cysteine):CAS号为616-91-1;Sigma产品,货号A9165。烟酰胺(Nicotinamide):CAS号为98-92-0;Sigma产品,货号N0636。Y-27632,即Y-27632 dihydrochloride;CAS号为129830-38-2;MCE产品,货号HY-10583。人源胃泌素,即(Leu15)-Gastrin I (human);CAS号为39024-57-2;南京肽业生物科技有限公司,货号Pep12307。HEPES,即N-2-羟乙基哌嗪-N-2-乙烷磺酸。HEPES溶液(1M):Gibco产品,货号15630080。霍乱毒素(Cholera Toxin):CAS号为9012-63-9;Listlabs产品,货号100B。L-乳酸:CAS号为79-33-4;Solarbio产品,货号IL0540。
MEM非必需氨基酸溶液 (100×):含甘氨酸10mM、L-丙氨酸10mM、L-天冬酰胺10mM、L-天冬氨酸10mM、L-谷氨酸10mM、L-脯氨酸10mM和L-丝氨酸10mM。MEM非必需氨基酸溶液(100×):Gibco产品,货号11140050。GlutaMAX添加剂(100×):含200mM L-丙氨酰-L-谷氨酰胺。GlutaMAX添加剂(100×):Gibco产品,货号35050061。
N-2(100×),又称为N-2添加剂(100×)。N-2(100×):含10000mg/L人饱和转铁蛋白(Human Transferrin(Holo))、500mg/L胰岛素重组全链(Insulin Recombinant FullChain)、0.63mg/L孕酮(Progesterone)、1611mg/L腐胺(Putrescine)和0.52mg/L亚硒酸盐(Selenite)。N-2(100×):Gibco产品,货号17502001。B-27(50×),又称为B-27添加剂 (50×)。B-27(50×):含生物素(Biotin)、DL-α-生育酚乙酸酯(DL Alpha TocopherolAcetate)、DL-α-生育酚(DL Alpha-Tocopherol)、BSA(fatty acid free Fraction V)、过氧化氢酶(Catalase)、人重组胰岛素(Human Recombinant Insulin)、人转铁蛋白(HumanTransferrin)、超氧化物歧化酶(Superoxide Dismutase)、皮质酮(Corticosterone)、D-半乳糖(D-Galactose)、乙醇胺盐酸(Ethanolamine HCl)、还原型谷胱甘肽(Glutathione(reduced))、左旋肉碱盐酸(L-Carnitine HCl)、亚油酸(Linoleic Acid)、亚麻酸(Linolenic Acid)、孕酮(Progesterone)、腐胺(Putrescine 2HCl)、亚硒酸钠(SodiumSelenite)、三碘甲状腺原氨酸(T3(triodo-I-thyronine))。B-27(50×):Gibco产品,货号12587010。ITS-X(100×),又称为ITS-X添加剂 (100×)。ITS-X(100×): 含1000mg/L 胰岛素(Insulin)、550mg/L 转铁蛋白(Transferrin)、0.67mg/L 亚硒酸钠(Sodium Selenite)和200mg/L 乙醇胺(Ethanolamine)。ITS-X(100×):Gibco产品,货号51500056。
抗真菌抗生素(100×):含10000U/mL青霉素、10000µg/mL链霉素和25µg/mL两性霉素B。抗真菌抗生素(100×):Gibco产品,货号15240062。Primocin抗生素:含50mg/mlPrimocin。Primocin抗生素:InvivoGen产品,货号ant-pm-1。Advanced DMEM/F-12培养基:Gibco产品,货号12634010。
青霉素-链霉素溶液(100×) :含10000U/mL青霉素和10000 µg/mL链霉素。青霉素-链霉素溶液(100×) :Gibco产品,货号15140122。HBSS(Hanks' 平衡盐溶液):Gibco产品,货号14170161;pH6.7-7.8。PBS(磷酸盐缓冲液):Gibco产品,货号10010049;pH7.4。胎牛血清:Gibco产品,货号12484028。EDTA溶液(0.5M):Invitrogen产品,货号AM9261;pH8.0。Tris溶液(1M):Invitrogen产品,货号AM9850G;pH7.0。DMEM培养基:Gibco产品,货号11965092。
胶原酶I:Gibco产品,货号17100017。胶原酶II:Gibco产品,货号17101015。胶原酶IV:Gibco产品,货号17104019。StemPro™ Accutase™ 细胞解离试剂:Gibco产品,货号A1110501。TrypLE™ Express酶(1×):Gibco产品,货号12604013。
第四,本发明保护所述PTC组合物的应用。
所述PTC培养基的应用为如下(a1)或(a2):
(a1)在制备口腔癌PTC中的应用;
(a2)在制备产品中的应用;所述产品用于制备口腔癌PTC。
第五,本发明保护所述PTC培养基的应用。
所述PTC培养基的应用为如下(a1)或(a2):
(a1)在制备口腔癌PTC中的应用;
(a2)在制备产品中的应用;所述产品用于制备口腔癌PTC。
第六,本发明保护所述试剂盒在制备口腔癌PTC中的应用。
所述试剂盒的应用为如下(a1)或(a2):
(a1)在制备口腔癌PTC中的应用;
(a2)在制备产品中的应用;所述产品用于制备口腔癌PTC。
第七,本发明保护一种制备口腔癌PTC的方法。
一种制备口腔癌PTC的方法,包括如下步骤:对口腔癌实体瘤样本进行解离处理,然后获取细胞并用PTC培养基进行悬浮培养,得到口腔癌PTC。
所述悬浮培养的时间可为1-7天。
所述悬浮培养的时间可为2-3天。
具体的,所述方法中,利用样本解离液对口腔癌实体瘤样本进行解离处理。
所述方法具体包括如下步骤:
取口腔癌实体瘤样本,采用样本清洗液清洗,然后剪切;
然后,用样本解离液进行解离处理;
然后,加入消化终止液以终止解离;
然后,收集细胞,用PTC培养基悬浮培养,得到PTC。
所述方法具体包括如下步骤:
取口腔实体瘤样本,采用样本清洗液清洗,然后剪切;
然后,用样本解离液37℃消化1小时;
然后,加入消化终止液以终止解离,混匀,用100μm的滤网进行过滤,收集滤液,即为细胞悬液;
取所述细胞悬液,4℃、300g离心10分钟,收集细胞沉淀;
用PTC培养基重悬所述细胞沉淀,然后以10
所述样本清洗液如以上任一所述。
所述样本解离液如以上任一所述。
所述消化终止液如以上任一所述。
所述PTC培养基如以上任一所述。
第八,本发明保护上述方法制备得到的口腔癌PTC。
第九,本发明保护一种获取口腔癌肿瘤细胞的方法。
一种获取口腔癌肿瘤细胞的方法,包括如下步骤:
(1)按照上述方法制备口腔癌PTC;
(2)取所述PTC,消化后进行贴壁培养,获得原代肿瘤细胞。
所述方法具体包括如下步骤:
(1)按照上述方法制备口腔癌PTC;
(2)取所述PTC,采用细胞消化液消化,然后加入消化终止液终止消化,然后收集细胞并用PTC培养基贴壁培养,得到原代肿瘤细胞。
所述方法还包括如下步骤:
(3)收集原代肿瘤细胞,采用细胞消化液消化,然后加入消化终止液终止消化,然后收集细胞并用PTC培养基贴壁培养,得到P1代肿瘤细胞。
可按照步骤(3)重复传代,获得细胞系。
每代细胞均可加入细胞冻存液中,然后置于液氮中长期保存。
所述细胞消化液如以上任一所述。
所述消化终止液如以上任一所述。
所述PTC培养基如以上任一所述。
所述细胞冻存液如以上任一所述。
以上任一所述口腔癌PTC可用作口腔癌微肿瘤模型。
所述口腔癌微肿瘤模型可用于精准治疗的药敏检测或药物筛选。
所述口腔癌微肿瘤模型可用于其他科学研究。
EGF:表皮生长因子(epidermal growth factor)。
bFGF:碱性成纤维细胞生长因子(basic fibroblast growth factor)。
HGF:肝细胞生长因子(hepatocyte growth factor)。
FGF-10:成纤维细胞生长因子10(Fibroblast Growth Factor 10)。
Wnt-3a:细胞因子Wnt-3a。
Noggin:细胞因子Noggin 。
RSPO1:细胞因子RSPO1。
IL-2:白细胞介素2(Interleukin 2)。
IL-15:白细胞介素15(Interleukin 15)。
现有技术存在如下局限性:①样本需求量大:口腔癌类器官一般需要术后的大块样本(>1g)来培养;②培养和检测周期长:口腔癌类器官通常需8-11天才能形成,得到对应药敏数据则需要1个月左右;③培养成功率低:从已发表的文献数据来看,口腔癌类器官整体培养成功率为70%-80%;④构建成本高:目前市场上依赖基质胶为原料进行培养的口腔癌类器官成本为1.2-1.5万元/例;⑤缺乏免疫微环境:口腔癌类器官是基于肿瘤干细胞的诱导分化机制形成的,其主要成分是肿瘤上皮细胞;⑥与临床对应关系较差:从现有的文献报道数据来看,以口腔癌类器官为基础开展的临床试验,其一致性通常不高于85%。
相对于现有技术,本发明解决了如下技术问题:①样本需求量小:口腔癌微肿瘤可以对穿刺活检等微量样本(<200mg)完成培养;②培养和检测周期短:口腔癌微肿瘤只需要2-3天即可完成培养,且可以在1-2周内实现药敏检测;③培养成功率高:口腔癌微肿瘤的培养成功率大于95%;④构建成本低:口腔癌微肿瘤不依赖基质胶,其培养基含有特定细胞因子、无血清,总成本只需0.2-0.5万元/例;⑤保留免疫微环境:口腔癌微肿瘤是通过细胞自组装和增殖等机制形成的,其包含多种原始肿瘤组织来源的细胞类型,包括肿瘤上皮细胞、成纤维细胞、间质细胞、肥大细胞、巨噬细胞、自然杀伤细胞、B细胞、T细胞等,可以在很高程度上模拟肿瘤微环境;⑥与临床对应关系好:对于口腔癌微肿瘤来说,以目前开展的新辅助治疗临床试验为实施案例,其整体一致性大于90%。
本发明提供的方法口腔癌微肿瘤模型构建速度更快,检测周期更短、成本更低、规范化和标准化程度更高,可操作性和重复性更好。口腔癌微肿瘤模型可以代替患者试药,为部分耐药患者寻找非常规的或者跨适应症的二三线药物。口腔癌微肿瘤模型适合大面积推广,将进一步加快国内相关基础研究和转化应用的发展。利用本发明方法得到的口腔癌微肿瘤模型可以准确反应患者原病灶的各种特征,是肿瘤精准诊疗领域良好的科研实验模型和临床前实验模型。可以预见,这种培养方法在口腔癌的研究和临床诊断治疗领域具有广泛的应用前景。
附图说明
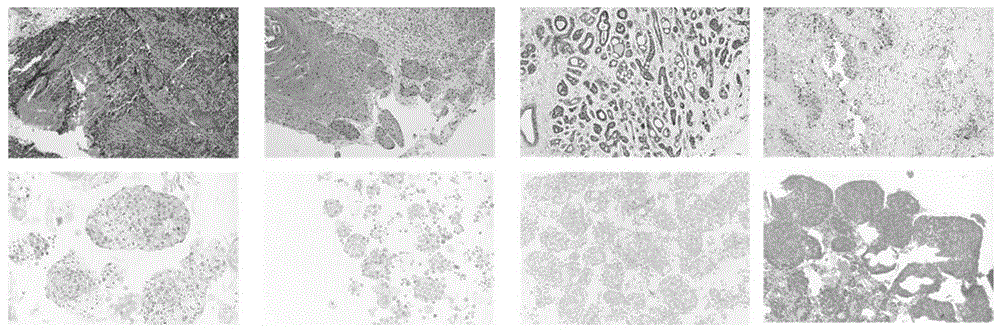
图1为实施例5的步骤四中将待检样本分别制作石蜡切片并进行HE染色的结果图。
图2为实施例5的步骤六中PTC进行免疫荧光标记后的结果图。
图3为实施例6中原代细胞、第一代肿瘤细胞、第二代肿瘤细胞的示例性照片。
图4为实施例7中Nikon Ti-U显微镜系统获取的各个时间点的PTC照片和结果。
图5为实施例8中采用不同培养基培养PCT的面积比较结果。
图6为采用A+X培养基培养4天后的PTC的照片和HE染色后的照片。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。如无特殊说明,以下实施例中的定量试验,均设置三次重复实验,结果取平均值。HEPES溶液(1M):含1M HEPES;Gibco产品,货号15630080。青霉素-链霉素溶液(100×) :Gibco产品,货号15140122;含10000U/mL青霉素和10000 µg/mL链霉素。HBSS(Hanks' 平衡盐溶液):Gibco产品,货号14170161;pH6.7-7.8。PBS(磷酸盐缓冲液):Gibco产品,货号10010049;pH7.4。胎牛血清:Gibco产品,货号12484028;试剂形态为液态。Advanced DMEM/F-12培养基:Gibco产品,货号12634010;试剂形态为液态。EDTA溶液(0.5M):Invitrogen产品,货号AM9261;pH8.0。Tris溶液(1M):Invitrogen产品,货号AM9850G;pH7.0。DMEM培养基:Gibco产品,货号11965092;试剂形态为液态。如无特殊说明,细胞培养箱设置均为:37℃,5% CO
实施例1、采集口腔癌实体瘤样本的方法
实体瘤样本的取样要求:可通过手术切除、穿刺活检或内镜活检方式获得,均在手术室中完成取样,避免微生物污染样本。手术切除样本应取血管丰富的新鲜癌症组织(新鲜组织应在离体30min内切取),避免坏死区域、纤维化区域、脂肪组织以及被电刀灼烧过的组织,最大程度保持组织中的细胞活力,要求肿瘤组织重量不少于50mg。穿刺活检样本需要2条以上,每条长度≥1cm。内镜活检样本需要至少2块,每块边长≥2mm。
实体瘤样本的取样后保存:取样样本在生理盐水内进行振荡清洗,去除污浊;然后立刻保存于含5ml样本保存液的15mL无菌离心管内。
样本保存液由胎牛血清、青霉素-链霉素溶液(100×)、HEPES溶液(1M)和HBSS组成。样本保存液中,含1%-5%(体积百分含量)胎牛血清、100-200U/mL青霉素、100-200μg/mL链霉素和8-12mM HEPES。样本保存液中,含2%(体积百分含量)胎牛血清、100U/mL青霉素、100μg/mL链霉素和10mM HEPES。
实体瘤样本也可用无菌冻存管保存。
实体瘤样本4℃运输。实体瘤样本采样24小时内进行PTC的制备。
实施例2、口腔癌微肿瘤培养基的制备
用于制备口腔癌微肿瘤培养基的试剂原料信息见表1。
/>
。
人EGF储备液(1000×)由人EGF、BSA和PBS组成,人EGF的浓度为50μg/mL,BSA的浓度为0.01g/mL。人bFGF储备液(1000×)由人bFGF、BSA和PBS组成,人bFGF的浓度为20μg/mL,BSA的浓度为0.01g/mL。人HGF储备液(1000×)由人HGF、BSA和PBS组成,人HGF的浓度为20μg/mL,BSA的浓度为0.01g/mL。人FGF-10储备液(1000×)由人FGF-10、BSA和PBS组成,人FGF-10的浓度为20μg/mL,BSA的浓度为0.01g/mL。人Wnt-3a储备液(1000×)由人Wnt-3a、BSA和PBS组成,人Wnt-3a的浓度为200μg/mL,BSA的浓度为0.01g/mL。人Noggin储备液(1000×)由人Noggin、BSA和PBS组成,人Noggin的浓度为100μg/mL,BSA的浓度为0.01g/mL。人RSPO1储备液(1000×)由人RSPO1、BSA和PBS组成,人RSPO1的浓度为400μg/mL,BSA的浓度为0.01g/mL。人IL-2储备液(1000×)由人IL-2、BSA和PBS组成,人IL-2的浓度为20μg/mL,BSA的浓度为0.01g/mL。人IL-15储备液(1000×)由人IL-15、BSA和PBS组成,人IL-15的浓度为20μg/mL,BSA的浓度为0.01g/mL。
CHIR-99021储备液(10000×)由CHIR-99021和DMSO组成,CHIR-99021的浓度为30mM。SB 202190储备液(1000×)由SB 202190和DMSO组成,SB 202190的浓度为10mM。A 83-01储备液(100000×)由A 83-01和DMSO组成,A 83-01的浓度为100mM。N-乙酰基-L-半胱氨酸储备液(1000×)由N-乙酰基-L-半胱氨酸和超纯水组成,N-乙酰基-L-半胱氨酸的浓度为1M。烟酰胺储备液(1000×)由烟酰胺和超纯水组成,烟酰胺的浓度为10M。Y-27632储备液(1000×)由Y-27632和超纯水组成,Y-27632的浓度为10mM。人源胃泌素储备液(1000×)由人源胃泌素和超纯水组成,人源胃泌素的浓度为10μM。霍乱毒素储备液(10000×)由霍乱毒素和溶解液组成,霍乱毒素的浓度为10μM;溶解液由Tris溶液、NaCl、叠氮化钠、EDTA溶液和超纯水组成,Tris的浓度为0.05M,NaCl的浓度为0.2M,叠氮化钠的浓度为3mM,EDTA的浓度为1mM。L-乳酸储备液(1000×)由L-乳酸和超纯水组成,L-乳酸的浓度为5μM。
口腔癌微肿瘤培养基由人EGF储备液(1000×)、人bFGF储备液(1000×)、人HGF储备液(1000×)、人FGF-10储备液(1000×)、人Wnt-3a储备液(1000×)、人Noggin储备液(1000×)、人RSPO1储备液(1000×)、人IL-2储备液(1000×)、人IL-15储备液(1000×)、CHIR-99021储备液(10000×)、SB 202190储备液(1000×)、A 83-01储备液(100000×)、N-乙酰基-L-半胱氨酸储备液(1000×)、烟酰胺储备液(1000×)、Y-27632储备液(1000×)、人源胃泌素储备液(1000×)、霍乱毒素储备液(10000×)、L-乳酸储备液(1000×)、HEPES溶液(1M)、MEM非必需氨基酸溶液 (100×)、GlutaMAX添加剂(100×)、N-2(100×)、B-27(50×)、ITS-X(100×)、抗真菌抗生素(100×)、Primocin抗生素和Advanced DMEM/F12培养基组成。
口腔癌微肿瘤培养基中:人EGF的浓度为50ng/mL、人bFGF的浓度为20ng/mL、人HGF的浓度为20ng/mL、人FGF-10的浓度为20ng/mL、人Wnt-3a的浓度为200ng/mL、人Noggin的浓度为100ng/mL、人RSPO1的浓度为400ng/mL、人IL-2的浓度为20ng/mL、人IL-15的浓度为20ng/mL、CHIR-99021的浓度为3μM、SB 202190的浓度为10μM、A 83-01的浓度为1μM、N-乙酰基-L-半胱氨酸的浓度为1mM、烟酰胺的浓度为10mM、Y-27632的浓度为10μM、人源胃泌素的浓度为10nM、霍乱毒素的浓度为1nM、L-乳酸的浓度为5nM、HEPES的浓度为10mM、甘氨酸的浓度为0.1mM、L-丙氨酸的浓度为0.1mM、L-天冬酰胺的浓度为0.1mM、L-天冬氨酸的浓度为0.1mM、L-谷氨酸的浓度为0.1mM、L-脯氨酸的浓度为0.1mM、L-丝氨酸的浓度为0.1mM、L-丙氨酰-L-谷氨酰胺浓度为2mM、N-2的浓度为1%(体积百分含量)、B-27的浓度为2%(体积百分含量)、ITS-X的浓度为1%(体积百分含量)、青霉素浓度为100U/mL、链霉素浓度为100μg/mL、两性霉素B浓度为250ng/mL、Primocin的浓度为50μg/mL。
口腔癌微肿瘤培养基是本发明的发明人通过大量预实验以及优化实验获得的,示例性的优化过程见实施例8。
实施例3、本发明建立的制备PTC的方法
1、取实施例1获得的实体瘤样本,采用样本清洗液至少清洗5次,如样本中存在坏死区域和脂肪组织,尽可能去除。
样本清洗液由青霉素-链霉素溶液(100×)、HEPES溶液(1M)和PBS组成。样本清洗液中,含100U/mL青霉素、100μg/mL链霉素和10mM HEPES。
2、完成步骤1后,将样本剪切成小块,然后用样本解离液37℃消化1小时(在消化过程中每15分钟用枪头进行吸吹)。
胶原酶I:Gibco产品,货号17100017;试剂形态为固态;根据说明书记载,该试剂活性大于125U/mg(使用时以125U/mg计)。
胶原酶II:Gibco产品,货号17101015;试剂形态为固态;根据说明书记载,该试剂活性大于125U/mg(使用时以125U/mg计)。
胶原酶IV:Gibco产品,货号17104019;试剂形态为固态;根据说明书记载,该试剂活性大于160U/mg(使用时以160U/mg计)。
样本解离液由胶原酶I、胶原酶II、胶原酶IV、EDTA溶液和PBS组成。样本解离液中,含200U/mL胶原蛋白酶I、200U/mL胶原蛋白酶II、200U/mL胶原蛋白酶IV和1mM EDTA。胶原蛋白酶I、胶原蛋白酶II、胶原蛋白酶IV和EDTA的作用为:水解结缔组织中的基质和胶原蛋白成分,从而使肿瘤细胞从组织中充分解离出来。
3、完成步骤2后,加入消化终止液以终止解离,混匀。
消化终止液由胎牛血清、青霉素-链霉素溶液(100×)和DMEM培养基组成。消化终止液中,含10%(体积百分含量)胎牛血清、100U/mL青霉素和100μg/mL链霉素。
4、完成步骤3后,用100μm的滤网进行过滤,收集滤液,即为细胞悬液。
5、取步骤4得到的细胞悬液,4℃、300g离心10分钟,收集细胞沉淀。
6、用口腔癌微肿瘤培养基(制备方法见实施例2)重悬步骤5获得的细胞沉淀,然后以10
7、完成步骤6后,用40μm滤网进行过滤,收集直径大于40μm的PTC。
实施例4、评价实施例3的方法的成功率
在知情同意的前提下,按照实施例1的方法采集95例口腔癌实体瘤样本,分别来自口腔癌患者的各个发病部位(舌、牙龈、颊、颌骨、口底、腮腺、咽、腭部等)。
95例口腔癌样本中,74例为鳞癌样本(其中,55例手术切除样本,2例穿刺活检样本,17例内镜活检样本),21例为腺癌样本(其中,18例手术切除样本,3例穿刺活检样本)。
取口腔癌实体瘤样本,按照实施例3的方法制备PTC。
完成实施例3的步骤6后,满足如下标准的定义为培养成功:在10×物镜下观察,对形成的细胞团进行长径、短径的测量,若在3个视野中均有长径大于25μm、长短径的比值小于3、且视野内细胞团数量大于10个的情况,则判断为培养成功。
74例鳞癌样本中,71例培养成功,3例培养失败(其中 1个穿刺活检样本由于细胞太少培养失败、2个手术切除样本由于细菌污染培养失败)。21例腺癌样本全部培养成功。整体培养成功率为92/95=96.8%。
实施例5、PTC作为口腔癌微肿瘤模型的全方面科研表征
一、单核苷酸多态性(SNP)
在知情同意的前提下,按照实施例1的方法采集4例口腔癌实体瘤样本及其癌旁组织(腺癌#43样本、腺癌#62样本、鳞癌#45样本、鳞癌#58样本),均为手术切除样本。
每个口腔癌实体瘤,制备3个待检样本,分别为原肿瘤组织(取实体瘤样本,按照实施例3的步骤1处理会后即为原肿瘤组织)、癌旁组织(取实体瘤样本相应的癌旁组织,按照实施例3的步骤1处理后即为癌旁组织)和PTC(取口腔癌实体瘤样本,按照实施例3的方法制备PTC)。
将待检样本分别提取基因组DNA,利用包括712个基因的筛选列表(北京基石生命科技有限公司,货号#1001000)检测SNP并比较SNP差异。以癌旁组织的检测结果为参比,分别统计原肿瘤组织和PTC与癌旁的差异SNP,并且列出其排名前列的交集基因。对于各个实体瘤样本,其PTC与原肿瘤组织的排名前列的SNP均很相似,其中腺癌#43样本SNP一致率为24/25=96%、腺癌#62样本SNP一致率为23/25=92%、鳞癌#45样本SNP一致率为23/25=92%、鳞癌#58样本SNP一致率为25/25=100%。示例性样本排名前列的SNP差异比对结果见表2。
/>
。
二、拷贝数差异性(CNV)
在知情同意的前提下,按照实施例1的方法采集2例口腔癌实体瘤样本(腺癌#25样本、鳞癌#35样本),均为手术切除样本。
每个口腔癌实体瘤样本,制备2个待检样本,分别为原肿瘤组织(取实体瘤样本,按照实施例3的步骤1处理会后即为原肿瘤组织)和PTC(取口腔癌实体瘤样本,按照实施例3的方法制备PTC)。
将待检样本分别提取基因组DNA,利用全外显子测序(WES)检测拷贝数差异性(CNV)。
对于各个实体瘤样本,其PTC与原肿瘤组织的CNV均保持高度一致。
三、基因表达差异
在知情同意的前提下,按照实施例1的方法采集3例口腔癌实体瘤样本(鳞癌#54样本、腺癌#62样本和鳞癌#58样本),均为手术切除样本。
每个口腔癌实体瘤样本,制备2个待检样本,分别为原肿瘤组织(取实体瘤样本,按照实施例3的步骤1处理会后即为原肿瘤组织)和PTC(取口腔癌实体瘤样本,按照实施例3的方法制备PTC)。
将待检样本分别提取总RNA,利用转录组测序(RNA-seq)检测PTC与原肿瘤组织的基因表达差异。结果见表3。对于鳞癌和腺癌来说,其总的相似度均大于0.97。而且每个肿瘤样本的数据(如鳞癌#54,与腺癌#62和鳞癌#58的相似度分别都小于0.96)只和自己对应的PTC的数据最相似,充分体现出不同样本之间的异质性。
。
四、病理组化
在知情同意的前提下,按照实施例1的方法采集4例口腔癌实体瘤样本(鳞癌1#样本、鳞癌#29样本、腺癌#25样本和腺癌#27样本),均为手术切除样本。
每个口腔癌实体瘤样本,制备2个待检样本,分别为原肿瘤组织(取实体瘤样本,按照实施例3的步骤1处理后即为原肿瘤组织)和PTC(取口腔癌实体瘤样本,按照实施例3的方法制备PTC)。
将待检样本分别制作石蜡切片并进行HE染色。
结果见图1(上面一行对应原肿瘤组织,下面一行对应PTC;自左至右,第1列对应鳞癌1#样本,第2列对应鳞癌#29样本,第3列对应腺癌#25样本,第4列对应腺癌#27样本)。对于鳞癌,PTC重现了其原始肿瘤组织的大致形态。对于腺癌,PTC保留了其具有腺泡样结构的形态。
五、免疫组化
在知情同意的前提下,按照实施例1的方法采集3例口腔癌实体瘤样本(鳞癌#1样本、腺癌#25样本和腺癌#27样本),均为手术切除样本。
每个口腔癌实体瘤样本,制备2个待检样本,分别为原肿瘤组织(取实体瘤样本,按照实施例3的步骤1处理会后即为原肿瘤组织)和PTC(取口腔癌实体瘤样本,按照实施例3的方法制备PTC)。
将待检样本分别制作石蜡切片并进行免疫组化。
对于鳞癌#1样本制备的待检样本分别采用针对如下抗原的抗体进行免疫组化:CK5/6 (基底细胞)、P40、P53(肿瘤标志物)、α-SMA (肌上皮)、CD44 (肿瘤干性标志物)、ki67 (增殖相关--核抗原)、EGFR。
对于腺癌#25样本制备的待检样本分别采用针对如下抗原的抗体进行免疫组化:EpCAM (上皮)、CD24 (肿瘤干性)、CK5 (基底细胞)、CD31 (内皮细胞)、CK7(腺上皮)、CD44(肿瘤干性标志物)、CK19 (腺上皮及导管上皮)、CD45 (免疫细胞)、P53 (肿瘤标志物)、Vimentin (间质)、P63 (肿瘤标志物)、α-SMA(肌上皮)、TUBB3 (神经)。
对于腺癌#27样本制备的待检样本分别采用针对如下抗原的抗体进行免疫组化:CD44(肿瘤干性标志物)、PancK、CD45(免疫细胞)、Muc-1、ki67(增殖相关--核抗原)、TUBB3(神经)、Vimentin (间质)、MuC5Ac(黏蛋白)。
鳞癌#1实体瘤样本的PTC与原肿瘤组织的病理结果完全一致,其中P53指标均为阴性(-);CK5/6、P40、α-SMA、CD44、ki67和EGFR指标均为阳性(+)。
腺癌#25属于腺癌中的腺样囊性癌实体瘤样本,其PTC与原肿瘤组织的病理结果完全一致,其中CD31、P53、TUBB3指标均为阴性(-);EpCAM、CD24、CK5、CK7、CD44、CK19、CD45、Vimentin、P63和α-SMA指标均为阳性(+)。
腺癌#27属于腺癌中的黏液表皮样瘤实体瘤样本,其PTC与原肿瘤组织的病理结果一致, 其中CD44、PancK、CD45、Muc-1、ki67、TUBB3、Vimentin和MuC5Ac指标均为阳性(+)。
结果表明,对于鳞癌和腺癌来说,PTC都能维持原肿瘤组织对于各分子标记物的阴性、阳性情况。
六、免疫荧光
在知情同意的前提下,按照实施例1的方法采集1例口腔癌实体瘤样本(腺癌#43样本),为手术切除样本。
取口腔癌实体瘤样本,按照实施例3的方法制备PTC。
取PTC,进行免疫荧光标记。
照片见图2。左图(CD20红色标记,CD56灰色标记,CD68蓝色标记,PanCK绿色标记)的CD20、CD56、CD68标记物分别染B细胞、自然杀伤细胞、巨噬细胞等;右图(CD3蓝色标记,CD45红色标记,Vimentin灰色标记,PanCK绿色标记)的CD3、CD45、Vimentin标记物分别染T细胞和成纤维细胞;PanCK染上皮细胞。结果表明,PTC中,大部分为肿瘤细胞(绿色),同时存在少量免疫细胞(红色、蓝色、灰色)。
本实施例的结果表明,经由口腔癌实体瘤样本培养得到的PTC从遗传特征(SNP、CNV、RNA-seq)、病理组化特征(HE、IHC)、细胞成分特征(免疫荧光)等多个方面与原肿瘤组织保持高度一致,可作为口腔癌微肿瘤模型。采用本发明的方法制备口腔癌微肿瘤模型,人为干扰小,标准化、规范化程度高。
实施例6、从口腔癌微肿瘤模型中获取原代肿瘤细胞
一、制备细胞消化液、消化终止液和细胞冻存液。
StemPro™ Accutase™ 细胞解离试剂:Gibco产品,货号A1110501;试剂形态为液态。TrypLE™ Express酶(1×):Gibco产品,货号12604013;试剂形态为液态。
细胞消化液由 StemPro™ Accutase™ 细胞解离试剂、EDTA溶液、TrypLE™Express酶 (1×)和PBS组成。细胞消化液中,StemPro™ Accutase™ 细胞解离试剂的浓度为50%(体积百分含量)、EDTA的浓度5mM、TrypLE™ Express酶的浓度为20%(体积百分含量)。
消化终止液由胎牛血清、青霉素-链霉素溶液(100×)和DMEM培养基组成。消化终止液中,含10%(体积百分含量)胎牛血清、100U/mL青霉素和100μg/mL链霉素。
细胞冻存液的组成:由20体积份Advanced DMEM/F-12培养基、2体积份DMSO和1体积份1g/100ml甲基纤维素水溶液。
二、从口腔癌微肿瘤模型中获取原代肿瘤细胞
1、在知情同意的前提下,按照实施例1的方法采集1例口腔癌实体瘤样本(鳞癌#79),为手术切除样本。
2、取口腔癌实体瘤样本,按照实施例3的方法制备PTC。
3、取PTC,采用细胞消化液消化(37℃,5-10min),加入消化终止液并混匀,离心之后弃上清,用口腔癌微肿瘤培养基重悬沉淀,然后加入到培养皿中进行培养(原代肿瘤细胞会慢慢贴壁)至细胞密度达到70%-90%,即为原代肿瘤细胞。
4、收集原代肿瘤细胞,采用细胞消化液消化,加入消化终止液并混匀,离心之后弃上清,用口腔癌微肿瘤培养基重悬沉淀,然后加入到培养皿中进行培养,至细胞密度达到70%-90%,即为第一代肿瘤细胞。
5、收集第一代肿瘤细胞,采用细胞消化液消化,加入消化终止液并混匀,离心之后弃上清,用口腔癌微肿瘤培养基重悬沉淀,然后加入到培养皿中进行培养,至细胞密度达到70%-90%,即为第二代肿瘤细胞。
按照上述步骤,可进行连续传代,从而获得细胞系。
每代细胞均可加入细胞冻存液中,然后置于液氮中长期保存。
原代细胞、第一代肿瘤细胞、第二代肿瘤细胞的示例性照片见图3(自左至右依次为原代细胞、第一代肿瘤细胞和第二代肿瘤细胞)。
实施例7、口腔癌微肿瘤模型的药敏检测
实施例5的结果表明,口腔癌实体瘤样本经由本发明的方法培养得到的PTC保持了原肿瘤组织的各项生物学特征,因此可以作为口腔癌微肿瘤模型代替患者在体外进行试药。
口腔癌微肿瘤培养基的制备方法见实施例2。
一、确定药敏检测方案
对于药敏检测方案,由于口腔癌患者来源的肿瘤组织样本大小不一,根据其获得的PTC的实际数目,可以计算出体外药敏检测的方案个数。一般地,优先选取临床上最关心的药物/药物组合进行药敏测试,推荐用一线、二线药物进行筛选。具体地,对于不同的癌种和癌症的不同进展阶段,其临床用药方案各不相同,可参照临床医生经验或指南确定最终药物筛选列表。特别地,对于一些癌症晚期的患者,可以在患者签署知情同意书的前提下开展跨适应症的多线药物筛选方案。具体地,推荐的候选药物方案如表4所示。
。
二、进行药物筛选
1、在知情同意的前提下,按照实施例1的方法采集1例口腔癌实体瘤样本(鳞癌#24样本),为手术切除样本。
2、取口腔癌实体瘤样本,按照实施例3的方法制备PTC。
3、取步骤2制备的PTC,用PBS清洗,然后4℃、300g离心10分钟,收集沉淀,然后用口腔癌微肿瘤培养基重悬,得到PTC悬液(每200μL含30-50个PTC)。
4、取96孔板,试验孔每孔加入198μL PTC悬液和2μL供试药物溶液,NC孔每孔加入200μL PTC悬液,通过Nikon Ti-U显微镜系统获取每孔中PTC的图片(0时刻)。供试药物溶液是将供试药物用PBS或DMSO溶解并稀释得到的。
5、完成步骤4后,将所述96孔板置于细胞培养箱中培养,分别于培养第4天和培养第7天后再次通过Nikon Ti-U显微镜系统获取每个孔中PTC的图片。
利用Nikon Ti-U显微镜的配套软件进行拍摄和图像分析,获得每孔的PTC图像面积。将0时刻孔的PTC图像面积作为参比1,计算培养4天后或培养7天后孔的PTC图像面积的相对值,结果见表5。最终的结果以加药前后微肿瘤总面积的大小变化作为判断标准。若<0.7则为有效杀伤,若在0.7-0.9之间,则为稳定,若在0.9-1.0之间,则为耐药,若>1,则为强烈耐药。
示例性照片见图4(自上至下,第1行对应0时刻,第2行对应第4天,第3行对应第7天;自左至右,第1列对应“顺铂+氟尿嘧啶+西妥昔单抗”处理,第2列对应“顺铂+氟尿嘧啶+多西他赛”,第3列对应NC)。可以发现,培养第4天的结果与培养第7天的结果趋势一致,因此药敏结果反馈的最短周期为处理培养1-2天+加药分析4-5天,大约6-7天(1周)。
不同药物对PTC的杀伤效果不尽相同。此次筛选的最优方案是顺铂+氟尿嘧啶+西妥昔单抗(0.17)以及卡铂+氟尿嘧啶(0.13)。
。
实施例8、口腔癌微肿瘤培养基的优化
1、在知情同意的前提下,按照实施例1的方法采集1例口腔癌实体瘤样本(鳞癌#16样本,内镜活检取样,190mg)。
2、完成步骤1后,将样本剪切成小块,然后用样本解离液(同实施例3)37℃消化1小时(在消化过程中每15分钟用枪头进行吸吹)。
3、完成步骤2后,加入消化终止液(同实施例3)以终止解离,混匀。
4、完成步骤3后,用100μm的滤网进行过滤,收集滤液,即为细胞悬液。
5、取步骤4得到的细胞悬液,4℃、300g离心10分钟,收集细胞沉淀。
6、用供试培养基重悬步骤5获得的细胞沉淀,然后以10
设置7种供试培养基,分别为:A,A+X,B,B+X,C,C+X以及NC。
NC:DMEM培养基。
A+X,即实施例2制备的口腔癌微肿瘤培养基。
A,与实施例2制备的口腔癌微肿瘤培养基相比,差异仅在于去除了L-乳酸。
B+X,由人EGF储备液(1000×)、人bFGF储备液(1000×)、人HGF储备液(1000×)、人MSP储备液(1000×)、人IL-2储备液(1000×)、人IL-15储备液(1000×)、Y-27632储备液(1000×)、Forskolin、L-乳酸储备液(1000×)、HEPES溶液(1M)、MEM非必需氨基酸溶液(100×)、GlutaMAX添加剂(100×)、B-27(50×)、ITS-X(100×)、青霉素-链霉素溶液和Advanced DMEM/F12培养基组成。B+X中:人EGF的浓度为50ng/mL、人bFGF的浓度为20ng/mL、人HGF的浓度为20ng/mL、人MSP的浓度为20ng/mL、人IL-2的浓度为20ng/mL、人IL-15的浓度为20ng/mL、Y-27632的浓度为10μM、Forskolin的浓度为5μM、 L-乳酸的浓度为5nM、HEPES的浓度为10mM、甘氨酸的浓度为0.1mM、L-丙氨酸的浓度为0.1mM、L-天冬酰胺的浓度为0.1mM、L-天冬氨酸的浓度为0.1mM、L-谷氨酸的浓度为0.1mM、L-脯氨酸的浓度为0.1mM、L-丝氨酸的浓度为0.1mM、L-丙氨酰-L-谷氨酰胺浓度为2mM、B-27的浓度为2%(体积百分含量)、ITS-X的浓度为1%(体积百分含量)、青霉素浓度为100U/mL、链霉素浓度为100μg/mL。
B,与B+X相比,差异仅在于去除了L-乳酸。
C+X由人EGF储备液(1000×)、人bFGF储备液(1000×)、人HGF储备液(1000×)、人Noggin储备液(1000×)、人RSPO1储备液(1000×)、人IL-2储备液(1000×)、人IL-15储备液(1000×)、SB 202190储备液(1000×)、A 83-01储备液(100000×)、N-乙酰基-L-半胱氨酸储备液(1000×)、烟酰胺储备液(1000×)、Y-27632储备液(1000×)、霍乱毒素储备液(10000×)、L-乳酸储备液(1000×)、HEPES溶液(1M)、GlutaMAX添加剂(100×)、N-2(100×)、B-27(50×)、ITS-X(100×)、抗真菌抗生素(100×)、Primocin抗生素、皮质醇、Forskolin和Advanced DMEM/F12培养基组成。C+X中:人EGF的浓度为50ng/mL、人bFGF的浓度为20ng/mL、人HGF的浓度为20ng/mL、人Noggin的浓度为100ng/mL、人RSPO1的浓度为400ng/mL、人IL-2的浓度为20ng/mL、人IL-15的浓度为20ng/mL、SB 202190的浓度为10μM、A83-01的浓度为1μM、N-乙酰基-L-半胱氨酸的浓度为1mM、烟酰胺的浓度为10mM、Y-27632的浓度为10μM、霍乱毒素的浓度为1nM、L-乳酸的浓度为5nM、HEPES的浓度为10mM、L-丙氨酰-L-谷氨酰胺浓度为2mM、N-2的浓度为1%(体积百分含量)、B-27的浓度为2%(体积百分含量)、ITS-X的浓度为1%(体积百分含量)、青霉素浓度为100U/mL、链霉素浓度为100μg/mL、两性霉素B浓度为250ng/mL、Primocin的浓度为50μg/mL、皮质醇的浓度为25ng/mL、Forskolin的浓度为5μM。
C,与C+X相比,差异仅在于去除了L-乳酸。
7、完成步骤6后,通过Nikon Ti-U显微镜系统获取每个孔中PTC的图片。利用配套软件进行拍摄和人工智能图像分析,获得每孔的PTC图像总面积。
结果见图5(纵坐标为PTC微肿瘤的面积,单位为mm
采用A+X培养基培养4天后的PTC的照片见图6的左图(明场,10X),该PTC制作石蜡切片并进行HE染色后的照片见图6的右图(10X)。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
