检测心血管病常见药物相关基因多态性的方法和试剂盒
文献发布时间:2024-04-18 19:59:31
技术领域
本申请涉及心血管病常见药物相关基因多态性检测技术领域,特别是涉及一种检测心血管病常见药物相关基因多态性的方法和试剂盒。
背景技术
心血管发病率、死亡率高居不下,且不断攀升,已经成为危害人民生命和健康的重大疾病,给医疗卫生带来了很大的挑战。对于心血管病,长期有规律的服用药物是控制病情的关键。临床上心血管病常见药物主要包括抗血栓药、降脂药、降压药、降糖药、抗血栓药物及抗心律失常药、抗心绞痛药、抗心力衰竭药等。药物基因组学研究和临床应用作为临床精准用药重要手段,越来越受到临床医生的重视。遗传因素是造成个体化用药显著差异的主要因素,有研究表明遗传因素导致的个体间药物代谢与效应差异平均占60%,甚至可达95%。对心血管病患者进行药物相关基因检测分型,是提高药物疗效和降低药物不良反应的有效方法。
药物相关基因检测的内容大部分来源于说明书、指南、遗传药理学知识库(PharmGKB)和文献的循证评价。根据药物药效和不良反应与对应基因多态性研究的相关性的证据级别将检测的药物相关基因分为4个等级。
(1)1级证据的基因位点,包括1A和1B,相关性最高,通常经过多次一定规模随机对照临床试验(RCT)论证,临床要求必须进行基因检测,才能进行个体化药物治疗。
(2)2级证据的基因位点,通常有临床研究论证过,临床建议进行基因检测,作为个体化药物治疗的依据。
(3)3级证据的基因位点,为有争议的研究论证,可选择性进行检测。
(4)4级证据的基因位点证据最少,仅有少量研究报道,仅作为提示。
此外,从卫生经济学方面考虑,检测的内容还可根据当地的基因频率做出适当的调整。
将药物基因组学应用在心血管疾病患者的个体化精准用药,不但能帮助患者选择更有效的药物,还能减少药物毒性的临床风险。
目前,检测药物相关基因多态性位点(SNPs)的基因技术主要包括一代测序(Sanger测序)、二代测序(NGS)、荧光PCR法及基因芯片法等。
Sanger测序可直接获取靶标基因序列,是SNP分型检测的金标准技术,不但可以检测已知SNP位点,还能检测未知SNP位点;并且,作为金标准还可以验证其他分型结果的准确性。但是由于通量低,每个反应仅能检测一个位点,且耗时长,开盖操作容易污染。
二代测序(NGS)以其高通量,高准确率占有大的优势,可以十分有效的解决目前对于临床上心脑血管疾病中临床样本基础上需要对多基因、多靶点检测这一难点,可以对77个基因,219个位点进行精准检测;但是大多数位点未经过临床数据的积累,可靠性还有待验证。另外,NGS技术高度依赖信息分析技术和昂贵的测序技术,成本高,周期长,20工作日左右,对于患者用药指导不及时,不适合大规模应用。
基因芯片法主要应用高度集成含有药物代谢及效应相关基因突变的互补寡核苷酸序列,设置阳性参考探针,对每个突变设置野生型基因探针和突变型基因探针而对每个位点进行基因分型。但是,该方法灵活度低,成本高,需要特殊的仪器设备,限制了其广泛应用。
荧光PCR法又分为荧光探针法、PCR毛细管电泳法及荧光探针熔解曲线法。qPCR仪器和平台普及度高,价格便宜,灵敏度高,特异性好,已经在是临床检测的最常用方法。荧光探针法其引物探针设计简单,闭管检测,不容易污染,但检测及分型通量低。PCR毛细管电泳法可以在一管内实现通过多重PCR,实现一管式扩增十几个基因上的几十个多态性位点,特异性高、灵敏度高、可靠性强、操作简便、实用性强、成本低,具备大批量检测的能力;但由于仪器昂贵,不容易普及,开盖操作,非常容易污染。荧光探针熔解曲线法,主要基于探针与靶标结合后退火的温度不同,Tm值不同来进行精准分型,该法相比于荧光探针法只需要一个探针可以检测每个位点的两种基因型,而荧光探针法需要两个标记不同的荧光探针才能做得到,因此每孔通量比荧光探针法高出一倍,特异性高、有效避免假阳性的出现,且操作简单、周期短、成本低。但该法灵敏度难以保证,尤其是扩增出单链不够多时容易出现假阴性情况。
因此,目前尚未有一套能够行之有效的适用于心血管疾病常见药物相关基因多态性检测的方案。
发明内容
本申请的目的是提供一种新的检测心血管病常见药物相关基因多态性的方法和试剂盒。
为了实现上述目的,本申请采用了以下技术方案:
本申请的一方面公开了一种检测心血管病常见药物相关基因多态性的方法,包括采用针对心血管病常见药物相关基因多态性位点设计的特异性的不对称PCR扩增引物对和特异性探针,对待测样本进行指数扩增和线性扩增,并利用熔解曲线法获得准确分型;不对称PCR扩增引物对中,上游引物作为限制性引物,下游引物作为非限制性引物;并且,限制性引物的Tm值比非限制性引物的Tm值高5-10℃;特异性探针为与野生位点或突变位点完全匹配,并且与反义链结合的荧光探针。
需要说明的是,本申请的方法将指数后线性扩增PCR,即本申请改进的不对称PCR扩增,与荧光熔解曲线法联合,组成一种新的技术方案,即LATEPCR-MMCA;本申请的方法,综合了荧光探针熔解曲线法的诸多优点,例如操作简单、特异性高,可以实现单管多重分型,无需开管检测,防止污染。最重要的是,本申请的方法,利用指数后线性扩增PCR技术能够在不对称PCR的基础上实现与对称PCR同等的扩增效率,因此灵敏度极高。可以对血液样本、口腔拭子样本,以及唾液、干血片等其他含人类基因组的样本,进行快速的心血管病常见药物相关基因多态性检测,为心血管疾病个体化用药提供参考。
本申请的一种实现方式中,心血管病常见药物相关基因多态性位点包括rs1065852、rs1057910、rs1799752、rs776746、rs5186、rs1801253、rs5065、rs1805128、rs10919035、rs10800397、rs12720441、rs4244285、rs4986893、rs12248560、rs429358、rs7412、rs2306283和rs4149056,共计18个位点。
本申请的一种实现方式中,包括将18个位点的特异性的不对称PCR扩增引物对和特异性探针分为若干组,每组中的各特异性探针的荧光标记不同,荧光淬灭基团相同或不同,每组分别进行多重PCR扩增和多色荧光熔解曲线法,实现一个反应同时检测至少两个位点。
本申请的一种实现方式中,将18个位点的特异性的不对称PCR扩增引物对和特异性探针分为五组,第一组由rs1065852、rs1057910、rs1799752、rs776746,四个位点的不对称PCR扩增引物对和特异性探针组成;第二组由rs5186、rs1801253、rs5065,三个位点的不对称PCR扩增引物对和特异性探针组成;第三组由rs1805128、rs10919035、rs10800397、rs12720441,四个位点的不对称PCR扩增引物对和特异性探针组成;第四组由rs4244285、rs4986893、rs12248560,三个位点的不对称PCR扩增引物对和特异性探针组成;第五组由rs429358、rs7412、rs2306283和rs4149056,四个位点的不对称PCR扩增引物对和特异性探针组成。
需要说明的是,将18个位点的特异性的不对称PCR扩增引物对和特异性探针分为五组,只是本申请的一种具体实现方案;本申请的方法能够利用多色荧光熔解曲线法,实现一个反应对多个位点进行同时检测;但是,多色荧光熔解曲线,依赖于实时荧光PCR仪能够检测的荧光通道数量;因此,本申请将18个位点分为五组,每组3-4位点,能够满足大部分的实时荧光PCR仪。可以理解,也可以根据实际情况,将18个位点分为三组或四组,只要能够确保各组中的引物和探针能够满足多重PCR扩增的需求即可。同样的,本申请的五组中,每组具体选择的位点也是基于多重PCR扩增的需求;在满足多重PCR扩增需求的情况下,各组中的位点和数量可以进行调整,在此不作具体限定。
还需要说明的是,如果仅仅是对18个位点进行检测,本申请可以根据需求将其分为3组、4组、5组或更多组;各组也可以根据多重PCR扩增的需求进行调整。但是,本申请的一种实现方式中,特定位点组成的五组,实际上具有不同的检测功能;因此,五组可以一起检测,作为综合的全面的心血管病常见药物相关基因多态性检测方案,也可以将五组拆开分别进行检测,例如可以只检测第一组和第二组,实现对5种降血压药物的相关基因多态性检测;又例如,只检测第三组,实现抗心律失常药物相关基因多态性检测;又例如,只检测第四组,实现抗血栓药物氯吡格雷相关基因多态性检测;又例如,只检测第五组,实现他汀类基础抗血脂药物相关基因多态性检测。
本申请的一种实现方式中,rs1065852不对称PCR扩增引物对的上游引物为Seq IDNo.1所示序列,下游引物为Seq ID No.2所示序列,特异性探针为Seq ID No.3所示序列;rs1057910不对称PCR扩增引物对的上游引物为Seq ID No.4所示序列,下游引物为Seq IDNo.5所示序列,特异性探针为Seq ID No.6所示序列;rs1799752不对称PCR扩增引物对的上游引物为Seq ID No.7所示序列,下游引物为Seq ID No.8所示序列,特异性探针为Seq IDNo.9所示序列;rs776746不对称PCR扩增引物对的上游引物为Seq ID No.10所示序列,下游引物为Seq ID No.11所示序列,特异性探针为Seq ID No.12所示序列;rs5186不对称PCR扩增引物对的上游引物为Seq ID No.13所示序列,下游引物为Seq ID No.14所示序列,特异性探针为Seq ID No.15所示序列;rs1801253不对称PCR扩增引物对的上游引物为Seq IDNo.16所示序列,下游引物为Seq ID No.17所示序列,特异性探针为Seq ID No.18所示序列;rs5065不对称PCR扩增引物对的上游引物为Seq ID No.19所示序列,下游引物为Seq IDNo.20所示序列,特异性探针为Seq ID No.21所示序列;rs1805128不对称PCR扩增引物对的上游引物为Seq ID No.22所示序列,下游引物为Seq ID No.23所示序列,特异性探针为SeqID No.24所示序列;rs10919035不对称PCR扩增引物对的上游引物为Seq ID No.25所示序列,下游引物为Seq ID No.26所示序列,特异性探针为Seq ID No.27所示序列;rs10800397不对称PCR扩增引物对的上游引物为Seq ID No.28所示序列,下游引物为Seq ID No.29所示序列,特异性探针为Seq ID No.30所示序列;rs12720441不对称PCR扩增引物对的上游引物为Seq ID No.31所示序列,下游引物为Seq ID No.32所示序列,特异性探针为Seq IDNo.33所示序列;rs4244285不对称PCR扩增引物对的上游引物为Seq ID No.34所示序列,下游引物为Seq ID No.35所示序列,特异性探针为Seq ID No.36所示序列;rs4986893不对称PCR扩增引物对的上游引物为Seq ID No.37所示序列,下游引物为Seq ID No.38所示序列,特异性探针为Seq ID No.39所示序列;rs12248560不对称PCR扩增引物对的上游引物为SeqID No.40所示序列,下游引物为Seq ID No.41所示序列,特异性探针为Seq ID No.42所示序列;rs429358不对称PCR扩增引物对的上游引物为Seq ID No.43所示序列,下游引物为Seq ID No.44所示序列,特异性探针为Seq ID No.45所示序列;rs7412不对称PCR扩增引物对的上游引物为Seq ID No.46所示序列,下游引物为Seq ID No.47所示序列,特异性探针为Seq ID No.48所示序列;rs2306283不对称PCR扩增引物对的上游引物为Seq ID No.49所示序列,下游引物为Seq ID No.50所示序列,特异性探针为Seq ID No.51所示序列;rs4149056不对称PCR扩增引物对的上游引物为Seq ID No.52所示序列,下游引物为Seq IDNo.53所示序列,特异性探针为Seq ID No.54所示序列。
本申请的一种实现方式中,下游引物的浓度为上游引物浓度的5-20倍。
需要说明的是,本申请虽然采用的是不对称PCR扩增的基本原理,先进行指数扩增再进行线性扩增;但是,与常规的不对称PCR要求限制性引物与非限制性引物的最佳比例为1:50-1:100不同的是,本申请对上游引物和下游引物的用量配比有特殊要求。本申请研究发现,在本申请的应用中,限制性引物的用量是关键因素,限制性引物量过多,则产物主要是双链DNA;限制引物量过少,在前几轮PCR扩增循环中就被耗尽,从而导致单链的产量减少。并且,由于引物浓度会影响引物反应的Tm值,当引物浓度比较低时,其Tm值会下降,导致退火时出现效率低因而出现扩增效率下降的情况。本申请在不对称PCR的基础上发展出Linear-After-The-Exponential-PCR(LATE-PCR,指数后线性PCR),使数量限制的引物比过量的引物的解链温度更高,从而维持较高的反应效率。因此,本申请优选的反应体系中,限制性引物的浓度为0.025-0.1μM,非限制性引物的浓度为0.25-1.0μM,并且非限制性引物的浓度为限制性引物浓度的5-20倍。在本申请的一种实现方式中,还对反应体系中的特异性探针的浓度进行了限定,优选为0.1~0.4μM。
本申请的另一方面公开了一种检测心血管病常见药物相关基因多态性的试剂盒,其包括第一反应液、第二反应液、第三反应液、第四反应液和第五反应液中的至少一组;第一反应液中含有rs1065852、rs1057910、rs1799752、rs776746,四个位点的不对称PCR扩增引物对和特异性探针;第二反应液中含有rs5186、rs1801253、rs5065,三个位点的不对称PCR扩增引物对和特异性探针;第三反应液中含有rs1805128、rs10919035、rs10800397、rs12720441,四个位点的不对称PCR扩增引物对和特异性探针;第四反应液中含有rs4244285、rs4986893、rs12248560,三个位点的不对称PCR扩增引物对和特异性探针;第五反应液中含有rs429358、rs7412、rs2306283和rs4149056,四个位点的不对称PCR扩增引物对和特异性探针;不对称PCR扩增引物对中,上游引物作为限制性引物,下游引物作为非限制性引物;并且,限制性引物的Tm值比非限制性引物的Tm值高5-10℃;特异性探针为与野生位点或突变位点完全匹配,并且与反义链结合的荧光探针。
需要说明的是,本申请的试剂盒实际上就是将本申请的方法中,将18个位点的引物和探针分为五组的技术方案,为了便于使用,将五组的引物和探针分别组合成第一至第五反应液。可以理解,如前面所描述,本申请的试剂盒中五组反应液可以一起使用,使其作为综合的全面的心血管病常见药物相关基因多态性检测试剂盒;也可以将第一至第五反应液分开使用,例如只使用第一反应液和第二反应液,使得试剂盒能够检测5种降血压药物的相关基因多态性;或者,只使用第三反应液,使得试剂盒能够检测抗心律失常药物相关基因多态性;或者,只使用第四反应液,使得试剂盒能够检测抗血栓药物氯吡格雷相关基因多态性;又或者,只使用第五反应液,使得试剂盒能够检测他汀类基础抗血脂药物相关基因多态性。
因此,本申请的试剂盒也可以是包括以下几种组合的至少一组:
(1)第一反应液和第二反应液;
(2)第三反应液;
(3)第四反应液;
(4)第五反应液。
以上四种组合,每种组合都具有一种功能,例如检测降血压药物相关基因多态性、抗心律失常药物相关基因多态性、抗血栓药物氯吡格雷相关基因多态性、他汀类基础抗血脂药物相关基因多态性。四种组合可以单独使用,也可以一起使用。
本申请的一种实现方式中,各组中各位点的引物和探针、以及引物和探针的用量或配比都可以参考本申请的检测心血管病常见药物相关基因多态性的方法,在此不累述。
需要说明的是,本申请的试剂盒中各组引物的关键在于,既能够特异性的用于各位点检测,又能够很好的满足多重PCR扩增的需求,使得各组内部各位点的引物和探针在进行多重PCR扩增时的相互影响降低,即不影响或者尽量少的影响各位点引物和探针各自的扩增效率。
可以理解,为了实现各组内部的多重PCR扩增和检测,第一反应液中,rs1065852、rs1057910、rs1799752、rs776746,四个位点的特异性探针分别具有不同的荧光标记,以及相同或不同的荧光淬灭基团;第二反应液中,rs5186、rs1801253、rs5065,三个位点的特异性探针分别具有不同的荧光标记,以及相同或不同的荧光淬灭基团;第三反应液中,rs1805128、rs10919035、rs10800397、rs12720441,四个位点的特异性探针分别具有不同的荧光标记,以及相同或不同的荧光淬灭基团;第四反应液中,rs4244285、rs4986893、rs12248560,三个位点的特异性探针分别具有不同的荧光标记,以及相同或不同的荧光淬灭基团;第五反应液中,rs429358、rs7412、rs2306283和rs4149056,四个位点的特异性探针分别具有不同的荧光标记,以及相同或不同的荧光淬灭基团。
至于具体的荧光基团可以参考现有技术,例如各组反应液中的特异性探针的荧光标记不重复的选自FAM、VIC、ROX、HEX、TET、JOE、Cy3、Cy5、TAMRA、Texas Red、Quasar 670、CY5.5;至于荧光淬灭基团,则根据所选择的荧光基团可重复的选自Dabcyl、BHQ-1、QYS-7、BHQ-2、TAMRA、Eclipse、Int BHQ1 dT。
本申请的一种实现方式中,第一反应液中还含有Taq聚合酶、dNTPs、dUTP、UNG酶和PCR反应Buffer;第二反应液中还含有Taq聚合酶、dNTPs、dUTP、UNG酶和PCR反应Buffer;第三反应液中还含有Taq聚合酶、dNTPs、dUTP、UNG酶和PCR反应Buffer;第四反应液中还含有Taq聚合酶、dNTPs、dUTP、UNG酶和PCR反应Buffer;第五反应液中还含有Taq聚合酶、dNTPs、dUTP、UNG酶和PCR反应Buffer。
需要说明的是,本申请试剂盒的关键在于将五组位点的引物和探针各自组合在一起形成第一至第五反应液,至于反应液中还含有Taq聚合酶、dNTPs、dUTP、UNG酶和PCR反应Buffer,只是为了方便使用;这些成分也可以在使用时再与引物和探针组合。
本申请的一种实现方式中,本申请的试剂盒还包括阴性对照品和阳性对照品;阴性对照品为Nuclease-Free Water,阳性对照品为rs1065852、rs1057910、rs1799752、rs776746、rs5186、rs1801253、rs5065、rs1805128、rs10919035、rs10800397、rs12720441、rs4244285、rs4986893、rs12248560、rs429358、rs7412、rs2306283和rs4149056,共计18个位点的基因的突变型和野生型的质粒的混合液。
需要说明的是,采用Nuclease-Free Water作为阴性对照品只是本申请的一种实现方式中最简单方便,且成本较低的一种方式,不排除还可以采用其他的不含有检测靶标的溶液作为阴性对照品,例如不含靶标的质粒溶液。同样的,采用突变型和野生型的质粒的混合液作为阳性对照品只是为了提供一种相对较稳定的阳性对照品;也可以直接采用含有扩增靶标片段的核酸溶液作为阳性对照品。
本申请的试剂盒中,下游引物的浓度为上游引物浓度的5-20倍。
需要说明的是,本申请的试剂盒中,第一至第五反应液,实际上就是直接进行多重PCR扩增的反应液,为了能够获得足够的单链反应产物,本申请优选下游引物的浓度为上游引物浓度的5-20倍。
由于采用以上技术方案,本申请的有益效果在于:
本申请检测心血管病常见药物相关基因多态性的方法,将指数后线性扩增PCR与荧光熔解曲线法联合,具有灵敏度高、特异性强、操作简单等优点,能够对各种含有基因组的样本进行检测,快速、准确的获得心血管病常见药物相关基因多态性检测结果。
附图说明
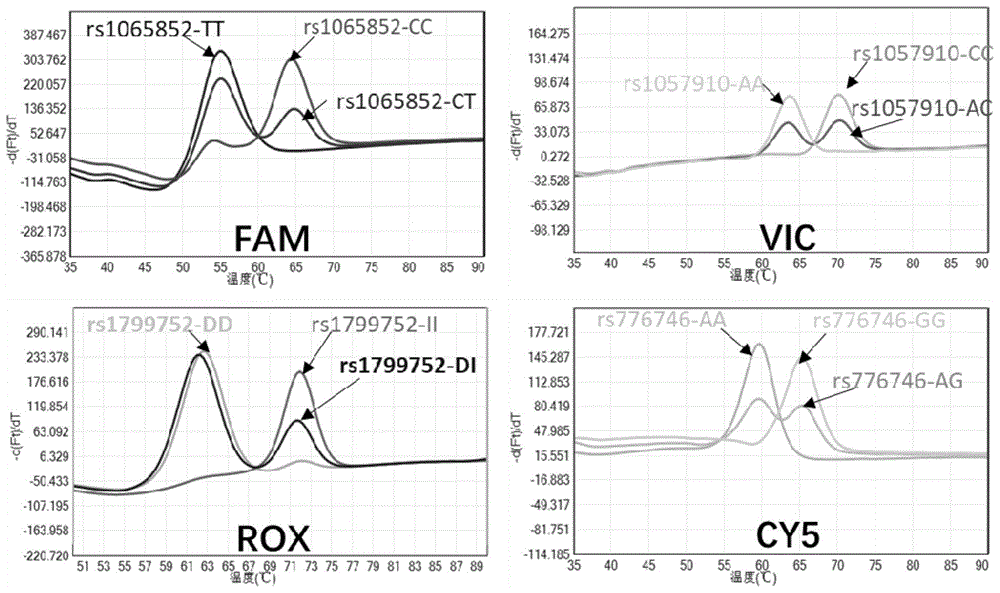
图1是本申请实施例中第一反应液对降血压药物相关基因多态性位点的精准分型检测结果;
图2是本申请实施例中第二反应液对降血压药物相关基因多态性位点的精准分型检测结果;
图3是本申请实施例中第三反应液对心率失常药物相关基因多态性位点的精准分型检测结果;
图4是本申请实施例中第四反应液对抗血栓药物相关基因多态性位点的精准分型检测结果;
图5是本申请实施例中第五反应液对降血脂药物相关基因多态性位点的精准分型检测结果;
图6是本申请实施例中检测口腔拭子样本(低浓度)的第一反应液中4个基因多态性位点的精准分型结果。
具体实施方式
尽管已经存在多种技术应用在各种药物基因检测领域,但目前这些技术仍然存在一些局限性和不足,且并没有比较完善的针对心血管疾病常见药物相关基因多态性检测的技术方案。现有技术的局限性如表1所示。
表1现有检测技术的局限性
本申请针对现有检测技术的不足,研发了一种快速、精准系统地检测心血管疾病常用药物相关基因多态性的方法和试剂盒,即指数后线性扩增PCR与荧光熔解曲线法联合,具体包括,采用针对心血管病常见药物相关基因多态性位点设计的特异性的不对称PCR扩增引物对和特异性探针,对待测样本进行指数扩增和线性扩增,并利用熔解曲线法获得准确分型。其中,不对称PCR扩增引物对的上游引物作为限制性引物,下游引物作为非限制性引物;并且,限制性引物的Tm值比非限制性引物的Tm值高5-10℃;特异性探针为与野生位点或突变位点完全匹配,并且与反义链结合的荧光探针。
本申请的方法和试剂盒主要解决的技术问题以及和现有检测技术相比的特点如表2所示。
表2本申请检测方法的特点
本申请的心血管病常见药物相关基因多态性检测方法和试剂盒,利用指数后线性PCR耦合多色荧光熔解曲线法,本申请使用的不对称PCR,可选择性的扩增出靶标DNA的一条链,从而与荧光标记的探针结合。反应中限制一个引物的加入量,随着这一引物的用尽,后续的扩增中另一过量的引物延伸的产物量大大过量。这一技术的关键是使用的限制引物的量要合适,限制引物量过多,则产物主要是双链DNA;限制引物量过少,在前几轮循环就被耗尽,结果导致单链的产量减少。与常规对称PCR相比,不对称PCR扩增效率会大大降低,由于引物浓度会影响引物自身的Tm值,当引物浓度比较低时,其Tm值会下降,导致退火时出现效率低因而出现扩增效率下降的情况。在不对称PCR的基础上发展出Linear-After-The-Exponential-PCR(LATE-PCR,线性指数PCR),使数量限制的引物比过量的引物的解链温度更高,从而维持较高的反应效率。本申请的技术原理是通过设计靶标结合的限制上游引物(Limited forward primer,LP)与过量下游引物(Express reverse primer,EP),与野生位点者或突变位点完全匹配的并且与反义链结合的荧光探针,不同的荧光探针标记不同荧光基团。限制引物的Tm值比下游引物Tm值高5-10℃,在进行PCR扩增,理论上在消耗完限制引物的同时,仅剩过量引物实现指数后线性扩增,无需广泛的反应优化即可获得高产量的单链DNA产物。得到大量单链DNA产物后与设计好的探针进行反应,与野生位点者或突变位点完全匹配的探针与错配一个碱基位点结合时出现Tm值下降(相比于完全匹配),记录下不同Tm值即可进行准确分型,多色荧光探针允许单管检测4个位点的多态性。由于LATE-PCR,这些探针的Tm值允许低于引物的Tm值,可以在熔解曲线阶段进行终点荧光采集,在不影响特异性的前提下能够明显增加一个位点错配带来的Tm值差异,进而进行准确分型。
与现有技术相比,本申请的检测方法和试剂盒主要带来如下效益:
1.本申请利用改进的探针熔解曲线法,即指数后线性PCR耦合多色荧光熔解曲线法,提高了不对称PCR扩增的扩增效率,最低检测限低至1ng/μL。
2.本申请采用一条探针结合熔解曲线法可以检测一个位点的3种基因型,例如野生纯合、突变纯合、突变杂合,相比于荧光探针法成本更低。
3.本申请检测心血管疾病常见药物相关基因多态性位点的试剂盒,共5个反应孔可检测18个位点的基因多态性。同时既可以做成一个综合心血管药物检测试剂盒,也可以拆开作为4种常见心血管病用药的检测试剂盒,例如,包括5种降血压药物检测的试剂盒,即只需第一反应液和第二反应液;主要抗心律失常药物检测的试剂盒,只需要第三反应液;抗血栓药物氯吡格雷检测的试剂盒,只需要第四反应液;他汀类基础抗血脂药物检测的试剂盒,只需要第五反应液。
下面通过具体实施方式结合附图对本申请作进一步详细说明。在以下的实施方式中,很多细节描述是为了使得本申请能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他装置、材料、方法所替代。在某些情况下,本申请相关的一些操作并没有在说明书中显示或者描述,是为了避免本申请的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。
实施例1
心血管病常见药物相关基因多态性检测引物和探针的设计。本例具体针对18个位点设计的特异性的不对称PCR扩增引物对和特异性探针,对待测样本进行指数扩增和线性扩增,并利用熔解曲线法获得准确分型。其中,不对称PCR扩增引物对的上游引物作为限制性引物,下游引物作为非限制性引物;并且,限制性引物的Tm值比非限制性引物的Tm值高5-10℃;特异性探针为与野生位点或突变位点完全匹配,并且与反义链结合的荧光探针。18个位点的基因和相关信息如表3所示。
表3心血管病常见药物相关基因多态性检测位点
本例针对18个位点设计的引物和探针如表4所示。
表4不对称PCR引物对和探针
本例将18个位点的特异性的不对称PCR扩增引物对和特异性探针分为五组,第一组由rs1065852、rs1057910、rs1799752、rs776746,四个位点的不对称PCR扩增引物对和特异性探针组成;第二组由rs5186、rs1801253、rs5065,三个位点的不对称PCR扩增引物对和特异性探针组成;第三组由rs1805128、rs10919035、rs10800397、rs12720441,四个位点的不对称PCR扩增引物对和特异性探针组成;第四组由rs4244285、rs4986893、rs12248560,三个位点的不对称PCR扩增引物对和特异性探针组成;第五组由rs429358、rs7412、rs2306283和rs4149056,四个位点的不对称PCR扩增引物对和特异性探针组成。
每组引物和探针构建一个反应体系,因此,本例设计了五个反应液,即第一反应液、第二反应液、第三反应液、第四反应液和第五反应液。并设计了阴性对照品、阳性对照品,用于构建试剂盒。
本例五个反应液除了含有相应的五组引物和探针以外,为了方便使用,还含有酶和反应液,具体的五个反应液的组成如下:
第一反应液包括200μLqPCR premix with UNG(内含Taq聚合酶、dNTP、dUTP、UNG酶及反应Buffer等,购自天筛(上海)科技有限公司、TAKARA)、rs1065852检测引物与探针、rs1057910检测引物与探针、rs1799752检测引物与探针、rs776746检测引物与探针及Nuclease-Free Water。
第二反应液包括200μLqPCR premix with UNG(内含Taq聚合酶、dNTP、dUTP、UNG酶及反应Buffer等)、rs5186检测引物与探针、rs1801253检测引物与探针、rs5065检测引物与探针Nuclease-Free Water。
第三反应液包括200μLqPCR premix with UNG(内含Taq聚合酶、dNTP、dUTP、UNG酶及反应Buffer等)、rs1805128检测引物与探针、rs10919035检测引物与探针、rs10800397检测引物与探针、rs12720441检测引物与探针Nuclease-Free Water。
第四反应液包括200μLqPCR premix with UNG(内含Taq聚合酶、dNTP、dUTP、UNG酶及反应Buffer等)、rs4244285检测引物与探针、rs4986893检测引物与探针、rs12248560检测引物与探针Nuclease-Free Water。
第五反应液包括200μLqPCR premix with UNG(内含Taq聚合酶、dNTP、dUTP、UNG酶及反应Buffer等)、rs429358检测引物与探针、rs7412检测引物与探针、rs2306283检测引物与探针、rs4149056检测引物与探针Nuclease-Free Water。
各反应上机体系组成:2×qPCR premix:1.0~3U DNA聚合酶,0.2~0.8mM dA/C/D/T/UTP,2.5~8mM Mg
阴性对照品为Nuclease-Free Water(体积为50μL);阳性对照为rs1065852、rs1057910、rs1799752、rs776746、rs5186、rsS1801253、rs5065、rs1805128、rs10919035、rs10800397、rs12720441、rs4244285、rs4986893、rs12248560、rs429358、rs7412、rs2306283及rs4149056共18个基因位点的突变型和野生型质粒混合液,浓度为10
本例的心血管病常见药物相关基因多态性检测包括以下步骤:
1.使用通用基因组DNA提取试剂盒提取全血、口腔拭子等样本的基因组DNA。
2.每个样本分5个反应孔检测,每个反应体系共20μL,反应孔1含15μL第一反应液和5μL提取自样本的基因组DNA;反应孔2含15μL第二反应液和5μL提取自样本的基因组DNA;反应孔3含15μL第三反应液和5μL提取自样本的基因组DNA;反应孔4含15μL第四反应液和5μL提取自样本的基因组DNA;反应孔5含15μL第五反应液和5μL提取自样本的基因组DNA。
3.将96孔板密封后4000rpm离心1min。如果检测样本较少,也可以使用八联管。
4.将离心好的孔板置于实时荧光PCR仪中进行PCR扩增检测。
5.实时荧光PCR扩增程序设置如下表5所示。
表5实时荧光PCR扩增程序
本例的心血管病常见药物相关基因多态性检测的结果判定如下:
(1)对照结果判定及有效性判定:
阴性对照品应在5个反应孔中均无任何熔解曲线峰;阳性对照品应该在5个反应孔的每个检测位点均有两个熔解曲线峰,即为本次实验有效。
(2)每个反应孔检测基因型及对应Tm值如表6所示。
表6检测基因型及对应Tm值
/>
实施例2
本例在实施例1的基础上,对不同限制性引物与非限制性引物的浓度和配比进行测试,采用阳性对照品作为检测对象,其他与实施例1相同。具体的,上机各反应体系浓度引物浓度如下:
第一组实验(LP:EP=1:5):方案一,LP引物浓度0.05μM,EP引物浓度0.25μM;方案二,LP引物浓度0.1μM,EP引物浓度0.5μM。
第二组实验(LP:EP=1:10):方案一,LP引物浓度0.05μM,EP引物浓度0.5μM;方案二,LP引物浓度0.1μM,EP引物1.0μM。
第三组实验(LP:EP=1:20):方案一,LP引物浓度0.025μM,EP引物0.5μM;方案二,LP引物浓度0.05μM,EP引物1.0μM。
结果表明,在18个基因多态性位点检测中,LP:EP=1:5、LP:EP=1:10、LP:EP=1:20,均能实现不对称PCR的正常扩增,且扩增出的大量单链能够用于多色荧光探针的结合,三组引物不同浓度比均可以精准分型。
实施例3
本例取4个志愿者的全血样本,并且4个样本都是已知基因型,使用实施例1中的第一反应液和第二反应液,检测高血压药物相关基因的多态性,即降血压药物相关基因多态性。
全血样本提取:
本例使用血液/细胞/组织基因组DNA提取试剂盒(DP304,购于天根生化科技(北京)有限公司),并按照试剂盒说明书提取全血样本,得到DNA溶液备用。
加样上机:
每个样本分2个反应孔检测,每个反应体系共20μL,反应孔1含15μL第一反应液和5μL基因组DNA;反应孔2含15μL第二反应液和5μL基因组DNA。将反应96孔板封膜离心后放置于宏石全自动PCR分析仪(购于上海宏石医疗科技有限公司)。扩增程序与实施例1相同。
4个全血样本的检测统计结果如表7所示,部分熔解曲线结果如图1和图2所示,图1为第一反应液检测4个位点的精准分型结果,图2为第二反应液检测3个位点的精准分型结果。
表7 4个全血样本第一反应液和第二反应液的检测结果
/>
表7、图1和图2的结果显示,本例的第一反应液和第二反应液能够准确的对4个样本进行分型,分型结果与4个全血样本的实际情况完全相符。
实施例4
取4个志愿者全血样本,4个样本都是NGS检测剩余样本,并且已知基因型。使用实施例1中的第三反应液,检测抗心律失常药物相关基因的多态性。样本提取、加样上机过程同实施案例3。
4个全血样本的检测统计结果如表8所示,部分熔解曲线结果如图3所示。
表8 4个全血样本第三反应液的检测结果
/>
表8和图3的结果显示,本例的第三反应液能够准确的对4个样本进行分型,分型结果与4个全血样本的实际情况完全相符。
实施例5
取4个志愿者全血样本,4个样本都是NGS检测剩余样本,并且已知基因型。使用实施例1中的第四反应液,检测抗血栓药物相关基因的多态性。该抗血栓药物尤其是指氯吡格雷。样本提取、加样上机过程同实施案例3。
4个全血样本的检测统计结果如表9所示,部分熔解曲线结果如图4所示。
表9 4个全血样本第四反应液的检测结果
表9和图4的结果显示,本例的第四反应液能够准确的对4个样本进行分型,分型结果与4个全血样本的实际情况完全相符。
实施例6
取4个志愿者全血样本,4个样本都是NGS检测剩余样本,并且已知基因型。使用实施例1中的第五反应液,检测降血脂药物相关基因的多态性。该降血脂药物尤其是指他汀类基础抗血脂药物。样本提取、加样上机过程同实施案例3。
4个全血样本的检测统计结果如表10所示,部分熔解曲线结果如图5所示。
表10 4个全血样本第五反应液的检测结果
表10和图5的结果显示,本例的第五反应液能够准确的对4个样本进行分型,分型结果与4个全血样本的实际情况完全相符。
实施例7
取8例低浓度口腔拭子样本,使用实施例1的第一至第五反应液,检测8例样本的18个位点的基因型,验证检测方法和试剂盒的分析灵敏度。
口腔拭子样本提取采用磁珠法通用型基因组DNA提取试剂盒,并按照试剂盒说明书提取DNA溶液备用。8例口腔拭子样本提取的DNA编号依序为S1至S8,采用Qubit方法测试其浓度,结果如表11所示。
表11 8例口腔拭子样本提取的DNA溶液的浓度
加样上机过程同实施案例3。
8例口腔拭子DNA样本的检测统计结果如表12所示,部分熔解曲线结果如图6所示。
表12 8例口腔拭子DNA样本的检测结果
与此同时,对8例口腔拭子DNA样本的18个位点的基因多态性进行Sanger测序验证。结果显示,采用第一至第五反应液,按照实施例的LATEPCR-MMCA方法进行心血管病常见药物相关基因多态性检测的分型结果,与Sanger测序结果一致。说明,本例的反应液能够准确的检测低浓度口腔拭子样本的18个位点的基因型。
此外,本例对8例口腔拭子DNA样本的检测结果还显示,本例的反应液对浓度低至0.62ng/μL的DNA样本仍能准确分型,说明检测灵敏度极高。
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换。
