药剂评价方法
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及药剂评价方法。
背景技术
在肝脏中,药物或其它化合物被吸收到肝细胞内并代谢。肝代谢物在被排泄到毛细胆管内并到达胆囊之后,排泄到体外。
以往,已知将从肝细胞分泌的胆汁回收并分析的一些方法。例如,已知通过夹层培养法在膜片上培养肝细胞而形成微小胆管并回收从微小胆管分泌的胆汁的方法(下述专利文献1)。另外,例如,已知通过向小鼠等实验用动物的胆道插入的导管将胆汁直接向体外排泄并回收的方法。
现有技术文献
专利文献
专利文献1:日本特开2013-17411号公报
发明内容
发明所要解决的课题
根据夹层培养法,肝细胞的寿命短(例如10日左右)是问题。另外,由于是不排泄胆汁的、胆管闭塞的状态,因此需要为了回收胆汁而破坏细胞间连接,无法进行连续的(细胞保持存活的状态下的)解析。也就是说,夹层培养法无法将胆汁从人类肝脏的排泄以连续的形式模型化。因此,夹层培养法虽然能够进行胆汁的某一时间点的评价,但无法长时间地对投送药剂所造成的肝损伤进行评价。
另外,在动物实验中,药剂的响应性存在每个物种的个体差异的问题,另外,需要难度高的移植技术和动物操作的技能。由于本来就使用动物,因此也不知道是否会表现出与人类相同的举动。
出于以上情况,存在如下需求:在临床前,想要在接近人体的环境下在整个规定期间中连续地对药效、与药剂投送相伴的长期的副作用及药剂的动态进行评价,确认药剂的安全性。
鉴于上述课题,本发明的目的在于提供一种能够在接近人体的环境下连续地而非只在某一时间点回收胆汁并评价药剂的药剂评价方法。
用于解决课题的手段
本发明的药剂评价方法的特征在于:具备:
工序1,向微流体设备中导入肝细胞及培养基;
工序2,在所述工序1之后将所述肝细胞培养至能够排泄胆汁;
工序3,在所述工序2之后向所述肝细胞投送药剂;以及
工序4,在所述工序3之后回收从所述肝细胞排泄的胆汁。
根据该方案,当回收从肝细胞排泄的胆汁时,能够在持续进行肝细胞培养的前提下回收胆汁,因此,能够不是在某一时间点,而是在接近人体的环境下连续地回收胆汁。
在本发明的药剂评价方法中,也可以构成为还具备:工序5,对在所述工序4中回收的胆汁进行分析;以及工序6,根据在所述工序5中获得的分析结果评价药物动态。
根据该方案,能够长时间地连续地评价药物动态。
在本发明的药剂评价方法中,也可以构成为:所述工序6是对被进行胆汁排泄的药剂的结构、被进行胆汁排泄的药剂的成分组成、胆汁排泄的速度参数、随着时间经过而产生的连续的排泄速度的变化及排泄量的变化以及随着时间经过而产生的连续的代谢/排泄的变化中的一个以上进行评价的工序。
在本发明的药剂评价方法中,也可以构成为:所述工序4连续执行1日以上。
另外,在本发明的药剂评价方法中,也可以构成为:所述工序5在时间上独立的至少两个时间点执行。
根据这些方案,能够长时间地掌握在暴露于药剂的情况下对肝细胞的损伤。
附图说明
图1是本实施方式的微流体设备俯视图。
图2A是图1所示的微流体设备的A-A线剖面图。
图2B是图1所示的微流体设备的B-B线剖面图。
图2C是图1所示的微流体设备的C-C线剖面图。
图2D是图1所示的微流体设备的D-D线剖面图。
图2E是图1所示的微流体设备的E-E线剖面图。
图3是第三口附近的立体图。
图4A是第一基板的立体图。
图4B是第二基板的立体图。
图5是用于对使用了微流体设备的药剂评价方法进行说明的示意图。
图6是药剂评价方法的全流程图。
图7是药剂评价方法的流程图。
图8是药物动态(AMDE)试验的流程图。
图9是药剂的毒性/安全性试验的流程图。
图10是用于对微流体设备的另一使用例进行说明的剖面图。
具体实施方式
参照附图对本发明的药剂评价方法进行说明。此外,本说明书所公开的各附图只是示意性地进行图示的图。即,附图上的尺寸比与实际的尺寸比未必一致,另外,即使在各附图之间尺寸比也未必一致。
[微流体设备的结构]
图1是表示药剂评价方法所使用的微流体设备1的一个例子的俯视图。图2A是图1所示的微流体设备1的A-A线剖面图。图2B是图1所示的微流体设备1的B-B线剖面图。图2C是图1所示的微流体设备1的C-C线剖面图。图2D是图1所示的微流体设备1的D-D线剖面图。图2E是图1所示的微流体设备1的E-E线剖面图。
微流体设备1是在第一基板10的一个主面10a上以局部接触的方式层叠第二基板20的一个主面20a并进行接合而形成的。所谓主面,是指构成基板10、20的面中的面积远大于其它面的面。基板10、20上有两个主面,该两个主面相互对置地配置。
第一基板10的主面10a具有多个槽11a(详见后述)。另外,第二基板20的主面20a具有凹部21a(详见后述)。第二基板20的另一个主面20b位于与第一基板10相反的一侧,且具有第一~第三口22~24(后述)。
在以下的说明中,适当参照在第一基板10与第二基板20接合的状态下将与第一基板10的主面10a、10b及第二基板20的主面20a、20b平行的面设为XY平面且将与该XY平面正交的方向设为Z方向的XYZ坐标系。
另外,在本说明书中,当表达方向时,在区别正负朝向的情况下,将会像“+X方向”、“-X方向”这样标上正负符号进行记载。另外,在不区别正负朝向地表达方向的情况下,将会仅记载为“X方向”。即,在本说明书中,在仅记载为“X方向”的情况下,包含“+X方向”和“-X方向”双方。关于Y方向及Z方向,也是相同的。此外,微流体设备1通常以Z方向为上下方向而使用,-Z方向相当于上侧方向。
第一基板10及第二基板20分别具有同一形状的主面。在本实施方式的微流体设备1中,第一基板10及第二基板20在Z方向视角下为大致T字状。第二基板20的厚度比第一基板10的厚度大。第一基板10的厚度例如为0.1~1mm,第二基板20的厚度例如为3~10mm。
第一基板10的主面10a具备槽11a。槽11a以沿Y方向延伸的方式形成于主面10a。槽11a在X方向上排列形成有多个,多个槽11a通过使第一基板10与第二基板20接合而作为被两基板10、20夹着的副流路11发挥功能。槽11a例如为10~1000根,在图1~3中,为了便于说明,仅示出了8根。
槽11a是以一定的宽度及深度沿Y方向延伸的狭缝状。槽11a的剖面呈矩形形状。不过,槽11a的剖面并不限定于矩形形状,也可以是宽度朝向槽底变窄的梯形形状、半椭圆形状等。
槽11a的X方向的宽度11W(参照图2B)例如为5~100μm,在本实施方式中为50μm。槽11a的宽度11W是在主面10a上开口的开口部分处的宽度。另外,槽11a彼此的间隔11S(参照图2B)例如为宽度11W的1~2倍,在本实施方式中为50μm。另外,槽11a的深度11H(参照图2B)例如为50~150μm,在本实施方式中为50μm。另外,槽11a的长度11L(参照图2E)例如为4~20mm,在本实施方式中为6mm。
第二基板20的主面20a具备凹部21a。凹部21a以沿X方向延伸的方式形成于主面20a。凹部21a通过使第一基板10与第二基板20接合而作为被两基板10、20夹着的中空状的主流路21发挥功能。
凹部21a是以一定的宽度及深度沿X方向延伸的狭缝状。凹部21a的剖面呈矩形形状。
凹部21a的Y方向的宽度21W(参照图2D)例如为1~10mm。另外,凹部21a的深度21H(参照图2D)例如为0.1~5mm。另外,凹部21a的长度21L(参照图1)例如为4~40mm。
在第一基板10的主面10a上形成槽11a,在第二基板20的主面20a上形成凹部21a,由此,通过将第一基板10与第二基板20接合,主流路21位于第一XY平面内,副流路11位于与第一XY平面不同的第二XY平面内。即,副流路11相对于主流路21而言沿Z方向与之邻接。
第一口22以与凹部21a的-X方向侧的端部连接,从第二基板20的主面20a向主面20b延伸并贯通第二基板20的方式形成。第二口23以与凹部21a的+X方向侧的端部连接,从第二基板20的主面20a向主面20b延伸并贯通第二基板20的方式形成。
第三口24以从第二基板20的主面20a向主面20b延伸并贯通第二基板20的方式形成在与凹部21a独立的位置。第三口24形成于在第一基板10与第二基板20接合的状态下与形成于第一基板10的槽11a的一端11b对置的位置。由此,通过使第一基板10与第二基板20接合,第三口24被连接在槽11a的一端11b。
第一口22、第二口23及第三口24均为沿Z方向延伸的圆柱状的空洞。在本实施方式的微流体设备1中,第一口22、第二口23及第三口24的直径d(参照图1)全部相同,例如为1~10mm。此外,第一口22、第二口23及第三口24的直径d不需要全部相同。第一口22、第二口23及第三口24的高度h(参照图2A)全部相同,例如为3~10mm。主流路21(凹部21a)的中心线与第三口24的中心的Y方向上的距离例如为3~10mm(参照图2E)。
第一口22与第二口23通过主流路21连接。即,也可以说主流路21具有与主流路21连接且向主面20b延伸的第一口22及第二口23。
第一口22、第二口23具有向微流体设备1供给液体的目的和从微流体设备1排出液体的目的中的至少一个目的。例如,可以是:第一口22作为供给口使用,第二口23作为排出口使用。
如图1及图3所示,槽11a在第一基板10与第二基板20接合的状态下以一端11b位于通过第三口24的中心向X方向延伸的直线上的方式形成。由此,槽11a的一端11b侧与第三口24连通。另外,如图1所示,槽11a的另一端11c位于凹部21a的-Y方向侧的缘部21b。多个槽11a的长度11L是一定的。通过使槽11a的长度11L一定,流路阻力一定。
在第一基板10与第二基板20接合在一起的状态下,槽11a在从Z方向观察时沿与凹部21a交叉的Y方向延伸,一部分与凹部21a重叠。即,副流路11在从Z方向观察时沿与主流路21交叉的Y方向延伸,一部分与主流路21重叠。在此,将副流路11与主流路21从Z方向观察时重叠的区域称为“重叠区域12”。
槽11a在第一基板10与第二基板20接合的状态下与凹部21a对置。由此,槽11a在重叠区域12中向主流路21开口而与主流路21连通。
微流体设备1在内部具有培养空间3,能够在培养空间3中培养细胞。培养空间3是重叠区域12中的主流路21内的空间。培养空间3在重叠区域12中同副流路11与主流路21相接的接触面3a(参照图2A)对置。后面将会详细说明,导入主流路21的细胞黏着在培养空间3的底面,具体而言是接触面3a,更具体而言是重叠区域12中的第一基板10的主面10a。此时,细胞以覆盖槽11a的方式黏着在副流路11上。
第三口24与副流路11连接。即,也可以说副流路11具有与副流路11连接且向主面20b延伸的第三口24。
第三口24具有将槽11a的液体向外部排出的目的。例如,第三口24也可以作为对槽11a的液体进行回收的回收口使用。
如上,本实施方式的微流体设备1是在内部具有培养空间3,能够在培养空间3中培养细胞的微流体设备1,具备主流路21和副流路11。主流路21在XY平面内延伸。副流路11在与XY平面垂直的方向(Z方向)上与主流路21邻接,在从与XY平面垂直的方向(Z方向)观察时沿与主流路21交叉的方向延伸,一部分与主流路21重叠。副流路11具有在与主流路21重叠的重叠区域12中向主流路21开口而与主流路21连通的槽11a。培养空间3是在与主流路21重叠的重叠区域12中同副流路11与主流路21相接的接触面3a对置的主流路21内的空间。
在本实施方式的微流体设备1中,优选的是,接触面3a具有细胞黏着性。所谓细胞黏着性,意指拥有成为细胞黏着的基础(日文:足場)的化学键,或者拥有能够被ECM成分(胶原、明胶、层粘连蛋白等)包覆的表面性质,例如具有羟基、羧基等官能团的表面。
在本实施方式的微流体设备1中,优选的是,主流路21的宽度21W比被培养的细胞大,并且槽11a的宽度11W比被培养的细胞小。
[微流体设备的制造方法]
接下来,对微流体设备1的制造方法进行详细说明。
(基板的准备工序)
准备构成微流体设备1的第一基板10和第二基板20。图4A是从主面10a侧对接合前的第一基板10进行观察的立体图,图4B是从主面20a侧对接合前的第二基板20进行观察的立体图。
对于构成基板10、20的材料,优选使用实质上为非多孔质体的材料。在此,所谓“实质上为非多孔质体”,是指基板的表观的表面积与实际的表面积近似的状态。作为形成上述的非多孔质体的材料的例子,可列举玻璃、硅等无机材料或者聚甲基丙烯酸甲酯(PMMA)、聚碳酸酯(PC)、环烯烃共聚物(COC)、环烯烃聚合物(COP)、聚苯乙烯(PS)、硅酮等树脂材料。此外,也可以使这些树脂材料组合两种以上。另外,也可以使第一基板10和第二基板20所使用的材料不同。
对本实施方式中的基板的形状进行说明。第一基板10及第二基板20分别使用具有同一形状的主面的基板。另外,第二基板20的厚度比第一基板10的厚度大。然而,第一基板10及第二基板20的主面也可以不是同一形状。例如,第一基板10的主面的纵向和横向的尺寸也可以比第二基板20的主面的纵向和横向的尺寸大,第二基板20的主面的纵向和横向的尺寸也可以比第一基板10的主面的纵向和横向的尺寸大。另外,第二基板20的厚度也可以与第一基板10的厚度相同,第二基板20的厚度也可以比第一基板10的厚度小。
第一基板10的一个主面10a具有多个槽11a。槽11a例如通过光刻工序与蚀刻工序的组合、纳米压印、激光加工、射出成型、铣削加工等形成。
第二基板20的一个主面20a具有凹部21a。第一口22、第二口23及第三口24在第二基板20的另一个的主面20b上开口。
为了对第二基板20设置开口及凹部,例如有射出成型、切削加工等手段,可以根据构成基板的材料选择最佳手段。作为一个例子,第二基板20如上所述地由聚甲基丙烯酸甲酯(PMMA)、聚碳酸酯(PC)、环烯烃共聚物(COC)、环烯烃聚合物(COP)、聚苯乙烯(PS)、硅酮、丙烯酸等树脂材料构成,由此能够通过射出成形容易地形成凹部。
(基板的接合工序)
将所制作的第一基板10的主面10a与第二基板20的主面20a接合。以下所示的接合方法是不需要在基板上形成成为黏着剂的薄膜的方法,通过以下的步骤来执行。
首先,对两基板的接合面(10a、20a)进行使表面活化的处理。作为表面活化处理的方法,能够利用照射紫外线的方法、接触等离子气体的方法。
在照射紫外线的方法中,例如通过从照射波长172nm的光的氙准分子灯等紫外线光源对第二基板20的主面20a及第一基板10的主面10a照射波长200nm以下的真空紫外线来执行。作为紫外线光源的其它例子,能够适当使用在185nm处具有亮线的低压汞灯、在波长120~200nm的范围中具有亮线的氘灯。真空紫外线的照度例如为10~500mW/cm
在接触等离子气体的方法中,通过使利用大气压等离子体将以氮气、氩气等为主成分且含有0.01~5体积%的氧气的工艺气体进行等离子体化而得的物质与第二基板20的主面20a及第一基板10的主面10a接触来执行。还可以使用氮气与清洁干燥空气(CDA)的混合气体。等离子气体的接触时间例如为5~100秒钟。
接下来,进行接合工序,即,以使被实施了表面活化处理的两基板的接合面(10a、20a)接触的方式使第一基板10与第二基板20重叠,使用压力机将两基板按压接合。为了维持表面活化状态,可以在从完成紫外线照射工序起的规定时间内、例如10分钟以内进行接合工序。
为了使接合牢固,该接合工序根据需要在加热的环境下进行。在接合工序中,加热温度、按压力等接合条件根据第一基板10的构成材料及第二基板20的构成材料来设定。若要列举具体的条件,则按压时的温度例如为40~130℃,用于进行接合的按压力例如为0.1~10MPa。
在将第一基板10与第二基板20被接合而得的基板(以下,有的情况下称为“接合基板”)加压规定时间之后,也可以根据需要进一步加热规定时间。通过在对接合基板进行加压之后进行加热,即使在加压后的层叠基板中的接合界面处混杂有获得了充分的接合状态的部分和未获得充分的接合状态的部分的情况下,也能够通过加热而在未获得充分的接合状态的部分将其接合状态设为所期望的状态。
将接合基板的加压状态维持规定时间,之后,也可以解除该加压状态,使接合基板的温度上升至规定温度,维持该温度至获得所期望的接合状态。在此,所谓规定温度,是接合基板上不会产生变形的温度。例如,加热温度例如为40~130℃,加热时间例如为60~600秒钟。
之后,经过冷却工序,制作出在第一基板10的主面10a上接合了第二基板20的微流体设备1。
[药剂评价方法]
接下来,对使用了微流体设备1的药剂评价方法进行详细说明。不过,在本发明的药剂评价方法中,用于回收胆汁的微流体设备并不限定于上述的微流体设备1。
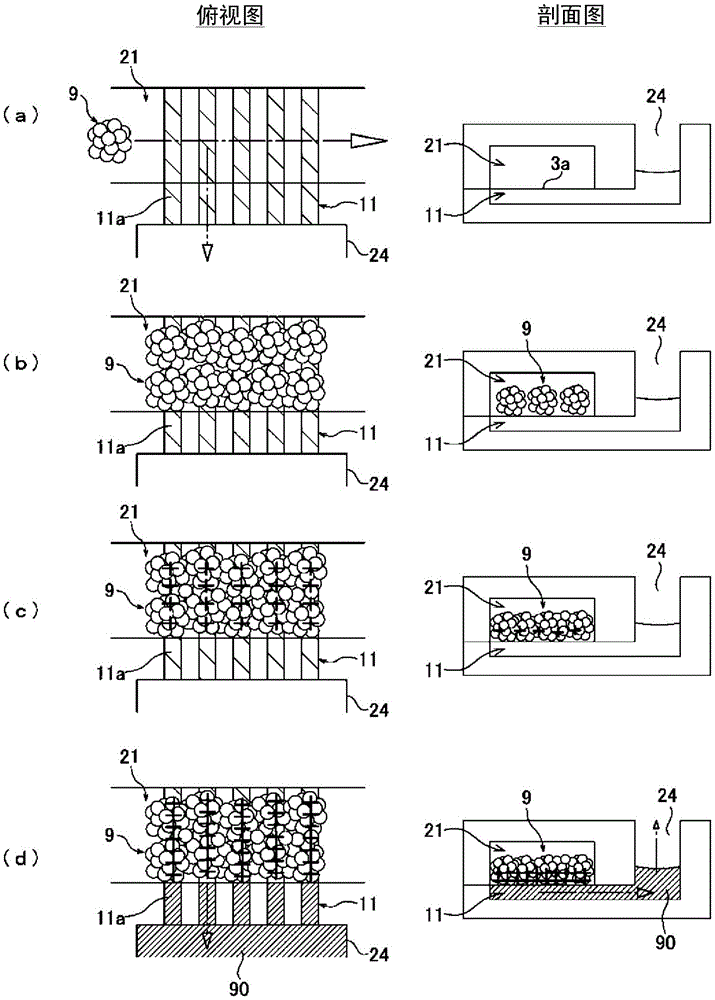
图5是用于对使用了微流体设备1的药剂评价方法进行说明的示意图,在左侧示出了俯视图,在右侧示出了剖面图。此外,在俯视图中,为了便于说明,槽11a被用阴影线表示。图6是药剂评价方法的全流程图。图7是药剂评价方法的流程图。图8是药物动态(AMDE)试验的流程图。
(1)最开始,执行图7及图8所示的准备培养工序。首先,如图5的(a)及图6所示,向微流体设备1中导入肝细胞9及培养基(图5的(a)中未示出)(本申请的工序1)。具体而言,如图5的(a)所示,将肝细胞9从供给口(例如第一口22)投入,接种到主流路21中。此时,肝细胞9被作为细胞块投入。细胞块的尺寸例如为50~300μm左右。
如图5的(b)所示,导入到主流路21中的细胞块黏着在主流路21的底面(接触面3a)。此时,通过将槽11a的宽度11W设定为比细胞块小,细胞块被黏着在副流路11上。
(2)接着,如图5的(c)所示,从供给口注入培养基。培养基为通过被从排出口(例如第二口23)回收而在主流路21内灌流,对肝细胞9进行培育的培养基。肝细胞9增殖至覆盖副流路11的上部的大部分或全部。随着肝细胞9生长,在肝细胞9中形成微小胆管(毛细胆管),进行培养基灌流并持续进行肝细胞9的培育,直到能够排泄胆汁的状态为止(本申请的工序2、图8的步骤101)。接着,使用荧光色素示踪物、TEER确认已经形成了胆管及屏障这一情况(图8的步骤102)。另外,采集从肝细胞9连续排泄的胆汁(图8的步骤103)。
在工序2之后,执行图7及图8所示的肝功能评价工序。这是为了废弃肝功能不满足标准的微流体设备1,使用肝功能为标准以上的微流体设备1实施后述的药剂评价。
肝功能评价工序执行以下的工序。首先,向灌流的培养基中添加和供给标准药剂(图8的步骤104)。接着,利用肝细胞9取入标准药剂,向胆汁回收流路(槽11a)排泄胆汁(图8的步骤105)。接着,回收包含灌流后的培养基以及排泄出的胆汁的液体(图8的步骤106)。接着,例如利用液相色谱质谱分析装置对所回收的胆汁中的标准药剂、代谢后化学结构、胆汁结合(日文:抱合)后化学结构及它们的浓度进行分析(图8的步骤107)。同样,例如利用液相色谱质谱分析装置对所回收的培养基中的标准药剂、代谢后化学结构、胆汁结合后化学结构及它们的浓度进行分析(图8的步骤108)。接着,测量微流体设备1的代谢能力、排泄能力(图8的步骤109)。其为后述的药剂评价时的基准。此时,如图6所示,还能够利用显微镜对成为基准的细胞培养状态进行观察。
(3)接着,执行图7及图8所示的药剂评价工序。首先,在培养出了能够排泄胆汁的肝细胞9的主流路21内,如图6所示,从供给口投入生理活性物质以及成为评价对象的药剂(本申请的工序3、图8的步骤110)。利用肝细胞9取入药剂,向胆汁回收流路(槽11a)排泄胆汁(图8的步骤111)。
(4)接着,如图6所示,回收包含灌流后的培养基以及排泄出的胆汁的液体(图8的步骤112)。如图5的(d)所示,从微小胆管排泄的胆汁90流入副流路11的槽11a内,并从回收口(例如第三口24)进行回收(本申请的工序4)。此时,由于副流路11的上部的大部分或全部被肝细胞9覆盖,因此能够大部分或完全抑制主流路21中的培养基向副流路11侧流入。在本实施方式的药剂评价方法中,当回收胆汁90时,不需要破坏细胞间连接,能够在持续进行肝细胞9的培养的前提下回收胆汁90。因此,能够不是在某一时间点,而是在接近人体的环境下连续地回收胆汁90。
回收胆汁90的工序4优选连续执行1日(24小时)以上。在此,所谓回收胆汁90的工序4连续执行1日以上,不仅包含连续1日以上持续地回收胆汁90,还包含在1日以上的期间中多次回收胆汁90,例如,在第一次回收胆汁90之后,经过规定日数再进行第二次以后的胆汁回收。以较长的时间跨度连续回收胆汁90的理由是为了长时间地掌握在暴露于药剂的情况下对肝细胞9的损伤。
(5)接着,如图6所示,对从回收口回收的胆汁90进行分析(本申请的工序5)。工序5例如通过气相色谱法或液相色谱法进行。具体而言,例如利用液相色谱质谱分析装置对所回收的胆汁中的标准药剂、代谢后化学结构、胆汁结合后化学结构及它们的浓度进行分析(图8的步骤113)。同样,例如利用液相色谱质谱分析装置对所回收的培养基中的标准药剂、代谢后化学结构、胆汁结合后化学结构及它们的浓度进行分析(图8的步骤114)。
另外,工序5优选在时间上独立的至少两个时间点执行。即,优选对在时间上独立的至少两个时间点回收的胆汁90进行分析。例如,每隔1日回收胆汁90或者每隔1周回收胆汁90并进行分析。
(6)接着,根据在工序5中获得的分析结果,如图6所示,评价药物动态(本申请的工序6)。具体而言,通过计算药剂的药物动态(代谢速度、代谢方式、胆汁酸结合、排泄浓度),并将其与通过上述肝功能评价获得的基准进行比较,评价药物动态(图8的步骤115)。另外,能够反复投送药剂或者长时间供给药剂来进行药物动态的长时间的评价(图8步骤116)。
此外,在药物动态中,主要根据药物的血药浓度的随着时间推移来研究生物体内的药物的活动。并且,将为此而使用的要素称为药物动态参数。作为药物动态参数,可列举最高血药浓度(Cmax)、最低血药浓度(Cmin)、最高血药浓度到达时间(Tmax)、血药浓度半衰期(T1/2)、血药浓度-时间曲线下面积(AUC)等。
药物动态的评价主要使用液相色谱法对被进行胆汁排泄的药剂的结构、被进行胆汁排泄的药剂的成分组成、胆汁排泄的速度参数、随着时间经过而产生的连续的排泄速度的变化及排泄量的变化、随着时间经过而产生的连续的代谢/排泄的变化进行。以下对其细节进行说明。
a)被进行胆汁排泄的药剂的结构
如果想要知道药剂的存在,则能够通过红外分光来进行分析。而且,对与胆汁一起排泄的药剂化合物的化学结构的状态进行评价。对于结构是否发生了变化,以及,如果发生了变化的话变成了什么样的结构,将所回收的胆汁置于GC/MS(气相色谱质谱分析装置)、LC/MS/MS(液相色谱质谱分析装置)中辨别结构。
由此,能够知晓药剂化合物经过胆汁排泄会产生什么样的化学结构的变化。所谓化学结构的变化,是指胆汁酸的结合、官能团的修饰、置换、键的切断等。
b)排泄胆汁、排泄药剂的种类、分布、构成、内容、组成、倾向
上述a)中的化学结构的变化不限于一个种类。会在药剂化合物的各种各样的部位产生化学结构的变化而生成各种各样的派生化合物。
另外,胆汁酸也是多个种类的物质的混合物。如果对其组成(种类、浓度)的变化进行分析并将其与现有的药剂的生理活性建立关联,则能够通过研究其组成来进行未评价的药剂所拥有的生理活性的预测。
c)速度
通过知道药剂的胆汁排泄速度,能够知道处于血液中的药剂以多大的速度降低,准确地预测药剂投送后的任意的经过时间的时间点的血中药剂浓度。另外,通过与培养基中的药剂浓度的减少速度对照,还能够计算细胞内的药剂蓄积速度。由此,能够预测在肝脏细胞内药剂浓度超过无毒性的阈值的供给量、时间点。由此,能够研究人的安全的处方量。
d)量
还能够估计被进行胆汁排泄的药剂的收支。
e)时间变化
以此为基础,能够用培养试验系统更多方面地评价药剂的药效、药物动态、毒性的评价。
胆汁排泄功能并不是长时间都一定的。由于药剂的影响(药效的反作用、依赖、中毒状态),肝细胞功能会产生变化。就期间而言,存在从在数小时内出现的情况(急性)到绵延数日的情况(慢性)。另外,生物体会受到生物节律的影响。在体外(in vitro)试验系统的情况下,胆汁排泄功能根据细胞的培养状态(功能的成熟度、从开始培养起的期间等)而变化。
因此,对各个某经过时间的变化进行评价是重要的。通过连续地回收胆汁并进行成分分析,能够进行监视其随着时间的变化的试验。另外,能够进行以药剂的长期投送为模型的评价。
此外,根据所回收的胆汁的分析结果,还能够评价药剂的药效或者毒性。例如,通过监视胆汁排泄速度,能够评价药剂给胆汁排泄速度带来的影响。此时,使胆汁排泄速度下降的药剂阻碍胆汁排泄(胆汁瘀滞)。另外,由于肝脏内的药剂浓度上升,因此表现出毒性。另外,使胆汁排泄速度上升的药剂促进胆汁排泄,因此肝脏内的药剂浓度下降,表现出药效。
图9是药剂的毒性/安全性试验的流程图。首先,执行准备培养工序。
步骤201~203由于与图8的步骤101~103相同,因此省略说明。
接着,执行肝功能评价工序。步骤204~209由于与图8的步骤104~109相同,因此省略说明。在步骤210中,利用显微镜对成为基准的细胞培养状态进行观察。
接着,执行药剂评价工序。步骤211~216由于与图8的步骤110~115相同,因此省略说明。在步骤217中,测定培养基中及胆汁中的生物学标记物(伤害标记物、炎症标记物、炎症诱发物质)。在步骤218中,观察细胞培养状态而观察细胞伤害的状态。
在步骤219中,能够反复投送药剂或者长时间供给药剂来进行药物动态的长时间的评价。
另外,在步骤220中,也可以评价药剂使胆汁排泄速度降低的效果。
另外,在步骤221中,也可以从微流体设备1回收肝细胞9并测定细胞表面、细胞内的生物学标记物(伤害标记物、炎症标记物、炎症诱发物质)的内容、量。
另外,在步骤222中,也可以从微流体设备1回收肝细胞9并获取mRNA,测定基因表达。
另外,还能够像步骤218那样,通过直接观察细胞来评价药剂的毒性。通过荧光探针有无在细胞内滞留,对相对于正常状态的胆管形成根数的减少量、死细胞数的增加量、以及胆汁排泄的路径的功能发挥进行定量评价。
以上,基于附图对本发明的实施方式进行了说明,但应当认为具体构成并不限定于这些实施方式。本发明的范围不是只由上述的实施方式的说明,还由权利要求书表示,而且包含与权利要求书等同的意思及范围内的全部变更。
能够将上述的各实施方式所采用的结构用于其它的任意实施方式。各部的具体构成并不仅限定于上述的实施方式,能够在不脱离本发明的主旨的范围内进行各种变形。
图10是用于对微流体设备1的另一使用例进行说明的剖面图。最开始,1)向主流路21中填充凝胶原液。接着,2)仅留下被填充到槽11a中的凝胶原液而使之凝胶化。作为凝胶13,例如能够使用胶原凝胶。胶原凝胶是由胶原纤维构成的凝胶,通过向槽11a内填充凝胶13,即使是比槽11a的宽度11W小的细胞,也能够在培养空间3中培养。
接着,3)接种肝细胞。接着,4)使肝细胞固定于培养空间3(30分钟~1小时)。具体而言,使干细胞黏着于培养空间3的底面即接触面3a。
接着,5)包含第一口22、第二口23在内都填满培养基,使肝细胞增殖,形成肝脏组织(数日)。
接着,6)在肝脏组织内形成毛细胆管。接着,7)毛细胆管向槽11a侧开口。接着,8)向槽11a中排出胆汁。
此外,在细胞生长而变成了不会向槽11a内落下的程度的大小的情况下,也可以去除凝胶13。作为去除凝胶13的方法,能够适当使用使其自然分解的方法、加热而使其溶解的方法、用酶使其分解的方法等。在去除了凝胶13的情况下,培养空间3中培养出的细胞膜等也会被相邻的槽11a的主面10a支承,因此其形态得以维持。
附图标记说明
1:微流体设备
3:培养空间
3a:接触面
9:肝细胞
90:胆汁
11:副流路
11a:槽
12:重叠区域
21:主流路
21a:凹部
22:第一口
23:第二口
24:第三口
