局部分泌表达PD-L1单链抗体的重组溶瘤腺病毒及应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于基因治疗和肿瘤免疫治疗,涉及局部分泌表达PD-L1单链抗体的重组溶瘤腺病毒及应用。是能在肿瘤局部分泌表达PD-L1单链抗体的重组溶瘤腺病毒ZD55-aPD-L1scFv的构建、扩增、纯化、体外阻断PD-L1抗原表位的验证、体外促进人PBMC对肿瘤细胞生长抑制作用分析和小鼠体内抑制肿瘤生长作用分析,揭示了肿瘤局部分泌表达PD-L1单链抗体的重组溶瘤腺病毒在肿瘤药物开发中的应用前景。
背景技术
程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1),由位于第2q37.3号染色体上的PDCD1基因编码,是具有288个氨基酸的Ⅰ型跨膜蛋白,属于CD28超家族中的一员,主要表达在活化免疫细胞,如T细胞、自然杀伤性细胞(NK细胞)和B细胞表面,主要起到调节外周耐受性和自身免疫的作用。
PD-L1(CD274,B7-H1)由位于第9p.24.1号染色体上的CD274基因编码,是PD-1(CD279)的配体。PD-L1主要表达在抗原呈递细胞(APC)、树突状细胞(DC)、巨噬细胞、活化的单核细胞、自然杀伤(NK)细胞、T细胞、B细胞、上皮细胞、血管内皮细胞、神经胶质细胞和肿瘤细胞,细胞因子IFN-γ能诱导多种肿瘤细胞表达PD-L1。
在机体免疫应答过程中,免疫检查点信号通路能够负调节免疫细胞的活性,使免疫应答更准确。活化的T细胞表面会表达PD-1,当PD-1结合靶细胞表面的配体PD-L1或PD-L2时,会激活T细胞一系列抑制信号,通过包括阻止增殖、诱导凋亡、抑制T细胞活化等途径,最终导致T细胞功能降低或衰竭凋亡。这一机制也被肿瘤细胞用于免疫逃逸。肿瘤细胞通过各种途径上调PD-L1的表达,能与活化T细胞表面的PD-1结合,抑制T细胞的效应功能,从而逃避宿主免疫监视。
针对肿瘤细胞利用PD-1/PD-L1免疫检查点信号通路进行免疫逃逸的现象,可以通过用抑制剂阻断PD-1和PD-L1的相互作用,恢复效应T细胞的活性。目前已经有多种PD-1和PD-L1抗体阻断抑制剂被批准用于临床治疗,包括PD-1阻断抗体纳武利尤单抗、帕博利珠单抗、西米普利单抗、信替利单抗、卡瑞利珠单抗、特瑞利单抗、替利珠单抗、津贝利单抗、普罗戈利单抗和多斯塔利单抗;PD-L1阻断抗体阿特珠单抗(atezolizumab)、度伐利尤单抗(durvalumab)和阿维鲁单抗(avelumab)。
然而,尽管PD-1/PD-L1阻断抗体在一些患者治疗中展现出了抗肿瘤作用,但是依然有大部分患者无法从PD-1/PD-L1阻断治疗中获益,患者应答率低。因为PD-1/PD-L1免疫检查点不是抗肿瘤免疫应答中唯一的限速步骤,很多肿瘤本身缺少免疫应答,被称为“冷肿瘤”,效应免疫细胞浸润少,尤其是免疫原性低的三阴性乳腺癌、肾癌、宫颈癌和胶质瘤等。所以,需要寻找能提升患者对PD-1/PD-L1阻断疗法应答率的治疗策略。
此外,临床报告显示全身系统性递送PD-1/PD-L1抑制剂在患者中出现12%-37%的免疫相关的毒副作用事件,其中一些事件甚至危及患者生命安全。这主要是由于全身系统性递送PD-1/PD-L1抑制剂会导致效应T细胞的过度活化而导致。因此如何降低因全身系统性递送免疫检查点抑制剂造成的毒副作用也是需要我们研究解决的问题之一。
溶瘤病毒疗法是潜在提升患者对PD-1/PD-L1阻断疗法应答率和降低因全身性递送抑制剂造成的毒副作用的治疗策略。溶瘤病毒是一类天然存在或经过基因改造的病毒,能选择性的在肿瘤细胞复制并裂解杀死肿瘤细胞,裂解肿瘤细胞的同时能产生肿瘤相关抗原进一步激活全身性抗肿瘤免疫。目前,常见研究的溶瘤病毒类型有腺病毒(Adenovirus)、单纯疱疹病毒(herpes simplex virus)、痘苗病毒(vaccinia virus)、柯萨奇病毒(coxsackievirus)、麻疹病毒(Measles virus)、细小病毒(parvovirus)和新城疫病毒(Newcastledisease virus)等。
腺病毒是一种没有包膜的双链线性DNA病毒,基因组长约36kb,外面主要有纤毛、五邻体和六邻体蛋白组成的二十面体衣壳包裹,病毒颗粒直径约为80-110nm。自上世纪50年代发现腺病毒以来,已陆续分离到52种不同血清型(serotype)人腺病毒,可以分为A~G七个亚群(subgroup),其中2型和5型腺病毒研究较多,5型腺病毒应用最广泛,包括疫苗、基因治疗和肿瘤治疗。两者在血清学分类上属于C亚群,在DNA序列上有95%的同源性。病毒基因组分为编码区和非编码区,其中编码区有与腺病毒遗传物质复制修饰等过程密切相关的5个早期转录单位(E1~E4),2个延迟转录单位(Ⅸ和Iva2)和一个与病毒颗粒组装密切相关的晚期转录单位(L1~L5)。早期转录单位E1~E4参与调控晚期转录单位L1~L5,只有当早期转录单位积累到一定量时才启动晚期转录单位的转录表达,所以可以通过对早期转录单位E1~E4的调控来控制病毒复制。目前,研究较多的为E1A基因,该基因是最早转录表达的一个蛋白,且E1A蛋白参与了病毒整个基因组复制的过程,所以可以通过修饰调控E1A基因的转录表达来控制病毒的复制。腺病毒A~G七个亚群除了遗传物质有一定程度上的差异外,与细胞的结合靶点和进入细胞的途径也存在差异。5型腺病毒感染细胞过程中首先通过与细胞膜上的柯萨奇-腺病毒受体(coxsackie and adenovirus receptor,CAR)结合,从而粘附在靶细胞表面,再通过五邻体基座上的多肽序列精氨酸-甘氨酸-天门冬氨酸(Arg-Gly-Asp,RGD)与细胞表面整合素αvβ3和αvβ5相互作用,形成质膜囊泡内吞病毒进入细胞,病毒基因组脱衣壳通过核孔进入细胞核进行转录和复制。
腺病毒的优势:安全性高,病毒基因组不会整合到宿主基因组上,降低了基因突变和致癌的风险;基因组容量大,允许非必要基因的删除和允许多个外源基因的插入;靶向性强,可以从多个维度修饰控制其靶向性;静息期和分裂期的细胞都能有效感染;病毒复制能力强,容易获得较高产量的病毒等。所以腺病毒作为理想的基因递送载体和溶瘤病毒的候选对象受到广泛关注。
综上所述,溶瘤病毒可以激活机体的免疫,改善肿瘤免疫抑制微环境,使“冷肿瘤”变成“热肿瘤”,联合免疫检查点抑制剂能产生更好的疗效。但考虑到全身性递送免疫检查点阻断抗体的用药剂量高、经济成本高、毒副作用大,而单链抗体具有全长抗体相似的结合能力以及分子量小更有利于在致密的实体瘤内部穿梭等优点,利用溶瘤腺病毒在肿瘤局部表达PD-L1阻断抗体是否比单独的溶瘤病毒或溶瘤病毒联合PD-L1全长阻断抗体会有更强的抗肿瘤作用?针对这一问题,本发明构建了能在肿瘤局部分泌表达PD-L1单链抗体的重组溶瘤腺病ZD55-aPD-L1 scFv,探究重组溶瘤腺病毒ZD55-aPD-L1 scFv在体内外的抗肿瘤作用。
发明内容
本发明的目的之一是提供局部分泌表达PD-L1单链抗体的重组溶瘤腺病毒ZD55-aPD-L1 scFv,此病毒是以5型腺病毒基因组为骨架,在E1A基因组后面插入分泌表达PD-L1单链阻断抗体(aPD-L1 scFv)序列。
所述分泌表达PD-L1单链阻断抗体(aPD-L1 scFv)的DNA序列如SEQ ID No.1所示:
ATGGAGAAAGACACACTCCTGCTATGGGTACTGCTGCTCTGGGTTCCAGGTTCCACTGGTGAAGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGCCTGCGCCTGAGCTGCGCGGCGAGCGGCTTTACCTTTAGCGATAGCTGGATTCATTGGGTGCGCCAGGCGCCGGGCAAAGGCCTGGAATGGGTGGCGTGGATTAGCCCGTATGGCGGCAGCACCTATTATGCGGATAGCGTGAAAGGCCGCTTTACCATTAGCGCGGATACCAGCAAAAACACCGCGTATCTGCAGATGAACAGCCTGCGCGCGGAAGATACCGCGGTGTATTATTGCGCGCGCCGCCATTGGCCGGGCGGCTTTGATTATTGGGGCCAGGGCACCCTGGTGACCGTGGGTGGTGGTGGTTCTGGCGGCGGCGGCTCCGGTGGTGGTGGATCCGATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGATCGCGTGACCATTACCTGCCGCGCGAGCCAGGATGTGAGCACCGCGGTGGCGTGGTATCAGCAGAAACCGGGCAAAGCGCCGAAACTGCTGATTTATAGCGCGAGCTTTCTGTATAGCGGCGTGCCGAGCCGCTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCGGAAGATTTTGCGACCTATTATTGCCAGCAGTATCTGTATCATCCGGCGACCTTTGGCCAGGGCACCAAAGTGGAAATTAAATAA
所述分泌表达PD-L1单链阻断抗体(aPD-L1 scFv)的氨基酸序列如SEQ ID No.2所示:
MEKDTLLLWVLLLWVPGSTGEVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVGGGGSGGGGSGGGGSDIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQ QYLYHPATFGQGTKVEIK
本发明所述重组溶瘤腺病毒ZD55-aPD-L1 scFv的制备方法,通过以下步骤实现:
由南京金斯瑞生物科技有限公司代为合成PD-L1阻断抗体阿特株单抗(Atezolizumab)的单链抗体序列,该序列用(GGGGS)3连接子连接了此抗体的重链可变区(VH)和轻链可变区(VL),并在N端添加分泌信号肽。PCR扩增aPD-L1 scFv基因,并用EcoR I和Xho I双酶切aPD-L1 scF基因和pCA13质粒,然后用T4连接酶连接。将鉴定正确的质粒命名为pCA13-aPD-L1scFv。用BglⅡ酶切pCA13-aPD-L1scFv和pSD55质粒,aPD-L1scFv表达框和去磷酸化线性化的pSD55连接。将鉴定正确的质粒命名为pSD55-aPD-L1 scFv。用Pme I限制性内切酶线性化的腺病毒穿梭质粒pSD55-aPD-L1 scFv转化到含有pAd-easy-1的BJ5183感受态菌株进行同源重组,将同源重组正确的质粒命名为pZD55-aPD-L1 scFv。pZD55-aPD-L1scFv经质粒大抽后用Pac I限制性内切酶进行单酶切使其线性化,然后将线性化的pZD55-aPD-L1 scFv转染到人胚肾细胞HEK293A中进行病毒包装,随后进行病毒扩增、纯化和滴度测定从而获得重组腺病毒ZD55-aPD-L1 scFv。
本发明的另一个目的是所述重组溶瘤腺病毒ZD55-aPD-L1 scFv在制备免疫治疗PD-L1阳性的肿瘤药物中的应用。所述应用是ZD55-aPD-L1 scFv在肿瘤局部分泌表达PD-L1单链阻断抗体,通过促进淋巴细胞在肿瘤中的浸润和阻断PD-1:PD-L1信号通路,增强效应T淋巴细胞对肿瘤生长的抑制作用。所述肿瘤为三阴性乳腺癌、黑色素瘤等。
本发明利用分子克隆成功构建了重组溶瘤腺病毒ZD55-aPD-L1 scFv,用蛋白免疫印迹法和ELISA实验验证了ZD55-aPD-L1 scFv感染的细胞能有效分泌表达aPD-L1 scFv,其与PD-L1蛋白的亲和力测定为6.5nM;体外流式细胞术实验表明ZD55-aPD-L1 scFv感染人三阴性乳腺癌MDA-MB-231后能有效阻断细胞表面PD-L1的抗原表位;体外肿瘤细胞和人PBMC共培养实验中ZD55-aPD-L1 scFv处理组展现出最强的肿瘤细胞杀伤作用;在重度免疫缺陷的NOD-SCID小鼠荷瘤人三阴性乳腺癌MDA-MB-231模型中,ZD55-aPD-L1 scFv联合人PBMC治疗组肿瘤生长抑制作用明显强于对照治疗组,肿瘤浸润效应T淋巴细胞占比也最高,此外小鼠体重没有明显降低,说明没有严重的毒副作用;在免疫完全BALB/c小鼠荷瘤4T1模型和免疫完全C57BL/6小鼠荷瘤B16F10模型中,ZD55-aPD-L1 scFv治疗组也显出比对照溶瘤腺病毒ZD55治疗组更强的肿瘤生长抑制作用,延长小鼠存活时间更久,肿瘤浸润效应T淋巴细胞占比也最高。本发明所提供的重组溶瘤腺病毒ZD55-aPD-L1 scFv,具有转化应用前景,可用于开发三阴性乳腺癌、黑色素瘤等PD-L1阳性肿瘤免疫治疗药物。
本发明的有益效果是:(1)本发明通过在5型腺病毒E1A基因组后插入aPD-L1scFv基因,重组溶瘤腺病毒能够有效分泌表达aPD-L1 scFv,不影响其生物学特性,安全性较好;(2)本发明构建的重组溶瘤腺病毒ZD55-aPD-L1 scFv在体内体外实验中均验证了其比对照处理组具有更强的肿瘤生长抑制作用,奠定了此溶瘤腺病毒作为肿瘤免疫治疗性药物研发的基础。
附图说明
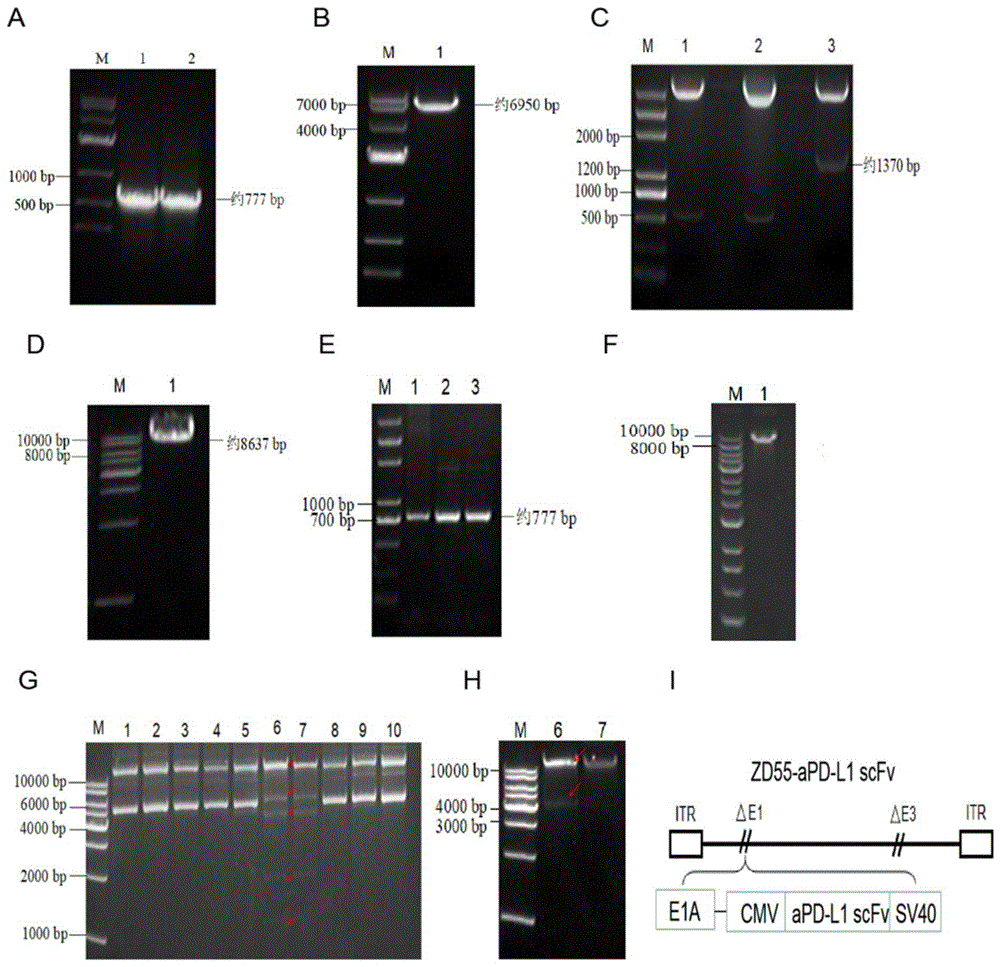
图1是构建重组溶瘤腺病毒ZD55-aPD-L1 scFv的分子克隆琼脂糖核酸凝胶电泳图。
图2是验证aPD-L1 scFv的表达情况和其与PD-L1的亲和力测定结果图。
图3是PD-L1阳性细胞筛选和ZD55-aPD-L1 scFv阻断PD-L1抗体表位能力验证结果图。
图4是ZD55-aPD-L1 scFv体外促进人PBMC细胞对肿瘤细胞杀伤作用结果图。
图5是ZD55-aPD-L1 scFv在NOD-SCID小鼠荷瘤人三阴性乳腺癌MDA-MB-231的肿瘤生长抑制结果图。
图6是ZD55-aPD-L1 scFv在BALB/c小鼠荷瘤鼠乳腺癌4T1的肿瘤生长抑制结果图。
图7是ZD55-aPD-L1 scFv在C57BL/6小鼠荷瘤鼠黑色素瘤B16F1010的肿瘤生长抑制结果图。
具体实施方式
本发明结合附图及实施例及作进一步的说明。
实施例1:重组溶瘤腺病毒ZD55-aPD-L1 scFv的构建、包装、扩增和纯化
实验方法:以合成的pUC57-aPD-L1 scFv质粒为模板,用引物序列3和4PCR扩增获取用于构建到pCA13质粒上的aPD-L1 scFv基因片段。用质粒小提试剂盒抽提pCA13质粒,并同胶回收的目的基因片段aPD-L1 scFv用EcoR I和Xho I进行双酶切。双酶切后的pCA13载体和目的基因用T4连接酶在16℃条件下,连接过夜。用质粒小提试剂盒抽提pSD55、pCA13-aPD-L1 scFv质粒,分别用BglⅡ进行单酶切。将BglⅡ单酶切线性化胶回收的pSD55载体去磷酸化,BglⅡ单酶切并进行去磷酸化反应后的pSD55载体和aPD-L1 scFv表达框用T4连接酶在16℃条件下,连接过夜。用质粒小提试剂盒抽提pSD55-aPD-L1 scFv质粒,用Pme I进行单酶切。将10μL Pme I线性化pSD55-aPD-L1 scFv转化到100μL BJ5183感受态(含pAd-easy-1骨架质粒)中进行同源重组,同源重组后用Mlu I酶切鉴定和Pac I酶切鉴定。生长状态良好HEK293A细胞进行计数铺板,6孔板每孔加2.5×10
实验结果:PCR成功扩增一条约770bp大小的aPD-L1 scFv基因条带(图1A),pCA13质粒用EcoR I和Xho I双酶切后获得一条约7000bp的条带(图1B),pCA13和aPD-L1 scFv连接后用BglⅡ单酶切获得约1370bp的表达框(图1C),连接正确的质粒命名为pCA13-aPD-L1scFv。pSD55用BglⅡ单酶切线性化获得一条约10kb的条带(图1D),BglⅡ线性化的pSD55经去磷酸化处理后于1370bp的表达框连接,重组的质粒用PCR验证,正确构建的质粒有一条约777bp的条带(图1E),构建正确的质粒命名为pSD55-aPD-L1 scFv。pSD55-aPD-L1 scFv用Pme I单酶切线性化后有一条约10kb的条带(图1F)。pSD55-aPD-L1scFv和pAd-easy-1同源重组后Mul I酶切有5条条带为病毒基因组完整的质粒(图1G),同源重组正确的质粒用PacI后有2条条带(图1H),将构建正确的质粒命名为pZD55-aPD-L1-scFv,重组病毒在HEK293A进行包装、扩增和纯化,结果成功构建了能分泌表达aPD-L1 scFv的重组溶瘤腺病毒ZD55-aPD-L1 scFv,图1I为重组病毒基因组示意图。
实施例2:aPD-L1 scFv的表达验证及其与PD-L1蛋白的亲和力测定
实验方法:分别用PBS、5MOI ZD55和5MOI ZD55-aPD-L1 scFv感染HEK293A48h,收集细胞蛋白样和培养基上清蛋白样用Western Blot检测aPD-L1 scFv的表达;用纯化的aPD-L1 scFv蛋白作为标准蛋白浓度,ELISA检测5MOI ZD55-aPD-L1 scFv感染HEK293A细胞24h、48h和72h后培养基上清中aPD-L1 scFv的蛋白量;纯化的aPD-L1 scFv蛋白和PD-L1抗原蛋白进行了亲和力测定。
实验结果:ZD55-aPD-L1 scFv病毒感染的细胞和培养基上清中有aPD-L1 scFv蛋白的表达,而PBS组和对照病毒ZD55组则没有(图2A)。24h的培养基上清中aPD-L1 scFv蛋白浓度大约为10ng/mL,48h大约为20ng/mL,72h大约为60ng/mL,由于重组病毒能在HEK293A中繁殖扩增,所以外源基因的表达量也会呈现出加速增加的现象(图2B)。aPD-L1scFv和PD-L1蛋白的亲和力为6.51nM(图2C),比其全长抗体阿特珠单抗的亲和力0.4nM略低。
实施例3:ZD55-aPD-L1 scFv对细胞表面PD-L1影响的分析
实验方法:以aPD-L1 IgG作为一抗,用流式细胞术检测对数生长期的HEK293A、A549、HeLa、MCF7、MDA-MB-453和MDA-MB-231细胞表面PD-L1的表达情况;用20MOI的ZD55病毒感染HEK293A、A549、MCF7、MDA-MB-453和MDA-MB-231细胞,24h后用流式细胞术检测细胞表面PD-L1的表达情况,方法同上;用0、1、5、20、50和100MOI的ZD55-aPD-L1-scFv感染MDA-MB-231细胞,24h后用流式细胞术检测细胞表面PD-L1的表达情况,方法同上。
实验结果3:MDA-MB-231细胞PD-L1染色峰明显右移,为细胞表面PD-L1阳性;其余5个细胞株几乎看不到有阳性偏移峰,可以认为是细胞表面PD-L1阴性(图3A)。溶瘤腺病毒ZD55的感染没有影响细胞表面PD-L1的表达(图3B)。MDA-MB-231细胞在被ZD55-aPD-L1scFv病毒感染后检测到细胞表面PD-L1都有降低,病毒剂量越高,检测到的PD-L1越少,当病毒量大于20MOI时,PD-L1降低极显著,间接说明只要重组病毒ZD55-aPD-L1 scFv表达的aPD-L1 scFv蛋白足以占据PD-L1的抗原表位达到阻断其与PD-1结合的效果(图3C)。
实施例4:ZD55-aPD-L1 scFv对PBMC抑制肿瘤细胞作用的分析
实验方法:MDA-MB-231细胞分别用PBS、20MOI ZD55、20MOI ZD55-aPD-L1 scFv和10μg/mL aPD-L1 IgG处理24h,A549细胞分别用PBS、2MOI ZD55、2MOI ZD55-aPD-L1scFv和10μg/mL aPD-L1 IgG处理24h,然后分别加入5μg/mL PHA非特异激活培养24h的PBMC细胞(PBMC与肿瘤细胞数量比约为1:1),同时设置不加PBMC的对照组。用显微镜观察肿瘤细胞生长情况,并在共培养48h后用100倍镜下拍摄明场细胞形态图并用流式细胞术统计存活的肿瘤细胞数;MDA-MB-231和MCF7细胞分别用PBS、20MOI ZD55、20MOI ZD55-aPD-L1 scFv和10μg/mL aPD-L1 IgG处理24h,然后加入5μg/mL PHA非特异激活培养24h的PBMC细胞(PBMC与肿瘤细胞数量比约为1:1),同时设置不加PBMC的对照组,并额外设置一组ZD55联合10μg/mLaPD-L1 IgG处理组,48h后用流式细胞术统计存活的肿瘤细胞数,方法同上。
实验结果:结果如图4A,PBS处理组、单独加10μg/mL aPD-L1 IgG处理组和未加病毒的PBMC处理组细胞已经长满且状态良好;单独加20MOI ZD55组和单独加20MOI ZD55-aPD-L1 scFv组的细胞出现了少量变圆的凋亡细胞,但底部仍有大量状态良好的细胞;的细胞也已经长满且生长状态良好,和PBS对照组无明显差异。ZD55和PBMC联合处理组出现较多变圆和破碎的细胞,底部仍有大量存活的肿瘤细胞,但比单独用ZD55处理组和单独用PBMC处理组有更强的抑制肿瘤细胞的作用;ZD55-aPD-L1 scFv和PBMC联合组出现大片成团死亡的细胞,底部只有极少的肿瘤细胞存活,比单独用ZD55-aPD-L1 scFv处理组、单独用PBMC处理组和ZD55与PBMC联合处理组有更强的肿瘤细胞杀伤作用;10μg/mL aPD-L1 IgG联合PBMC处理组肿瘤细胞生长状态良好,未见明显的细胞死亡形态;流式细胞术检测存活肿瘤细胞数量结果也表明ZD55-aPD-L1 scFv和PBMC联合组肿瘤生长抑制作用最强。A549和PBMC共培养实验结果也证明ZD55-aPD-L1 scFv和PBMC联合组具有最强的肿瘤生长抑制作用(图4B)。在MDA-MB-231和PBMC共培养实验中ZD55-aPD-L1 scFv和PBMC联合组比ZD55联合PBMC和10μg/mL aPD-L1 IgG处理组的肿瘤生长抑制作用效果好(图4C);在MCF7和PBMC共培养实验中ZD55-aPD-L1 scFv和PBMC联合组比ZD55联合PBMC和10μg/mL aPD-L1 IgG处理组的肿瘤生长抑制作用相似(图4D)。
实施例5:ZD55-aPD-L1 scFv在NOD-SCID小鼠荷瘤人三阴性乳腺癌MDA-MB-231肿瘤模型中的抗肿瘤作用分析
实验方法:按每只小鼠5×10
实验结果:结果如图5A所示,溶瘤腺病毒治疗组相对PBS组均有一定的肿瘤生长抑制效果,这和上一次的动物实验结果一致,ZD55联合aPD-L1 IgG组和ZD55单独治疗组肿瘤生长抑制效果差不多,而重组腺病毒ZD55-aPD-L1 scFv治疗组肿瘤抑制效果最显著,6只小鼠中的一只小鼠肿瘤完全消退,比对照病毒ZD55治疗组和ZD55联合aPD-L1 IgG治疗组显示出更强的肿瘤生长抑制作用,这和体外MDA-MB-231细胞和人PBMC共培养结果一致;小鼠体重未发生明显的降低,说明没有明显的毒副作用(图5B)。肿瘤组织分别用流式细胞术检测人CD3
实施例6:ZD55-aPD-L1 scFv在BALB/c小鼠荷瘤乳腺癌4T1肿瘤模型中的抗肿瘤作用分析
实验方法:皮下接种5×10
实验结果:结果如图6所示,ZD55-aPD-L1 scFv治疗组相比较于PBS对照组和ZD55治疗组具有更强的肿瘤生长抑制作用(图6A)和显著延长小鼠的存活时间(图6B)。ZD55-aPD-L1 scFv治疗组肿瘤浸润的CD3
实施例7:ZD55-aPD-L1 scFv在C57BL/6小鼠荷瘤鼠黑色素瘤B16F10肿瘤模型中的抗肿瘤作用分析
实验方法:在C57BL/6小鼠右翼皮下接种5×10
实验结果:结果如图7所示,ZD55-aPD-L1 scFv治疗组相较于其他治疗组更有效的抑制黑色素瘤的生长(图7A),显著延长小鼠的存活时间(图7B)。aPD-L1 IgG治疗组肿瘤浸润CD3
对于本领域的普通技术人员而言,具体实施例只是对本发明进行了示例性描述,显然本发明具体实现并不受上述方式的限制,只要采用了本发明的方法构思和技术方案进行的各种非实质性的改进,或未经改进将本发明的构思和技术方案直接应用于其它场合的,均在本发明的保护范围之内。
