一种用于鉴定小麦沉淀值的KASP标记及应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于生物技术领域,具体涉及一种用于鉴定小麦沉淀值的KASP标记及应用。
背景技术
小麦(Triticum aestivum L.)是我国最主要的粮食作物之一,对保障粮食安全具有重要战略意义。随着社会经济的发展和生活水平的提高,小麦品质受到育种者和消费者的极大关注,品质改良已经成为我国小麦育种的主要目标之一。根据我国现行的《小麦品种品质分类标准(GB/T 17320-2013)》,小麦品质指标主要包括硬度、粗蛋白含量(籽粒)、湿面筋含量、沉淀值、吸水量、稳定时间、最大拉伸阻力、能量(小麦粉)等。
沉淀值测定速度快、方法简单,并且能够反映面筋蛋白的含量及质量,是小麦品质极为重要的评价指标。此外,沉淀值遗传力高,可作为小麦品质育种早代筛选的指标。沉淀值呈数量性状遗传,其遗传性受多基因控制,基因作用以多基因加性效应为主。目前已定位到一些与小麦沉淀值相关的QTL,但由于受作图群体、遗传背景和作图方法等因素影响,结果只能反映出特定的小麦品种中包含的基因信息,且多数QTL对表型贡献率较小、在不同环境间重复性差,所以仍不能满足分子标记辅助选择(Marker Assisted Selection,MAS)的需要。因此,开发用于筛选小麦沉淀值的KASP标记,对提高小麦品质具有重要意义。
竞争性等位基因特异性PCR(Kompetitive Allele-Specific PCR,KASP)是一种基于荧光的同质基因分型技术。根据目标等位基因中包含的特定SNP或InDels设计引物,并在引物末端加入不同的荧光集团,基于PCR终端荧光信号的读取对目标序列进行精准的双等位基因分型,具有准确、高效、成本低的优点,在农业育种中有着广阔的应用前景。
发明内容
本发明的目的为如何筛选或辅助筛选不同沉淀值小麦。
本发明首先保护一种筛选或辅助筛选不同沉淀值小麦的方法,可包括如下步骤:检测待测小麦的基因型为基因型qSV1D.1a还是基因型qSV1D.1b,基因型qSV1D.1b的小麦的沉淀值>基因型qSV1D.1a的小麦的沉淀值;
所述基因型qSV1D.1b的小麦为基于T100G SNP位点的基因型为TT纯合型的小麦;
所述基因型qSV1D.1a的小麦为基于T100G SNP位点的基因型为GG纯合型的小麦;
所述T100G SNP位点为小麦基因组中SEQ ID NO:4自5’末端起的第100位核苷酸。
上述方法中,所述检测待测小麦的基因型为基因型qSV1D.1a还是基因型qSV1D.1b的步骤可如下:
(a1)以待测小麦的基因组DNA为模板,采用引物组1进行PCR扩增,得到PCR扩增产物;
所述引物组1由SEQ ID NO:1所示的上游引物F1、SEQ ID NO:2所示的上游引物F2和SEQ ID NO:3所示的下游引物R组成;
(a2)完成步骤(a1)后,采用仪器检测PCR扩增产物的荧光信号,根据荧光信号的颜色获得待测小麦的基因型。
上述方法中,采用引物组1进行PCR扩增的反应程序具体可为:94℃预变性15min;94℃变性20s,复性/延伸20s(第一次复性/延伸温度为61℃,每个循环降低0.6℃),共10个循环;94℃变性20s,55℃复性/延伸1min,共26个循环;72℃延伸3min;4℃保存。
上述方法中,采用引物组1进行PCR扩增的反应体系具体可为1.6μL,由0.4μL 2×KASP Master Mix(LGC,LotNo.13426773)、0.022μL引物工作液、0.8μL模板和超纯水组成。其中,引物工作液由12体积份上游引物F1水溶液(浓度为100μM)、12体积份上游引物F2水溶液(浓度为100μM)、30体积份下游引物R水溶液(浓度为100μM)和46体积份10mM Tris-HCl(pH 8.0)混合而成。
上述方法中,所述检测待测小麦的基因型为基因型qSV1D.1a还是基因型qSV1D.1b的步骤可如下:
(b1)以待测小麦的基因组DNA为模板,采用引物组2进行PCR扩增,得到PCR扩增产物;
所述引物组2由SEQ ID NO:1自5’末端起第22至46位所示的上游引物F1、SEQ IDNO:2自5’末端起第22至49位所示的上游引物F2和SEQ ID NO:3所示的下游引物R组成;
(b2)取步骤(b1)得到的PCR扩增产物,测序;
(b3)根据步骤(b2)得到的测序结果,获得待测小麦的基因型。
本发明还保护一种鉴定或辅助鉴定小麦沉淀值的试剂盒。所述试剂盒可包括检测待测小麦的基因型为基因型qSV1D.1a还是基因型qSV1D.1b的物质;
所述基因型qSV1D.1b为基于T100G SNP位点的基因型为TT纯合型;
所述基因型qSV1D.1a为基于T100G SNP位点的基因型为GG纯合型;
所述T100G SNP位点为小麦基因组中SEQ ID NO:4自5’末端起的第100位核苷酸。
所述试剂盒具体可由检测待测小麦的基因型为基因型qSV1D.1a还是基因型qSV1D.1b的物质组成。
上述任一所述检测待测小麦的基因型为基因型qSV1D.1a还是基因型qSV1D.1b的物质具体可为引物组1;所述引物组1由SEQ ID NO:1所示的上游引物F1、SEQ ID NO:2所示的上游引物F2和SEQ ID NO:3所示的下游引物R组成。
上述任一所述检测待测小麦的基因型为基因型qSV1D.1a还是基因型qSV1D.1b的物质具体可为引物组2;所述引物组2由SEQ ID NO:1自5’末端起第22至46位所示的上游引物F1、SEQ ID NO:2自5’末端起第22至49位所示的上游引物F2和SEQ ID NO:3所示的下游引物R组成。
所述试剂盒的制备方法也属于本发明的保护范围。所述试剂盒的制备方法包括将上述任一所述引物组1或上述任一所述引物组2中的各条引物分别单独包装的步骤。
本发明还保护SEQ ID NO:4或SEQ ID NO:4自5’末端起第76至133位所示的分子标记。
本发明还保护上述任一所述试剂盒或上述任一所述分子标记在鉴定或辅助鉴定小麦沉淀值中的应用。
本发明还保护上述任一所述试剂盒或上述任一所述分子标记在筛选或辅助筛选不同沉淀值小麦中的应用。
本发明还保护上述任一所述试剂盒或上述任一所述分子标记在小麦育种中的应用。
上文中,当分子标记中的T100G SNP位点的基因型为TT纯合型,则判定为基因型qSV1D.1b的小麦。当分子标记中的T100G SNP位点的基因型为GG纯合型,则判定为基因型qSV1D.1a的小麦。所述T100G SNP位点为小麦基因组中SEQ ID NO:4自5’末端起的第100位核苷酸。
基因型qSV1D.1b的小麦的沉淀值>基因型qSV1D.1a的小麦的沉淀值。
上文中,所述>具体可为统计学上的>。
上文中,SEQ ID NO:2自5’末端起第1至21位所示的核苷酸序列为荧光标签序列(即FAM荧光标签序列),荧光信号具体为绿色。SEQ ID NO:1自5’末端起第1至21位所示的核苷酸序列也为荧光标签序列(即HEX荧光标签序列),荧光信号具体为粉色。
实验证明,采用本发明提供的方法检测待测小麦基于T100G SNP位点的基因型,可以筛选或辅助筛选小麦沉淀值性状,同时本发明提供的方法还具有高通量、准确、低成本、操作简单、节约人力、物力等优点。本发明可以加快优质小麦新品种的培育进程,具有重要的应用价值。
附图说明
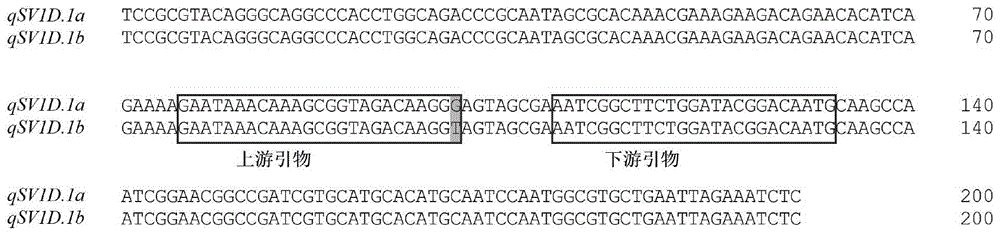
图1为T100G SNP位点和3个引物在SEQ ID NO:4所示的DNA分子上的位置。
图2为自然群体中359个小麦种质的基因分型的检测结果(CK为阴性对照;TT为TT纯合型,即基因型qSV1D.1b;GG为GG纯合型,即基因型qSV1D.1a)。
图3为不同环境下自然群体中基因型qSV1D.1b和基因型qSV1D.1a的小麦种质与沉淀值均值的关联分析;其中,18-19水地_G为2018-2019年水地环境的基因型qSV1D.1a,18-19水地_T为2018-2019年水地环境的基因型qSV1D.1b,19-20水地_G为2019-2020年水地环境的基因型qSV1D.1a,19-20水地_T为2019-2020年水地环境的基因型qSV1D.1b,20-21水地_G为2020-2021年水地环境的基因型qSV1D.1a,20-21水地_T为2020-2021年水地环境的基因型qSV1D.1b,18-19旱地_G为2018-2019年旱地环境的基因型qSV1D.1a,18-19旱地_T为2018-2019年旱地环境的基因型qSV1D.1b,19-20旱地_G为2019-2020年旱地环境的基因型qSV1D.1a,19-20旱地_T为2019-2020年旱地环境的基因型qSV1D.1b,20-21旱地_G为2020-2021年旱地环境的基因型qSV1D.1a,20-21旱地_T为2020-2021年旱地环境的基因型qSV1D.1b,**代表P<0.01,即差异达到极显著水平。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用的小麦材料(具体小麦种质名称记载于如下文献中:Jie Zhao,Lijing Sun,et al.Genome-wide association study ofyield-related traits incommon wheat(Triticum aestivum L.)under normal and drought treatmentconditions.Frontiers in Plant Science.DOI:10.3389/fpls.2022.1098560)均来自河北省农林科学院粮油作物研究所小麦研究中心,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的实验所用,不可作为其它用途使用。由于小麦材料均为栽培种,因此通常被默认为是高度纯合的植物材料,基因型均为纯合型。
实施例1、小麦基因组中T100G SNP位点的发现及小麦基于T100G SNP位点的基因型分型方法的建立
一、小麦基因组中T100G SNP位点的发现
本发明的发明人经过大量实验,在小麦基因组中发现了一个SNP位点,命名为T100G SNP位点。T100G SNP位点位于SEQ ID NO:4自5’末端起的第100位,基因型为TT纯合型和GG纯合型。在中国春小麦基因组IWGSC RefSeq v1.0中,T100G SNP位点的物理位置为1D染色体的第411733093位;SEQ ID NO:4所示的DNA分子的物理位置为1D染色体的第411732994-411733193位。
二、合成用于扩增T100G SNP位点的引物组
基于KASP技术原理,本发明的发明人经过大量实验摸索设计并合成了用于扩增T100G SNP位点的引物组。引物组由上游引物F1、上游引物F2和下游引物R组成。各个引物的核苷酸序列见表1。
表1
注:单下划线为FAM荧光标签序列,双下划线为HEX荧光标签序列。
T100G SNP位点和3个引物(部分)在SEQ ID NO:4所示的DNA分子上的位置见图1(红色背景代表T100G SNP位点,方框标识为引物)。
三、待测小麦基于T100G SNP位点的基因型分型方法的建立
本发明的发明人经过大量实验,建立了待测小麦基于T100G SNP位点的基因型分型方法。具体步骤如下:
1、待测小麦的基因组DNA的获得
采用CTAB法提取待测小麦的幼叶的基因组DNA,得到待测小麦的基因组DNA。
待测小麦的基因组DNA的质量和浓度均须满足PCR要求,达标标准为:1%琼脂糖电泳显示DNA条带清晰、无明显杂质、无降解;紫外分光光度计Nanodrop2000(Thermo)检测A260/A280比值在1.8左右,A260/A230比值大于1.8。
将待测小麦的基因组DNA用去离子水稀释至浓度为28.3ng/μL,得到下一步用于进行PCR扩增的模板。
2、以待测小麦的基因组DNA或水(作为阴性对照)为模板,采用步骤二合成的引物组进行PCR扩增,得到PCR扩增产物。
反应体系为1.6μL,由0.4μL 2×KASPMaster Mix(LGC,LotNo.13426773)、0.022μL引物工作液、0.8μL模板和超纯水组成。其中,引物工作液由12μL上游引物F1水溶液(浓度为100μM)、12μL上游引物F2水溶液(浓度为100μM)、30μL下游引物R水溶液(浓度为100μM)和46μL 10mM Tris-HCl(pH 8.0)混合而成。
反应程序为:94℃预变性15min;94℃变性20s,复性/延伸20s(第一次复性/延伸温度为61℃,每个循环降低0.6℃),共10个循环;94℃变性20s,55℃复性/延伸1min,共26个循环;72℃延伸3min;4℃保存。
3、完成步骤2后,用荧光检测系统(Araya)读取PCR扩增产物的荧光数据,结果用GraphPad Prism进行图形化展示,即根据荧光信号颜色判断待测小麦的基因型,具体原则如下:如果待测小麦显示绿色荧光信号,则该待测小麦基于T100G SNP位点的基因型为TT纯合型,此时将待测小麦的基因型命名为基因型qSV1D.1b;如果待测小麦显示粉色荧光信号,则该待测小麦基于T100G SNP位点的基因型为GG纯合型,此时将待测小麦的基因型命名为基因型qSV1D.1a。阴性对照没有任何的检出信号。
图形化展示结果为:显示粉色荧光信号的基因型qSV1D.1a分布于y轴附近;显示绿色荧光信号的基因型qSV1D.1b分布于x轴附近;无检出信号的阴性对照分布于原点附近。
实施例2、小麦两种基因型(基因型qSV1D.1b和基因型qSV1D.1a)与沉淀值的关联分析
一、自然群体中各个小麦的基因型分型
采用实施例1中步骤三的方法对自然群体中的各个小麦品种进行基因分型。自然群体由代表黄淮麦区主栽品种和优异品系的359个小麦种质(均为六倍体)组成。小麦种质名称详见表2和表3中的第2列。
检测结果见图2。
359个小麦种质的基因型详见表2中的第3-4列和表3中的第3-4列。288个小麦种质的基因型为基因型qSV1D.1a,71个小麦种质的基因型为基因型qSV1D.1b。
表2
/>
/>
/>
/>
/>
注:NA表示平均沉淀值数据缺失。
表3
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
注:NA表示平均沉淀值数据缺失。
二、小麦沉淀值性状的检测
将自然群体中的359个小麦种质连续三年(分别为2018-2019年、2019-2020年、2020-2021年)种植于河北省农林科学院粮油作物研究所堤上试验站,同时每年均播种于水地(足墒播种,拔节期和灌浆期各浇水一次,灌水量为50m
359个小麦种质在6个环境(即2018-2019年水地、2019-2020年水地、2020-2021年水地、2018-2019年旱地、2019-2020年旱地和2020-2021年旱地)下的平均沉淀值的统计结果见表2中的第5-7列(不同年份水地)和表3中的第5-7列(不同年份旱地),仅部分小麦种质因种植原因等没有获得平均沉淀值数据,用NA表示。
三、关联分析
1、将同一环境下的同一基因型的小麦种质的平均沉淀值取平均值,记为沉淀值均值。
2、采用双尾t-test检验将同一环境下自然群体中基因型qSV1D.1b和基因型qSV1D.1a的小麦种质与沉淀值均值进行关联分析。
结果见表4(统计小麦种质数目根据表2和表3获得,即去除没有获得平均沉淀值数据的小麦种质的数量)和图3。
表4
注:P<0.01代表差异达到极显著水平。
结果表明,359个小麦种质组成的自然群体中,基因型qSV1D.1b的小麦的沉淀值>基因型qSV1D.1a的小麦的沉淀值,所述“>”为在统计学上的>。对自然群体的研究表明,基因型qSV1D.1b是提高小麦沉淀值的优异基因型。
上述结果表明,通过检测待测小麦基于T100G SNP位点的基因型可以筛选或辅助筛选小麦沉淀值性状,在小麦分子标记辅助育种过程中具有重要的应用价值。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。
