一种甲壳动物体内基因过表达的方法
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于分子生物学领域,具体涉及一种甲壳动物体内基因过表达的方法。
背景技术
基因过表达是将目的基因CDS克隆到相应的质粒或病毒载体上,利用载体骨架上构建的调控元件,使基因可以在人为控制的条件下实现大量转录和翻译,从而实现目的基因的过表达。对目的基因进行过表达,并观察其产生的表型,是探索基因功能的一个不可或缺的方法。目前动物体内基因过表达的方式,广义上来说有两种:基因工程和病毒载体介导的动物体内基因转染。目前,甲壳动物没有成熟的细胞系,无法通过基因工程的方法实现目的基因的过表达,也没有开发出高效的病毒载体介导的甲壳动物体内基因转染的方法。目前主要有两种方法进行过表达研究:向甲壳动物体内直接注射重组蛋白(Gao et al.,mBio.2023,14(2):e0291922)或者目的基因的mRNA(Yang et al.,PLoS Pathog.2016,12(12):e1006127),但是这两种方式的效率还有待进一步提高。实现甲壳动物体内的基因高表达对研究甲壳动物的基因功能从而促进其生物学现象与功能的深入研究具有十分重要的作用,因此,甲壳动物研究迫切需要精准、高效的体内基因转染方法。
外泌体是一种直径为30-150nm的细胞外膜囊泡,在细胞间信息交流中发挥了重要作用。外泌体在大小和功能上与合成的纳米颗粒类似,作为天然内源性转运载体,具有毒性低、无免疫原性、渗透性好等优势,而今已被视为最具潜力的药物递送载体,适合递送各种化学物质、蛋白质、核酸和基因治疗剂。外泌体作为递送载体的一个关键问题是如何获得高产量、纯度高的外泌体,目前在甲壳动物中已经具备人工外泌体体外合成技术。利用人工外泌体作为运载工具,实现甲壳动物体内基因过表达,对于搭建甲壳动物基因功能研究平台具有重要意义。
专利申请号202211465018X记载了一种甲壳动物血细胞人工外泌体,但只是介绍了人工外泌体的制备方式及其能直接包裹蛋白质或RNA并保持相应活性的作用,但多数蛋白无法在体外纯化或者体外纯化没有办法保证蛋白活性,而直接包裹对应的核酸又无法保证其能在体内翻译,导致这种方法只能应用于少部分蛋白或核酸,且注入受体后能产生的作用也极为有限,需要进一步开发出高效的、适用面广的、能使甲壳动物体内基因过表达的方法,才能真正应用到生产研究中。
发明内容
本发明的目的在于,解决目前甲壳动物体内目的基因无法高效过表达的问题,提供一种甲壳动物体内基因过表达的新方法。该方法利用人工外泌体包裹带有目的基因的质粒,将其注射到甲壳动物体内实现目的基因的过表达。携带质粒的人工外泌体无毒,且可以高效地被受体细胞摄取,可将质粒带入受体细胞,实现目的基因的过表达。
为了解决上述技术问题,本发明采用如下技术方案:
一种甲壳动物体内基因过表达的方法,包括如下步骤:
A、扩增目的序列;
B、将所述目的序列负载在载体上,构建过表达质粒;
C、将所述过表达质粒包裹在人工外泌体内,形成过表达外泌体;
D、将所述过表达外泌体注射进甲壳动物体内,使其基因过表达。
优选的,所述目的序列包括核酸。
优选的,所述目的序列包括14-3-3、AIF、p53、GFP中的一种或多种。
优选的,目的序列基因可以是甲壳动物内源性或外源性基因。
优选的,所述载体包括所有含有可利用甲壳动物体内转录和翻译系统的启动子的载体。
优选的,所述载体包括pIZ-wsv249p-egfp质粒(Shi et al.,Developmental andcomparative immunology.2018,88,70–76)、pCDNA3.1质粒、pIZT/V5-His质粒中的一种或多种;所述甲壳动物包括拟穴青蟹、南美白对虾中的一种或多种。
优选的,步骤A中,根据所述目的序列和所述载体设计所述目的序列的扩增引物,进行扩增;步骤B中,采用一步法克隆构建所述过表达质粒;步骤C中,所述过表达质粒不小于200ng。
优选的,步骤C包括:
C1、收集血细胞;
C2、分离所述血细胞的细胞膜和细胞质基质;
C3、将所述细胞膜和所述细胞质基质加入到反应体系中,再加入所述过表达质粒,反应获得所述过表达外泌体。
优选的,所述再生体系为ATP再生体系,包括ATP,GDP-甘露糖,磷酸肌酸,磷酸肌酸酶,HEPEs-pH 7.2,山梨醇,乙酸钾,乙酸镁;所述孵育缓冲液包括KCl,CaCl
优选的,所述ATP再生体系包括10mM ATP,500mM GDP-甘露糖,400mM磷酸肌酸,40mM磷酸肌酸酶,20mM HEPEs-pH 7.2,250mM山梨醇,150mM乙酸钾,5mM乙酸镁;所述孵育缓冲液包括80mM KCl,20mM CaCl
甲壳动物血细胞人工外泌体极为困难,ATP浓度或缓冲液pH不合适均无法合成。本发明经过长期研究,不断调整调节配比,最终确定了合适ATP再生体系和孵育缓冲液,成功合成出甲壳动物血细胞人工外泌体。
优选的,包括如下步骤:
A、扩增目的序列:
A1、根据所述目的序列和所述载体的启动子后的酶切位点,按照一步法克隆的方法设计所述目的序列的体外扩增引物;
A2、用所述体外扩增引物扩增所述目的序列并纯化收集扩增产物;
B、将所述目的序列负载在载体上,构建过表达质粒:
B1、根据所述目的序列两端的酶切位点,将所述载体进行双酶切并纯化收集双酶切后产物;
B2、将所述扩增产物与所述双酶切后产物进行连接,筛选连接成功的重组质粒,形成所述过表达质粒;
C、将所述过表达质粒包裹在人工外泌体内,形成过表达外泌体:
C1、收集血细胞:
C1-1、从甲壳动物抽血,与抗凝剂混合,离心收集沉淀;
C1-2、用抗凝剂重悬步骤A1所获得的沉淀,离心收集沉淀,获得所述血细胞;
C2、分离所述血细胞的细胞膜和细胞质基质:
C2-1、将所述血细胞用均质液重悬,并在冰上超声震荡破碎所述血细胞,获得破碎细胞溶液;
C2-2、将所述破碎细胞溶液离心,收集上清液;
C2-3、将步骤C2-2所获得的上清液离心,收集上清液和沉淀;
C2-4、将步骤C2-3所获得的上清液离心,收集上清液,获得所述细胞质基质的溶液;
C2-5、将步骤C2-3所获得的沉淀用所述均质液和LiCl溶液重悬,离心,并用所述均质液重悬,获得所述细胞膜的溶液;
C3、将所述细胞质基质的溶液和所述细胞膜的溶液加入到ATP再生体系和孵育缓冲液中,再加入所述过表达质粒,反应获得所述过表达外泌体,冷冻保存;
D、将所述过表达外泌体注射进甲壳动物体内,使其基因过表达。
优选的,所述均质液包括250mM山梨醇,137mM NaCl,10mM PMSF,用Tris-HCl-pH7.4溶解;步骤C3中,所述细胞质基质的溶液、所述细胞膜的溶液、所述ATP再生体系、所述孵育缓冲液、所述过表达质粒的体积质量比为17uL:10uL:8uL:200ng。
ATP的用量过少,会导致人工外泌体无法合成成功。
优选的,所述体外扩增引物的设计要依据目的基因序列和所选载体序列,包括目的基因上不含载体上可供选择的酶切位点。
优选的,步骤A1中,所述甲壳动物包括拟穴青蟹、南美白对虾中的一种或多种,外泌体在不同物种中使用所对应物种的血液进行制备,抽血后与抗凝剂混合的体积比为1:1,离心操作为1000×g离心10min;步骤A2中,用抗凝剂重悬步骤A1所获得的沉淀的体积比为1000:1,离心操作为1000×g离心10min;步骤B1中,所述均质液与所述血细胞的体积比为10:1;步骤B1中,超声操作为超声开3s,关2s,持续3min;步骤B2中,离心操作为1500×g离心10min;步骤B3中,离心操作为20000×g离心30min;步骤B4中,离心操作为60000×g离心30min;步骤B5中,离心前重悬所述均质液、所述LiCl溶液与沉淀的体积比为2:1:1,离心后重悬所述均质液与沉淀的体积比为5:1;步骤B5中,离心操作为20000×g离心30min;步骤C中,冷冻保存的温度为-80℃。
优选的,所述均质液包括250mM山梨醇,137mM NaCl,10mM PMSF,用Tris-HCl-pH7.4溶解。
一种上述甲壳动物体内基因过表达的方法获得过表达外泌体。
一种上述人工外泌体包裹过表达基因的重组质粒实现甲壳动物体内基因过表达。
与现有技术相比较,实施本发明,具有如下有益效果:
通过采用本发明生产方法可以简单、高效地生产携带生物活性物质的外泌体;外泌体可以很容易被受体细胞摄取发挥生物活性物质的作用,保证了其所携带的质粒可以高效进入受体细胞,提高了质粒在受体细胞中的表达效率,在且外泌体本身无显著免疫排斥反应,不会对受体细胞造成伤害。携带生物活性物质的外泌体可以作为一种新型的递送工具广泛用于免疫学研究和各种疾病的治疗。
本发明将待过表达基因片段与载体连接后,利用人工外泌体将其运送到甲壳动物血细胞中,实现目的基因在甲壳动物血细胞中的过表达。该方法非病毒转染,能够有效进入细胞,简单实用,且对细胞的伤害比较低,解决了现有技术无法实现甲壳动物中特定目的基因高效过表达的问题。其中利用外泌体将外源基因导入到真核细胞中,促使细胞能够表达特异性基因,具有安全性和已修改的特性。
附图说明
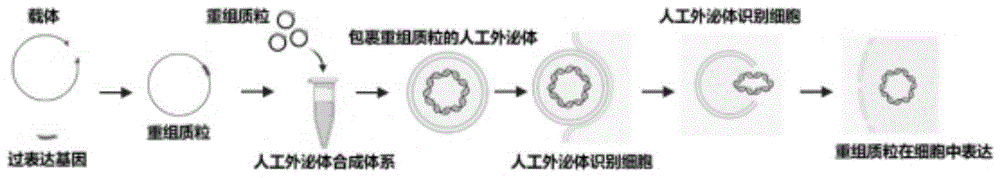
图1为本发明实施的方法流程图;
图2A为用青蟹血细胞制备人工外泌体分别包裹14-3-3mRNA、AIF mRNA和p53 mRNA后,PCR检测人工外泌体中是否装载的14-3-3mRNA,AIF mRNA和p53 mRNA;B为用青蟹血细胞制备人工外泌体分别包裹14-3-3蛋白,AIF蛋白和p53蛋白后,Western blot检测人工外泌体中是否装载14-3-3蛋白,AIF蛋白和p53蛋白。
图3A为14-3-3mRNA和装载14-3-3mRNA的外泌体注射到青蟹12h后,在共聚焦显微镜下观察,与对照组相比血细胞中14-3-3蛋白的含量;B为14-3-3mRNA和装载14-3-3mRNA的外泌体注射到对虾12h后,在共聚焦显微镜下观察,与对照组相比血细胞中14-3-3蛋白的含量;C为14-3-3蛋白和装载14-3-3蛋白的外泌体注射到青蟹12h后,在共聚焦显微镜下观察,与对照组相比血细胞中14-3-3蛋白的含量;D为14-3-3蛋白和装载14-3-3蛋白的外泌体注射到对虾12h后,在共聚焦显微镜下观察,与对照组相比血细胞中14-3-3蛋白的含量。
图4A为AIF mRNA和装载AIF mRNA的外泌体注射到青蟹12h后,在共聚焦显微镜下观察,与对照组相比血细胞中AIF蛋白的含量;B为AIF mRNA和装载AIF mRNA的外泌体注射到对虾12h后,在共聚焦显微镜下观察,与对照组相比血细胞中AIF蛋白的含量;C为AIF蛋白和装载AIF蛋白的外泌体注射到青蟹12h后,在共聚焦显微镜下观察,与对照组相比血细胞中AIF蛋白的含量;D为AIF蛋白和装载AIF蛋白的外泌体注射到对虾12h后,在共聚焦显微镜下观察,与对照组相比血细胞中AIF蛋白的含量。
图5A为p53 mRNA和装载p53 mRNA的外泌体注射到青蟹12h后,在共聚焦显微镜下观察,与对照组相比血细胞中p53蛋白的含量;B为p53 mRNA和装载p53 mRNA的外泌体注射到对虾12h后,在共聚焦显微镜下观察,与对照组相比血细胞中p53蛋白的含量;C为p53蛋白和装载p53蛋白的外泌体注射到青蟹12h后,在共聚焦显微镜下观察,与对照组相比血细胞中p53蛋白的含量;D为p53蛋白和装载p53蛋白的外泌体注射到对虾12h后,在共聚焦显微镜下观察,与对照组相比血细胞中p53蛋白的含量。
图6A为检测分别装载pIZ-wsv249p-egfp-14-3-3、pIZ-wsv249p-egfp-AIF和pIZ-wsv249p-egfp-p53的外泌体中是否含有pIZ-wsv249p-egfp-14-3-3、pIZ-wsv249p-egfp-AIF和pIZ-wsv249p-egfp-p53;B为将装载pIZ-wsv249p-egfp载体的人工外泌体注射到青蟹12h后,在共聚焦显微镜下观察GFP蛋白的含量,未包裹的人工外泌体注射到青蟹中作为对照;C为将装载pIZ-wsv249p-egfp载体的人工外泌体注射到对虾12h后,在共聚焦显微镜下观察GFP蛋白的含量,未包裹的人工外泌体注射到对虾中作为对照。
图7A为分别装载14-3-3mRNA、14-3-3蛋白和pIZ-wsv249p-egfp-14-3-3的外泌体注射到青蟹12h后,在共聚焦显微镜下观察血细胞中14-3-3蛋白的含量;B为分别装载14-3-3mRNA、14-3-3蛋白和pIZ-wsv249p-egfp-14-3-3的外泌体注射到青蟹12h后,Western blot检测青蟹血细胞中14-3-3蛋白及其下游调控蛋白MyD88和TLR的含量(Sun et al.,Journalof Immunology.2022,209:710-722);C为为分别装载14-3-3mRNA、14-3-3蛋白和pIZ-wsv249p-egfp-14-3-3的外泌体注射到青蟹12h后,qPCR检测青蟹血细胞中抗脂多糖因子ALF1、ALF4和ALF5的转录水平变化;D为分别装载14-3-3mRNA、14-3-3蛋白和pIZ-wsv249p-egfp-14-3-3的外泌体注射到对虾12h后,在共聚焦显微镜下观察血细胞中14-3-3蛋白的含量;E为分别装载14-3-3mRNA、14-3-3蛋白和pIZ-wsv249p-egfp-14-3-3的外泌体注射到对虾12h后,Western blot检测对虾血细胞中14-3-3蛋白及其下游调控蛋白MyD88和TLR的含量;F为分别装载14-3-3mRNA、14-3-3蛋白和pIZ-wsv249p-egfp-14-3-3的外泌体注射到对虾12h后,qPCR检测对虾血细胞中抗脂多糖因子ALF1、ALF4和ALF5的转录水平变化。
图8A为分别装载AIF mRNA、AIF蛋白和pIZ-wsv249p-egfp-AIF的外泌体注射到拟穴青蟹12h后,在共聚焦显微镜下观察血细胞中AIF蛋白的含量;B为分别装载AIF mRNA、AIF蛋白和pIZ-wsv249p-egfp-AIF的外泌体注射到青蟹12h后,流式细胞仪检测青蟹血细胞的凋亡水平变化(Gong et al.,PLoS pathogens.2020,16(5),e1008366);C为分别装载AIFmRNA、AIF蛋白和pIZ-wsv249p-egfp-AIF的外泌体注射到对虾12h后,在共聚焦显微镜下观察血细胞中AIF蛋白的含量;D、E和F为分别装载AIF mRNA、AIF蛋白和pIZ-wsv249p-egfp-AIF的外泌体注射到对虾12h后,流式细胞仪检测对虾血细胞的凋亡水平变化。
图9A为分别装载p53-mRNA、p53-protein和pIZ-wsv249p-egfp-p53的外泌体注射到青蟹12h后,在共聚焦显微镜下观察血细胞中p53蛋白的含量;B为分别装载P53 mRNA、P53蛋白和pIZ-wsv249p-egfp-P53的外泌体注射到青蟹12h后,流式细胞仪检测青蟹血细胞的凋亡水平变化(Gong et al.,Journal of Virology.2022,96(6),e0202921);C为分别装载P53 mRNA、P53蛋白和pIZ-wsv249p-egfp-P53的外泌体注射到对虾12h后,在共聚焦显微镜下观察血细胞中P53蛋白的含量;D、E和F为分别装载P53 mRNA、P53蛋白和pIZ-wsv249p-egfp-P53的外泌体注射到对虾12h后,流式细胞仪检测对虾血细胞的凋亡水平变化。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
需要说明,以下实施例采用的所有组分均可以通过购买或自制得到。
实施例1
本发明实施例提供的一种甲壳动物体内基因过表达的方法,如图1所示,该方法具体是通过以下步骤实现:
S1.过表达基因引物设计;
S2.过表达质粒构建;
S3.细胞收集:用5mL注射器从拟穴青蟹或对虾抽取血液,外泌体在不同物种中使用应该使用所对应物种的血液进行制备,1mL血液与1mL抗凝剂混合,1000g离心10min,抗凝剂重悬离心所获得的沉淀,再次1000g离心10min,收集细胞沉淀;
S4.细胞破碎:将上述细胞沉淀用10倍体积的均质液(250mM山梨醇,137mM NaCl,10mM PMSF,用Tris-HCl-pH 7.4溶解)重悬,并在冰上以5%功率破碎3min(超声开3s,关2s);
S5.低速离心:将S2中破碎后的溶液1500×g离心10min;
S6.高速离心:将S3离心后的上清再次20000×g离心30min;
S7.细胞质溶液收集:将S4离心后的上清60000×g离心30min并收集离心后的上清;
S8.细胞膜溶液收集:将S4离心后的沉淀用两倍体积的均质液和一倍体积的LiCl溶液重悬,20000×g离心30min,并用5倍体积的均质液重悬;
S9.体外反应:配制以下反应体系:17uL S7中获取的细胞质溶液,10uL S8中获取的细胞膜溶液,4uL ATP再生体系(10mM ATP,500mM GDP-甘露糖,400mM磷酸肌酸,40mM磷酸肌酸酶,20mM HEPEs-pH 7.2,250mM山梨醇,150mM乙酸钾,5mM乙酸镁);8uL孵育缓冲液(80mM KCl,20mM CaCl
S10.超速离心收集搭载过表达质粒的外泌体。20000×g离心30min,收集沉淀并用50uL PBS重悬,得到所述过表达外泌体,并用琼脂糖凝胶电泳检测,结果见图6A。结果表明人工外泌体可以包裹过表达质粒。
S11、还包括将所述过表达外泌体注射进甲壳动物体内,使其基因过表达的过程。
实施例2
S1.在人工外泌体合成体系中加入14-3-3mRNA,并通过琼脂糖凝胶电泳检测人工外泌体是否成功装载14-3-3mRNA;
结果见图2A。结果表明,合成的人工外泌体成功包裹14-3-3mRNA。
S2.将包裹14-3-3mRNA的人工外泌体和14-3-3mRNA分别注射到青蟹或对虾中,12h后分别收集青蟹和对虾血细胞并在共聚焦显微镜下观察血细胞中14-3-3蛋白含量;
结果见图3A和3B。结果表明,相比于直接注射14-3-3mRNA,注射包裹14-3-3mRNA的人工外泌体后,14-3-3在青蟹和对虾血细胞中的含量显著提高。
S3.在人工外泌体合成体系中加入14-3-3蛋白(14-3-3的重组蛋白),并通过Western blot检测人工外泌体是否成功装载14-3-3蛋白;
结果见图2B。结果表明合成的人工外泌体成功包裹14-3-3蛋白。
S4.将包裹14-3-3蛋白的人工外泌体和14-3-3蛋白分别注射到青蟹或对虾中,12h后分别收集拟穴青蟹和对虾血细胞并在共聚焦显微镜下观察血细胞中14-3-3蛋白含量;
结果见图3C和3D。结果表明,相比于直接注射14-3-3重组蛋白,注射包裹14-3-3蛋白的人工外泌体后,14-3-3在青蟹和对虾血细胞中的含量显著提高。
S5.14-3-3引物设计:根据pIZ-wsv249p-egfp上的酶切位点、14-3-3的基因序列,以及天根EasyGeno快速重组试剂盒引物设计说明,设计14-3-3体外扩增引物;
S6.过表达质粒构建:根据上述设计的14-3-3体外扩增引物,通过PCR获得大量14-3-3片段,同时根据所选酶切位点将pIZ-wsv249p-egfp载体切开,根据天根EasyGeno快速重组试剂盒使用说明将14-3-3片段连接到pIZ-wsv249p-egfp载体上;
S7.在人工外泌体合成过程中添加pIZ-wsv249p-egfp-14-3-3重组质粒,并通过琼脂糖凝胶电泳检测人工外泌体是否成功装载pIZ-wsv249p-egfp-14-3-3;
结果见图6A。结果表明合成的人工外泌体成功搭载pIZ-wsv249p-egfp-14-3-3。
S8.分别将包裹14-3-3mRNA、14-3-3蛋白和pIZ-wsv249p-egfp-14-3-3的人工外泌体分别注射到青蟹或对虾中,12h后分别收集青蟹和对虾血细胞,通过共聚焦显微镜和Western blot检测血细胞中14-3-3蛋白含量,并通过Western blot检测14-3-3下游调控蛋白MyD88和TLR的含量变化,通过qPCR检测14-3-3下游调控的抗脂多糖因子ALF1、ALF4和ALF5的表达变化;
结果见图7A、7B、7C、7D、7E和7F。结果表明,相比于注射包裹14-3-3mRNA或者14-3-3蛋白的人工外泌体,注射包裹pIZ-wsv249p-egfp-14-3-3的人工外泌体后,14-3-3在青蟹和对虾血细胞中的含量及其对下游调控通路的影响更显著。
实施例3
S1.在人工外泌体合成体系中加入AIF mRNA,并通过琼脂糖凝胶电泳检测人工外泌体是否成功装载AIF mRNA;
结果见图2A。结果表明合成的人工外泌体成功包裹AIF mRNA。
S2.将包裹AIF mRNA的人工外泌体和AIF mRNA分别注射到青蟹或对虾中,12h后分别收集青蟹和对虾血细胞并在共聚焦显微镜下观察血细胞中AIF蛋白含量;
结果见图4A和4B。结果表明,相比于直接注射AIF mRNA,注射包裹AIF mRNA的人工外泌体后,AIF在青蟹和对虾血细胞中显著提高。
S3.在人工外泌体合成体系中加入AIF蛋白(AIF的重组蛋白),并通过Westernblot检测人工外泌体是否成功装载AIF蛋白;
结果见图2B。结果表明,合成的人工外泌体成功包裹AIF蛋白。
S4.将包裹AIF蛋白的人工外泌体和AIF蛋白分别注射到青蟹或对虾中,12h后分别收集青蟹和对虾血细胞,并在共聚焦显微镜下观察血细胞中AIF蛋白含量;
结果见图4C和4D。结果表明,相比于直接注射AIF蛋白,注射包裹AIF蛋白的人工外泌体后,AIF在青蟹和对虾血细胞中显著提高。
S5.AIF引物设计:根据pIZ-wsv249p-egfp上的酶切位点、AIF的基因序列,以及天根EasyGeno快速重组试剂盒引物设计说明,设计AIF体外扩增引物;
S6.过表达质粒构建:根据上述设计的AIF体外扩增引物,通过PCR获得大量AIF片段,同时根据所选酶切位点将pIZ-wsv249p-egfp载体切开,根据天根EasyGeno快速重组试剂盒使用说明将AIF片段连接到pIZ-wsv249p-egfp载体上;
S7.在人工外泌体合成过程中添加pIZ-wsv249p-egfp-AIF重组质粒,并通过琼脂糖凝胶电泳检测人工外泌体是否成功装载pIZ-wsv249p-egfp-AIF;
结果见图6A。结果表明合成的人工外泌体成功搭载pIZ-wsv249p-egfp-AIF。
S8.分别将包裹AIF mRNA、AIF蛋白和pIZ-wsv249p-egfp-AIF的人工外泌体分别注射到青蟹或对虾中,12h后分别收集青蟹和对虾血细胞,通过共聚焦显微镜和Western blot检测血细胞中AIF蛋白含量,并通过流式细胞仪检测血细胞凋亡率;
结果见图8A、8B、8C、8D、8E和8F。结果表明,相比于注射包裹AIF mRNA或者AIF蛋白的人工外泌体,注射包裹pIZ-wsv249p-egfp-AIF的人工外泌体后,AIF在青蟹和对虾血细胞中的含量及其对下游调控通路的影响更显著。
实施例4
S1.在人工外泌体合成体系中加入p53 mRNA,并通过琼脂糖凝胶电泳检测人工外泌体是否成功装载p53 mRNA;
结果见图2A。结果表明合成的人工外泌体成功包裹p53 mRNA。
S2.将包裹p53 mRNA的人工外泌体和p53 mRNA分别注射到青蟹或对虾中,12h后分别收集青蟹和对虾血细胞,并在共聚焦显微镜下观察血细胞中p53蛋白含量;
结果见图5A和5B。结果表明,相比于直接注射p53 mRNA,注射包裹p53 mRNA的人工外泌体后,P53在青蟹和对虾血细胞中的含量显著提高。
S3.在人工外泌体合成体系中加入p53蛋白(p53的重组蛋白),并通过Westernblot检测人工外泌体是否成功装载p53蛋白;
结果见图2B。结果表明合成的人工外泌体成功包裹p53蛋白。
S4.将包裹p53蛋白的人工外泌体和p53蛋白分别注射到青蟹或对虾中,12h后分别收集青蟹和对虾血细胞,并在共聚焦显微镜下观察血细胞中p53蛋白含量;
结果见图5C和5D。结果表明,相比于直接注射p53蛋白,注射包裹p53蛋白的人工外泌体后,p53在青蟹和对虾血细胞中的含量显著提高。
S5.p53引物设计:根据pIZ-wsv249p-egfp上的酶切位点、p53的基因序列,以及天根EasyGeno快速重组试剂盒引物设计说明,设计p53体外扩增引物;
S6.过表达质粒构建:根据上述设计的p53体外扩增引物,通过PCR获得大量P53片段,同时根据所选酶切位点将pIZ-wsv249p-egfp载体切开,根据天根EasyGeno快速重组试剂盒使用说明将P53片段连接到pIZ-wsv249p-egfp载体上;
S7.在人工外泌体合成过程中添加pIZ-wsv249p-egfp-p53重组质粒,并通过琼脂糖凝胶电泳检测人工外泌体是否成功装载pIZ-wsv249p-egfp-p53;
结果见图6A。结果表明合成的人工外泌体成功搭载pIZ-wsv249p-egfp-p53。
S8.分别将包裹p53 mRNA、p53蛋白和pIZ-wsv249p-egfp-p53的人工外泌体分别注射到青蟹或对虾中,12h后分别收集青蟹和对虾血细胞,通过共聚焦显微镜和Western blot检测血细胞中p53蛋白含量,并通过流式细胞仪检测血细胞凋亡率;
结果见图9A、9B、9C、9D、9E和9F。结果表明,相比于注射包裹p53mRNA或者p53蛋白的人工外泌体,注射包裹pIZ-wsv249p-egfp-p53的人工外泌体,对p53在青蟹和对虾血细胞中的含量提高及其下游调控通路的影响更显著。
以上所揭露的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
