一种农杆菌介导玉米自交系B104幼胚的高效遗传转化方法
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及植物转基因技术领域,尤其涉及一种农杆菌介导玉米自交系B104幼胚的高效遗传转化方法。
背景技术
玉米作为一种重要的粮饲兼用型作物,在全球作物中占据着极为重要的地位。目前,传统育种方法早已不能满足需要,转基因育种技术对于提高玉米的产量、增强玉米品质和抗逆性等方面具有重要的意义,而发展转基因玉米的研究需要建立高效稳定的遗传转化体系。
“农杆菌介导的遗传转化方法”具有操作方法简单、成本低、被转化的DNA结构完整且能稳定遗传、转化的外源基因多为单拷贝或低拷贝且很少发生沉默等优点,目前这种方法已广泛应用于包括拟南芥、水稻、玉米、番茄、烟草等多种作物的遗传改良研究。
目前,Lowe等使用玉米形态调节基因Bbm和Wus2等刺激并转化细胞,二者结合能够在玉米幼胚表面形成丰富的体细胞胚,扩大可转化的基因型类型,并在一定程度上克服外植体依赖性,缩短转化时间,促进高效转化。后续也有很多研究者通过改造和优化Bbm和Wus2表达辅助载体,解决转化后玉米植株畸形不育等问题,近一步扩大其应用范围。玉米自交系B104是一种常规用于产生转基因系的温带硬杆自交系,有相关研究表明B104的幼胚和花粉供体植株在大田和温室中的表现较好,可能成为利用农杆菌介导法改良玉米农艺性状的模式自交系。
然而,虽然上述公开的研究表明在Bbm和Wus2等一系列表达辅助载体的应用下可以成功提高玉米转化效率,但“玉米B104骨干自交系”距离商品化和规模化育种还有很大距离,其遗传转化技术在相当多从事玉米研究的实验室中很难开展(转化技术难度大,转化效率不高)。
因此,有必要建立一种简单、高效、重复性好的农杆菌介导的玉米自交系B104遗传转化体系。
发明内容
本发明所要解决的技术问题在于提供一种简单、高效、重复性好的农杆菌介导玉米自交系B104幼胚的高效遗传转化方法。
本发明采用以下技术方案解决上述技术问题:
一种农杆菌介导玉米自交系B104幼胚的高效遗传转化方法,包括如下步骤:
(1)获取玉米幼胚;
(2)将含侵染质粒的EHA105农杆菌菌株在YEP活化培养基上划线,并利用第一悬浮液悬浮活化后的农杆菌,获得OD
将步骤(1)获得的玉米幼胚经第二悬浮液洗涤后,加入侵染菌液侵染5min;
侵染后,将玉米幼胚连同侵染菌液倒入共培培养基上共培养;
(3)将共培养2d后的玉米幼胚置于静息培养基上培养;
(4)将静息培养7~10d的胚状体用深蓝激发光源照射,再用体视镜观察,将含有绿色荧光的幼胚,夹掉其胚芽、胚根,转移到含双丙氨膦的筛选分化培养基中进行培养;挑选生长状态好的胚性愈伤组织转移至新的筛选分化培养基进行生长;
(5)将上一步筛选出的抗性组织继续置于筛选分化培养基上,分化出幼苗;
(6)生根培养及炼苗移栽。
作为本发明的优选方式之一,所述步骤(1)具体如下:
①将授粉9~12d后的玉米果穗,剥去苞叶和花丝后,削去果穗顶部及污染或长虫的部分;用75%酒精喷洒于玉米表面,用19%次氯酸钠、加入1~2滴吐温-20浸泡15min;最后,用无菌水冲洗3~4次,获得干净无菌的玉米果穗;
②将提前配置好的第二悬浮液分装到离心管中;
③用无菌手术刀片削去玉米果穗子粒的1/3胚乳,再用小刀或镊子从中上部将幼胚挑出,置于第二悬浮液中。
作为本发明的优选方式之一,所述步骤(2)具体如下:
①将含侵染质粒的EHA105农杆菌菌株在YEP活化培养基上划线,28℃黑暗培养2~3天;利用第一悬浮液悬浮农杆菌菌株,获得侵染菌液;
②将浸泡在第二悬浮液不超过1h的玉米幼胚,用第二悬浮液洗涤两次,吸去第二悬浮液;接着再加入1mL新的第二悬浮液,5000rpm常温离心30s,将幼胚沉入离心管下部;45℃水浴热激3min后,置于冰上1min;
③吸去玉米幼胚的第二悬浮液,加入1mL OD
④侵染后,将玉米幼胚连同侵染菌液倒入共培培养基上,将多余的侵染菌液吸去,用镊子使幼胚盾片的平面向下接触培养基,封口膜封好后于23℃黑暗培养2天。
作为本发明的优选方式之一,所述步骤(2)中,EHA105农杆菌菌株携带的侵染质粒中包含Bbm和Wus2转录因子。
作为本发明的优选方式之一,所述步骤(2)中,YEP活化培养基配方为:酵母提取物5g/L,NaCl 5g/L,蛋白胨10g/L,Agar 5g/L,pH7.0。
作为本发明的优选方式之一,所述步骤(2)中,第一悬浮液配方为:1/2MS,MES0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,200uM AS(乙酰丁香酮),pH5.4;第二悬浮液悬配方为:1/2MS,MES 0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,pH5.4。
作为本发明的优选方式之一,所述步骤(2)中,共培培养基配方为:1/2MS,MES0.5g/L,葡萄糖10g/L,蔗糖20g/L,L-脯氨酸0.1g/L,KT 0.1mg/L,2,4-D2mg/L,VB
作为本发明的优选方式之一,所述步骤(3)中,静息培养基配方为:MS,蔗糖30g/L,水解酪蛋白0.5g/L,L-脯氨酸1.38g/L,KT 0.1mg/L,2,4-D 2mg/L,VB
作为本发明的优选方式之一,所述步骤(4)中,筛选分化培养基配方为:MS,蔗糖60g/L,ZT 0.5mg/L,TDZ 0.1mg/L,6-BA1mg/L,特美汀200mg/L,双丙胺膦8mg/L,植物凝胶3g/L,pH5.8;
同时,所述生长状态好的胚性愈伤组织指“色泽鲜亮、致密颗粒状、干燥松散、生长旺盛的胚性愈伤组织”。
作为本发明的优选方式之一,所述步骤(6)具体如下:
①将分化的幼苗转移入生根培养基中,25℃、5000Lx光照培养至生根,10d后生长出根的幼苗;其中,生根培养基配方为:1/2MS,MES 0.5mg/L,蔗糖20g/L,NAA0.2mg/L,植物凝胶3g/L,pH5.8;
②开盖炼苗;7d后,将长度大于5cm的幼苗进行分子鉴定,记录生成的绿苗数量和阳性苗数量,同时根据检测结果剔除阴性植株,保留阳性植株;
③将阳性植株移入培养土(草炭土、珍珠岩、蛭石按5:1:1的体积混合均匀,按照100L基质添加鸡粪有机肥5L,氢氧化钙10g,硫酸钾复合肥50g,磷酸二铵50g并混合均匀)后,移至温室生长结种。
不同背景的玉米自交系的遗传转化会有区别(包括转化方法、培养基组成、转化效率高低等),往往一种方法并不能适用所有的自交系。为了将转基因和基因组编辑技术更好应用于玉米B104自交系规模化育种,在Bbm和Wus2表达辅助载体提高转化效率的基础上,还急需建立一种简单、高效、重复性好的农杆菌介导的玉米B104自交系遗传转化方法。本发明针对玉米自交系B104,对包括农杆菌侵染菌株类型、农杆菌吸光值、侵染时间、共培养时间、培养基组成等遗传转化过程中的关键变量进行优化;具体地,以玉米自交系B104授粉后9~12d的幼胚作为转化受体,对玉米幼胚共培养阶段的GFP瞬时转化率和筛选阶段的稳定转化率进行统计,获得农杆菌介导的玉米B104自交系快速遗传转化体系最优转化因子组合为:选用农杆菌EHA105菌株进行侵染,菌液吸光值OD600为0.3,侵染时间5min,共培养时间2d。
本发明相比现有技术的优点在于:
本发明成功建立了简单、高效、重复性好的适合玉米自交系B104的遗传转化体系及方法;以往传统的玉米遗传转化,通常需要3个月以上的时间才能得到阳性植株,而本发明得到阳性幼苗只需要60天左右的时间,大大缩短转基因育种进程,对加快玉米育种进程、基因功能解析、丰富玉米种质资源等方面具有重要意义。
附图说明
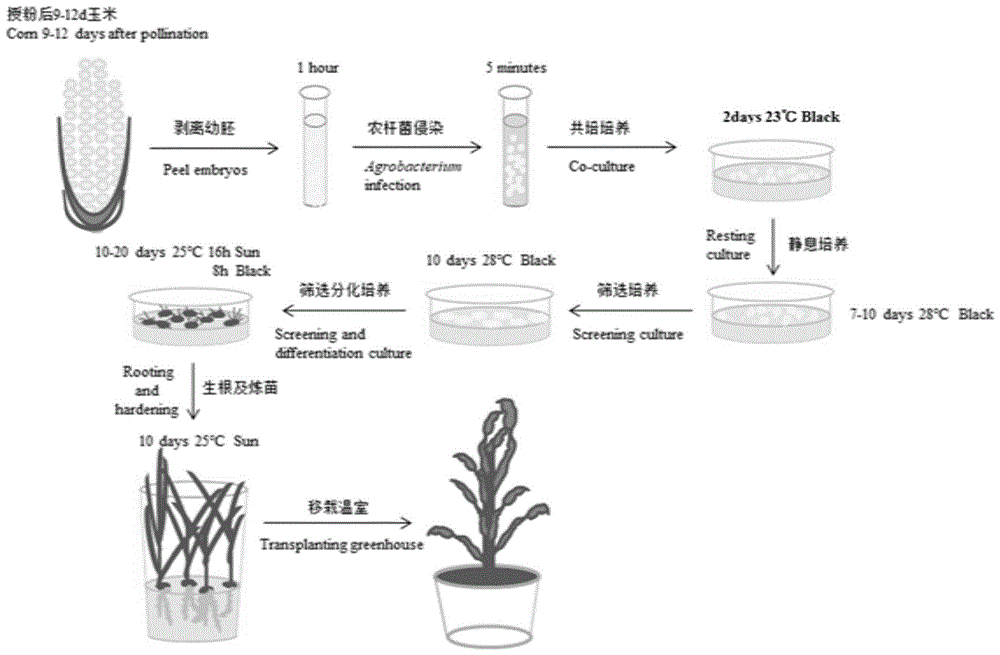
图1是实施例1、2、3中农杆菌介导玉米自交系B104幼胚的高效遗传转化流程图;
图2是实施例1、2、3中载体pCAMBIA1301-Bar的完整图谱示意图;
图3是实施例1、2、3中载体pCAMBIA1301-Bar的T-DNA区段示意图;
图4是试验例1中不同农杆菌菌株对转化率的影响结果图(图中,A图为瞬时转化率对比,B图为稳定转化率对比;“a”、“b”和“c”为不同农杆菌菌株对瞬时转化率和稳定转化率影响的显著性差异,P<0.05);
图5是试验例1中不同农杆菌侵染时间对瞬时转化率的影响结果图(图中,“a”、“b”和“c”为不同农杆菌侵染时间对瞬时转化率影响的显著性差异,P<0.05);
图6是试验例1中不同农杆菌侵染时间对污染率的影响结果图(图中,“a”、“b”和“c”为不同农杆菌侵染时间对污染率影响的显著性差异,P<0.05);
图7是试验例1中不同农杆菌菌液吸光值OD
图8是试验例1中共培养天数对转化率的影响结果图(图中,“a”、“b”、和“c”和“d”为不同共培养天数对转化率影响的显著性差异,P<0.05);
图9是试验例2中玉米遗传转化过程中不同生长阶段的状态图(图中,A图为共培阶段;B图为静息阶段;C~D图为筛选阶段;E图为分化阶段;F~G图为生根、炼苗阶段;H~I图为移栽温室);
图10是试验例2中通过荧光显微镜观察的绿色荧光蛋白表达情况(图中,A图为共培2d;B图为静息5d;C图为静息10d;D图为筛选6d;E图为筛选12d;F图为分化10d);
图11是试验例2中转化植株的分子鉴定结果图(图中,A图为PCR鉴定结果;B图为Bar试纸条检测结果)。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。同时,以下实施例中的所使用的试剂及方法,未经特别说明的,均为本领域常规试剂或方法,不再赘述。
实施例1
本实施例的一种农杆菌介导玉米自交系B104幼胚的高效遗传转化方法,参照图1,包括如下步骤:
1、获取玉米幼胚
(1)将授粉9d后的玉米果穗,剥去苞叶和花丝后,削去果穗顶部及污染或长虫的部分;用75%酒精喷洒于玉米表面,用19%次氯酸钠、加入1滴吐温-20浸泡15min;最后,用无菌水冲洗3次,得干净无菌的玉米果穗。
(2)将提前配置好的第二悬浮液分装到离心管中。
(3)用无菌手术刀片削去玉米果穗子粒的1/3胚乳,再用小刀从中上部将幼胚挑出,置于第二悬浮液中。第二悬浮液悬配方为:1/2MS,MES 0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,pH5.4。
2、农杆菌侵染和共培养
(1)将含侵染质粒的EHA105农杆菌菌株在YEP活化培养基上划线,28℃黑暗培养2天;利用第一悬浮液悬浮农杆菌菌株,得侵染菌液。
其中,侵染质粒为载体pCAMBIA1301-Bar,整体图谱如图2所示;所述载体pCAMBIA1301-Bar的pCAMBIA1301骨架和T-DNA区段的各基因均为公开序列;pCAMBIA1301-Bar中T-DNA区段(详见图3)的ZmWus和ZmBbm分别用pZmAXIG1和pZmPLTP启动子驱动表达,并分别连接PINII和Os-T28终止子;GFP(绿色荧光蛋白基因)为报告基因,用玉米ubi启动子连接编码,Bar(草丁膦乙酰转移酶基因)作为筛选标记基因,由35S启动子驱动表达,二者连接的终止子都是NOS。
YEP活化培养基配方为:酵母提取物5g/L,NaCl 5g/L,蛋白胨10g/L,Agar5g/L,pH7.0。
第一悬浮液配方为:1/2MS,MES 0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,200uM AS,pH5.4。
(2)将浸泡在第二悬浮液50min的玉米幼胚,用第二悬浮液洗涤两次,吸去第二悬浮液;接着再加入1mL新的第二悬浮液,5000rpm常温离心30s,将幼胚沉入离心管下部;45℃水浴热激3min后,置于冰上1min。
(3)最大限度吸去玉米幼胚的第二悬浮液,加入1mL OD
(4)侵染后,将玉米幼胚连同侵染菌液倒入共培培养基上,将多余的侵染菌液吸去,用镊子使幼胚盾片的平面向下接触培养基,封口膜封好后于23℃黑暗培养2天。
共培培养基配方为:1/2MS,MES 0.5g/L,葡萄糖10g/L,蔗糖20g/L,L-脯氨酸0.1g/L,KT 0.1mg/L,2,4-D 2mg/L,VB
3、静息培养
将共培养2d后的玉米幼胚置于静息培养基上均匀放置,28℃黑暗培养7d,一旦发现农杆菌过量或其他杂菌污染,应立即转移未污染幼胚。
静息培养基配方为:MS,蔗糖30g/L,水解酪蛋白0.5g/L,L-脯氨酸1.38g/L,KT0.1mg/L,2,4-D 2mg/L,VB
4、筛选分化培养I
将静息培养7d的胚状体用深蓝激发光源照射,再用体视镜观察,将含有绿色荧光的幼胚,夹掉其胚芽、胚根,转移到含双丙氨膦的筛选分化培养基中进行培养;28℃黑暗筛选10d后,观察愈伤组织并统计愈伤褐化死亡率;除去严重褐变或水渍化、质地软、无结构的非胚性愈伤组织,挑选生长状态好(色泽鲜亮、致密颗粒状、干燥松散、生长旺盛)的胚性愈伤组织转移至新的筛选分化培养基进行生长。
筛选分化培养基配方为:MS,蔗糖60g/L,ZT 0.5mg/L,TDZ 0.1mg/L,6-BA 1mg/L,特美汀200mg/L,双丙胺膦8mg/L,植物凝胶3g/L,pH5.8。
5、筛选分化培养II
将上一步筛选出的抗性组织继续置于筛选分化培养基上,转移到16h光照、8h黑暗、25℃条件下培养10d,分化出幼苗。
6、生根培养及炼苗移栽
(1)将分化的幼苗转移入生根培养基中,25℃、5000Lx光照培养至生根,10d后生长出根的幼苗;其中,生根培养基配方为:1/2MS,MES 0.5mg/L,蔗糖20g/L,NAA 0.2mg/L,植物凝胶3g/L,pH5.8。
(2)开盖炼苗;7d后,将长度大于5cm的幼苗进行分子鉴定,记录生成的绿苗数量和阳性苗数量,同时根据检测结果剔除阴性植株,保留阳性植株。
(3)将阳性植株移入培养土(草炭土、珍珠岩、蛭石按5:1:1的体积混合均匀,按照100L基质添加鸡粪有机肥5L,氢氧化钙10g,硫酸钾复合肥50g,磷酸二铵50g并混合均匀)后,移至温室生长结种。
实施例2
本实施例的一种农杆菌介导玉米自交系B104幼胚的高效遗传转化方法,参照图1,包括如下步骤:
1、获取玉米幼胚
(1)将授粉10d后的玉米果穗,剥去苞叶和花丝后,削去果穗顶部及污染或长虫的部分;用75%酒精喷洒于玉米表面,用19%次氯酸钠、加入2滴吐温-20浸泡15min;最后,用无菌水冲洗4次,得干净无菌的玉米果穗。
(2)将提前配置好的第二悬浮液分装到离心管中。
(3)用无菌手术刀片削去玉米果穗子粒的1/3胚乳,再用小刀或镊子从中上部将幼胚挑出,置于第二悬浮液中。第二悬浮液悬配方为:1/2MS,MES 0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,pH5.4。
2、农杆菌侵染和共培养
(1)将含侵染质粒的EHA105农杆菌菌株在YEP活化培养基上划线,28℃黑暗培养3天;利用第一悬浮液悬浮农杆菌菌株,得侵染菌液。
其中,侵染质粒为载体pCAMBIA1301-Bar,整体图谱如图2所示;所述载体pCAMBIA1301-Bar的pCAMBIA1301骨架和T-DNA区段的各基因均为公开序列;pCAMBIA1301-Bar中T-DNA区段(详见图3)的ZmWus和ZmBbm分别用pZmAXIG1和pZmPLTP启动子驱动表达,并分别连接PINII和Os-T28终止子;GFP(绿色荧光蛋白基因)为报告基因,用玉米ubi启动子连接编码,Bar(草丁膦乙酰转移酶基因)作为筛选标记基因,由35S启动子驱动表达,二者连接的终止子都是NOS。
YEP活化培养基配方为:酵母提取物5g/L,NaCl 5g/L,蛋白胨10g/L,Agar5g/L,pH7.0。
第一悬浮液配方为:1/2MS,MES 0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,200uM AS,pH5.4。
(2)将浸泡在第二悬浮液1h的玉米幼胚,用第二悬浮液洗涤两次,吸去悬浮液;接着再加入1mL新的第二悬浮液,5000rpm常温离心30s,将幼胚沉入离心管下部;45℃水浴热激3min后,置于冰上1min。
(3)最大限度吸去玉米幼胚的第二悬浮液,加入1mL OD
(4)侵染后,将玉米幼胚连同侵染菌液倒入共培培养基上,将多余的侵染菌液吸去,用镊子使幼胚盾片的平面向下接触培养基,封口膜封好后于23℃黑暗培养2天。
共培培养基配方为:1/2MS,MES 0.5g/L,葡萄糖10g/L,蔗糖20g/L,L-脯氨酸0.1g/L,KT 0.1mg/L,2,4-D 2mg/L,VB
3、静息培养
将共培养2d后的玉米幼胚置于静息培养基上均匀放置,28℃黑暗培养8d,一旦发现农杆菌过量或其他杂菌污染,应立即转移未污染幼胚。
静息培养基配方为:MS,蔗糖30g/L,水解酪蛋白0.5g/L,L-脯氨酸1.38g/L,KT0.1mg/L,2,4-D 2mg/L,VB
4、筛选分化培养I
将静息培养8d的胚状体用深蓝激发光源照射,再用体视镜观察,将含有绿色荧光的幼胚,夹掉其胚芽、胚根,转移到含双丙氨膦的筛选分化培养基中进行培养;28℃黑暗筛选10d后,观察愈伤组织并统计愈伤褐化死亡率;除去严重褐变或水渍化、质地软、无结构的非胚性愈伤组织,挑选生长状态好(色泽鲜亮、致密颗粒状、干燥松散、生长旺盛)的胚性愈伤组织转移至新的筛选分化培养基进行生长。
筛选分化培养基配方为:MS,蔗糖60g/L,ZT 0.5mg/L,TDZ 0.1mg/L,6-BA 1mg/L,特美汀200mg/L,双丙胺膦8mg/L,植物凝胶3g/L,pH5.8。
5、筛选分化培养II
将上一步筛选出的抗性组织继续置于筛选分化培养基上,转移到16h光照、8h黑暗、25℃条件下培养15d,分化出幼苗。
6、生根培养及炼苗移栽
(1)将分化的幼苗转移入生根培养基中,25℃、5000Lx光照培养至生根,10d后生长出根的幼苗;其中,生根培养基配方为:1/2MS,MES 0.5mg/L,蔗糖20g/L,NAA 0.2mg/L,植物凝胶3g/L,pH5.8。
(2)开盖炼苗;7d后,将长度大于5cm的幼苗进行分子鉴定,记录生成的绿苗数量和阳性苗数量,同时根据检测结果剔除阴性植株,保留阳性植株。
(3)将阳性植株移入培养土(草炭土、珍珠岩、蛭石按5:1:1的体积混合均匀,按照100L基质添加鸡粪有机肥5L,氢氧化钙10g,硫酸钾复合肥50g,磷酸二铵50g并混合均匀)后,移至温室生长结种。
实施例3
本实施例的一种农杆菌介导玉米自交系B104幼胚的高效遗传转化方法,参照图1,包括如下步骤:
1、获取玉米幼胚
(1)将授粉12d后的玉米果穗,剥去苞叶和花丝后,削去果穗顶部及污染或长虫的部分;用75%酒精喷洒于玉米表面,用19%次氯酸钠、加入2滴吐温-20浸泡15min;最后,用无菌水冲洗4次,得干净无菌的玉米果穗。
(2)将提前配置好的第二悬浮液分装到离心管中。
(3)用无菌手术刀片削去玉米果穗子粒的1/3胚乳,再用小刀或镊子从中上部将幼胚挑出,置于第二悬浮液中。第二悬浮液悬配方为:1/2MS,MES 0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,pH5.4。
2、农杆菌侵染和共培养
(1)将含侵染质粒的EHA105农杆菌菌株在YEP活化培养基上划线,28℃黑暗培养3天;利用第一悬浮液悬浮农杆菌菌株,得侵染菌液。
其中,侵染质粒为载体pCAMBIA1301-Bar,整体图谱如图2所示;所述载体pCAMBIA1301-Bar的pCAMBIA1301骨架和T-DNA区段的各基因均为公开序列;pCAMBIA1301-Bar中T-DNA区段(详见图3)的ZmWus和ZmBbm分别用pZmAXIG1和pZmPLTP启动子驱动表达,并分别连接PINII和Os-T28终止子;GFP(绿色荧光蛋白基因)为报告基因,用玉米ubi启动子连接编码,Bar(草丁膦乙酰转移酶基因)作为筛选标记基因,由35S启动子驱动表达,二者连接的终止子都是NOS。
YEP活化培养基配方为:酵母提取物5g/L,NaCl 5g/L,蛋白胨10g/L,Agar5g/L,pH7.0。
第一悬浮液配方为:1/2MS,MES 0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,200uM AS,pH5.4。
(2)将浸泡在第二悬浮液1h的玉米幼胚,用第二悬浮液洗涤两次,吸去第二悬浮液;接着再加入1mL新的第二悬浮液,5000rpm常温离心30s,将幼胚沉入离心管下部;45℃水浴热激3min后,置于冰上1min。
第二悬浮液悬配方为:1/2MS,MES 0.5g/L,葡萄糖36g/L,蔗糖60g/L,L-脯氨酸0.1g/L,pH5.4。
(3)最大限度吸去玉米幼胚的第二悬浮液,加入1mL OD
(4)侵染后,将玉米幼胚连同侵染菌液倒入共培培养基上,将多余的侵染菌液吸去,用镊子使幼胚盾片的平面向下接触培养基,封口膜封好后于23℃黑暗培养2天。
共培培养基配方为:1/2MS,MES 0.5g/L,葡萄糖10g/L,蔗糖20g/L,L-脯氨酸0.1g/L,KT 0.1mg/L,2,4-D 2mg/L,VB
3、静息培养
将共培养2d后的玉米幼胚置于静息培养基上均匀放置,28℃黑暗培养10d,一旦发现农杆菌过量或其他杂菌污染,应立即转移未污染幼胚。
静息培养基配方为:MS,蔗糖30g/L,水解酪蛋白0.5g/L,L-脯氨酸1.38g/L,KT0.1mg/L,2,4-D 2mg/L,VB
4、筛选分化培养I
将静息培养10d的胚状体用深蓝激发光源照射,再用体视镜观察,将含有绿色荧光的幼胚,夹掉其胚芽、胚根,转移到含双丙氨膦的筛选分化培养基中进行培养;28℃黑暗筛选10d后,观察愈伤组织并统计愈伤褐化死亡率;除去严重褐变或水渍化、质地软、无结构的非胚性愈伤组织,挑选生长状态好(色泽鲜亮、致密颗粒状、干燥松散、生长旺盛)的胚性愈伤组织转移至新的筛选分化培养基进行生长。
筛选分化培养基配方为:MS,蔗糖60g/L,ZT 0.5mg/L,TDZ 0.1mg/L,6-BA 1mg/L,特美汀200mg/L,双丙胺膦8mg/L,植物凝胶3g/L,pH5.8。
5、筛选分化培养II
将上一步筛选出的抗性组织继续置于筛选分化培养基上,转移到16h光照、8h黑暗、25℃条件下培养20d,分化出幼苗。
6、生根培养及炼苗移栽
(1)将分化的幼苗转移入生根培养基中,25℃、5000Lx光照培养至生根,10d后生长出根的幼苗;其中,生根培养基配方为:1/2MS,MES 0.5mg/L,蔗糖20g/L,NAA 0.2mg/L,植物凝胶3g/L,pH5.8。
(2)开盖炼苗;7d后,将长度大于5cm的幼苗进行分子鉴定,记录生成的绿苗数量和阳性苗数量,同时根据检测结果剔除阴性植株,保留阳性植株。
(3)将阳性植株移入培养土(草炭土、珍珠岩、蛭石按5:1:1的体积混合均匀,按照100L基质添加鸡粪有机肥5L,氢氧化钙10g,硫酸钾复合肥50g,磷酸二铵50g并混合均匀)后,移至温室生长结种。
试验例1
本试验例用于验证不同农杆菌侵染菌株类型、农杆菌吸光值、侵染时间、共培养时间对转化结果的影响。
植物材料:供试材料玉米自交系B104(安徽农业大学作物抗逆育种与减灾国家地方联合实验室保存)。
农杆菌及质粒:本试验例所用菌株包括根癌农杆菌EHA105、LBA4404、AGL1,植物侵染的载体pCAMBIA1301-Bar,均为安徽农业大学保存。
1、不同农杆菌菌株的影响:
不同农杆菌菌株的转化效率有很大区别,本发明选取三种农杆菌菌株EHA105、LBA4404、AGL1进行侵染效果的比较。
取授粉后10d的B104玉米果穗进行消毒、挖胚及侵染(参照实施例2方法),共培养后通过蓝色激发光源观察绿色荧光蛋白表达情况,统计瞬时转化率和筛选阶段的稳定转化率。
结果如图4所示。由图4可知,EHA105的瞬时转化率为54.33(±1.77)%,LBA4404的转化率为42.7(±2.7为)%,AGL1的瞬时转化率仅为19.0(±2.67)%,选择EHA105菌株侵染幼胚的瞬时转化率高出AGL1为35.33%,另外筛选阶段的稳定转化率也是EHA105菌株的最高。可以发现,选择不同的农杆菌菌株对幼胚进行侵染的遗传转化结果产生明显差异,EHA105菌株能明显提高转化效率。
因此,本发明在以农杆菌介导玉米自交系B104幼胚的遗传转化中选取EHA105作为最佳侵染菌株。
2、不同农杆菌侵染时间的影响:
分别设定3、5、7、9、11min,以测定不同农杆菌侵染时间对遗传转化的影响(本试验例农杆菌菌株以“EHA105菌株”为代表)。
测定瞬时转化率并记录幼胚的生长状态。
瞬时转化率结果如图5所示。由图5可知,当农杆菌侵染时间为3~7min时,幼胚的瞬时转化率逐渐上升;当侵染时间为7min时,幼胚瞬时转化率升至最高为52.22(±3.68)%;当侵染时间超过7min后,瞬时转化率逐渐降低。因此,农杆菌适宜侵染时间为7min。
同时,当农杆菌侵染时间为3~5min时,由图6可知,污染率为0;当侵染时间超过5min时,出现污染且污染率逐渐上升;在侵染时间为11min时,幼胚污染率最高为42.23(±3.69)%。
综合分析认为,本发明较适的农杆菌侵染时间应为5min。
3、不同农杆菌菌液吸光值OD
将OD
转化率结果如图7所示。由图7可知,当农杆菌菌液吸光值OD
幼胚生长状态见表1。由表1可知,不同农杆菌菌液吸光值条件下,当OD
综合分析认为,OD
表1不同农杆菌菌液吸光值OD
4、不同共培养时间的影响:
共培养天数也影响着瞬时转化率。将共培养天数分别设置为0、1、2、3、4、5d,共培养后统计幼胚生长状态,并通过蓝色激发光源观察绿色荧光蛋白表达情况,统计瞬时转化率(过程中的其他参数参照实施例2)。
转化率结果如图8所示。由图8可知,当共培养时间为0~2d时,幼胚的瞬时转化率逐渐上升;当共培养时间为2d时,瞬时转化率最高为58.9(±3.7)%;共培养时间为0d时,瞬时转化率为11.1(±1.37)%。
幼胚生长状态见表2。由表2可知,当共培养时间为0~3d时,幼胚的生长状态较好,被污染情况较少;而当共培养时间为4~5d时,农杆菌生长过盛,污染幼胚,严重影响后续转化。
综合分析,共培养时间2d为最适的共培养时间。
表2不同共培养时间对幼胚生长状态的影响
试验例2
本试验例用于验证本发明构建的玉米高效快速遗传转化体系的具体应用。
基于上述对遗传转化阶段关键条件的验证,本发明成功建立了一套完整的玉米高效快速遗传转化体系及方法。玉米遗传转化过程中的不同生长阶段状态如图9所示,其中,将不同生长阶段转化成功的幼胚或愈伤组织置于荧光体式显微镜下进行观察,发现其在蓝光视野下均能够呈现明亮的绿色荧光(图10所示)。
本发明优化后建立的玉米自交系B104快速遗传转化体系为:首先对外植体消毒,获取幼胚并对其进行农杆菌侵染,共培养阶段生长2d后将幼胚转移至静息培养基上生长7~10d,挑取含有绿色荧光标记的幼胚转移至筛选培养基上培养10d,再挑取存活的抗性愈伤组织于筛选分化培养基上见光培养,最终挑取有分化为独立植株趋势的小苗于生根培养基上培养生根,生根后再炼苗移栽入温室,整个阶段需要60d左右。本体系优化并缩短了筛选、分化阶段的培养时间,最终获得阳性植株,大大缩短了遗传转化周期,加快了后续的实验研究进程。
同时,对本发明体系方法所得的转基因植株进行分子鉴定,结果如图11所示。由图11可知,通过农杆菌浸染、抗性愈伤筛选及分化、生根等步骤,最终获得84棵转基因玉米苗。通过CTAB法提取幼叶的基因组,以其为模板对GFP基因进行PCR扩增并结合Bar试纸条检测,共计获得54棵阳性植株,阳性苗占比64%。
综上所述,本发明最终成功建立玉米自交系B104快速遗传转化体系。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
