Cas12a突变体及其应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于生物技术领域,具体为Cas12a蛋白及其用途。
背景技术
细菌和古细菌利用簇状规则间距短回文重复序列(clustered regularlyinterspaced short palindromic repeats,CRISPR)-CRISPR相关蛋白(Cas)系统作为适应性免疫系统,利用CRISPR基因座中编码的引导RNA(gRNA)序列来引导CRISPR相关(Cas)内切酶的活性,从而识别和切割特定的外来核酸序列。随着Cas酶的不断发现,人们对CRISPR-Cas蛋白的分类产生了浓厚的兴趣。Cas蛋白被分为两个不同的系统:第一类蛋白的特点是存在多个亚基,形成多蛋白效应复合物;第二类蛋白的特点是依靠单个蛋白实现其功能。除了少数利用1类CRISPR系统的核酸检测应用外,生物传感策略的大部分进展都依赖于2类CRISPR系统,因为它的组装过程简单、功效显著。目前,第二类系统的Cas9、Cas12和Cas13已成为基因编辑和核酸检测的主流系统。虽然Cas9也可用于核酸检测,但Cas12(Cas12a、Cas12b、Cas14f1)和Cas13a由于具有反式裂解机制,在核酸检测应用中取得了重大突破。
CRISPR-Cas13a属于第2类Ⅵ型CRISPR-Cas系统,与大多数CRISPR-Cas系统中的蛋白不同,Cas13a-crRNA效应复合物不具有DNase活性,但具备RNase活性。Cas13a蛋白呈双叶结构,包括crRNA识别叶和核酸酶叶。crRNA识别叶包含N端结构域(N-terminal domain,NTD)和Helical-1结构域,而核酸酶叶则由Helical-2、Helical-3以及具有RNA酶活性的HEPN-1、HEPN-2结构域组成。当crRNA-靶RNA复合物通过Cas13a蛋白的核酸酶通道时,会触发HEPN-1向HEPN-2结构域移动,导致外表面的HEPN催化位点激活,发挥RNase活性。除了特异性地剪切靶RNA外,Cas13a蛋白的反式RNase活性也被激活,可以非特异性地切割邻近的非靶RNA。正是基于Cas13a反式切割活性,研究人员开发了多种分子检测工具。
与Cas13a不同,大多数已知的Cas12a(又称Cpf1)特异性识别并切割双链DNA(double-strand DNA,dsDNA)。为了促进DNA底物的裂解,Cas12a需要在DNA中存在一个与crRNA间隔(Spacer)序列互补的原间隔区(Protospacer),以及位于原间隔区5'端的一段连续的原间隔紧邻基序(Protospacer Adjacent Motif,PAM)。PAM序列主要由胸腺嘧啶残基组成,紧邻原间隔的5'末端。dsDNA被裂解后(顺式DNase活性),Cas12a被激活并表现出对单链DNA(single-strand DNA,ssDNA)的非特异性裂解(反式DNase活性)。这种激活机制是Cas12a用于分子检测的基础。
通过对RNA和ssDNA寡聚物两端使用荧光基团和淬灭基团分别标记(荧光探针),Cas13a和Cas12a/crRNA分别识别RNA和DNA靶标核酸底物,其各自的反式裂解活性被激活,非特异性地分别裂解RNA和ssDNA荧光探针,从而产生可检测的荧光信号。
CRISPR-Cas13a和CRISPR-Cas12a是最常用的基于CRISPR原理的分子检测系统,如何快速、简便、廉价、精确的检测仍然是改进检测技术的重要方向,尤其是如何对核酸进行多重检测,是急待解决的问题。有研究尝试单管使用CRISPR-Cas13a和CRISPR/Cas12a两种系统同时检测两种靶标,但最近的研究显示,Cas12a的非特异性反式核酸酶活性除了裂解ssDNA外,还能裂解RNA和dsDNA,即Cas12a具有反式DNase和反式RNase两种活性。如果结合使用CRISPR-Cas13a和CRISPR-Cas12a两种系统,Cas13a反式RNase活性与Cas12a反式RNase活性相互干扰,导致错误的检测结果。
如何消除CRISPR-Cas12a的反式RNase活性而只保留可激活的反式DNase活性,是CRISPR-Cas13a和CRISPR-Cas12a能结合使用的前提。
发明内容
为了克服上述技术问题,本发明提供了一种检测准确性更高的基于CRISPR原理多重核酸检测试剂盒及其使用方法。
本发明提供一种Cas12a蛋白突变体,所述Cas12a蛋白突变体在野生型上发生H759A、K768A、K785A中的一种突变,所述Cas12a蛋白突变体的氨基酸序列如SEQ ID NO.1、SEQ ID NO.2、SEQ ID NO.3所示。
本发明还提供一种核酸分子,所述核酸分子包含如上所述的Cas12a蛋白突变体的核酸序列,所述序列如SEQ ID NO.4、SEQ ID NO.5、SEQ ID NO.6所示。
本发明还提供一种表达载体,所述表达载体含有如上所述的核酸分子。
本发明还提供一种CRISPR-Cas12a系统,所述CRISPR-Cas12a系统包括第一向导RNA和如上所述的Cas12a蛋白突变体。
本发明提供的CRISPR-Cas12a系统可应用于体内外基因编辑中,降低对细胞内RNA的非特异性脱靶效应,也可应用于分子检测中。
本发明还提供一种试剂盒,所述试剂盒包含如上所述的CRISPR-Cas12a系统。
本发明还提供一种双重检测试剂盒,所述试剂盒包含如上所述的CRISPR-Cas12a系统和CRISPR-Cas13a系统,所述CRISPR-Cas13a系统包括第二向导RNA和Cas13a蛋白。
进一步的,所述试剂盒中还包括两种不同的荧光基团和淬灭基团标记的核酸(DNA,RNA)探针。
本发明还提供使用如上所述的双重检测试剂盒用于非疾病诊断目的的检测样品中靶核酸的方法,将样品与如上所述的CRISPR-Cas12a系统和CRISPR-Cas13a系统以及两种不同的荧光基团和淬灭基团标记的核酸(DNA,RNA)探针接触,测量所述CRISPR-Cas12a系统和CRISPR-Cas13a系统切割所述加核酸探针而产生的可检测信号,从而检测两种不同靶核酸。
本发明中的靶核酸可以为单链核酸、双链核酸。
本发明中的靶核酸可以为病毒核酸、细菌核酸或与疾病相关的特异核酸。
本发明中的可检测信号可以是当切割检测核酸时产生的任何信号,例如,基于金纳米颗粒的检测,荧光偏振,基于荧光信号的检测,胶体相变/分散,电化学检测,基于半导体的传感。所述可检测信号可通过任何合适的方式读出,包括但不限于:可检测的荧光信号的测量,凝胶电泳检测(通过检测凝胶上的条带的变化),基于视觉或传感器的颜色的存在或不存在的检测、或者颜色存在的差异(例如,基于金纳米颗粒)以及电信号的差异。
本发明中的可检测信号可以是定量的也可以是定性的。
本发明中,检测核酸两端加的标签为分别设置的荧光基团和猝灭基团,当检测核酸被被切割后,可以表现出可检测的荧光信号。所述荧光基团选自FAM、FITC、VIC、JOE、TET、CY3、CY5、ROX、Texas Red或LC RED460中的一种或任意几种;所述淬灭基团选自BHQ1、BHQ2、BHQ3、Dabcy1或Tamra中的一种或任意几种。
本发明中的双重检测试剂盒用于检测两种不同的靶核酸,试剂盒中所使用的核酸探针也是不同的,第一核酸探针两端分别设置第一荧光基团、第一淬灭基团和第一核酸寡聚物;第二核酸探针两端分别设置第二荧光基团、第二淬灭基团和第二核酸寡聚物。
本发明中所述“靶核酸”是指从生物样品(待测样品)中提取的多核苷酸分子。所述生物样品是从任何生物体获得、排泄或分泌的任何固体或流体样品,包括但不限于单细胞生物,例如细菌、酵母、原生动物和变形虫等,多细胞生物(例如植物或动物,包括来自健康或表面健康的人类受试者或受待诊断或调查的病症或疾病影响的人类患者的样品,例如病原微生物例如病原细菌或病毒的感染)。例如,生物样品可以是从例如血液、血浆、血清、尿液、粪便、痰液、粘液、淋巴液、滑液、胆汁、腹水、胸腔积液、血清肿、唾液、脑脊液、水性或玻璃体液、或任何身体分泌物、渗出液、渗出液(例如,从脓肿或任何其他感染或炎症部位获得的液体)中获得的生物液体或从关节(例如,正常关节或受疾病影响的关节,例如类风湿性关节炎、骨关节炎、痛风或脓毒性关节炎)获得的液体,或皮肤或粘膜表面的拭子。样品也可以是从任何器官或组织获得的样品(包括活组织检查或尸体解剖标本,例如肿瘤活检)或者可以包含细胞(原代细胞或培养的细胞)或由任何细胞、组织或器官调理的培养基。示例性的样品包括但不限于,细胞、细胞裂解物、血涂片、细胞离心制剂、细胞学涂片、体液(例如血液、血浆、血清、唾液、痰、尿、支气管肺泡灌洗、精液等)、组织活检(例如肿瘤活组织检查)、细针抽吸物和/或组织切片(例如低温恒温器组织切片和/或石蜡包埋的组织切片)。
本发明中所述的“crRNA”具有本领域技术人员通常理解的含义。一般而言,crRNA可以包含直接重复序列(direct repeat,DR)和间隔序列(spacer)。在某些情况下,间隔序列是与靶序列(本发明中所述特征序列)具有足够互补性从而与所述靶序列杂交并引导CRISPR/Cas复合物与所述靶序列的特异性结合的任何多核苷酸序列,通常具有12-30nt的序列长度。所述的直接重复序列可折叠形成特定结构(如茎环结构)供Cas蛋白识别,以形成复合物。所述的间隔序列不需要与特征序列(靶序列)100%互补。所述的间隔序列不与核酸探针互补。
相对于现有技术,本发明具有如下有益效果:
1、本发明中的CRISPR-Cas12a系统(含有突变的Cas12a蛋白)可应用于体内外基因编辑中,降低对细胞内RNA的非特异性脱靶效应,也可应用于分子检测中,避免检测中错误结果的出现;
2、本发明中的CRISPR-Cas12a系统(含有突变的Cas12a蛋白)可实现与CRISPR-Cas13a联合使用,互不干扰,用于检测两种不同的靶核酸。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
附图说明
图1为H759A Cas12a突变体质粒图谱
图2为K768A Cas12a突变体质粒图谱
图3为K785A Cas12a突变体质粒图谱
图4为SDS-PAGE凝胶电泳/考马斯亮蓝染色结果图
图5为三个Cas12a突变体对反式RNase活性抑制图
图6为三个Cas12a突变体对反式DNase活性影响图
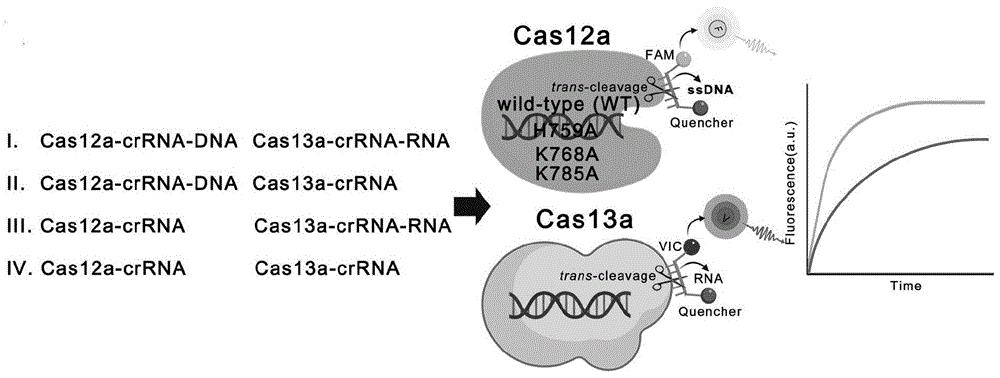
图7为Cas12a与Cas13a联合检测使用示意图
图8为Cas12a/WT与Cas13a联合检测结果图
图9为Cas12a/H759A与Cas13a联合检测结果图
图10为Cas12a/K768A与Cas13a联合检测结果图
图11为Cas12a/K785A与Cas13a联合检测结果图
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
本发明中所使用的DNA和RNA均可从基因合成服务公司化学合成所获得。
本发明中检测核酸RNA寡核苷酸和荧光基团/淬灭基团标记的核酸探针分别从百力格生物科技(上海)股份有限公司和生工生物工程(上海)股份有限公司化学合成;检测核酸DNA寡核苷酸和基因片段为PAGE纯化级,分别购自北京祥鸿生物科技有限公司和生工生物技术有限公司(上海)。DNA和RNA寡聚体溶解于不含DNase/RNase的水中,定量至100uM的储备液。
实施例1Cas12a蛋白突变体的制备
1.1质粒序列及图谱
分别构造如图1、图2和图3所示的质粒。
1.2蛋白表达与纯化
含有表达LbCas12a细菌表达载体pET28a质粒按照生产商提供的方法将质粒产物转化到BL21(DE3)高效细胞(天源公司,中国北京,产品目录号:CB105)中。这些含有表达质粒细胞先在37℃的LB液体培养基中培养,然后在25℃和0.4mM IPTG诱导下表达16小时。在色谱纯化之前,用高压匀浆器破坏细胞。使用HisTrap FF(Ni Sepharose 6Fast Flow)(Cytiva,产品目录编号:17525501)和HiLoad
1.3检测结果
由SDS-PAGE凝胶电泳/考马斯亮蓝染色结果可以看出,3个Cas12a突变蛋白表达纯化结果良好。如图4所示。
实施例2三种Cas12a蛋白突变体对反式RNase活性的抑制作用
2.1序列设计及获取
检测对象:甲型流感病毒(H1N1)
SEQ ID NO 7:Cas12a/crRNA(Cas12a/POP7/crRNA/CS):特异性识别人POP7基因片段(Homo sapiens POP7 homolog,ribonuclease P/MRP subunit(POP7),Gene ID:10248,该基因常作为核酸检测系统的人内源性内标)
5’-UAAUUUCUACUAAGUGUAGAUAAUUACUUGGGUGUGACCCU-3’
SEQ ID NO 8:Cas12a/POP7/ssDNA:人POP7基因片段,待检测单链DNA序列5’-CACATCCGAGTCTTCAGGGTCACACCCAAGTAATTGAAAAGACACTCCTC-3’
SEQ ID NO 13:ssDNA荧光探针:5’-TTTTTTTTTTTT-3’(两端标记:5`6-FAM,3`BHQ1)
SEQ ID NO 14:RNA荧光探针:5’-UUUUUUUUU-3’(两端标记:5`6-FAM,3`BHQ1)
2.2反应体系和荧光检测
反应体系按以下方案配置:Cas12a蛋白(100nM终浓度)、Cas12a/crRNA(序列1,100nM终浓度)、荧光/淬灭基团标记DNA探针(序列3,500nM终浓度)或荧光/淬灭基团标记RNA探针(序列6,500nM终浓度)、缓冲液(50mM醋酸钾、20mM Tris-醋酸、10mM醋酸镁、100μg/ml BSA)、RNase抑制剂(4U,Vazyme Biotech,南京,中国,产品目录编号:DD4102-PA)、ROX参考染料(500nM终浓度,Sangon Biotech,上海,中国,产品目录编号:B541010),以及靶核酸底物(序列2,100nM),最后加入无核酸酶水将反应总体积调至20ul。然后将含有反应体系的48孔反应板放入StepOne
2.3检测结果
对LbCas12a三个位点(H759A、K768A、K785A)进行了突变并测试对LbCas12a可激活的反式RNase活性和反式DNase活性的影响。Cas12a/crRNAs识别并结合靶标DNA后,分别激活野生型LbCas12a和3种突变体后,数据表明,与野生型LbCas12a蛋白相比,这三个位点的突变导致Cas12a反式RNase活性受到显著性地抑制(图5),但并不影响反式DNase活性(图6)。
实施例3 CRISPR/Cas12a(Cas12a/WT,Cas12a/H759A,Cas12a/K768A或Cas12a/K785A)和CRISPR/Cas13a系统双重检测实验
3.1序列设计及获取
检测对象:甲型流感病毒(H1N1)
SEQ ID NO 7:Cas12a/crRNA(Cas12a/POP7/crRNA/CS):特异性识别人POP7基因片段(Homo sapiens POP7 homolog,ribonuclease P/MRP subunit(POP7),Gene ID:10248,该基因常作为核酸检测系统的人内源性内标)
5’-UAAUUUCUACUAAGUGUAGAUAAUUACUUGGGUGUGACCCU-3’
SEQ ID NO 8:Cas12a/POP7/ssDNA:人POP7基因片段,待检测DNA序列
5’-CACATCCGAGTCTTCAGGGTCACACCCAAGTAATTGAAAAGACACTCCTC-3’
SEQ ID NO 9:Cas13a/crRNA:特异性识别甲型流感病毒(H1N1)第4段血凝素(HA)5’-GAUUUAGACCACCCCAAAAAUGAAGGGGACUAAAACUGGGUGUUUGACAAGUUGUAUUGCAAUC-3’
SEQ ID NO 10:Cas13a/FluA/RNA:待检测RNA序列,甲型流感病毒(H1N1)第4段血凝素(HA)基因片段
5’-UCCACGAUUGCAAUACAACUUGUCAAACACCCAAGGGU-3’
序列15:DNA荧光探针:5’-TTTTTTTTTTTT-3’(两端标记:5`6-FAM,3`BHQ1)
序列16:RNA荧光探针:5’-UUUUU-3’(两端标记:5`VIC,3`BHQ1)
3.2反应体系和荧光检测
反应体系按以下方案配置:LbCas12a蛋白(SEQ ID NO.11,100nM终浓度)、LbuCas13a蛋白(SEQ ID NO.12,100nM终浓度)、Cas12a/crRNA(序列1,100nM终浓度)、Cas13a/crRNA(序列4,100nM终浓度)、荧光/淬灭基团标记DNA探针(序列3,500nM终浓度)、荧光/淬灭基团标记RNA探针(序列6,500nM终浓度)、缓冲液(50mM醋酸钾、20mM Tris-醋酸、10mM醋酸镁、100μg/ml BSA)、RNase抑制剂(4U,Vazyme Biotech,南京,中国,产品目录编号:DD4102-PA)、ROX参考染料(500nM终浓度,Sangon Biotech,上海,中国,产品目录编号:B541010),以及不同靶核酸底物(DNA底物,序列2;RNA底物,序列5)组合,最后加入无核酸酶水将反应总体积调至20ul。然后将含有反应体系的48孔反应板放入StepOne
3.3检测结果
相比于野生型(wild-type,WT),Cas12a蛋白RNase关键位点的突变(Cas12a/H759A,Cas12a/K768A,Cas12a/K785A)导致反式RNase活性显著性下降。该突变蛋白可应用于体内外基因编辑中,降低对细胞内RNA的非特异性脱靶效应。也可应用于分子检测中。例如,仅保留反式DNase活性的Cas12a蛋白,适合与只有反式RNase活性的Cas13a联用。我们在单个反应体系中,使用CRISPR/Cas12a(Cas12a/WT,Cas12a/H759A,Cas12a/K768A或Cas12a/K785A)和CRISPR/Cas13a系统分别检测DNA(Homo sapiens POP7 homolog,ribonucleaseP/MRP subunit(POP7),Gene ID:10248,该基因常作为核酸检测系统的人内源性内标)和RNA(Influenza Avirus(ACalifornia072009(H1N1)hemagglutinin(HA)NC_026433.1),并分别使用不同荧光基团(FAM,VIC)标记的ssDNA和RNA探针作为检测信号(图7)。结果显示,Cas12a野生型蛋白(Cas12a/WT)、不同突变位点Cas12a蛋白(Cas12a/H759A,Cas12a/K768A,Cas12a/K785A)和Cas13a蛋白均能很好地检测到各自核酸靶标(图8-11)。但含有DNA核酸靶标存在而无RNA核酸靶标(图7,II.Cas12a-crRNA-DNACas13a-crRNA)的条件下,使用Cas12a/WT反应体系会出现明显的RNA报告物荧光信号,表明crRNA-DNA除激活了Cas12a/WT的反式DNase活性外,也激活了反式RNase活性,从而导致检测RNA靶标的“假阳性”结果(图8)。而使用了RNase失活的Cas12a突变蛋白(Cas12a/H759A,Cas12a/K768A,Cas12a/K785A)则避免了“假阳性”结果(图9-11)。
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
