一种用于检测髓系肿瘤CSF3R T618I突变的试剂盒及其专用引物与探针
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及生物技术领域,具体涉及一种用于检测髓系肿瘤CSF3R T618I突变的试剂盒及其专用引物与探针。
背景技术
CSF3R基因编码的细胞因子集落刺激因子3跨膜受体,是一种控制粒细胞的产生、分化和功能的细胞因子;接受由JAK和Src激酶家族介导的配体信号的刺激进而激活下游STAT、PI3K和MAPK信号通路的级联反应。CSF3R基因的胚系功能失活性变异可引起先天性重度中性粒细胞减少;功能激活性的体细胞突变可引起不依赖配体的受体二聚化,引起信号传导的异常。在髓系肿瘤中,CSF3R基因的体细胞突变可见于慢性中性粒细胞白血病(Chronic Neutrophilic Leukemia,CNL)、不典型慢性粒细胞白血病(atypical ChronicMyeloid Leukemia,aCML)和急性髓系白血病(Acute myeloid leukemia,AML),在上述髓系肿瘤的诊断和鉴别诊断及靶向治疗中具有重要价值。
CSF3R基因的体细胞突变形式主要包括外显子14的近膜突变(如T615A和T618I等)以及外显子17的截短突变(如D771fs、S783fs、Y752*和W791*等)。其中CSF3RT618I热点突变为CSF3R基因在髓系肿瘤中最常见的激活型体细胞突变的形式,美国国立卫生研究院国家癌症研究所及美国儿童肿瘤学组协作开展的TARGET AML研究在787例儿童AML中发现了19例CSF3R突变患者,其中最常见的突变为T618I(11/19,57.9%)。相似的,一项来自中国的研究在101例伴CEBPA双突变的AML中发现20例CSF3R突变,其中75%为CSF3R T618I热点突变。已有研究表明,携带CSF3R T618I突变的患者可能获益于JAK激酶抑制剂如芦可替尼的靶向治疗。检测CSF3R T618I突变不仅有助于相关髓系肿瘤的诊断、危险分层,而且有助于指导治疗选择及监测治疗反应等,具有重要意义。
目前用于CSF3R T618I突变检测的方法主要有传统的Sanger测序法和二代测序。Sanger测序法灵敏度较差且不能定量;二代测序具有高通量、高灵敏度、可相对定量等优点,但其费用相对昂贵,实验操作及后续数据分析均相对复杂,适用于没有明确候选基因的病例的筛查,不适用于CSF3R T618I突变这样单一基因且位点明确的基因突变的筛查及持续定量的跟踪检测。因此,目前亟需建立一种兼具高灵敏度、高特异度、可定量、可便捷操作且相对经济的检测方法来满足临床或科研工作中对CSF3RT618I热点突变的检测。
美国ABI公司的TaqMan-MGB探针(
发明内容
本发明的目的是提供一种用于检测基因组DNA上的CSF3R T618I热点突变的引物和TaqMan-MGB荧光探针。
为了实现上述目的,本发明首先提供了用于检测CSF3R T618I突变的成套试剂。
本发明提供的用于检测CSF3R T618I突变的成套试剂包括CSF3R T618wt-FP、CSF3R T618wt-RP、CSF3R T618wt-MGB-Probe和CSF3R T618I-MGB-Probe;
所述CSF3R T618wt-FP为SEQ ID No.1所示的单链DNA分子;
所述CSF3R T618wt-RP为SEQ ID No.2所示的单链DNA分子;
所述CSF3R T618wt-MGB-Probe为SEQ ID No.3所示的单链DNA分子;
所述CSF3R T618I-MGB-Probe为SEQ ID No.4所示的单链DNA分子。
上述成套试剂中,所述CSF3R T618wt-MGB-Probe和所述CSF3RT618I-MGB-Probe的5’端标记有发光颜色不同的报告荧光基团,3’端标记有不发光的淬灭基团和二氢环化吲哚卟啉-三肽。
进一步的,所述报告荧光基团可为FAM或HEX或VIC,所述不发光的淬灭基团可为NFQ。
再进一步的,所述CSF3R T618wt-MGB-Probe的5’端标记VIC荧光基团。
所述CSF3R T618I-MGB-Probe的5’端标记FAM荧光基团。
更进一步的,所述CSF3R T618wt-FP、所述CSF3R T618wt-RP、所述CSF3RT618wt-MGB-Probe和所述CSF3R T618I-MGB-Probe的摩尔比可为20:20:9:3。
为了实现上述目的,本发明又提供了上述成套试剂的新用途。
本发明提供了上述成套试剂在如下1)-10)任一种中的应用:
1)检测或辅助检测CSF3R T618I突变;
2)制备检测或辅助检测CSF3R T618I突变的产品;
3)检测或辅助检测待测者基因组DNA是否发生CSF3R T618I突变;
4)检测或辅助检测待测者基因组DNA是否发生CSF3R T618I突变的产品;
5)诊断或辅助诊断髓系肿瘤;
6)制备诊断或辅助诊断髓系肿瘤的产品;
7)筛查或辅助筛查髓系肿瘤患者;
8)制备筛查或辅助筛查髓系肿瘤患者的产品;
9)监测或辅助监测髓系肿瘤患者的治疗效果或治疗反应;
10)制备监测或辅助监测髓系肿瘤患者的治疗效果或治疗反应的产品。
为了实现上述目的,本发明还提供了用于检测CSF3R T618I突变的试剂盒。
本发明提供的用于检测CSF3R T618I突变试剂盒包括上述成套试剂。
进一步的,所述试剂盒中还包括阳性对照、野生型对照和阴性对照。
更进一步的,所述阳性对照为CSF3R T618I突变阳性患者骨髓单个核细胞的基因组DNA。
所述野生型对照为正常人骨髓单个核细胞的基因组DNA。
所述阴性对照为不含DNA的PCR扩增体系。
上述试剂盒在如下1)-10)任一种中的应用也属于本发明的保护范围:
1)检测或辅助检测CSF3R T618I突变;
2)制备检测或辅助检测CSF3R T618I突变的产品;
3)检测或辅助检测待测者基因组DNA是否发生CSF3R T618I突变;
4)制备检测或辅助检测待测者基因组DNA是否发生CSF3R T618I突变的产品;
5)诊断或辅助诊断髓系肿瘤;
6)制备诊断或辅助诊断髓系肿瘤的产品;
7)筛查或辅助筛查髓系肿瘤患者;
8)制备筛查或辅助筛查髓系肿瘤患者的产品;
9)监测或辅助监测髓系肿瘤患者的治疗效果或治疗反应;
10)制备监测或辅助监测髓系肿瘤患者的治疗效果或治疗反应的产品。
上述任一所述应用中,所述检测待测者基因组DNA是否发生CSF3R T618I突变为检测待测者骨髓单个核细胞中的基因组DNA是否发生CSF3R T618I突变。
所述检测待测者骨髓单个核细胞中的基因组DNA是否发生CSF3R T618I突变的方法包括如下步骤:
1)提取受试者的骨髓单个核细胞中的基因组DNA;
2)以步骤1)获得的基因组DNA为模板,采用上述成套试剂进行PCR扩增,得到扩增产物;
3)按照如下方法对步骤2)获得的扩增产物进行CSF3R基因的等位基因鉴别分析:若用于标记CSF3R T618wt-MGB-Probe的VIC荧光染料发出的荧光强度呈S型增长,同时用于标记CSF3R T618I-MGB-Probe的FAM荧光染料发出的荧光强度无增长,表示待测者未发生CSF3R T618I突变;若用于标记CSF3R T618wt-MGB-Probe的VIC荧光染料发出的荧光强度无增长,同时用于标记CSF3R T618I-MGB-Probe的FAM荧光染料发出的荧光强度呈S型增长,则表示待测者CSF3R发生T618I纯合突变;若用于标记CSF3R T618wt-MGB-Probe的VIC荧光染料和用于标记CSF3RT618I-MGB-Probe的FAM荧光染料发出的荧光强度同时呈S型增长,则表示待测者CSF3R发生T618I杂合突变。
在上述检测待测者基因组DNA是否发生CSF3R T618I突变的方法中,为了便于对检测结果进行分析,还可在步骤2)中添加CSF3R T618I突变阳性对照质粒标准品、野生型质粒标准品和阴性对照。其中,CSF3R T618I突变阳性对照质粒标准品、野生型质粒标准品可按照如下方法进行制备:以CSF3R T618I突变阳性患者及正常人骨髓单个核细胞的DNA为模板,采用CSF3R T618wt-FP引物和CSF3R T618wt-RP引物进行PCR扩增,得到扩增产物,扩增产物经纯化后,分别克隆入pUC57质粒载体,经过细菌转化、筛选、测序验证及扩增后,提取DNA分别得到CSF3R T618I突变阳性对照质粒和野生型质粒标准品。阴性对照为不含DNA的PCR扩增体系。
上述任一所述应用中,所述髓系肿瘤包括慢性中性粒细胞白血病、不典型慢性粒细胞白血病和急性髓系白血病。
上述任一所述CSF3R T618I突变是指CSF3R蛋白(SEQ ID No.6)氨基酸序列第618位的苏氨酸(T)突变为异亮氨酸(I),对应于CSF3R基因CDS序列(SEQ ID No.5第58-3176位)第1853位的碱基C突变为碱基T。
本发明通过将设计的用于对髓系肿瘤CSF3R T618I突变进行检测的引物和TaqMan-MGB探针结合实时荧光定量PCR检测技术,即可实现检测髓系肿瘤CSF3RT618I突变的目的。本发明所提供的成套试剂和试剂盒可用于临床及科研中对CSF3RT618I突变进行检测,不仅为髓系肿瘤的诊断提供了一条快速、可靠、准确的新途径,而且可进一步提供CSF3R突变基因与野生CSF3R基因的确切比值,从而可为疗效观察、微小残留病的动态观察提供依据。本发明将在医学检测领域发挥重要作用。
附图说明
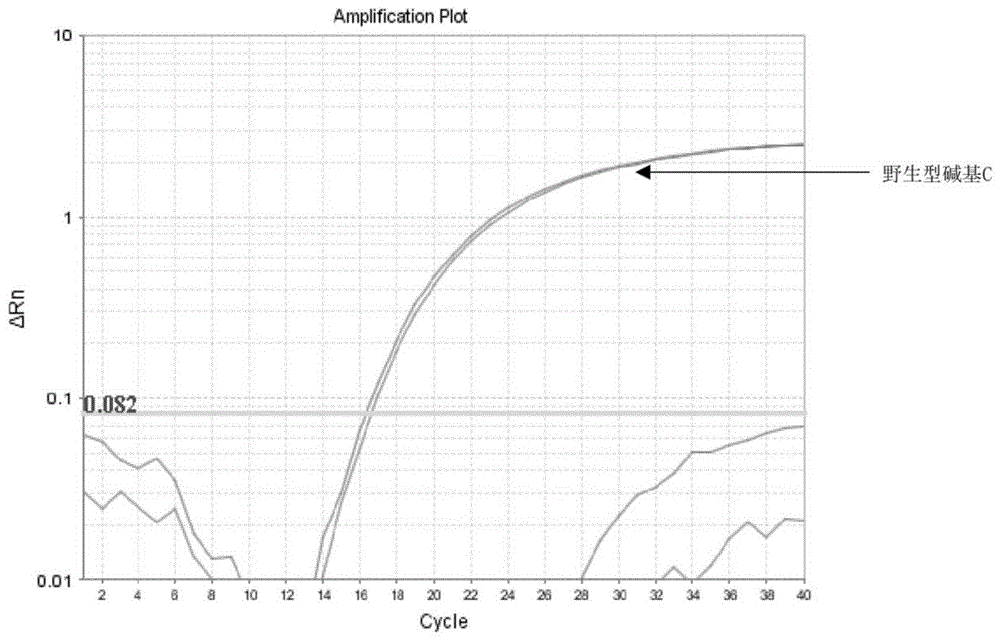
图1为CSF3R自氨基末端第618位氨基酸位点为野生型碱基C的扩增曲线。
图2为CSF3R自氨基末端第618位氨基酸位点为T618I杂合型的扩增曲线。左上为野生型碱基C的扩增曲线,右下为突变型碱基A的扩增曲线。
图3为计算CSF3R T618I突变基因占CSF3R总基因型的百分比值的标准曲线。
图4为本发明检测CSF3R T618I突变的灵敏度展示。左上为野生型碱基C的扩增曲线,右下为突变型碱基A的扩增曲线,从左至右分别展示突变负荷为40%、10%、2.5%、0.625%的阳性标准品检测结果。
图5为测序验证部分样品的CSF3R T618I突变的结果。上方为一CSF3R T618位点突变阴性样本(正常人对照)Sanger测序验证结果,下方为一CSF3R T618I位点突变阳性样本(髓系肿瘤阳性患者)Sanger测序验证结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用引物、TaqMan-MGB探针的合成及序列测定工作均由赛默飞世尔科技(中国)有限公司完成。
实施例1、用于对髓系肿瘤CSF3R T618I突变进行检测的引物和TaqMan-MGB探针的设计
野生型CSF3R基因位于人基因组第1号染色体,其基因组序列如NCBI ReferenceSequenc为NG_016270.1所示序列中的第4595-21866位,CDS序列为如SEQ ID No.5第58-3176位所示,编码的CSF3R蛋白的氨基酸序列如SEQ ID No.6所示。
CSF3R T618I突变基因为将野生型CSF3R基因的CDS序列第1853位的碱基由C(野生型)突变为T(突变型)后得到的基因,该突变导致编码的CSF3R蛋白氨基酸序列第618位的苏氨酸(T)的密码子ACC突变为编码异亮氨酸(I)的密码子ATC。
根据野生型CSF3R基因及CSF3R T618I突变基因,本发明设计了用于对髓系肿瘤CSF3R T618I突变进行检测的引物和TaqMan-MGB探针,具体如表1所示。
用于对髓系肿瘤CSF3R T618I突变进行检测的引物为SEQ ID No.1所示的CSF3RT618wt-FP和SEQ ID No.2所示的CSF3R T618wt-RP,扩增片段长度为133bp。
用于对髓系肿瘤CSF3R T618I突变进行检测的TaqMan-MGB探针为SEQ ID No.3所示的T618wt-MGB-Probe和SEQ ID No.4所示的T618I-MGB-Probe。其中,T618wt-MGB-Probe由16个碱基组成,针对野生型碱基类型C,5’端标记VIC荧光基团,3’端标记有不发光的NFQ淬灭基团,且NFQ淬灭基团连接有二氢环化吲哚卟啉-三肽(dehydrocyclopyrroindoletripetide,DPI3);T618I-MGB-Probe由15个碱基组成,针对突变型碱基T,5’端标记FAM荧光基团,3’端标记有不发光的NFQ淬灭基团。
表1、检测CSF3R T618I突变的引物、探针序列
实施例2、髓系肿瘤患者CSF3R T618I突变的检测
采用实施例1中设计的引物和TaqMan-MGB探针对423例在北京大学人民医院确诊为初治急性髓系白血病(AML)的患者的骨髓单个核细胞基因组DNA进行CSF3R突变的检测,并以同时期20例年龄匹配的健康骨髓移植供者的离体骨髓基因组DNA(NDM)为对照,具体方法如下:
1、待测样品基因组DNA的提取
按DNA zol试剂盒(美国Gibco公司)并参照试剂盒说明书在无菌条件下提取髓系肿瘤患者及正常骨髓移植供者的骨髓标本的基因组DNA。具体包括如下步骤:用EDTA抗凝,用淋巴细胞分层液(相对密度1.077g/L,上海华精高科技有限公司)分离出单个核细胞,将分离出的单个核细胞用生理盐水洗涤2次后,加入600μl DNAzol试剂,轻轻混合吹打后加入600μl无水冷乙醇,4℃、12000rpm离心1分钟,弃上清,将沉淀用80%的冷乙醇洗涤一次,室温干燥,用适量的灭菌注射用水溶解沉淀,最后用DNA/RNA紫外检测仪测定DNA含量及纯度,结果A260/A280>1.8,表明所提取的DNA纯度较高。
2、PCR扩增
以步骤1提取的基因组DNA为模板,在CSF3R T618wt-FP引物、CSF3R T618wt-RP引物、CSF3R T618wt-MGB-Probe探针以及CSF3R T618I-MGB-Probe探针的引导下,用ABI 7500实时荧光定量PCR仪(美国应用生物系统公司)进行PCR扩增,PCR反应体系为:
为了便于对检测结果进行分析,同时设置CSF3R T618I突变阳性对照质粒、野生型质粒和阴性对照,其中,CSF3R T618I突变阳性对照质粒、野生型对照质粒的制备方法如下:分别以CSF3R T618I突变阳性CNL患者骨髓单个核细胞、正常人骨髓单个核细胞的基因组DNA为模板,采用CSF3R T618wt-FP引物和CSF3R T618wt-RP引物进行PCR扩增,得到扩增产物,扩增产物经纯化后,分别克隆入pUC57质粒载体(北京百奥莱博科技有限公司,货号为GS0117),经过细菌转化、筛选、测序验证及扩增后,提取DNA分别得到CSF3R T618I突变阳性对照质粒和野生型质粒标准品。阴性对照为不含DNA的PCR扩增体系。
3、PCR扩增曲线鉴别分析及结果判断
对步骤2的扩增产物进行等位基因鉴别分析,若用于标记SEQ ID No.3的荧光染料VIC发出的绿色荧光强度呈S型增长,同时用于标记SEQ ID No.4的荧光染料FAM发出的蓝色荧光强度无增长,表示CSF3R基因型为野生型,扩增曲线如图1所示;反之,表示CSF3R基因型为CSF3R T618I纯合突变基因型;若两种荧光染料发出的荧光强度同时呈S型增长,表示CSF3R基因型为杂合突变基因型,扩增曲线如图2所示。
结果表明:423例AML患者中检出CSF3R T618I突变型16例,且所有423例AML患者的检测结果均经高通量靶区测序验证(图5),与本发明检测结果的一致率为100%。
实施例3、CSF3R T618I突变基因占CSF3R总基因型的百分比值的标准曲线的建立
通过测定吸光度值计算出CSF3R T618I突变阳性对照质粒标准品和野生型质粒标准品的拷贝数,分别制备十倍梯度稀释(10
分别以不同突变比例的CSF3R T618I突变阳性标准品为模板,按照实施例2中的方法检测CSF3R T618I突变。以CSF3R T618I/CSF3R
本发明建立的标准曲线为y=1.0612e
实施例4、本发明髓系肿瘤CSF3R T618I突变检测方法的灵敏度测定
通过测定吸光度值计算出CSF3R T618I突变阳性对照质粒标准品和野生型质粒标准品的拷贝数,分别制备十倍梯度稀释(10
分别以不同突变比例(即突变基因型/(突变基因型+野生基因型))的CSF3R T618I突变阳性标准品为模板,按照实施例2中的方法检测CSF3R突变。每梯度重复3-5管进行扩增。
结果表明:在0.625%梯度均可检出CSF3R T618I突变扩增曲线,表明本发明方法的检测灵敏度可达0.625%。突变比例为40%、10%、2.5%、0.625%的阳性标准品检测结果如图5所示。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
