一种检测猫呼吸道病原体的引物、试剂盒及其制备方法
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及一种检测猫呼吸道病原体的引物、试剂盒及其制备方法,属于生物技术领域。
背景技术
猫是理想的室内宠物,因为它们相对较小,不需要大量的空间。这使得猫成为城市居民的理想选择,尤其是那些住在公寓或有限空间中的人们。尤其不需要每天定期遛步,因此对于那些生活方式较为独立或忙碌的人来说,猫是理想的伴侣。由于猫的生活条件较单一并且运动量少导致一些猫的免疫力低下,所以较容易感染呼吸道病原体。猫的呼吸道中存在着一些主要的病原体,包括猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体和猫支原体,它们对猫的健康构成一定的危害。
猫杯状病毒(Feline Calicivirus,FCV)是一种常见的猫呼吸道病毒,可以引起猫的上呼吸道感染和口腔炎症。感染猫杯状病毒的猫会表现出打喷嚏、流眼泪、食欲不振等症状。严重的情况下,猫可能会出现口腔溃疡和关节炎等并发症。监测猫杯状病毒的存在对于及时采取预防措施、诊断和治疗感染的猫非常重要。猫疱疹病毒I型(Feline HerpesvirusType 1,FHV-1)又称猫鼻支病毒,感染猫疱疹病毒的猫会出现打喷嚏、流鼻涕、眼部炎症等症状。严重的情况下,猫可能会出现角膜炎、结膜炎和呼吸道并发症。猫波氏杆菌(Bordetella felis)是一种细菌,常常与其他呼吸道病原体一起感染猫的呼吸道。猫衣原体(Chlamydophila felis)和猫支原体(Mycoplasma felis)也是导致猫上呼吸道感染的常见病原体,感染后的猫会出现咳嗽、打喷嚏、流鼻涕等症状。
及时发现感染可以帮助兽医采取适当的治疗措施,减轻猫的症状并促进康复。监测病原体的存在可以提供重要的流行病学数据,帮助了解病原体的传播途径和影响范围,从而制定预防和控制措施。此外,对于养猫者来说,了解猫的健康状况可以帮助他们更好地照顾自己的宠物,减少疾病传播的风险。所以,监测以上五种病原体的存在对猫的健康和宠物猫群体的管理具有重要意义。目前,对猫呼吸道病原的检测方法主要包括传统PCR、实时荧光PCR。然而,这些方法均需要操作繁琐,不利于快速、便捷地进行检测。
LAMP(Loop-mediated isothermal amplification)扩增技术是一种在恒温条件下进行的核酸扩增技术,在60-65℃条件下,双链DNA处于解旋与结合的动态平衡,Bst聚合酶同时具有链置换活性和聚合酶活性,能在恒温条件下快速、高效、特异性的扩增模板,无需PCR热变性扩增循环。与PCR技术相比,LAMP的优势体现在以下几个方面:首先,LAMP扩增是在等温条件下进行的,不需要复杂的温度循环设备。相比之下,PCR反应需要精确控制不同温度的变化,需要耗费较多的时间和金钱来保证反应温度的准确性。LAMP扩增只需要一个恒温器就能完成扩增反应,因此更加简便和经济。其次,LAMP扩增具有较高的扩增效率和速度。由于LAMP反应采用了4~6条引物和Bst DNA聚合酶,可以在较短的时间内产生大量的扩增产物。
实验结果表明,LAMP扩增速度较快,通常在30分钟到1小时内就能获得明显的扩增产物,而PCR反应通常需要1-2小时。LAMP扩增对目标序列具有较高的特异性,LAMP反应使用多个引物,能够同时识别多个目标序列的不同区域,从而提高了特异性。相比之下,PCR反应通常只使用两个引物,可能会面临非特异性扩增的问题。此外,LAMP扩增还具有直接可视化的优势,LAMP扩增反应中通常加入一种pH指示剂,由于在反应会产生大量的H
鉴于目前市面上鲜有报道同时检测猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体和猫支原体的恒温扩增试剂盒。为此,针对猫呼吸道中的猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体和猫支原体等病原体,有必要提供一种检测的引物以及试剂盒产品,从而解决现有技术中实时监测不便、检测成本高和市场上缺少猫呼吸道病原体组合检测的问题,并解决现有技术中对猫呼吸道病原体的快速检测问题,缩短提取耗时并降低检测成本。
发明内容
为了解决上述问题,提供了一种检测猫呼吸道病原体的引物及包含该引物的试剂盒,可以在恒温条件下高效、快速、简便的对猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体和猫支原体等常见病原体进行检测,解决了现有技术中对样本中病原体提取耗时长、成本高的问题,并具有快速、高效、可靠的优点,具有较高的实用价值和市场竞争力。
根据本申请的一个方面,提供了一种检测猫呼吸道病原体的引物,所述引物包括下述1)~5)组中的一种或多种,每组中分别包括内引物FIP/BIP、外引物F3/B3和环引物LF/LB;
1)猫杯状病毒组:FIP如SEQ ID No.1所示,BIP如SEQ ID No.2所示,F3如SEQ IDNo.3所示,B3如SEQ ID No.4所示,LF如SEQ ID No.5所示,LB如SEQ ID No.6所示;
2)猫疱疹病毒组:FIP如SEQ ID No.7所示,BIP如SEQ ID No.8所示,F3如SEQ IDNo.9所示,B3如SEQ ID No.10所示,LB如SEQ ID No.11所示;
3)猫波氏杆菌组:FIP如SEQ ID No.12所示,BIP如SEQ ID No.13所示,F3如SEQ IDNo.14所示,B3如SEQ ID No.15所示,LF如SEQ ID No.16所示,LB如SEQ ID No.17所示;
4)猫衣原体组:FIP如SEQ ID No.18所示,BIP如SEQ ID No.19所示,F3如SEQ IDNo.20所示,B3如SEQ ID No.21所示,LB如SEQ ID No.22所示;
5)猫支原体组:FIP如SEQ ID No.23所示,BIP如SEQ ID No.24所示,F3如SEQ IDNo.25所示,B3如SEQ ID No.26所示,LB如SEQ ID No.27所示。
其中猫疱疹病毒组、猫衣原体组和猫支原体组不含LF引物序列。
根据本申请的另一个方面,提供了一种检测猫呼吸道病原体的试剂盒,其特征在于,所述试剂盒包括Bst酶、dNTP、镁离子和权利要求1所述的检测猫呼吸道病原体的引物。
可选的,所述试剂盒中与每组引物配合使用的所述Bst酶用量为4~8U,按50 μl体系计。
可选的,所述Bst酶用量选自4U、5U、6U、7U、8U及其间的任意值。
可选的,所述试剂盒中与每组引物配合使用的所述dNTP浓度为1~3.0 mM。
可选的,所述dNTP浓度选自1.0 mM、1.25 mM、1.5 mM、1.75 mM、2.0 mM、2.25 mM、2.5 mM、2.75 mM、3 mM及其间的任意值。
可选的,所述试剂盒中与每组引物配合使用的所述镁离子浓度为4~8 mM。
可选的,所选镁离子浓度选自4 mM、5 mM、6 mM、7 mM、8 mM及其间的任意值。
可选的,所述试剂盒中与每组引物配合使用的试剂还包括苯酚红,每组中所述苯酚红浓度为20~80 µM。
通过添加苯酚红于扩增体系中,可以可视化地显示扩增结果,从而方便通过肉眼对比颜色即可对检测结果进行判断。由于苯酚红微溶于水,进行苯酚红试剂配制时,超500µM就已经达到饱和状态,为此在扩增体系中添加苯酚红的浓度设置为低于500 µM的范围。
可选的,所述苯酚红浓度选自20 µM、25 µM、30 µM、35 µM、40 µM、45 µM、50 µM、55µM、60 µM、65 µM、70 µM、75 µM、80 µM及其间的任意值。
优选的,所述苯酚红浓度为50 µM。
可选的,所述试剂盒还包括样本释放剂,所述样本释放剂包括:1~5 M盐酸胍、10~20 mM Tris、0.5~1 g/L吸附树脂、0.01~0.5%聚山梨醇酯20。
可选的,所述盐酸胍浓度选自1 M、2 M、3 M、4 M、5 M及其间的任意值;所述Tris浓度选自10 mM、11 mM、12 mM、13 mM、14 mM、15 mM、16 mM、17 mM、18 mM、19 mM、20 mM及其间的任意值;所述吸附树脂浓度选自0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L及其间的任意值;所述聚山梨醇酯20质量浓度选自0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.2%、0.3%、0.4%、0.5%及其间的任意值。
优选的,所述吸附树脂浓度为1 g/L。
优选的,所述聚山梨醇酯20浓度为0.1%。
可选的,所述吸附树脂为吸附树脂XAD-7。
根据本申请的又一个方面,提供了一种可视化检测猫呼吸道病原体的试剂盒,所述试剂盒包括猫杯状病毒检测管、猫疱疹病毒检测管、猫波氏杆菌检测管、猫衣原体检测管、猫支原体检测管和阴性比色管;
所述猫杯状病毒检测管包括如权利要求1所述的猫杯状病毒组引物,所述猫疱疹病毒检测管包括如权利要求1所述的猫疱疹病毒组引物,所述猫波氏杆菌检测管包括如权利要求1所述的猫波氏杆菌组引物,所述猫衣原体检测管包括如权利要求1所述的猫衣原体组引物,所述猫支原体检测管包括如权利要求1所述的猫支原体组引物;
每个检测管中还包括50 μl的LAMP反应液,所述LAMP反应液包括:Bst聚合酶4~8U、甜菜碱0.5~2 µL、dNTP混合液1~3.0 mM、镁离子4~8 mM、苯酚红20~80 µM;
所述试剂盒还包括样本释放剂,所述样本释放剂包括:1~5 M盐酸胍、10~20 mMTris、0.5~3 g/L吸附树脂、0.01~0.5%聚山梨醇酯20;
所述试剂盒还包括液体石蜡。
优选的,所述苯酚红浓度为50 µM。
优选的,所述吸附树脂浓度为1 g/L。
优选的,所述聚山梨醇酯20浓度为0.1%。
根据本申请的再一个方面,提供了任一上述的试剂盒的制备方法。
根据本申请的再一个方面,提供了上述的试剂盒的制备方法,所述LAMP反应液中还包括冻干保护剂,所述制备方法包括将所述LAMP反应液制备成冻干球的步骤。
根据本申请的再一个方面,提供了上述的引入在制备检测猫呼吸道病原体产品中的应用。
本申请的有益效果包括但不限于:
1.根据本申请的检测猫呼吸道病原体的试剂盒,以在恒温条件下高效、快速、简便的对猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体和猫支原体这5种猫呼吸道常见病原体进行检测。
2.根据本申请的检测猫呼吸道病原体的试剂盒,配合直扩核酸释放剂大大增加了样品中目标序列的检出率,提高了检测的灵敏度,达到10
3.根据本申请的检测猫呼吸道病原体的试剂盒,本发明所提供的检测猫呼吸道病原体试剂盒,可兼容实时荧光仪、PCR仪、FireMini-8恒温核酸扩增仪进行扩增检测,并且在扩增时配合液体石蜡进行封层,大大降低了气溶胶污染,可以在常规实验室或家庭中进行检测,具有高度的可操作性和普适性,为猫呼吸道病原体检测提供了更方便、快速、简单和可靠的方法。
4.根据本申请的检测猫呼吸道病原体的试剂盒,试剂中加入了具有pH指示作用的苯酚红,反应中会产生大量的H
5.根据本申请的检测猫呼吸道病原体的试剂盒,本发明所提供的快速检测猫呼吸道病原体的试剂盒,解决了现有技术中实时监测不便、检测成本高、以及市场上缺少猫呼吸道病原体组合检测产品的问题,可广泛应用于猫呼吸道病原体的检测和研究,并且具有较大的市场前景和经济价值。
6.根据本申请的检测猫呼吸道病原体的试剂盒,使用直扩的方法对样本进行核酸的提取释放,具有快速、高效、可靠等优点,解决了样本中病原体提取耗时长、成本高的问题,有较高的实用价值和市场竞争力。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
图1为本申请实施例涉及的不同引物组合的筛选结果图;
图2为本申请实施例涉及的引物特异性验证结果图;
图3为本申请实施例涉及的直扩核酸释放剂的优化中使用直扩核酸释放剂和试剂盒提取的样本扩增结果图;
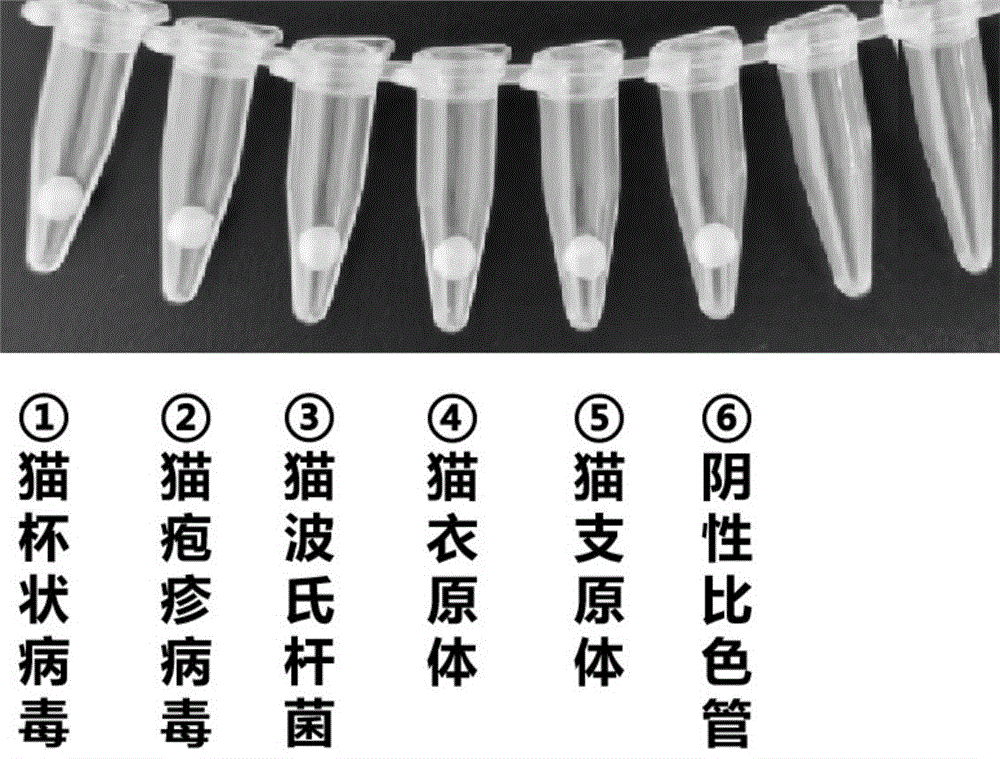
图4为本申请实施例涉及的快速检测5种猫呼吸道病原体的排布示意图;
图5为本申请实施例涉及的可视化快速检测5种猫呼吸道病原体的试剂盒灵敏度检测结果图;
图6为本申请实施例涉及的可视化快速检测5种猫呼吸道病原体的试剂盒真实样本的检测结果图一;
图7为本申请实施例涉及的可视化快速检测5种猫呼吸道病原体的试剂盒真实样本的检测结果图二。
具体实施方式
下面结合实施例详述本申请,但本申请并不局限于这些实施例,如无特别说明,本申请的实施例中的原料和催化剂均通过商业途径购买。
本发明针对猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体和猫支原体5种组合的呼吸道病原体,设计出5套用于特异性检测病原的核酸序列。其中,FIP/BIP为内引物,F3/B3为外引物,LF/LB为环引物。
本发明还提供了用于检测5种猫呼吸道病原体检测的试剂盒。试剂盒中包括LAMP反应体系所需的冻干球(引物、酶、缓冲液等试剂),以及用于核酸提取的核酸释放剂,用于封层的液体石蜡。具体操作如下:
S1:用拭子在眼睑下,充分擦拭以采集眼拭子样品;用同一根拭子适度拭抹口腔和鼻腔分泌物,采集鼻咽拭子样品。拭子样品采集后,应迅速将拭子头折断于核酸释放剂中,震荡10秒充分混匀,室温放置5分钟,使拭子头上的病原体充分溶解到核酸释放剂中。
S2:按照以下进行试剂配制,检测试剂组成包括:扩增冻干球1份盛装于八连管中、检测样品50 μL/孔和液体石蜡50 μL/孔;
S3:将八连管放入FireMini-8恒温核酸扩增仪中,进行核酸扩增反应;反应结束,待降温至室温后,置于光线良好的环境中观察。
结果判读:反应液为红色为阴性,反应液为黄色则为阳性。
下面通过具体实施例来对本发明的方案进行说明。
实施例1 引物的设计与筛选
根据GenBank中各个病原体的基因,在PrimerExplorer V5(http://primerexplorer.jp/e/)网站上设计特异性引物并按照特异性引物序列构成原则进行筛选。各个病原体的标准品为生物公司合成的质粒。每种病原体设计多对引物进行筛选,选出特异好无交叉反应及扩增效率好的引物,测试引物见表1。
表1 待选测试引物列表
表1续表1
表1续表2
不同的引物和模板的结合效率不同,在可视化LAMP反应中则体现在最终的颜色变化会有较大的差异。比如,同样浓度的模板,三个不同的引物,会呈现不同程度的颜色(黄色、橙色、红色),颜色越黄则说明这个引物与模板更易于结合,设计的相对较好,反之则差,结果见图1。
图1中以检测猫杯状病毒的引物为例,从扩增结果和扩增时间与颜色可以看出,采用No.1 FCV和No.3 FCV引物后,虽然扩增结果的阴阳性对比度明显,但是扩增效率较No.4FCV引物差,难以获得高灵敏度的检测结果。而采用No.2 FCV、No.5 FCV和No.6 FCV引物后,在65℃下经过30分钟的恒温扩增,阴阳性对比度不明显,所以筛选出No.4 FCV引物作为本试剂盒的扩增引物组合。猫疱疹病毒、猫波氏杆菌、猫衣原体、猫支原体的检测呈现出同样的结果,采用本发明引物,不产生交叉反应,因此灵敏度更高,特异性更优。而采用图1中其他引物组合,则扩增灵敏度与特异性很差,无法实现猫呼吸道病原体的检测。所以后续实验选用No.4 FCV、No.6 FHV、No.2猫波、No.1 CP、No.2 MP这五种组合进行特异性与灵敏度的检测,引物信息详见表2。
表2 筛选出的引物
实施例2 引物特异性验证
选择猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体、猫支原体质粒的10
由图2扩增结果可知,使用猫呼吸道病原体引物对不同类型的质粒模板进行扩增后,仅引物与模板对应的位点(引物)扩增成功,结果显示为黄色阳性;其他质粒模板,结果为红色阴性;说明本套扩增体系的特异性良好。
实施例3 反应体系的优化
准备50 μl的LAMP反应液,配比如下:Bst聚合酶 4~8U、甜菜碱1µL、dNTP混合液 1~3.0 mM、镁离子4~8 mM、苯酚红50 µM、无菌水补齐至50 µL、FIP 1.6 µM、BIP 1.6 µM、F30.2 µM、B3 0.2 µM、LF 0.4 µM、LB 0.4 µM。
由于双链DNA在65℃条件下处于动态平衡的稳定状态,LAMP引物可以跟双链靶基因中的互补序列结合,继而利用Bst聚合酶的链置换活性启动DNA合成,从而取代并释放另一条单链DNA,所以Bst聚合酶的量在扩增中非常重要。dNTP是在扩增步骤提供原料,在反应中,使用低dNTP浓度,可减少非靶位置启动和延伸时的核苷酸错误掺入,但是过低浓度的dNTP由于扩增过程中的原料不足,会导致扩增不完全,为此发明人摸索了最佳的dNTP浓度。镁离子主要是影响酶的活性,一般来说镁离子浓度越高,扩增效率就高,但是特异性会下降;发明人筛选出了针对本发明5种病原体检测的最佳Bst聚合酶的量、dNTP浓度、镁离子浓度。
首先是Bst聚合酶用量的优化,设定Bst聚合酶的用量为4U、5U、6U、7U、8U,扩增温度为65℃,dNTP终浓度为2.5 mM,镁离子终浓度为6 mM,除Bst聚合酶用量改变,其余设定不变,扩增仪器为FireMini-8恒温核酸扩增仪,选择猫杯状病毒的10
其次是dNTP浓度的优化,设定dNTP浓度的用量为1.0 mM、1.25 mM、1.5 mM、1.75mM、2.0 mM、2.25 mM、2.5 mM、2.75 mM、3 mM,扩增温度为65℃,Bst聚合酶用量为8U,镁离子终浓度为6 mM,除dNTP浓度用量改变,其余设定不变,扩增仪器为FireMini-8恒温核酸扩增仪,选择猫杯状病毒的10
镁离子的优化,设定镁离子浓度为4 mM、5 mM、6 mM、7 mM、8 mM,扩增温度为65℃,Bst聚合酶用量为8U,dNTP终浓度为2.5 mM,除镁离子用量改变,其余设定不变,扩增仪器为FireMini-8恒温核酸扩增仪,选择猫杯状病毒的10
表3 50 μl反应体系组成
其中,buffer Mix包含1% Tween-20,100 mM (NH
实施例4 直扩核酸释放剂的优化
直扩核酸释放剂是将核酸从样本中直接裂解,无需进行核酸提取,核酸释放剂的成分既要保证样本中核酸的有效释放,并且不能影响后续LAMP的扩增。使用核酸释放剂可以省去核酸提取的步骤,从而简化实验操作流程和节约实验时间,加快实验进程。传统的核酸提取过程包括多个步骤,如细胞的裂解、核酸沉淀、洗涤等过程,而核酸释放剂能够直接将核酸从样本中裂解,无需这些繁琐的步骤,因此可以节约实验所需的时间。
为了实现上述目的,本发明提供了一种核酸释放剂,该核酸释放剂可以快速释放拭子中病原体的核酸且去除绝大部分扩增抑制剂,获得可以用于直接扩增以对猫呼吸道拭子样本核酸进行分析。
由于本扩增试剂是基于pH的变化进行的,所以样本释放剂的pH为8.5±0.5(偏碱性)。所述样本释放剂包含:1-5 M 盐酸胍、10-20 mM Tris、吸附树脂XAD-7(1 g/L)、0.1%的聚山梨醇酯20和适量的水。体系中加入适量的盐酸胍和聚山梨醇酯20可以保证病原体细胞裂解充分,不会对样本出现漏检的情况;加入适量的Tris是为了保证病原体的核酸在一个较为稳定的环境中,短时间内不会造成降解;加入吸附树脂XAD-7可以将样本中的黏蛋白等杂质吸附并且沉降下来,是扩增反应能够顺利进行而不被其他杂质所影响;将猫杯状病毒的10
基于以上实验结论,对1 M盐酸胍、10 mM Tris、吸附树脂XAD-7(1 g/L)、0.1%的聚山梨醇酯20进行溶液配制用于核酸直扩释放剂。对qPCR检测结果猫杯状病毒、猫支原体、猫疱疹病毒为阳性的宠物猫样本,进行眼鼻咽拭子取样,一份样本置于500 μl核酸释放剂中,震荡后室温孵育5分钟后作为扩增样本,按照实施例4的体系配制,加入5 μl样本,在FireMini-8恒温核酸扩增仪中对样本进行检测;一份样本使用凡知医学的病毒 DNA/RNA提取试剂盒(磁珠法)试剂盒进行核酸提取,提取后的样本作为扩增样本,按照实施例4的体系配制,加入5 μl样本,在FireMini-8恒温核酸扩增仪中对样本进行检测。扩增30分钟后,得到结果如图3所示。
由图3结果可以得出结论:在30分钟的扩增时间内,使用直扩核酸释放剂扩增的样本结果与金标准qPCR的检测结果一致率为100%;而使用试剂盒提取的样本猫杯状病毒和猫疱疹病毒与金标准qPCR的检测结果一致率为100%,而猫支原体的三个平行中,有1个模板未检出。本申请提供的核酸释放剂能够直接裂解样本中的核酸,并释放到溶液中,因此可以提高有效扩增的核酸产量。相比之下,核酸提取过程中可能会有一定的损失,导致核酸的产量相对较低。本申请提供的直扩核酸释放剂仅裂解样本中的核酸,而不对核酸的结构和功能产生影响,因此该核酸释放剂进行样本裂解时不对后续的LAMP扩增造成影响。
实施例5 可视化快速检测5种猫呼吸道病原体的试剂盒的建立
结合实施例3中的体系按照以下程序进行冻干:准备50 μl的LAMP冻干反应液,配比如下:Bst聚合酶8 U、甜菜碱1 µL、dNTP混合液2.5 mM、镁离子6 mM、苯酚红50 µM、无菌水补齐至50 µL、FIP 1.6 µM 、BIP 1.6 µM 、F3 0.2 µM、B3 0.2 µM、LF 0.4 µM、LB 0.4 µM、RT酶75U、冻干保护剂20 µL,由于真实样本中存在DNA和RNA,冻干加入RT酶用于对RNA进行反转录。按上述配方配制试剂,灌装到点珠机内,点珠机按照50 µL/滴滴入液氮中,将预冻的微球迅速转移到预冻的西林瓶中,半压盖后转移至预冻的真空冷冻干燥机中,进行真空冷冻干燥,得到冻干球后,按照图4中排布方式进行分装至0.2 ml透明八连排中。
实施例6 可视化快速检测5种猫呼吸道病原体的试剂盒灵敏度检测
将实施例1获得的质粒,从原始质粒10
从图5结果中可以看出,作为猫呼吸道病原体检测的联检试剂盒,猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体、猫支原体均可稳定检出至10
实施例7 可视化快速检测5种猫呼吸道病原体的试剂盒真实样本的检测
从猫咖店采集30例猫的拭子样本,同一只猫的一只拭子样本包含眼、鼻、口腔三个部分,按照以下步骤进行操作:
S1用拭子在眼睑下,充分擦拭以采集眼拭子样品;用同一根拭子适度涂抹猫的口腔和鼻腔分泌物,采集鼻咽拭子样品。拭子样品采集后,应迅速将拭子头折断于核酸释放剂中,震荡10秒充分混匀,室温放置5分钟,使拭子头上的病原体充分溶解到核酸释放剂中。
S2进行试剂配制:一个八连排从左至右的扩增位点为猫杯状病毒、猫疱疹病毒、猫波氏杆菌、猫衣原体、猫支原体,其中每份八连管中包含1份扩增冻干球和50 μL/孔的检测样品以及50 μL/孔的液体石蜡。
S3将八连管放入FireMini-8恒温核酸扩增仪中,进行核酸扩增反应;反应结束,待降温至室温后,置于光线良好的环境中观察,反应结果如图6和图7所示。
从图6和图7结果中可知,30只猫中,完全健康的有15只(50%),感染支原体的有11只(36.7%),感染猫波氏杆菌的有9只(30%),感染猫杯状病毒的有4只(13.3%),感染猫衣原体的有3只(10%),感染猫疱疹病毒的有2只(6.7%)。在检测出呼吸道疾病的15只猫中,有5只猫出现严重打喷嚏、流泪等现象,其余10只无明显症状。对30例猫样本使用qPCR复检,检测结果与可视化快速检测5种猫呼吸道病原体的试剂盒符合率为100%,证明本试剂盒的准确性与qPCR一致。
以上所述,仅为本申请的实施例而已,本申请的保护范围并不受这些具体实施例的限制,而是由本申请的权利要求书来确定。对于本领域技术人员来说,本申请可以有各种更改和变化。凡在本申请的技术思想和原理之内所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
