一种不含蛋白酶的快速磁珠法核酸提取试剂盒及核酸的提取及纯化方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及核酸提取技术领域,尤其涉及一种不含蛋白酶的快速磁珠法核酸提取试剂盒及核酸的提取及纯化方法,用于病毒、鼻咽拭子或组织样本核酸的提取、富集和纯化。
背景技术
目前市面存在的核酸提取或纯化试剂组分数量在4-7种,主要由裂解液、蛋白酶K、磁珠、2-3种洗涤液以及洗脱液组成。首先磁珠作为转移吸附介质,蛋白酶K加入裂解液中,样本经过一定时间的裂解过程使样本内的核酸暴露,之后利用磁珠转移至之后的2-3种洗涤液中依次洗涤,最后洗脱过程将样本核酸富集在体积较小的洗脱液中。显而易见,现有的大部分核酸提取或纯化试剂过程仍旧繁琐,提取时间相对较长,通常提取一个样本的周期都在10min以上,有些需要耗费近20min,不利于大量样本的临床检测。此外,蛋白酶K的本质仍然是一种蛋白质,容易在运输和储存过程中因保存不当导致蛋白酶K变性失效,因此含蛋白酶K的核酸提取试剂存储和运输成本高且相对保质期短。
发明内容
(一)要解决的技术问题
鉴于现有技术的上述缺点、不足,本发明提供一种不含蛋白酶的快速磁珠法核酸提取试剂盒,通过对试剂盒配方进行重调和组合,可在保证检测准确度的前提下、简化核酸提取或纯化过程,缩短检测周期,有利于大量样本的快速处理,降低试剂盒储存难度,减少运输和储存成本。
(二)技术方案
为了达到上述目的,本发明采用的主要技术方案包括:
第一方面,本发明提供一种不含蛋白酶的快速磁珠法核酸提取试剂盒,其由第一组分、第二组分和第三组分所组成;
所述第一组分为裂解液,其由3M-5M盐酸胍、0.2M-0.4M氯化锂、质量体积比为1-2%的吐温20、质量体积比为0.5-1%的Triton X-100、质量体积比为40-60%的异丙醇和浓度为1-2mg/mL的磁珠所组成;
所述第二组分为洗涤液,其由3mM-5mM柠檬酸三钠和质量体积比0.01%-0.3%的吐温20所组成;
所述第三组分为洗脱液,洗脱液为无菌纯化水。
根据本发明的较佳实施例,所述第一组分由4M盐酸胍、0.3M氯化锂、质量体积比为1.5%的吐温20、质量体积比为0.8%的Triton X-100、质量体积比为50%的异丙醇和浓度为1-2mg/mL磁珠所组成。
根据本发明的较佳实施例,所述第二组分由4mM柠檬酸三钠和质量体积比0.2%的吐温20所组成。
根据本发明的较佳实施例,所述第一组分和第二组分中的溶剂为无菌纯化水。
本发明的核酸提取及纯化试剂盒,裂解液中的盐酸胍主要作用是使蛋白质变性,使样本内部的核酸暴露出来;氯化锂主要作用是沉淀RNA;吐温20作为表面活性剂,主要作用是使试剂快速渗透到样本内部,使样本裂解更加快速充分;Triton X-100作为表面活性剂,主要作用是溶解样本表面的脂质,使样本裂解更加快速充分;异丙醇主要作用是沉淀或者析出DNA;磁珠作为核酸的转移吸附介质。洗涤液中的柠檬酸三钠主要作用是促进裂解样本残留物的分散;吐温20作为表面活性剂,起到强化分散的作用。
本发明的核酸提取及纯化试剂盒中,将适当浓度的盐酸胍、氯化锂、吐温20、Triton X-100、异丙醇等五种成分联用组成裂解液,以强化裂解效果,其不需要蛋白酶K辅助仍可以达到很强的裂解效果,且无蛋白酶K,有利于降低储存成本;本发明只使用了一种无醇洗涤液,减少洗涤次数和抑制物残留(醇会抑制PCR),实现了在缩短单份样本核酸提取纯化耗时的情况下,使核酸的提取纯化效果不变甚至更高,提高PCR检测灵敏度。
第二方面,本发明提供一种核酸的提取及纯化方法,其包括:
将上述试剂盒中的各组分分装到孔板中,裂解液的分装体积为300-400μL,洗涤液的分装体积为550-700μL,洗脱液分装体积为70-90μL;
使用全自动核酸提取仪,按照如下条件设置程序:
裂解混合90s,分段磁吸60s,转移至洗涤液孔位;裂解过程全程加热直至80℃恒定;
洗涤混合45s,分段磁吸45s,转移至洗脱液孔位;
洗脱混合120s,分段磁吸30s,回收磁珠至裂解液孔位;裂解过程全程控制在85℃加热;
在裂解液孔位混合10s即运行结束;
提取结束后可将洗脱得到的核酸样本转移至无核酸酶离心管内,放置于-20±5℃保存。
最后,将保存的样本进行PCR扩增和ABI荧光定量。
(三)有益效果
本发明的试剂盒相较于现有技术,具有如下的技术效果:
(1)在对同一样本进行核酸检测时,可简化核酸提取和纯化的步骤,从而节约一个检测样本所需要的时间,有利于大量样本的临床检测。
(2)对低浓度样本和高浓度样本进行核酸提取和纯化后,用于PCR扩增时CT值减小,说明试剂盒灵敏度更高;对于低浓度样本而言,标准差和变异系数更小,说明检测结果具有很好的稳定性。
(3)本发明的试剂盒不使用蛋白酶K,节省试剂原料成本,降低储存和运输难度,降低储存成本,保证较长的有效期。
附图说明
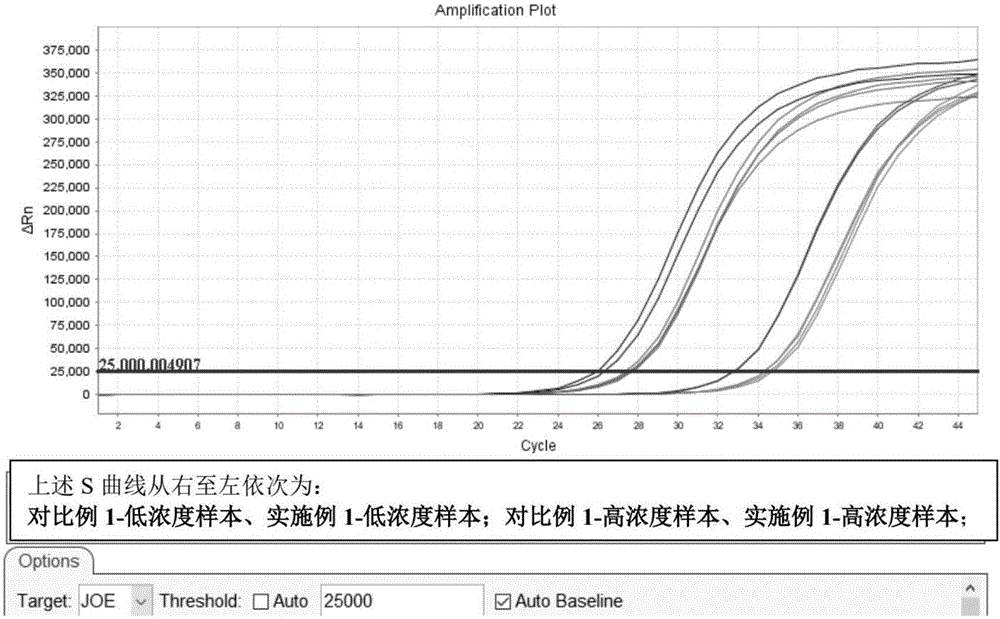
图1为使用本发明实施例1和对比例1的试剂盒分别对低浓度样本和高浓度样本中的核酸进行提取和纯化后再PCR扩增的结果对比图。
具体实施方式
为了更好的解释本发明,以便于理解,下面结合附图,通过具体实施方式,对本发明作详细描述。
为了缩短各个步骤所用时间,以利于应对紧急事件,实现快速对大量样本进行临床核酸检测,本发明首先通过增强裂解液的裂解效果,减少裂解所需时间,实现DNA和RNA共提;由于裂解液的裂解效果得到强化,因此并不需要蛋白酶K进行辅助裂解,减少人工操作,储存和运输更加方便。试剂中不包含蛋白酶K,运输及储存条件放宽,节省成本,使试剂具有较长的保质期。本发明还将磁珠与裂解液合并,减少转移磁珠所需时间。本发明的试剂盒只使用了一种洗涤液,可减少洗涤次数,仅使用该洗涤液洗涤一次;洗涤液中不含醇(为无醇洗涤液),可有效减少抑制物质的残留,不需要等待晾干的时间,节省耗时,并减少在晾干过程中易产生的气溶胶污染。
实施例1
本实施例的快速磁珠法核酸提取试剂盒,其包括裂解液、洗涤液和洗脱液。裂解液由4M盐酸胍、0.3M氯化锂、质量体积比为1.5%的吐温20、质量体积比为0.8%的Triton X-100、质量体积比为50%的异丙醇和浓度为2mg/mL磁珠组成。洗涤液由4mM柠檬酸三钠和质量体积比0.2%的吐温20所组成。洗脱液为无菌纯化水。其中裂解液和洗涤液中的溶剂均为无菌纯化水。
对比例1
本对比例与实施例1的裂解液不同,其裂解液由4.5M盐酸胍、100mM的Tris-HCl、质量体积比为1.5%的吐温20、质量体积比为0.8%的Triton X-100、质量体积比为50%的异丙醇和浓度为2mg/mL磁珠组成,溶剂为无菌纯化水。洗涤液和洗脱液与实施例1相同。
按照实施例1和对比例1的试剂盒各组分分别配制得到裂解液、洗涤液和洗脱液后,分装到96孔板中使用。裂解液(含磁珠)分装体积为400μL,洗涤液分装体积为680μL,洗脱液分装体积为85μL。按前述要求分装完毕后,使用全自动核酸提取仪,整个过程的步骤如下:
利用移液器依次加入样本300μL(乙型流感灭活毒株经稀释后,分别得到10
①裂解混合90s,分段磁吸60s,转移至洗涤液孔位(此过程全程加热直至80℃恒定);
②洗涤混合45s,分段磁吸45s,转移至洗脱液孔位;
③洗脱混合120s,分段磁吸30s,回收磁珠至裂解液孔位(此过程全程85℃加热);
④在裂解液孔位混合10s即运行结束;
提取结束后可将洗脱得到的核算样本转移至无核酸酶离心管内,放置于-20±5℃保存。
使用提取后的样本,使用乙型流感病毒PCR扩增试剂盒说明书加样,
在ABI荧光定量PCR仪扩增,得到如图1和表1所示结果。
表1:对同一样本采用实施例1和对比例1试剂盒提取及纯化的核酸进行扩增的数据分析表:
根据表1的分析结果可知,实施例1的试剂盒核酸提取或纯化核酸的效果明显更好,在同一样本验证下,无论是高浓度样本还是低浓度样本,CT值都减小1.5左右,这说明实施例1的试剂盒相比对比例1用于核酸检测时,前者的相对灵敏度更高。
实施例2
本实施例的快速磁珠法核酸提取试剂盒,其包括裂解液、洗涤液和洗脱液。裂解液由4M盐酸胍、0.35M氯化锂、质量体积比为2%的吐温20、质量体积比为0.8%的Triton X-100、质量体积比为55%的异丙醇和浓度为1.5mg/mL磁珠组成。洗涤液由4.5mM柠檬酸三钠和质量体积比0.15%的吐温20所组成。洗脱液为无菌纯化水。其中裂解液和洗涤液中的溶剂均为无菌纯化水。
为了探究本发明试剂盒中各组分对样本中核酸提取结果的影响,通过调整裂解液中部分组成,得到如下对比例。
对比例2
本对比例是在实施例2基础上单独去掉了裂解液中氯化锂成分,其他组成与实施例2相同,洗涤液和洗脱液与实施例2也相同。
对比例3
本对比例是在实施例2基础上,将盐酸胍的浓度降低至2M盐酸胍,同时将氯化锂盐浓度提高到0.8M,其他组成与实施例2相同,洗涤液和洗脱液与实施例2也相同。
对比例4
本对比例是在实施例2基础上,添加体积浓度为5%的蛋白酶K,同时裂解液的其他组分都予以保留,与实施例2相同,洗涤液和洗脱液与实施例2也相同。
按照实施例2和对比例2-4的试剂盒各组分分别配制得到裂解液、洗涤液和洗脱液后,分装到96孔板中使用。裂解液(含磁珠)分装体积为400μL,洗涤液分装体积为600μL,洗脱液分装体积为80μL。按前述要求分装完毕后,使用全自动核酸提取仪,整个过程的步骤如下:
利用移液器依次加入样本300μL(与实施例1为同一乙型流感灭活毒株稀释样本)至A1-H1、A7-H7裂解液孔位中,每个样本做4个重复,加样完成后将96孔板放在全自动核酸提取仪相应位置,插入搅拌套;打开程序并运行:
①裂解混合90s,分段磁吸60s,转移至洗涤液孔位(此过程全程加热直至80℃恒定);
②洗涤混合45s,分段磁吸45s,转移至洗脱液孔位;
③洗脱混合120s,分段磁吸30s,回收磁珠至裂解液孔位(此过程全程85℃加热);
④在裂解液孔位混合10s即运行结束;
提取结束后可将洗脱得到的核算样本转移至无核酸酶离心管内,放置于-20±5℃保存。
使用提取后的样本,使用乙型流感病毒PCR扩增试剂盒说明书加样,
在ABI荧光定量PCR仪扩增,得到表2所示结果。
表2:对同一样本采用实施例2、对比例2-4的试剂盒提取及纯化的核酸进行扩增的数据分析表:
由上表分析结果可知,当裂解液中缺失氯化锂时,扩增所得数据相较实施例2大1-2个CT值,说明裂解液中若缺少氯化锂会导致试剂盒提取或纯化核酸的效果变差,检测灵敏度下降;而若氯化锂的浓度过高(高于0.5M)同时盐酸胍过低(低于3M)时,扩增所得数据相较实施例2大2个CT值,这说明本发明裂解液中各个组分的含量应严格地控制在本发明所要求的范围内,含量过低或过高都会导致核酸提取或纯化的效果变差,检测灵敏度下降。此外,本发明不含蛋白酶K,但与添加有蛋白酶K的试剂盒比较,二者在核酸提取效果上基本相当。由此可见,本发明通过试剂盒的裂解液中省略蛋白酶K后,依然可以达到很好的核酸提取和纯化效果,且由于蛋白酶K的省略,使得本发明的试剂盒不需要在严苛的条件下储存和运输,并能够有效保证试剂盒的有效保质期。
此外,将本发明试剂盒与现有商品在组分数量、提取和纯化核酸的耗时方面进行比较,结果如下:
表3:使用不同试剂盒在全自动核酸提取仪上对核酸样本进行提取和纯化的耗时比较:
其中,黑色填充部分表示需要耗费该时间,白色无填充表示不含该操作(耗时0),(达安公司)下灰色填充部分表示该工序和耗费时间为可选值。
从上表组分数量上看,本发明的试剂盒组分数量只有3种,可简化全自动核酸提取仪的执行步骤。又根据计算,使用本发明的试剂盒,整个核酸提取和纯化的全过程耗时共计6分钟40秒,实际运行时间在7分钟33秒左右,不同仪器磁珠吸附转移过程有一定的区别,时间有所延长或缩短。而对比例1耗时12分56秒,其他各商品化试剂盒核酸提取和纯化耗时在9min以上,部分接近19min。
综上所述,本发明的试剂盒在缩减单份样本核酸提取和纯化周期的同时,核酸提取纯化效果不变甚至更高,使PCR检测的灵敏度也更高。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
