用于绵羊FecB基因分型的crRNA、试剂盒及方法
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及绵羊基因分型技术领域,具体涉及用于绵羊FecB基因分型的crRNA、试剂盒及方法。
背景技术
FecB是绵羊上首个被发现的多胎主效基因,该基因第8外显子的第746位碱基发生错义突变(A746G)。携带该突变的绵羊卵巢中,以剂量依赖式降低了颗粒细胞对BMP4刺激AMH产生的反应,有效提高绵羊的排卵率和产羔数。FecB突变的筛选和鉴定为多胎绵羊的选育提供了坚定的技术支撑,极大的提高了羊产业的经济效益。
针对FecB基因的检测技术目前应用最广泛的是聚合酶链式反应(PCR)+Sanger测序法,但PCR需要精密的温控设备、耗时过长、样品纯度要求较高且Sanger测序极依赖于业务人员的专业水平,不适用于现场检测。重组酶聚合酶扩增(RPA)技术由英国TwistDx Inc公司开发,其关键在于根据目的基因序列设计扩增引物,通过链置换反应在37-42℃条件下完成核酸扩增。无需通过高温解链,扩增过程十分快,扩增模板含量要求低(10-100copy),一般约20min获得可检出水平的扩增产物,灵敏度极优于PCR。RPA因其特点被广泛应用于病原物检测、食物鉴别、SNP分型中。
成簇规律间隔短回文重复序列(Clustered Regularly InterspersedPalindromic Repeats,CRISPR),被发现于细菌及古细菌的一种获得性免疫机制。由CRISPR阵列和编码CRISPR相关蛋白(Cas)组成。其中II类V型CRISPR效应蛋白Cas12a识别富含T的前间隔序列邻近序列(PAM),在与靶序列互补的CRISPR衍生RNA(crRNA)的引导下,识别并切割目标双链DNA。同时Cas12a也会不加选择地切割附近单链DNA,这一特性被称为“反式切割(trans-cleavage)”。这种“反式切割”被用于敏感和特异的目标序列检测,通过Cas12a/crRNA/靶序列复合体的结合激活该特性,使得荧光报告探针被切割,进而使底物产生荧光信号。CRISPR/Cas12a系统可以识别和切割具有单碱基分辨特异性的靶核酸,因此可以实现SNP分型。
但是,目前尚未见基于RPA-CRISPR/Cas12a对绵羊FecB基因进行分型的相关报道。
发明内容
本发明的目的在于克服现有技术存在的上述缺陷和不足,提供一种用于绵羊FecB基因分型的crRNA、试剂盒及方法。
本发明的第一个方面,提供用于绵羊FecB基因分型的crRNA,所述crRNA为SEQ IDNO.1所示的crRNA-a和SEQ ID NO.2所示的crRNA-g。所述crRNA-a是针对FecB外显子第746位为A的碱基序列,筛选出的非突变位点引入了单个碱基错配的与目的片段互补配对的RNA序列,引导Cas12a识别、切割靶DNA序列,所述crRNA-g是针对FecB外显子第746位为G的碱基序列,筛选出的非突变位点引入了单个碱基错配的与目的片段互补配对的RNA序列,引导Cas12a识别、切割靶DNA序列。
本发明的第二个方面,提供一种用于绵羊FecB基因分型的试剂盒,包括
RPA引物:用于引导扩增目的片段,通过引入的单个错配碱基提供LbCas12a识别的PAM序列;
crRNA:用于引导Cas12a特异性识别、切割靶DNA序列;
Cas12a核酸酶:核酸内切酶,在所述crRNA的引导下,具备切割靶DNA片段和不加选择的切割ssDNA的活性。
在本发明的一实施例中,所述RPA引物的核苷酸序列如SEQ ID NO.3和SEQ IDNO.4所示。
在本发明的一实施例中,所述ssDNA荧光探针的5′端用FAM荧光基团修饰,3′端用BHQ1淬灭基团修饰。
在本发明的一实施例中,所述ssDNA荧光探针的核苷酸序列为FAM-TTA TT-BHQ1。
进一步的,所述试剂盒还包括
红细胞裂解液:用于去除绵羊血液样品中的红细胞;
核酸释放剂:用于破坏血液样品中白细胞的细胞膜和核膜,使细胞内核酸释放到溶液中;
ERA试剂:包括Basic Buffer、Reaction Buffer、激活剂,快速扩增出满足CRISPR检测限的目的片段;
NEBuffer2.1:用于协助Cas12a充分发挥酶切活性;
RNA酶抑制剂:用于抑制crRNA的降解。
本发明的第三个方面,提供一种基于所述试剂盒的鉴别绵羊FecB基因SNP基因型的方法,步骤如下:
利用红细胞裂解液去除待鉴别绵羊血液样品中的红细胞;
利用核酸释放剂释放待鉴别绵羊血液样品中的基因组DNA,得到产物1;
利用所述RPA引物对产物1进行扩增,得到产物2;
将所述产物2分别加入CRISPR/Cas12a-WT体系和CRISPR/Cas12a-MT体系,39℃孵育10min;所述CRISPR/Cas12a-WT体系中的crRNA为crRNA-a,所述CRISPR/Cas12a-MT体系中的crRNA为crRNA-g;
蓝光下肉眼观测结果。
进一步的,获得产物2的体系为:Reaction Buffer 10μL、Basic Buffer 5μL、激活剂1μL、10nM的RPA上游引物1.25μL、10nM的RPA下游引物1.25μL、产物1 3μL,RNase-freewater补充至25μL;
程序为:39℃孵育20min。
进一步的,所述CRISPR/Cas12a-MT体系为:1μM的LbCas12a 2μL、10×NEBuffer2.12μL、25μM的ssDNA荧光探针1μL、40U/μL的RNA酶抑制剂0.1μL、1μM的crRNA-g 2μL、产物2 2μL,RNase-free water补充至20μL;
所述CRISPR/Cas12a-WT体系为:1μM的LbCas12a 0.25μL、10×NEBuffer2.12μL、25μM的ssDNA荧光探针1μL、40U/μL的RNA酶抑制剂0.1μL、1μM的crRNA-a 0.25μL、产物2 2μL,RNase-free water补充至20μL。
进一步的,蓝光下肉眼观测结果的具体方法为:
若CRISPR/Cas12a-WT体系和CRISPR/Cas12a-MT体系反应产物在蓝光照射下均有荧光亮度,则表示待鉴别绵羊FecB基因的基因型为AG;若CRISPR/Cas12a-WT体系反应产物在蓝光照射下有荧光亮度,而CRISPR/Cas12a-MT体系反应产物在蓝光照射下无荧光亮度,则表示待鉴别绵羊FecB基因的基因型为AA;若CRISPR/Cas12a-WT体系反应产物在蓝光照射下无荧光亮度,而CRISPR/Cas12a-MT体系反应产物在蓝光照射下有荧光亮度,则表示待鉴别绵羊FecB基因的基因型为GG。
本发明具有如下有益效果:
本发明提供的用于绵羊FecB基因分型的crRNA、试剂盒,基于CRISPR/Cas12a系统与RPA技术鉴别绵羊FecB外显子第746位的基因型,在检测过程中不需要大型昂贵的仪器,且检测时间缩至约40min,极大地拓展了适用场景,更适用于现场检测。
附图说明
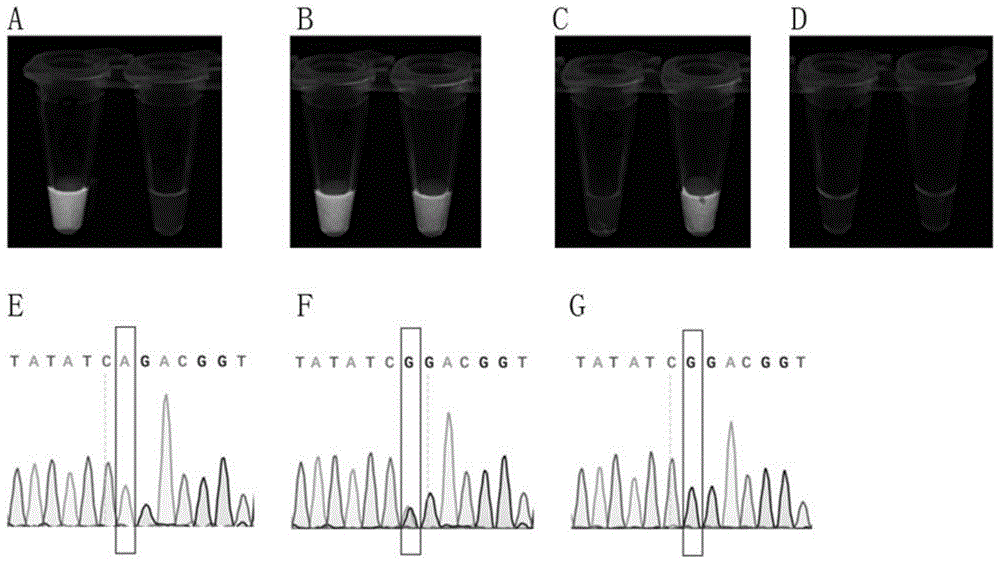
图1为实施例1的肉眼观测的分型结果及各样品FecB位点的Sanger测序图,图中,A-C依次为1号滩羊、2号滩羊、3号滩羊的肉眼观测的分型结果,D为阴性对照的肉眼观测的分型结果,E-F为1号滩羊、2号滩羊、3号滩羊的Sanger测序结果。
图2为实施例2的crRNA-a筛选结果,图中,A为各crRNA-a检测的荧光强度,B为各crRNA-a检测的荧光强度信噪比,C为各crRNA-a检测的肉眼观测的分型结果。
图3为实施例2的crRNA-g筛选结果,图中,A为crRNA-g0至crRNA-g7检测的荧光强度,B为crRNA-g0至crRNA-g7检测的荧光强度信噪比,C为crRNA-g8至crRNA-g15检测的荧光强度,D为crRNA-g8至crRNA-g15检测的荧光强度信噪比。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明的限制。如未特殊说明,下述实施例中所用的技术手段为本领域技术人员所熟知的常规手段,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明中包含的各元件如下:
红细胞裂解液:用于去除绵羊血液样品中的红细胞(BL503A,购自Biosharp)。
核酸释放剂:破坏血液样品中白细胞的细胞膜和核膜,使细胞内核酸释放到溶液中(LA,购自苏州先达基因科技有限公司)。
RPA引物组:引导扩增目的片段,通过引入单个碱基错配提供LbCas12a识别的PAM序列(由上海生工生物工程股份有限公司合成)。
ERA试剂:包括Basic Buffer、Reaction Buffer、激活剂,快速扩增出满足CRISPR检测限的目的片段(基础性核酸扩增试剂盒ERA法,购自苏州先达基因科技有限公司)。
Cas12a:核酸内切酶,在crRNA的引导下,具备切割靶片段和不加选择的切割ssDNA的活性(M0653T,New England Biolabs)。
NEBuffer2.1:协助Cas12a充分发挥酶切活性(New England Biolabs)。
crRNA-a:针对FecB位点A碱基序列,筛选出的非突变位点引入了单个碱基错配的与目的片段互补配对的RNA序列,引导Cas12a识别、切割靶DNA序列(由南京金斯瑞生物科技有限公司合成)。
crRNA-g:针对FecB位点G碱基序列,筛选出的非突变位点引入了单个碱基错配的与目的片段互补配对的RNA序列,引导Cas12a识别、切割靶DNA序列(由南京金斯瑞生物科技有限公司合成)。
ssDNA荧光探针:两端由荧光基团和淬灭基团修饰的短单链DNA,根据是否发光指示Cas12a-crRNA-靶序列的识别情况(由金唯智生物科技有限公司合成),序列为FAM-TTATT-BHQ1。
RNA酶抑制剂:抑制crRNA的降解(R8061,购自北京索莱宝科技有限公司)。
本发明的总体技术原理:Cas12a在工作时需要靶序列中存在PAM序列(富含T的序列),由于FecB突变位点附近没有TTTN(5′→3′)序列,故本研究在设计RPA扩增引物时引入单个错配碱基以形成Cas12a识别的PAM序列,通过RPA技术对含FecB突变位点片段进行扩增。针对FecB突变位点的两种碱基型(A/G),筛选出两条引入了单个错配碱基且信噪比最高的crRNA序列,将这两条crRNA分别加入到CRISPR部分的两体系中,利用CRISPR/Cas12a系统单碱基错配敏感性和Cas12a-靶dsDNA-ssDNA(荧光探针)复合体激活的反式切割ssDNA的特性,根据荧光探针的发光情况判定FecB分型结果,开发一种快速、精准、简便、现场即时检测FecB基因多态性的技术。
实施例1:鉴别绵羊FecB基因SNP基因型的方法
(1)利用红细胞裂解液去除绵羊血液样品中的红细胞
将300μL待鉴别绵羊(1号滩羊、2号滩羊、3号滩羊)全血和600μL红细胞裂解液加入至1.5mL离心管中,涡旋10s(7000rpm/min),离心1min(12000rpm/min),弃去上清,加入600μL红细胞裂解液,涡旋10s(7000rpm/min),离心1min(12000rpm/min),弃去上清;
(2)释放基因组DNA
在步骤1的产物中加入100μL核酸释放剂-LA,涡旋20s,95℃孵育5min,离心1min(12000rpm/min),得到基因组释放液;
(3)RPA扩增:
以步骤(2)的基因组释放液为模板,利用SEQ ID NO.3和SEQ ID NO.4所示RPA引物对进行扩增,得到RPA扩增产物。
体系:Reaction Buffer 10μL、Basic Buffer 5μL、激活剂1μL、10nM的上游引物1.25μL、10nM的下游引物1.25μL、基因组释放液3μL,RNase-free water补充至25μL。
程序:39℃孵育20min。
上游引物(SEQ ID NO.3):5′-GGCCAGCTGGTTCCGAGAGACAGAAAT TTATC-3′;
下游引物(SEQ ID NO.4):5′-CTAGGAAACCCTGAACATCGCTAATAC AGAC-3′;
(4)CRISPR检测
将步骤(3)的扩增产物加入CRISPR/Cas12a-WT体系和CRISPR/Cas12a-MT体系,39℃孵育10min;所述CRISPR/Cas12a-WT体系中的crRNA为crRNA-a,所述CRISPR/Cas12a-MT体系中的crRNA为crRNA-g;
crRNA-a(SEQ ID NO.1):5′-UAAUUUCUACUAAGUGUAGAUUCAGA CGAUGUUGAUGAGGCAU-3′;
crRNA-g(SEQ ID NO.2):5′-UAAUUUCUACUAAGUGUAGAUUCGGC CGGUGUUGAUGAGGCA-3′;
CRISPR/Cas12a-MT体系为:1μM的LbCas12a 2μL、10×NEBuffer2.1 2μL、25μM的ssDNA荧光探针1μL、40U/μL的RNA酶抑制剂0.1μL、1μM的crRNA-g2μL、RPA扩增产物2μL,RNase-free water补充至20μL;
CRISPR/Cas12a-WT体系为1μM的LbCas12a 0.25μL、10×NEBuffer2.1 2μL、25μM的ssDNA荧光探针1μL、40U/μL的RNA酶抑制剂0.1μL、1μM的crRNA-a0.25μL、RPA扩增产物2μL,RNase-free water补充至20μL。
程序:39℃孵育10min。
(5)判定
蓝光下肉眼观测结果,若CRISPR/Cas12a-WT体系和CRISPR/Cas12a-MT体系反应产物在蓝光照射下均有荧光亮度,则表示待鉴别绵羊FecB基因的基因型为AG;若CRISPR/Cas12a-WT体系反应产物在蓝光照射下有荧光亮度,而CRISPR/Cas12a-MT体系反应产物在蓝光照射下无荧光亮度,则表示待鉴别绵羊FecB基因的基因型为AA;若CRISPR/Cas12a-WT体系反应产物在蓝光照射下无荧光亮度,而CRISPR/Cas12a-MT体系反应产物在蓝光照射下有荧光亮度,则表示待鉴别绵羊FecB基因的基因型为GG。
结果:如图1所示,图1A-C中单数管添加crRNA-a,偶数管添加crRNA-g,肉眼观测的分型结表明1号滩羊、2号滩羊、3号滩羊FecB基因外显子第746位的基因型依次为AA、AG、GG,该结果与Sanger测序结果一致,表明本实施例的方法可以实现现场的速测。
实施例2:crRNA的筛选
针对FecB突变序列,在突变位点3’端的不同位置引入了单个碱基错配(表2);针对FecB野生型序列,参照crRNA-g1引入突变的位置附近设计了10条不同的单碱基错配的crRNA(表1),表中,加粗代表scafford序列,下划线代表spacer序列,双下划线代表突变位点序列,粗线代表错配碱基。
利用表1和表2所示crRNA对滩羊FecB基因SNP基因型进行鉴别。结果显示:crRNA-a2展现出了较高的信噪比(图2)。crRNA-g1对野生型信号的抑制作用较强(图3),推断可能在该序列引入错配碱基位置附近存在Cas12a较强的单碱基错配识别敏感性。因此,我们在crRNA-g1引入错配的位置及其±1nt的位置设计了引入不同碱基类型的单碱基错配的crRNA,crRNA-g11对野生型背景信号的抑制效果最佳,但突变型信号也有所降低。综合比较,crRNA-a2和crRNA-g11的组合效果最佳。
表1crRNA-a错配序列
表2crRNA-g错配序列
需要说明的是,本发明权利要求书中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,为了防止赘述,本发明描述了优选的实施例。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
