一种三菌耦合发酵合成乳酰-N-三糖Ⅱ的方法
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及发酵工程技术领域,尤其是指一种三菌耦合发酵合成乳酰-N-三糖Ⅱ的方法。
背景技术
母乳寡糖(human milk oligosaccharides,HMOs)是母乳中含量第三丰富的固体成分,在婴儿生长发育过程中有着积极的影响。乳酰-N-三糖Ⅱ(lacto-N-trioseⅡ,LNTⅡ)由N-乙酰氨基葡萄糖(N-acetylglucosamine,GlcNAc)和乳糖通过β-1,3-糖苷键连接而成,它是HMOs的核心结构单元。LNTⅡ不仅可以通过TLR途径激活NF-κB,即LNTⅡ在一定程度上显示出对免疫细胞的调控作用,还能与人的肠道上皮细胞发生作用,有效减少炎症的发生率。然而,天然母乳和牛乳中LNTⅡ的丰度极低,不能满足大规模合成母乳寡糖的需求,因此,LNTⅡ的廉价生产对多样化母乳寡糖的商业化生产具有重要意义。
目前LNTⅡ合成方法有化学法、酶催化法和微生物发酵法。尹晓娟利用化学法来以乳糖和GlcNAc为起始原料,采用“1+2”的策略获得LNTⅡ,收率为14%。由于化学法需要激活、保护和去保护等多个步骤,且收率低,导致化学法并不适合工业化生产LNTⅡ。BLIXT等鉴定出一种来自脑膜炎奈瑟球菌(Neisseria meningitidis)的β-1,3-N-乙酰氨基葡萄糖转移酶(LgtA),可以催化尿苷二磷酸乙酰氨基葡萄糖(UDP-GlcNAc)上的GlcNAc残基转移到乳糖受体生成LNTⅡ(Glycobiology,1999);LIU等从巴斯德毕赤酵母(Pichia pastoris)中异源表达并纯化出β-N-乙酰氨基己糖苷酶(HaHex74),该酶以N-乙酰壳二糖和乳糖作为底物在5L发酵罐中孵育168h后获得7.1g/L LNTⅡ(Bioorganic&Medicinal Chemistry,2016)。虽然酶催化法转化率高,但酶制剂制备冗长繁琐以及价格昂贵等缺点限制了其工业应用。
近年来,通过构建细胞工厂来生产LNTⅡ受到了极大的关注。DONG等构建了一株用于生产LNTⅡ和乳酰-N-新四糖(lacto-N-neotetraose,LNnT)的重组枯草芽孢杆菌,过表达关键前体UDP-GlcNAc和尿苷二磷酸半乳糖代谢途径中的相关基因,并利用木糖诱导的CRISPRi干扰系统调控竞争途径中靶基因沉默,经优化培养条件后,通过3L发酵罐分批补料发酵的培养方式同时产生LNTⅡ和LNnT的效价分别为2.64-2.98g/L和4.52-5.41g/L(Journal of Agricultural and Food Chemistry,2020)。此外,PRIEM等在E.coli JM109(pCWLgtA)(lacY
单一细胞工厂生产LNTⅡ的代谢途径复杂,且产物难以向胞外释放,将会导致反馈抑制,从而影响最终产量。因此,如何优化发酵生产体系组成与工艺以实现LNTⅡ的高效合成成为亟需解决的问题。
发明内容
为解决上述技术问题,本发明提供了一种三菌耦合发酵产乳酰-N-三糖Ⅱ的方法,利用含有N-乙酰氨基己糖1-位激酶基因nahK的E.coli JM109(DE3)/pET28a-nahK将GlcNAc和ATP一步转化成GlcNAc-1-P。然后构建含UDP-HexNAc焦磷酸化酶agx1的重组大肠杆菌。将自主构建的E.coli JM109(DE3)/pET28a-nahK和E.coli JM109(DE3)/pET28a-agx1与含有lgtA基因的E.coli JM109(DE3)/pET28a-lgtA耦合,建立三菌株耦合发酵合成LNTⅡ的生产体系,并对其体系进行优化,得到最佳发酵条件。
本发明的目的是提供一种三菌耦合发酵合成乳酰-N-三糖Ⅱ的方法,以乳糖和N-乙酰氨基葡萄糖为底物,利用三种以大肠杆菌为宿主的基因工程菌耦合发酵,基因工程菌包括:
表达N-乙酰氨基己糖1-位激酶NahK的第一基因工程菌;
表达UDP-HexNAc焦磷酸化酶AGX1的第二基因工程菌;
表达β-1,3-N-乙酰氨基葡萄糖转移酶LgtA的第三基因工程菌。
进一步地,乳糖在发酵体系中的浓度为80-140mmol/L。
优选地,乳糖的浓度为80mmol/L。
进一步地,N-乙酰氨基葡萄糖在发酵体系中的浓度为80-140mmol/L。
优选地,N-乙酰氨基葡萄糖的浓度为80mmol/L。
进一步地,上述第一、第二和第三基因工程菌在发酵体系中的比例为(1-2):(1-2):(1-2)。
进一步地,发酵体系中添加辅因子ATP和UTP。
进一步地,ATP在发酵体系中的浓度为40-60mmol/L。
优选地,ATP的浓度为50mmol/L。
进一步的,UTP在发酵体系中的浓度为60-90mmol/L。
优选地,UTP的浓度为60mmol/L。
进一步地,发酵体系中添加二价金属离子。
优选地,发酵体系中添加Mg
优选地,Mg
进一步地,发酵时间为12-28小时。
优选地,发酵时间为28小时。
进一步地,发酵温度为30-37℃。
优选地,发酵时间为30℃。
本发明的上述技术方案相比现有技术具有以下优点:
本研究通过自主构建的三株工程菌E.coli JM109(DE3)/pET 28a-nahK、E.coliJM109(DE3)/pET28a-agx1及E.coli JM109(DE3)/pET28a-lgtA耦合发酵,成功将廉价易得的底物GlcNAc和乳糖转化为具有高附加值的LNTⅡ。通过对合成体系进行层层递进式的优化,最终获得LNTⅡ的最大产量为3.03g/L,相较优化前提高了接近4倍。
附图说明
图1是三菌株耦合发酵合成LNTⅡ设计路线;
图2是实施例1中酶切产物电泳检测和重组酶NahK的SDS-PAGE分析;
图3是实施例2中E.coli JM109(DE3)/pET28a-nahK合成GlcNAc-1-P的TLC、HPLC检测,L1-ATP;L2-GlcNAc;L3-GlcNAc-1-P;L4-空白对照;L5-单菌合成GlcNAc-1-P产物。
图4是实施例2中不同因素对E.coli JM109(DE3)/pET28a-nahK合成GlcNAc-1-P的影响;
图5是实施例3中重组酶AGX1,AGX2,PmGlmU分别在E.coli JM109(DE3)中表达的SDS-PAGE分析;
图6是实施例4中UDP-HexNAc焦磷酸化酶催化合成UDP-GlcNAc的TLC、HPLC检测;
图7是实施例5中不同因素对E.coli JM109(DE3)/pET28a-nahK和E.coli JM109(DE3)/pET28a-agx1双菌耦合合成UDP-GlcNAc的影响;
图8是实施例6中酶切产物电泳检测和重组酶LgtA的SDS-PAGE分析;
图9是实施例7中三菌株耦合发酵合成LNTⅡ的TLC、HPLC、MALDI-TOF MS分析,L1-乳糖;L2-LNTⅡ;L3-空白对照;L4-单菌合成产物;L5-双菌耦合合成产物;L6-三菌株耦合发酵产物。
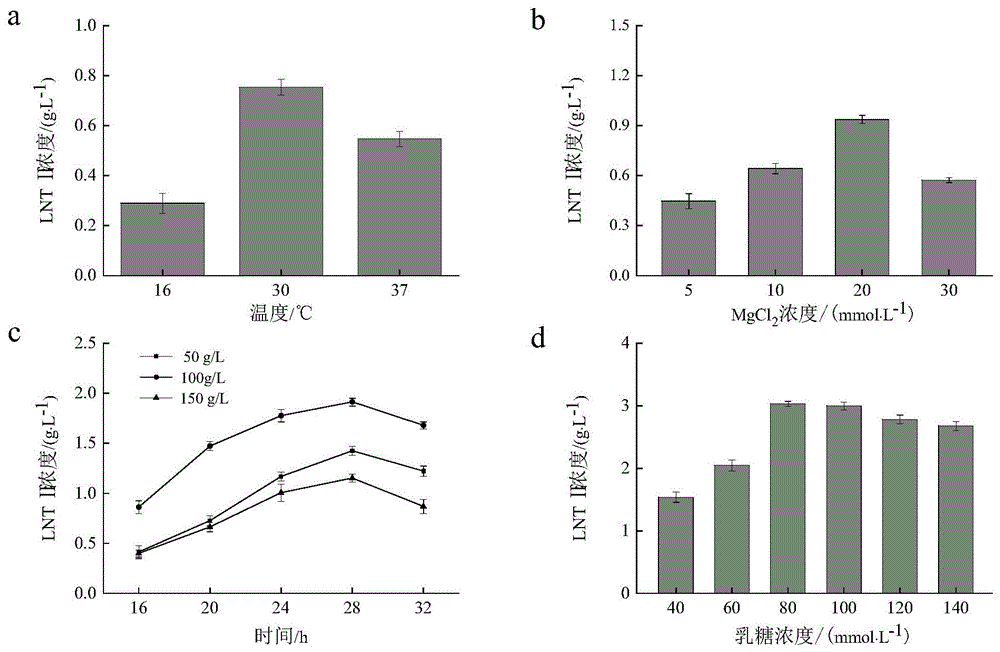
图10是实施例8中不同因素对E.coli JM109(DE3)/pET28a-lgtA合成LNTⅡ的影响。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
1.GlcNAc-1-P的分析检测
TLC(薄层层析)检测:参考COYNE等[11]方法。展开剂:V(正丁醇):V(乙酸):V(水)=2:1:1;显色剂:对茴香醛染色液。
HPLC(高效液相色谱)检测:Bio-Rad Aminex HPX-87H柱(300mm×7.8mm)有机酸离子层析柱,流动相5mmol/L H2SO4;流速0.6mL/min;柱温60℃;进样量10μL;紫外检测波长210nm。
2.UDP-GlcNAc的分析检测
TLC检测:与GlcNAc-1-P的检测方法相同,使用紫外分析仪照射显色。
HPLC检测:汉邦Lichrospher-5-C18色谱柱(250mm×4.6mm i.d.,5μm);流动相:甲醇-6‰(体积分数)磷酸水溶液(用三乙胺调节至pH 6.6)(体积比为3:97),流速0.6mL/min;检测波长261nm;柱温30℃;进样量10μL。
3.LNTⅡ的分析检测
TLC检测:与GlcNAc-1-P的检测方法相同。
HPLC检测:与GlcNAc-1-P的检测方法相同,示差检测器检测。
4.LNTⅡ的分离与鉴定
发酵液用HyperSep Hypercarb固相萃取小柱进行分离。收集的洗脱液用基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)在正离子模式下对产物的质荷比进行分析。
实施例1:工程菌E.coli JM109(DE3)/pET28a-nahK的构建及nahK的表达
以B.infantis ATCC 15697中nahK基因(GeneBank登录号:LR655210.1)序列为模板,设计引物nahKF(5'-ACCC
测序验证正确后,将重组质粒pET28a-nahK转化E.coli JM109(DE3)中。将工程菌株E.coli JM109(DE3)/pET28a-nahK接种至含Kan的10mL LB液体培养基中,37℃、200r/min摇瓶培养12h,再按2%的接种量转接到含Kan的200mL LB液体培养基中继续培养至OD600值约0.7,加入终浓度为0.2mmol/L的IPTG进行诱导,200r/min摇瓶培养20h,4℃、12 000r/min离心10min收集菌体。用Tris-HCl缓冲液(pH 7.2)重悬,超声破碎细胞后,4℃、8 000r/min离心20min,该上清液即为粗酶液。通过12% SDS-PAGE电泳检测目的蛋白的表达。SDS-PAGE电泳结果如图2所示,与对照组相比,诱导组在35-45kDa之间有明显的表达条带,nahK基因在重组菌株中成功表达。
实施例2:单菌合成GlcNAc-1-P体系的建立和优化
E.coli JM109(DE3)/pET28a-nahK以GlcNAc和ATP为底物,全细胞合成G1cNAc-1-P和ADP,2mL体系中包含60mmol/L GlcNAc、20mmol/L ATP、100mmol/L Tris、10mmol/LMgCl
为提高E.coli JM109(DE3)/pET28a-nahK催化合成GlcNAc-1-P的产量,主要对催化时间、ATP浓度、GlcNAc浓度这三个因素进行单因素催化条件优化,结果如图4所示。随着时间增加GlcNAc-1-P的产量也随之增加,直至20h达到最大值。在此条件下,继续对ATP添加量进行优化,结果如图4b所示,当发酵液中ATP终浓度低于50mmol/L时,GlcNAc-1-P的产量逐渐上升,在50mmol/L达到最高值为12.04g/L,但随着ATP浓度持续增加,GlcNAc-1-P的产量减少,原因可能是高浓度ATP对NahK的酶活性有一定抑制作用,故选取50mmol/L ATP较益。接着探究了不同GlcNAc浓度对GlcNAc-1-P合成的影响,结果如图4c所示,GlcNAc-1-P的产量随着GlcNAc浓度增加而增加,在80mmol/L达到最高值为16.88g/L,此时对GlcNAc摩尔转化率为70.12%,因此,选择80mmol/L GlcNAc效果最好。
实施例3:工程菌E.coli JM109(DE3)/pET28a-agx1,agx2,pmglmU的构建及表达
以分别来源于H.sapiens的agx1基因(Gene ID:6675)与agx2基因(GenBank登录号:AAH09377.1)、P.multocida来源的pmglmU基因(GenBank登录号:LR134514.1)序列为模板,设计相应引物(见表1)进行PCR,将纯化后的PCR产物与pET28a空质粒载体用限制性内切酶消化后连接,将连接产物转化E.coli JM109(DE3)。
表1用于克隆和表达的引物序列Table 1Primer sequences for cloning andexpression
采用实施例1的方法,分别将质粒上携带不同种属来源的编码UDP-HexNAc焦磷酸化酶基因的三株重组大肠杆菌进行诱导表达,SDS-PAGE电泳检测目的蛋白的表达。SDS-PAGE结果如图5所示,分别与其诱导前对比,这三种诱导20h的全细胞均具有明显的表达条带,三种编码UDP-HexNAc焦磷酸化酶的基因在重组大肠杆菌中均成功表达。
实施例4:不同种属来源的UDP-HexNAc焦磷酸化酶催化活性比较
为获得最适应本合成体系的UDP-HexNAc焦磷酸化酶,现对研究较多的三种不同种属来源的UDP-HexNAc焦磷酸化酶的催化能力做比较。1mL反应体系含100mmol/L Tris-HCl(pH 8.5),30mmol/L GlcNAc-1-P,30mmol/L UTP,10mmol/L MgCl
实施例5:双菌耦合合成UDP-GlcNAc体系的优化
为顺利实现双菌(E.coli JM109(DE3)/pET28a-nahK和E.coli JM109(DE3)/pET28a-agx1)耦合发酵高效合成UDP-GlcNAc,对耦合发酵条件也进行了研究。以实施例2优化的单菌合成GlcNAc-1-P体系为基础,分别探索了两种工程菌的生物量比例和底物UTP浓度对UDP-GlcNAc合成的影响,2mL体系中包含50mmol/L UTP、50mmol/L ATP、100mmol/LGlcNAc、100mmol/L Tris、30mmol/L MgCl
实施例6:工程菌E.coli JM109(DE3)/pET28a-lgtA的构建及LgtA的表达
以N.meningitidis中lgtA基因(GeneBank登录号:AAC44084.1)序列为模板,设计引物lgtAF(5’-CATG
将自主构建的重组质粒pET28a-lgtA双酶切验证(见图8a)。送样测序验证正确后,将重组质粒pET28a-lgtA转化到E.coli JM109(DE3)中。采用实施例1的方法检测蛋白表达,低温诱导表达结束后其SDS-PAGE电泳结果如图8b所示。与对照组相比,诱导组在35-45kDa之间有明显的表达条带,lgtA基因在重组菌株中成功表达。
实施例7:三菌株耦合发酵合成LNTⅡ体系的建立
为确保顺利建立三菌株耦合发酵合成LNTⅡ体系,目前采用“单菌合成LNTⅡ—双菌耦合合成LNTⅡ—三菌耦合发酵合成LNTⅡ”的递进思路进行。分别以单菌合成和双菌耦合的形式对合成LNTⅡ的条件进行实验。
单菌合成LNTⅡ的条件为2mL体系中包含1mL UDP-GlcNAc溶液、60mmol/L乳糖、100mmol/L Tris、10mmol/L MgCl2、10mL/L甘油、4g/L十八胺聚氧乙烯醚、4g/L乙醇和50g/LE.coli JM109(DE3)/pET28a-lgtA,30℃,200r/min,24h。双菌耦合合成LNTⅡ的条件为2mL体系包含1mLGlcNAc-1-P溶液、60mmol/L乳糖、60mmol/L UTP、10mmol/L MgCl2、10mL/L甘油、4g/L十八胺聚氧乙烯醚、4g/L乙醇、50g/L E.coli JM109(DE3)/pET28a-agx1和50g/LE.coli JM109(DE3)/pET28a-lgtA,30℃,200r/min,24h。
结果如图9a所示,以UDP-GlcNAc和乳糖为底物,在菌浓为100g/L E.coli JM109(DE3)/pET28a-lgtA的条件下,其单细胞发酵液(L4)中存在与标准品LNTⅡRf值相同的物质,表明利用单菌可以合成LNTⅡ;以GlcNAc-1-P、UTP以及乳糖为底物,在菌浓均为100g/LE.coli JM109(DE3)/pET28a-agx1和E.coli JM109(DE3)/pET28a-lgtA存在的条件下,其双菌耦合发酵液(L5)中具有与LNTⅡRf值一致的化合物,表明双菌耦合可以成功合成出LNTⅡ。
用廉价的GlcNAc(替代价格昂贵的GlcNAc-1-P/UDP-GlcNAc)作为起始底物,添加辅因子ATP和UTP,在实施例5已优化的双菌耦合合成UDP-GlcNAc体系基础上,探索建立三菌耦合发酵合成LNTⅡ体系的可行性,结果如图9a所示。发酵液(L6)中存在与LNTⅡRf值一致的化合物。将该发酵液分离纯化后,采用HPLC和MALDI-TOF MS进一步分析检测,发酵液中存在与标准品LNTⅡ保留时间相同的峰(见图9d),LNTⅡ浓度为0.75g/L,且在质荷比m/z568.093位置出现目标离子峰(见图9e),即为LNTⅡ(Mr 545),表明“三菌株耦合发酵体系”成功实现了LNTⅡ的合成。
实施例8:三菌株耦合发酵合成LNTⅡ体系的优化
初步的三菌株耦合发酵检测结果发现LNTⅡ的产量较低。为进一步提高产量,分别从反应温度、Mg
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
