一种利用谷氨酸棒杆菌生产新型染料谷蓝的方法及其应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及一种利用谷氨酸棒杆菌生产新型染料谷蓝的方法及其应用,属于生物工程领域。
背景技术
新型天然蓝色染料谷蓝(CAS号为2435-59-8)是一种来自细菌的天然色素,其分子式为C
天然色素具有安全、营养、保健等优点,而人工合成的谷蓝通过使用一种名为苯胺的有毒化合物化学合成来满足市场需求,对人体危害较大。为寻求更加环保温和的靛蓝合成方式,生物合成成为研究热点。基于代谢工程的天然色素的过量生产可以为这一不可持续的化学生产织物染料的问题提供解决方案。
在天然色素中,谷蓝是一种由单一模块类型的非核糖体多肽合成酶(NRPS)编码的天然蓝色颜料。其强烈深蓝色使其成为一种有吸引力的替代织物染料。此外,谷蓝有一个简单的生物合成途径,涉及L-谷氨酰胺的两个摩尔分子的缩合,转化L-谷氨酰胺合成谷蓝。此外,谷蓝合成酶需要一个磷酸泛酰巯基乙胺基转移酶(PPTase)将辅酶A上的4’-磷酸泛酰巯基乙胺转移到巯基化结构域保守的丝氨酸残基上使之活化。
目前已在多种细菌菌株中发现编码谷蓝合成酶的基因,包括Erwiniachrysanthemi、Streptomyces aureofaciens CCM 3239,Streptomyces chromofuscusATCC 49982和Streptomyces lavendulae.已有几项研究报道了利用异源宿主(包括大肠杆菌、酿酒酵母和恶臭假单胞菌)生产谷蓝的研究。由于谷蓝是通过两个L-谷氨酰胺残基的缩合生物合成的,因此谷氨酸棒杆菌被认为是理想的生产宿主,因为它能够大量合成L-谷氨酰胺以及其前体L-谷氨酸。此外,其他异源生产宿主,如大肠杆菌、酿酒酵母等需要额外表达PPTase来产生谷蓝。谷氨酸棒杆菌具有天然的ppta
发明内容
为解决上述技术问题,本发明提供一种生产新型天然蓝色染料谷蓝的重组谷氨酸棒杆菌及其构建方法。
本发明的第一个目的是提供一种高产谷蓝的谷氨酸棒杆菌底盘细胞,谷氨酸棒杆菌C.glutamicum ATCC13032、C.glutamicum N01(所述谷氨酸棒杆菌N01保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO:M 2021931)、C.glutamicum E01(记载于CN103215198B的中国发明专利文本中)。进一步地,所述谷氨酸棒杆菌底盘细胞N01以及E01分别是L-谷氨酰胺和L-谷氨酸的高产菌株,以这两种菌株作为谷蓝的生产菌株,不需要额外添加L-谷氨酰胺或L-谷氨酸作为底物,其生产谷蓝能力远超过大肠杆菌及野生谷氨酸棒杆菌。
本发明提供了一种重组谷氨酸棒杆菌,所述重组谷氨酸棒杆菌是以谷氨酸棒杆菌(C.glutamicum)N01或谷氨酸棒杆菌E01为宿主细胞,表达了来源于Streptomyceschromofuscus ATCC 49982的天然蓝色素合成酶。
在本发明的一种实施方式中,所述天然蓝色素合成酶的氨基酸序列如SEQ IDNO.4所示。
在本发明的一种实施方式中,编码所述天然蓝色素合成酶的核苷酸序列如SEQ IDNO.1所示。
在本发明的一种实施方式中,采用pECXK-99E为表达载体。
在本发明的一种实施方式中,所述天蓝蓝色素合成酶基因与载体之间添加RBS序列;所述RBS序列为5’-AAAGGAGGACAACC-3’。
本发明还提供了一种提高谷氨酸棒杆菌合成谷蓝的产量的方法,所述方法为,以谷氨酸棒杆菌(C.glutamicum)N01或谷氨酸棒杆菌E01为宿主细胞,表达了来源于Streptomyces chromofuscus ATCC 49982的天然蓝色素合成酶。
在本发明的一种实施方式中,所述天然蓝色素合成酶的氨基酸序列如SEQ IDNO.4所示。
在本发明的一种实施方式中,编码所述天然蓝色素合成酶的核苷酸序列如SEQ IDNO.1所示。
在本发明的一种实施方式中,采用pECXK-99E为表达载体。
在本发明的一种实施方式中,所述天蓝蓝色素合成酶基因与载体之间添加RBS序列;所述RBS序列为5’-AAAGGAGGACAACC-3’。
本发明提供了一种生产谷蓝的方法,所述方法为,采用上述重组谷氨酸棒杆菌发酵制备得到谷蓝。
在本发明的一种实施方式中,所述方法为,将上述任一重组谷氨酸棒杆菌的种子液接种至发酵培养基中,在温度为25~30℃,转速为180~220rpm,发酵培养至菌体生长OD600达到0.6-0.8时,加入IPTG,在温度为25~30℃,设置不同转速180~220rpm条件下诱导发酵60h。
在本发明的一种实施方式中,所述种子液的制备方法为:从保存有重组菌株谷氨酸棒杆菌的固体培养基上挑取单菌落至10mL含有50μg/mL卡那霉素的BHI液体培养基当中,30℃,180rpm培养24h,即得到种子液。
在本发明的一种实施方式中,将所述种子液按照1%~2%的接种量接种至发酵培养基中。
在本发明的一种实施方式中,所述发酵培养基包含:120g/L葡萄糖、40g/L(NH
在本发明的一种实施方式中,将种子培养液按1%(v/v)接种量接种到发酵培养基中,温度为25℃,转速为180rpm,发酵培养至菌体生长OD600达到0.6-0.8时,加入0.5mMIPTG,在温度为25℃,设置不同转速220rpm条件下诱导发酵60h。
本发明提供一种表达所述天然蓝色素合成酶基因的重组菌构建方法。
在本发明的一种实施方式中,所述方法为,所述重组菌以谷氨酸棒杆菌为宿主,以pEC-XK99E为表达载体。
在本发明的一种实施方式中,所述方法为,所述表达载体电转入C.glutamicumATCC13032、高产L-谷氨酰胺和L-谷氨酸的谷氨酸棒杆菌N01和E01中,构建重组谷氨酸棒杆菌。
本发明还提供利用所述重组谷氨酸棒杆菌发酵生产谷蓝染料的方法,所述方法是以L谷氨酸或L-谷氨酰胺为底物催化合成谷蓝染料。
本发明还提供了采用上述重组谷氨酸棒杆菌或上述方法在制备谷蓝或者含有谷蓝的产品中的应用。
有益效果
(1)本发明从Streptomyces aureofaciens CCM 3239、Erwinia chrysanthemi、Streptomyces chromofuscus ATCC 49982克隆了合成谷蓝所需的天然蓝色素合成酶基因bpsA、IndC、Sc-IndC。通过将基因克隆在谷氨酸棒杆菌中异源表达,得到的重组谷氨酸棒杆菌能以L-谷氨酰胺为直接底物合成谷蓝。
(2)本发明通过RBS工程优化天然蓝色素合成酶基因bpsA、IndC、Sc-IndC表达水平,优化后的RBS与启动子结合更强成功提高了基因表达水。同时优化了谷蓝发酵条件,确定了其在添加0.5mM IPTG时最佳诱导温度和转速分别为,25℃和220rpm。
(3)本发明中谷氨酸棒杆菌N01是L-谷氨酰胺的高产菌株,以它作为谷蓝的新型生产菌株,不需要额外添加谷氨酰胺作为底物,在生产上其潜能大大超过大肠杆菌及野生谷氨酸棒杆菌。并且由于该色素是一种来源于谷氨酸棒杆菌的天然色素,在生产过程中无污染,且对人体无毒害,因此在未来的研究中,可以将该色素用作工业染料甚至是食品添加色素。通过谷氨酸棒杆菌C.glutamicum N01-Sc-IndC发酵生产谷蓝,在诱导温度25℃,IPTG为0.5mM时,5L发酵罐发酵60h产量可到达52.48g/L;C.glutamicum N01/pECXK-99E-R4-Sc-IndC发酵60h谷蓝产量最终可达到74.16±0.41g/L。
附图说明
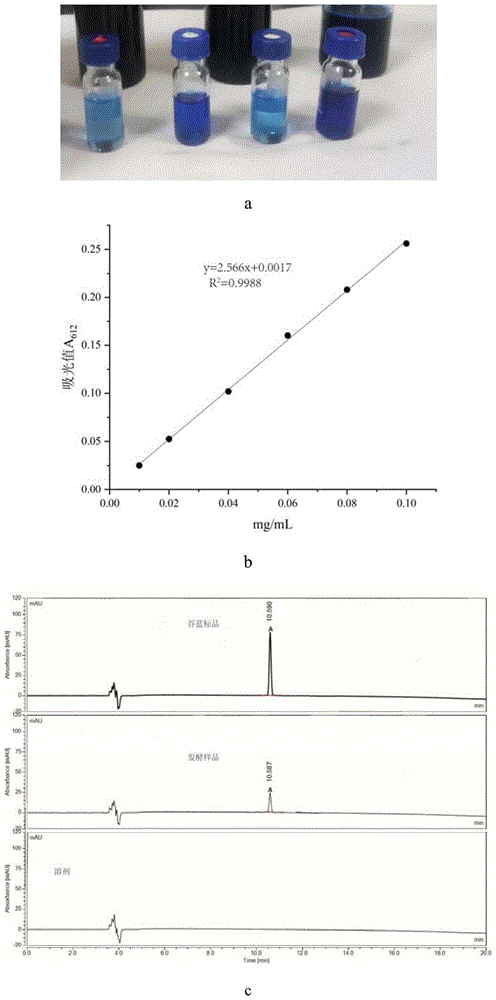
图1:a、谷蓝标品样品;b、谷蓝标品的OD
图2:a、重组谷氨酸棒杆菌发酵60h的谷蓝产量;b、重组谷氨酸棒杆菌在不同温度和转速条件下发酵60h的谷蓝产量。
图3:a、C.glutamicum N01/pECXK-99E-Sc-IndC 5L发酵罐数据图;b、C.glutamicum N01/pECXK-99E-R4-Sc-IndC 5L发酵罐数据图。
图4:Sc-IndC蛋白、bpsA蛋白、IndCdan蛋白的表达。
图5:替换为RBS4后,Sc-IndC、bpsA、IndC的表达水平。
具体实施方式
下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
下述实施例中所涉及的谷氨酸棒杆菌N01(C.glutamicum N01)记载于公开号为CN113684165B的中国发明专利文本中,保藏编号为CCTCC NO:M 2021931;下述实施例中所涉及的谷氨酸棒杆菌E01(C.glutamicum E01)记载于CN 103215198 B的中国发明专利文本中。
下述实施例中所涉及的培养基:
(1)LB培养基(1L):10g NaCl、10g胰蛋白胨、5g酵母提取物。
(2)BHI培养基及BHI固体培养基(g/L):脑心浸出液BHI 38.5
(3)谷氨酸棒杆菌感受态培养基(g/L):葡萄糖0.7,蛋白胨1,酵母提取物0.5,NaCl1,甘氨酸3;吐温-80 100μL/L
(4)种子培养基(/L):30g葡萄糖、6g尿素、30mL玉米糖浆、0.5g K
(5)发酵培养基(/L):120g葡萄糖、40g(NH
下述实施例中所涉及的谷蓝的提取与分析如下:
为提取谷蓝色素,将1ml发酵液放入1.5ml的离心管中,在21000g的条件下离心10min。去掉上清液,用1毫升甲醇清洗颗粒三次,以去除细胞中的其他代谢物。用21000g离心10min,收集粗蓝色素,真空干燥,超声溶解于1ml二甲基亚砜(DMSO)中。通过离心法(850g,5min)去除DMSO不溶组分和细胞碎片,即可得到纯的谷蓝色素。采用Agilent 1260高效液相色谱法(C18,5μm,4.6×150mm色谱柱)对谷蓝色素进行分析,以10~90%甲醇水溶液为线性梯度洗脱,流速为1ml/min,洗脱时间为50min(图1)。
下述实施例中所涉及的制作谷蓝的标准曲线的方法如下:
取1mg纯化的谷蓝溶于1mL的二甲基亚砜(DMSO)当中,配成浓度为1mg/mL的indigoidine溶液。将此标准溶液连续稀释成不同浓度:0.02mg/mL、0.04mg/mL、0.06mg/mL、0.08mg/mL、0.10mg/mL。采用分光光度计于612nm波长下检测分别检测上述5种不同浓度标准溶液的的吸光度。以谷蓝的浓度为横坐标,吸光度为纵坐标,线性拟合得到indigoidine的标准曲线。菌体中indigoidine的标准曲线R
实施例1:重组谷氨酸棒杆菌菌株的构建
具体步骤如下:
(1)大肠杆菌BL21感受态的制备
制备大肠杆菌化转感受态细胞,采用TakaRa公司的感受态细胞制备试剂盒Competent Cell Preparation Kit,详细操作参照说明书。
(2)表达质粒pECXK-99E-Sc-IndC的构建
天然蓝色素合成酶Sc-IndC(核苷酸序列见SEQ ID NO.1)经密码子优化序列后,由苏州金唯智生物科技有限公司合成,连接至pET-28a载体上后,获得质粒pET-28a-Sc-IndC。
以质粒pET-28a-Sc-IndC为模板,以引物P1/P2扩增得到Sc-IndC片段,所得的基因片段经纯化后,与线性化质粒pECXK-99E(P3/P4扩增)通过同源重组酶连接,转入E.coliBL21(DE3)感受态细胞,得到转化子。
将转化子涂布于含有浓度为50μg/mL的卡那霉素的LB固体培养基中,37℃培养12h,挑取阳性菌落,以P5/P6为引物通过Taq DNA聚合酶对单菌落进行菌落PCR验证;带有目的条带大小的阳性单菌落接种于含有LB液体培养基的小瓶中培养12h后,提质粒,送金唯智公司测序。测序正确,则E.coli BL21/pECXK-99E-Sc-IndC构建成功。
(3)具体实施方式同步骤(1)~(2),区别在于,调整天然蓝色素合成酶Sc-IndC分别为:来源于Streptomyces aureofaciens CCM 3239的bpsA(序列如SEQ ID NO.2所示)、来源于Erwinia chrysanthemi的IndC(序列如SEQ ID NO.3所示);成功构建了E.coli BL21/pECXK-99E-bpsA以及E.coli BL21/pECXK-99E-IndC。
所涉及的引物序列如下:
P1:5’-ggaaacagaccatggaattcaaaggaggacaaccatgagcgtagagaccatccc-3’;
P2:5’-aggtcgactctagaggatcctcagtagttgggcgtcttgc-3’;
P3:5’-gaattccatggtctgtttcctgtg-3’;
P4:5’-ggatcctctagagtcgacctgc-3’;
P5:5’-ctggcaaatattctgaaatgagctg-3’;
P6:5’-ttgatgcctggcagttccct-3’。
(4)SDS-PAGE分析蛋白质表达
分别将上述重组大肠杆菌(E.coli BL21/pECXK-99E-Sc-IndC、E.coli BL21/pECXK-99E-bpsA以及E.coli BL21/pECXK-99E-IndC)在添加50μg/mL的卡那霉素的10ml LB中过夜生长,转接100ml的LB培养基,生长至OD
(5)表达质粒pECXK-99E-Sc-IndC、pECXK-99E-bpsA、pECXK-99E-IndC电转入谷氨酸棒杆菌。
将C.glutamicum ATCC13032、C.glutamicum E01以及C.glutamicum N01在无抗的BHI平板上进行划线,于30℃培养箱放置培养后挑取菌落接种于10mL的含有BHI培养基的小瓶中培养12h,1%(v/v)接种量转接至50mL的感受态培养基瓶中,当菌体浓度达至0.4-0.6时,准备谷氨酸棒杆菌感受态的制备。提前进行相关试剂及仪器的预冷处理,准备无菌10%甘油、1.5mL EP管以及50mL的离心管放置于冰上,离心机控温至4℃。将50mL的菌液在无菌操作台进行分装,离心(8000r·min
分别制备得到重组菌:C.glutamicum ATCC13032/pECXK-99E-Sc-IndC、C.glutamicum E01/pECXK-99E-Sc-IndC、C.glutamicum N01/pECXK-99E-Sc-IndCC.glutamicum ATCC13032/pECXK-99E-bpsA、C.glutamicum E01/pECXK-99E-bpsA、C.glutamicum N01/pECXK-99E-bpsA、C.glutamicum ATCC13032/pECXK-99E-IndC、C.glutamicum E01/pECXK-99E-IndC、C.glutamicum N01/pECXK-99E-IndC。
(6)RBS工程优化基因表达水平
设计4条不同强度的RBS序列(RBS1-RBS4;序列分别为:5’-GAAAGGAGAGGATTGC-3’、5’-AGAAGGAGGGTTATTAG-3’、5’-GGAAGGAGAGTAAAC-3’、5’-AGGAGGAGGGTTATTAG-3’),初始RBS序列RBS0(5’-AAAGGAGGACAACC-3’)为本实验前期筛选获得的较强RBS。
构建含不同RBS序列的重组质粒pECXK-99E-Rn-egfp(具体步骤同(1)~(5),区别在于调整目的基因为NCBI编号为:72203egfp,同时采用RBS1-RBS4替换基因前原始的RBS0),测序正确后分别电转入C.glutamicum N01中,构建一系列重组菌C.glutamicumN01-RBS(分别制备得到:C.glutamicum N01/pECXK-99E-R1-egfp、C.glutamicum N01/pECXK-99E-R2-egfp、C.glutamicum N01/pECXK-99E-R3-egfp、C.glutamicum N01/pECXK-99E-R4-egfp)。
测定不同RBS的荧光强度:
分别将上述重组菌株在30℃条件下,培养到OD600为0.6-0.8,添加0.5mM IPTG,培养24h后,检测培养液的荧光强度。
结果显示:C.glutamicum N01/pECXK-99E-R1-egfp、C.glutamicum N01/pECXK-99E-R2-egfp、C.glutamicum N01/pECXK-99E-R3-egfp、C.glutamicum N01/pECXK-99E-R4-egfp菌株发酵后的荧光强度分别为:15450±125、10520±110、18245±115、21100±125。
可见,采用RBS-3和RBS-4的菌株发酵后的荧光强度高于原始RBS0,分别较RBS0提高了0.56和0.82倍。
因此,将基因前的RBS0替换为RBS-4(5’-AGGAGGAGGGTTATTAG-3’);按照上述方法分别构建得到重组质粒pECXK-99E-R4-Sc-IndC、pECXK-99E-R4-bpsA、pECXK-99E-R4-IndC,分别点转入C.glutamicum ATCC13032、C.glutamicum E01以及C.glutamicum N01。
结果显示:SDS-PAGE分析E.coli BL21/pECXK-99E-R4-Sc-IndC、E.coli BL21/pECXK-99E-R4-bpsA以及E.coli BL21/pECXK-99E-R4-IndC蛋白表达情况,相较于RBS0替换为RBS4后,Sc-IndC、bpsA、IndC的表达水平都有了一定的提高(图5)。
所涉及的引物序列如下:
P7:5’-gaattccatggtctgtttcctgtgt-3’;
P8:5’-acacaggaaacagaccatggaattcGAAAGGAGAGGATTGC-3’;
P9:5’-acacaggaaacagaccatggaattcAGAAGGAGGGTTATTAG-3’;
P10:5’-acacaggaaacagaccatggaattcGGAAGGAGAGTAAAC-3’
P11:5’-acacaggaaacagaccatggaattcAGGAGGAGGGTTATTAG-3’。
实施例2:重组谷氨酸棒杆菌摇瓶发酵生产谷蓝
具体步骤如下:
(1)分别从保存有重组菌株谷氨酸棒杆菌C.glutamicum ATCC13032/pECXK-99E-Sc-IndC,C.glutamicum E01/pECXK-99E-Sc-IndC、C.glutamicum N01/pECXK-99E-Sc-IndC、C.glutamicum ATCC13032/pECXK-99E-bpsA、C.glutamicum E01/pECXK-99E-bpsA、C.glutamicum N01/pECXK-99E-bpsA、C.glutamicum ATCC13032/pECXK-99E-IndC、C.glutamicum E01/pECXK-99E-IndC、C.glutamicum N01/pECXK-99E-IndC的固体培养基上挑取单菌落至5mL含有50μg/mL卡那霉素的BHI液体培养基当中,30℃,180rpm培养16h,即得到重组菌的种子培养液。
(2)将种子培养液按1%(v/v)接种量接种到发酵培养基中,温度为30℃,转速为180rpm,发酵培养至菌体生长OD600达到0.6-0.8时,加入0.5mM IPTG,30℃继续诱导发酵60h。
表1:不同菌株的谷蓝的产量
结果显示:Sc-IndC的发酵效果较好,25℃摇瓶发60h,C.glutamicum ATCC13032/pECXK-99E-Sc-IndC的谷蓝产量为1.17±0.05g/L,C.glutamicum E01/pECXK-99E-Sc-IndC为4.95±0.02g/L,C.glutamicum N01/pECXK-99E-Sc-IndC的谷蓝色素产量最高达到11.68±0.08g/L;
因此,C.glutamicum N01/pECXK-99E-Sc-IndC的谷蓝生产潜力最大。
(2)分别从保存有重组菌株谷氨酸棒杆菌C.glutamicum ATCC13032/pECXK-99E-R4-Sc-IndC,C.glutamicum E01/pECXK-99E-R4-Sc-IndC、C.glutamicum N01/pECXK-99E-R4-Sc-IndC、C.glutamicum ATCC13032/pECXK-99E-R4-bpsA、C.glutamicum E01/pECXK-99E-R4-bpsA、C.glutamicum N01/pECXK-99E-R4-bpsA、C.glutamicum ATCC13032/pECXK-99E-R4-IndC、C.glutamicum E01/pECXK-99E-R4-IndC、C.glutamicum N01/pECXK-99E-IndC的固体培养基上挑取单菌落至5mL含有50μg/mL卡那霉素的BHI液体培养基当中,30℃,180rpm培养16h,即得到重组菌的种子培养液。
(2)将种子培养液按1%(v/v)接种量接种到发酵培养基中,温度为30℃,转速为180rpm,发酵培养至菌体生长OD600达到0.6-0.8时,加入0.5mM IPTG,30℃继续诱导发酵60h。
表2:不同菌株的谷蓝的产量
结果显示:Sc-IndC的发酵效果较好,25℃摇瓶发60h,C.glutamicum ATCC13032/pECXK-99E-R4-Sc-IndC的谷蓝产量为1.46±0.08g/L,C.glutamicum E01/pECXK-99E-R4-Sc-IndC为8.65±0.05g/L,C.glutamicum N01/pECXK-99E-R4-Sc-IndC的谷蓝色素产量最高达到16.68±0.08g/L;
实施例3:重组谷氨酸棒杆菌摇瓶发酵在不同诱导温度条件下生产谷蓝
具体步骤如下:
(1)从保存有重组菌株谷氨酸棒杆菌C.glutamicum ATCC13032/pECXK-99E-R4-Sc-IndC,C.glutamicum E01/pECXK-99E-R4-Sc-IndC、C.glutamicum N01/pECXK-99E-R4-Sc-IndC的固体培养基上挑取单菌落至5mL含有50μg/mL卡那霉素的BHI液体培养基当中,30℃,180rpm培养16h,即得到重组菌的种子培养液。
(2)将种子培养液按1%(v/v)接种量接种到发酵培养基中,温度为30℃,转速为180rpm,发酵培养至菌体生长OD600达到0.6-0.8时,加入0.5mM IPTG,分别在18℃、25℃、30℃条件下,继续诱导发酵60h(图2)。
表3:不同温度条件下的谷蓝的产量
结果显示:25℃诱导发酵60h,C.glutamicumATCC13032/pECXK-99E-R4-Sc-IndC谷蓝产量为1.97±0.05g/L,C.glutamicum E01/pECXK-99E-R4-Sc-IndC为6.95±0.02g/L,C.glutamicum N01/pECXK-99E-R4-Sc-IndC的谷蓝色素产量最高达到19.85±0.25g/L。
实施例4:重组谷氨酸棒杆菌摇瓶发酵不同转速条件下生产谷蓝
具体步骤如下:
(1)从保存有重组菌株谷氨酸棒杆菌C.glutamicum ATCC13032/pECXK-99E-R4-Sc-IndC,C.glutamicum E01/pECXK-99E-R4-Sc-IndC、C.glutamicum N01/pECXK-99E-R4-Sc-IndC的固体培养基上挑取单菌落至5mL含有50μg/mL卡那霉素的BHI液体培养基当中,30℃,180rpm培养16h,即得到重组菌的种子培养液。
(2)将种子培养液按1%(v/v)接种量接种到发酵培养基中,温度为25℃,转速为180rpm,发酵培养至菌体生长OD600达到0.6-0.8时,加入0.5mM IPTG,在温度为25℃,设置不同转速180rpm、200rpm、220rpm条件下诱导发酵60h(图2)。
表4:不同转速条件下的谷蓝的产量
结果显示:当转速为220rpm时,25℃诱导发酵60h,C.glutamicumATCC13032/pECXK-99E-R4-Sc-IndC谷蓝产量为2.51±0.05g/L,C.glutamicum E01/pECXK-99E-R4-Sc-IndC为5.91±0.11g/L,C.glutamicum N01/pECXK-99E-R4-Sc-IndC的谷蓝产量最高达到28.85±0.21g/L。
实施例5:重组谷氨酸棒杆菌5L发酵罐生产谷蓝
选择发酵效果最好谷蓝产量最高的C.glutamicum N01/pECXK-99E-Sc-IndC菌株进行5L发酵罐发酵(图3),具体步骤如下:
(1)从保存有重组菌株谷氨酸棒杆菌C.glutamicum N01/pECXK-99E-Sc-IndC、C.glutamicum N01/pECXK-99E-R4-Sc-IndC的固体培养基上挑取单菌落至5mL含有50μg/mL卡那霉素的BHI液体培养基当中,30℃,180rpm培养16h,即得到重组菌的一级种子液;
(2)二级种子液的制备:通过转接20mL一级种子液至1L摇瓶(含有180mL种子培养基)中继续培养12h制备得到。
(3)将全部二级种子液接种到含有1.4L发酵培养基的5L发酵罐中,加入质量分数为80%葡萄糖溶液使发酵初始总体积为2L,在30℃条件下进行培养24h后,加入终浓度为0.5mM的IPTG,在25℃诱导酶的表达,搅拌速度设置为600r·min
结果显示:C.glutamicum N01/pECXK-99E-Sc-IndC发酵60h谷蓝产量最终可达到52.96±0.53g/L。C.glutamicum N01/pECXK-99E-R4-Sc-IndC发酵60h谷蓝产量最终可达到74.16±0.41g/L。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
