包含转谷氨酰胺酶的酶剂及其用途
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及以转谷氨酰胺酶为有效成分的酶剂(转谷氨酰胺酶剂)及其用途。
背景技术
转谷氨酰胺酶(也称为TG)是催化肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的酶,蛋白质中的赖氨酸残基的ε-氨基作为酰基受体发挥作用时,使蛋白质分子的分子内或分子间形成ε-(γ-Gln)-Lys交联键。
转谷氨酰胺酶在加工蛋白质的用途中进行了各种用途开发,但实用化的酶很少。在食品用途中使用的酶大多数为链霉菌属(Streptomyces)来源或其近缘种来源,除此以外,还已知有芽孢杆菌属(Bacillus)来源的转谷氨酰胺酶。专利文献1中公开了一种链霉菌属来源转谷氨酰胺酶,专利文献2中公开了一种白色库茨涅尔氏菌(Kutzneria albida)来源转谷氨酰胺酶。
现有技术文献
专利文献
专利文献1:日本特开平4-108381号公报
专利文献2:日本特开2020-195397号公报
发明内容
将转谷氨酰胺酶用于食用肉类、水产加工用途的情况下,需要在低温下反应,但现有的转谷氨酰胺酶在低温下的反应性并不充分。本发明所要解决的课题在于提供含有低温下的反应性高的转谷氨酰胺酶的酶剂及其用途。
本发明人等这次新发现了一种吐鲁番长丝菌(Longimycelium tulufanense)来源的新型转谷氨酰胺酶,并确定了其氨基酸序列。本发明的新型转谷氨酰胺酶的氨基酸序列与专利文献1中记载的链霉菌属来源转谷氨酰胺酶的氨基酸序列的序列同源性为29%。另外,本发明的新型转谷氨酰胺酶的氨基酸序列与专利文献2中记载的白色库茨涅尔氏菌来源转谷氨酰胺酶的氨基酸序列的序列同源性为65%。此外,本发明人等对上述确定的新型转谷氨酰胺酶的反应性进行了测定,结果发现在低温下的反应性较高。本发明是基于上述见解而完成的。
根据本发明,提供以下发明。
<1>一种酶剂,含有由与序列号1的氨基酸序列具有90%以上的序列同源性的氨基酸序列构成的转谷氨酰胺酶作为有效成分。
<2>根据<1>所述的酶剂,其中,转谷氨酰胺酶为长丝菌属来源。
<3>一种酶剂,以转谷氨酰胺酶为有效成分,所述转谷氨酰胺酶为长丝菌属来源,利用SDS-PAGE测定的分子量为28~30kDa,20℃时的酶活性为50℃时的酶活性的20%以上。
<4>根据<3>所述的酶剂,其中,最佳pH为pH6.5~7.5。
<5>根据<3>或<4>所述的酶剂,其中,在50℃下进行40分钟热处理后的酶活性为热处理前的酶活性的60%以上。
<6>根据<3>~<5>中任一项所述的酶剂,其中,pH4时的酶活性为pH8时的酶活性的50%以上。
<7>一种蛋白质或肽的改性方法,包括如下步骤:使<1>~<6>中任一项所述的酶剂作用于底物。
<8>一种食品的制造方法,包括如下步骤:使<1>~<6>中任一项所述的酶剂作用于食品。
<9>一种食品,是用<1>~<6>中任一项所述的酶剂处理所得的。
<10>一种转谷氨酰胺酶的制造方法,所述转谷氨酰胺酶由与序列号1的氨基酸序列具有90%以上的序列同源性的氨基酸序列构成,所述制造方法包括培养长丝菌属细菌的工序。
<11>一种转谷氨酰胺酶的制造方法,包括培养吐鲁番长丝菌NBRC107726株的工序。
本发明的含有转谷氨酰胺酶的酶剂在低温下的反应性高,适用于食品、医疗用途的领域。
附图说明
图1示出确认吐鲁番长丝菌来源转谷氨酰胺酶的分子量的结果。
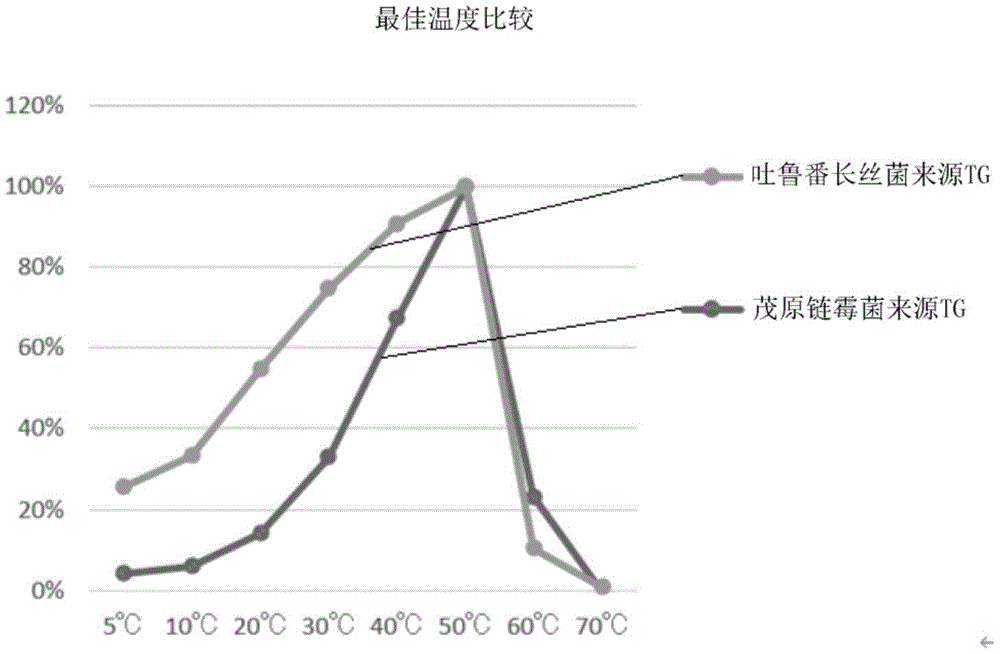
图2示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌(S.mobaraensis)来源转谷氨酰胺酶的最佳温度的比较。
图3示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的最佳pH的比较。
图4示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的热稳定性(50℃)的比较。
图5示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的pH稳定性的比较。
图6示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的交联反应性的比较。
图7示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的对大豆的交联活性的比较。
图8示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的对豌豆的交联活性的比较。
图9示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的对杏仁的交联活性的比较。
图10示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的对黑麦的交联活性的比较。
图11示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的对小麦的交联活性的比较。
图12示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的对椰子的交联活性的比较。
图13示出吐鲁番长丝菌来源转谷氨酰胺酶与茂原链霉菌来源转谷氨酰胺酶的对奇亚籽的交联活性的比较。
图14示出图7~图13所示的各天然原料的21小时反应时的结果。吐鲁番长丝菌来源转谷氨酰胺酶示于各栏的左侧,茂原链霉菌来源转谷氨酰胺酶示于各栏的右侧。
图15示出图7~图13所示的各天然原料在反应温度5℃下的21小时反应时的结果。吐鲁番长丝菌来源转谷氨酰胺酶示于各栏的左侧,茂原链霉菌来源转谷氨酰胺酶示于各栏的右侧。
图16示出使用吐鲁番长丝菌来源转谷氨酰胺酶或茂原链霉菌来源转谷氨酰胺酶制造豆腐时的豆腐的强度的比较。吐鲁番长丝菌来源转谷氨酰胺酶示于各栏的左侧,茂原链霉菌来源转谷氨酰胺酶示于各栏的右侧。
图17示出使用吐鲁番长丝菌来源转谷氨酰胺酶或茂原链霉菌来源转谷氨酰胺酶制造豆奶酸奶时的豆奶酸奶的强度的比较。吐鲁番长丝菌来源转谷氨酰胺酶示于各栏的左侧,茂原链霉菌来源转谷氨酰胺酶示于各栏的右侧。
具体实施方式
1.以转谷氨酰胺酶为有效成分的酶剂
本发明的酶剂含有由序列号1的氨基酸序列或与该氨基酸序列等价的氨基酸序列构成的转谷氨酰胺酶作为有效成分。
“等价氨基酸序列”是指虽然与基准的氨基酸序列(序列号1的氨基酸序列)在一部分存在差异、但该差异不对蛋白质的功能(这里为转谷氨酰胺酶活性)造成实质性影响的氨基酸序列。因此,具有等价氨基酸序列的酶催化转谷氨酰胺酶所致的酶反应。活性的程度只要能够发挥作为转谷氨酰胺酶的功能,就没有特别限定。其中,优选与由作为基准的氨基酸序列构成的酶(具有序列号1的氨基酸序列)为相同程度或比其更高。
序列号1的氨基酸序列为吐鲁番长丝菌来源的转谷氨酰胺酶的氨基酸序列(成熟体)。应予说明,在序列号2中示出吐鲁番长丝菌来源的转谷氨酰胺酶的全长氨基酸序列。
“氨基酸序列的一部分的差异”例如通过构成氨基酸序列的氨基酸中的1个或多个氨基酸的缺失、置换、对氨基酸序列附加、插入1个或多个氨基酸、或者它们的任意组合而产生。氨基酸序列的一部分的差异只要可保持转谷氨酰胺酶活性,就可被允许(活性可以有稍许变化)。只要满足该条件,氨基酸序列的存在差异的位置就没有特别限定。另外,氨基酸序列的差异也可以在多个位置(部位)产生。
带来氨基酸序列的一部分的差异的氨基酸的个数为相当于构成氨基酸序列的全部氨基酸的例如约小于30%、约小于20%、或者约小于10%的个数,优选为相当于约小于8%的个数,更优选为相当于约6%的个数,进一步优选为相当于约小于4%的个数,更进一步优选为相当于约小于2%的个数,最优选为相当于约小于1%的个数。因此,等价蛋白质与基准的氨基酸序列具有例如约70%以上、约80%以上、或者约90%以上、优选约92%以上、更优选约94%以上、进一步优选约96%以上、更进一步优选约98%以上、最优选约99%以上的同源性。
“氨基酸序列的一部分的差异”的典型例之一是通过构成氨基酸序列的氨基酸中的1~40个(优选1~30个、更优选1~10个、进一步优选1~7个、更进一步优选1~5个、进一步优选1~3个)的氨基酸的缺失、置换、对氨基酸序列附加、插入1~40个(优选1~30个、更优选1~10个、进一步优选1~7个、更进一步优选1~5个、进一步优选1~3个)的氨基酸、或者它们的组合而使氨基酸序列发生变异(变化)。
优选通过在对于转谷氨酰胺酶活性为非必需的氨基酸残基中发生保守性氨基酸置换而得到等价的氨基酸序列。这里的“保守性氨基酸置换”是指将某氨基酸残基置换成具有同样性质侧链的氨基酸残基。氨基酸残基根据其侧链被分类为碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、无电荷极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸)、β-支化侧链(例如苏氨酸、缬氨酸、异亮氨酸)、芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)这样的几个家族。保守性氨基酸置换优选为相同家族内的氨基酸残基间的置换。
二个氨基酸序列的同源性(%)例如可以通过以下步骤来确定。首先,以能够进行最佳比较的方式对二个序列进行排列(例如,可以在第一序列中引入空位使与第二序列的比对最优化)。第一序列的特定位置的分子(氨基酸残基)与第二序列中的对应位置的分子相同时,可以说该位置的分子相同。二个序列的同源性是这二个序列所共同的相同位置的个数的函数(即,同源性(%)=相同位置的个数/位置的总数×100),优选也考虑比对的最优化所需的空位的个数和尺寸。
二个序列的比较和同源性的确定可以使用数学算法来实现。作为序列的比较中可利用的数学算法的具体例,有Karlin和Altschul(1990)Proc.Natl.Acad.Sci.USA87:2264-68中记载的、Karlin和Altschul(1993)Proc.Natl.Acad.Sci.USA90:5873-77中修改后的算法,但并不限定于此。氨基酸序列的同源性例如可以通过National Center forBiotechnology Information(NCBI)的blastp(protein-protein BLAST)而得到。参数只要使用默认的参数即可,例如只要使用BLOSUM62矩阵将Gap Costs设定为Existence:11、Extension:1即可。
作为本发明的酶剂的有效成分的转谷氨酰胺酶也可以为更大的蛋白质(例如融合蛋白)的一部分。作为附加于融合蛋白的序列,例如,可举出多重组氨酸残基这样的有助于纯化的序列、确保重组生产时的稳定性的附加序列等。
本发明中的转谷氨酰胺酶(以下,也称为本酶)可以通过培养产生该转谷氨酰胺酶的微生物(转谷氨酰胺酶产生株)、例如长丝菌(Longimycelium)属细菌而得到,作为一个例子,有吐鲁番长丝菌(Longimycelium tulufanense)。转谷氨酰胺酶产生株可以为野生株,也可以为变异株(例如通过紫外线照射而得到变异株)。转谷氨酰胺酶产生株的具体例为吐鲁番长丝菌(NBRC107726)。吐鲁番长丝菌(NBRC107726)为保藏于NBRC(独立行政法人制品评价技术基础机构生物技术中心)的菌株,可以经过规定的手续而接受其分发。
本酶可以由产生本酶的微生物的培养液和/或菌体来制备。培养条件、培养方法只要可生成本酶,就没有特别限定。即,可以以可生产本酶为条件,适当地设定适于培养所使用的微生物的方法、培养条件。作为培养方法,可以为液体培养、固体培养中的任一种,优选利用液体培养。以液体培养为例对其培养条件进行说明。
作为培养基,只要是所使用的微生物可生长繁殖的培养基,就没有特别限定。例如,可以使用添加了葡萄糖、蔗糖、龙胆二糖、可溶性淀粉、甘油、糊精、糖蜜、有机酸等碳源、以及硫酸铵、碳酸铵、磷酸铵、乙酸铵、或者明胶、蛋白胨、酵母提取物、玉米浆、酪蛋白水解物、麸皮、肉提取物等氮源、以及钾盐、镁盐、钠盐、磷酸盐、锰盐、铁盐、锌盐等无机盐的培养基。可以在培养基中添加维生素、氨基酸等来促进所使用的微生物的生长繁殖。培养基的pH例如调节为约3~8、优选约4~7左右,培养温度通常在约20~40℃、优选约25~35℃左右,在需氧的条件下培养1~20天、优选3~10天左右。作为培养方法,例如可以利用振荡培养方法、使用发酵罐的需氧深部培养方法。
按照以上条件进行培养后,从培养液或菌体中回收目标酶。从培养液中回收的情况下,例如可以通过将培养上清进行过滤、离心处理等除去不溶物后,适当组合基于超滤膜的浓缩、硫酸铵沉淀等盐析、透析、离子交换树脂等各种色谱法等进行分离、纯化而得到本酶。另一方面,从菌体内回收的情况下,例如可以通过将菌体利用加压处理、超声波处理等粉碎后,与上述同样地进行分离、纯化而得到本酶。应予说明,可以通过过滤、离心处理等预先从培养液中回收菌体后,进行上述一系列的工序(菌体的粉碎、分离、纯化)。
本酶也可以利用基因工程方法而容易地制备。例如,可以通过用编码本酶的DNA将适当的宿主细胞(例如大肠杆菌)进行转化,回收在转化体内表达的蛋白质来制备。所回收的蛋白质根据需要而进行适当的纯化。如果这样以重组蛋白的形式得到目标酶,则可以进行各种修饰。例如,如果将编码本酶的DNA和其它的适当的DNA插入到相同的载体中,并使用该载体来进行重组蛋白的生产,则能够得到由连接有任意的肽或蛋白质的重组蛋白构成的本酶。另外,也可以实施糖链和/或脂质的附加、或者产生N末端或C末端加工这样的修饰。通过如上的修饰,能够实现重组蛋白的提取、纯化的简化、或者生物学功能的附加等。
通常,如上所述利用适当的宿主-载体体系进行基因的表达~表达产物(本酶)的回收,但也可以利用无细胞合成体系。这里,“无细胞合成体系(无细胞转录体系、无细胞转录/翻译体系)”是指不使用活细胞而使用活细胞来源的(或者利用基因工程方法得到的)核糖体、转录·翻译因子等,由作为模板的核酸(DNA、mRNA)在体外(in vitro)合成其编码的mRNA、蛋白质。无细胞合成体系中一般使用将细胞破碎液根据需要纯化而得到的细胞提取液。细胞提取液中一般含有蛋白质合成所需的核糖体、起始因子等各种因子、tRNA等各种酶。进行蛋白质的合成时,在该细胞提取液中添加各种氨基酸、ATP、GTP等能量源、磷酸肌酸等蛋白质合成所需的其它物质。当然,在蛋白质合成时,可以根据需要补充另外准备的核糖体、各种因子和/或各种酶等。
还报道了重建蛋白质合成所需的各分子(因子)的转录/翻译体系的开发(Shimizu,Y.et al.:Nature Biotech.,19,751-755,2001)。该合成体系中,由大肠杆菌基因组对由构成细菌的蛋白质合成体系的3种起始因子、3种延伸因子、参与终止的4种因子、使各氨基酸与tRNA结合的20种氨基酰基tRNA合成酶、和甲硫氨酰tRNA甲酰基转移酶构成的31种因子的基因进行扩增,使用它们在体外重建蛋白质合成体系。本发明中可以利用这样重建的合成体系。
术语“无细胞转录/翻译体系”可与无细胞蛋白质合成体系、体外翻译体系或体外转录/翻译体系互换使用。体外翻译体系中RNA被用作模板来合成蛋白质。使用全RNA、mRNA、体外转录产物等作为模板RNA。另一个体外转录/翻译体系中DNA被作为模板使用。模板DNA应该包含核糖体结合域,而且优选包含适当的终止子序列。应予说明,体外转录/翻译体系中,以转录反应和翻译反应连续进行的方式设定添加各反应所需因子的条件。
也可以通过将如上所述得到的纯化酶利用例如冷冻干燥、真空干燥或喷雾干燥等进行粉末化而提供。此时,也可以使纯化酶预先溶解于乙酸缓冲液、磷酸缓冲液、三乙醇胺缓冲液、Tris-HCl缓冲液或GOOD缓冲液中。可以优选使用乙酸缓冲液、磷酸缓冲液、三乙醇胺缓冲液。应予说明,这里,作为GOOD缓冲液,可举出PIPES、MES或MOPS。
酶的纯化度没有特别限定。另外,最终形态可以为液体状,也可以为固体状(包括粉体状)。
根据本发明人等的研究,如下确定由序列号1的氨基酸序列构成的吐鲁番长丝菌来源转谷氨酰胺酶的各种性质(详细参照后述的实施例)。因此,也可以根据以下的酶化学性质来确定本酶。应予说明,评价各酶化学性质时的转谷氨酰胺酶活性的测定条件、测定顺序等的详细内容如后述的实施例所示。
(1)作用
本酶为转谷氨酰胺酶。
(2)最佳温度和低温反应性
在10、20、30、40、50、60、70℃下进行比较时的本酶的最佳温度约为50℃。
将本酶的反应温度50℃时的酶活性设为100%时,本酶的反应温度20℃时的相对酶活性为20%以上(优选为30%以上,更优选为40%以上,进一步优选为50%以上)。
将本酶的反应温度50℃时的酶活性设为100%时,优选本酶的反应温度5℃下的相对酶活性为10%以上(优选为15%以上,更优选为20%以上),本酶的反应温度10℃下的相对酶活性为10%以上(优选为20%以上,更优选为30%以上),本酶的反应温度30℃下的相对酶活性为40%以上(优选为50%以上,更优选为60%以上,进一步优选为70%以上),本酶的反应温度40℃下的相对酶活性为70%以上(优选为80%以上,更优选为90%以上)。
(3)最佳pH
在pH5、6、7、8、9、10下进行比较时的本酶的最佳pH为pH7。
(4)热稳定性(50℃)
本酶在50℃下进行40分钟热处理后的酶活性为热处理前的酶活性的60%以上(优选为70%以上,更优选为80%以上,进一步优选为90%以上)。
优选本酶即便在50℃下进行10分钟热处理也没有活性实质性降低。
优选本酶即便在50℃下进行20分钟热处理也没有活性实质性降低。
优选本酶在50℃下进行80分钟热处理后的酶活性为热处理前的酶活性的50%以上(优选为60%以上,更优选为70%以上,进一步优选为80%以上)。
优选本酶在50℃下进行120分钟热处理后的酶活性为热处理前的酶活性的40%以上(优选为50%以上,更优选为60%以上)。
(5)pH稳定性
本酶的pH4时的酶活性为pH8时的酶活性的50%以上(优选为60%以上,更优选为70%以上,进一步优选为80%以上)。
优选本酶在pH5、pH6和pH7时的酶活性为pH8时的酶活性的80%以上(优选为85%以上,更优选为90%以上)。
优选本酶在pH3时的酶活性为pH8时的酶活性的30%以上(优选为40%以上,更优选为50%以上,进一步优选为60%以上,特别优选为70%以上)。
优选本酶在pH2时的酶活性为pH8时的酶活性的20%以上(优选为30%以上,更优选为40%以上,进一步优选为50%以上)。
优选本酶在pH11时的酶活性为pH8时的酶活性的80%以上(优选为85%以上,更优选为90%以上)。
另外,本酶的利用SDS-PAGE(SDS-聚丙烯酰胺凝胶电泳)测定的分子量为28~30kDa。另一方面,由序列号2的氨基酸序列算出的分子量为30kDa。
本发明的酶剂中的有效成分(本酶)的含量没有特别限定,例如,可以将有效成分的含量设定或调整成每1g本酶剂的转谷氨酰胺酶活性为0.1U~5000U、优选为1U~500U、更优选为10U~300U。应予说明,转谷氨酰胺酶活性的单位(1U)的定义如后述的实施例所记载。
本发明的酶剂除了有效成分(本发明的修饰型酶)以外,也可以含有赋形剂、缓冲剂、悬浮剂、稳定剂、保存剂、防腐剂、生理食盐水、各种蛋白质、各种蛋白质的分解物、各种提取物类、各种盐类、各种抗氧化剂、半胱氨酸、谷胱甘肽、谷氨酸钠、肌酐酸钠、鸟苷酸钠、贝壳煅烧钙、二氧化硅等。作为赋形剂,可以使用淀粉、糊精、麦芽糖、海藻糖、乳糖、D-葡萄糖、山梨糖醇、D-甘露醇、白糖、甘油等。作为缓冲剂,可以使用磷酸盐、柠檬酸盐、乙酸盐等。作为稳定剂,可以使用丙二醇、抗坏血酸等。作为保存剂,可以使用苯酚、苯扎氯铵、苯甲醇、氯丁醇、对羟基苯甲酸甲酯等。作为防腐剂,可以使用乙醇、苯扎氯铵、对羟基苯甲酸、氯丁醇等。蛋白质的例子为大豆蛋白质、小麦蛋白质、玉米蛋白质、乳蛋白质、动物来源蛋白质等。提取物类的例子为肉提取物、植物提取物、酵母提取物等。盐类的例子为氯化盐、磷酸盐、多磷酸盐、焦磷酸盐、柠檬酸盐、乳酸盐、碳酸盐等。抗氧化剂的例子为L-抗坏血酸盐、亚硫酸氢钠等。本发明的酶剂的形状没有特别限定,例如为粉末状、颗粒状、液体状、胶囊状等。
2.基因
编码本酶的基因由编码包含序列号1的氨基酸序列的蛋白质的DNA构成。该方式的具体例为由序列号3所示的碱基序列构成的DNA和由序列号4所示的碱基序列构成的DNA。序列号3的DNA为仅编码成熟体的氨基酸序列(序列号1)的DNA,序列号4的DNA除了编码成熟体(序列号1的氨基酸序列)以外还编码信号肽和前序列。
编码本酶的基因典型地用于制备本酶。根据使用编码本酶的基因的基因工程制备方法,能够得到更均匀的状态的本酶。另外,可以说该方法也适用于制备大量的本酶的情况。应予说明,编码本酶的基因的用途并不限于制备本酶。例如,也可以利用该核酸作为以阐明本酶的作用机制等为目的的实验用工具或者作为用于设计或制作本酶的突变体(改变体)的工具。
本说明书中“编码本酶的基因”是指使其表达时得到本酶的核酸,当然包含具有与本酶的氨基酸序列对应的碱基序列的核酸,也包含在这样的核酸中附加不编码氨基酸序列的序列而成的核酸。另外,密码子的简并也被考虑在内。
核酸可以通过参考本说明书或所附的序列表所公开的序列信息,利用标准的基因工程方法、分子生物学方法、生化学方法、化学合成、PCR法(例如重叠延伸PCR)或它们的组合来制备成分离的状态。
也可以使用与编码本酶的基因的碱基序列进行比较时其编码的蛋白质的功能虽然等同但一部分碱基序列不同的核酸(以下,也称为“等价核酸”,另外,也将规定等价核酸的碱基序列称为“等价碱基序列”)。作为等价核酸的例子,可以举出由以编码本酶的核酸的碱基序列为基准包含1个或多个碱基的置换、缺失、插入、附加或倒位的碱基序列构成且编码具有本酶特征性的酶活性(即,转谷氨酰胺酶活性)的蛋白质的DNA。碱基的置换、缺失等可以在多个部位产生。这里的“多个”根据该核酸编码的蛋白质的立体结构中的氨基酸残基的位置、种类而不同,例如为2~40碱基,优选为2~20碱基,更优选为2~10碱基。等价核酸相对于作为基准的碱基序列(序列号3或序列号4),具有例如70%以上、80%以上、85%以上或90%以上、优选92%以上、更优选94%以上、进一步优选96%以上、更进一步优选约98%以上、最优选99%以上的序列同源性。
如上的等价核酸例如通过限制酶处理、基于核酸外切酶或DNA连接酶等的处理、基于定点突变导入法(Molecular Cloning,Third Edition,Chapter 13,Cold SpringHarbor Laboratory Press,New York)或随机突变导入法(Molecular Cloning,ThirdEdition,Chapter 13,Cold Spring Harbor Laboratory Press,New York)的突变导入等而得到。另外,也可以通过紫外线照射等其它方法得到等价核酸。
也可以使用具有与编码本酶的基因的碱基序列互补的碱基序列的核酸。也可以使用具有相对于编码本酶的基因的碱基序列或者与其互补的碱基序列至少约90%、92%、94%、96%、98%或99%相同的碱基序列的核酸。
也可以使用具有在严格条件下对与编码本酶的基因的碱基序列或其等价碱基序列互补的碱基序列进行杂交的碱基序列的核酸。“严格条件”是指形成所谓的特异性杂交而不形成非特异性杂交的条件。这样的严格条件是本领域技术人员所公知的,例如可以参照Molecular Cloning(Third Edition,Cold Spring Harbor Laboratory Press,NewYork)、Current protocols in molecular biology(edited by Frederick M.Ausubel etal.,1987)设定。作为严格条件,例如,可以举出如下条件:使用杂交液(50%甲酰胺,10×SSC(0.15M NaCl,15mM柠檬酸钠,pH 7.0)、5×Denhardt溶液、1%SDS、10%硫酸葡聚糖、10μg/ml的变性鲑鱼精DNA、50mM磷酸缓冲液(pH7.5))在约50℃下孵育,然后使用0.1×SSC、0.1%SDS在约65℃下进行清洗。作为进一步优选的严格条件,例如,可以举出使用50%甲酰胺、5×SSC(0.15M NaCl,15mM sodium citrate,pH 7.0)、1×Denhardt溶液、1%SDS、10%硫酸葡聚糖、10μg/ml的变性鲑鱼精DNA、50mM磷酸缓冲液(pH7.5)作为杂交液的条件。
也可以使用包含编码本酶的基因的重组DNA。重组DNA例如以载体的形式提供。本说明书中术语“载体”是指能够将插入于其中的核酸向细胞等靶内递送的核酸性分子。
根据使用目的(克隆、蛋白质的表达)并考虑宿主细胞的种类来选择适当的载体。作为以大肠杆菌为宿主的载体,可以例示M13噬菌体或其改变体、λ噬菌体或其改变体、pBR322或其改变体(pB325、pAT153、pUC8等)等,作为以酵母为宿主的载体,可以例示pYepSec1、pMFa、pYES2等,作为以昆虫细胞为宿主的载体,可以例示pAc、pVL等,作为以哺乳类细胞为宿主的载体,可以例示pCDM8、pMT2PC等。
载体优选为表达载体。“表达载体”是指能够将插入于其中的核酸导入到目标细胞(宿主细胞)内并且能够使其在该细胞内表达的载体。表达载体通常包括被插入的核酸的表达所需的启动子序列、促进表达的增强子序列等。也可以使用包含选择标记的表达载体。使用上述表达载体的情况下,可以利用选择标记来确认是否导入表达载体(及其程度)。
核酸向载体的插入、选择标记基因的插入(必要时)、启动子的插入(必要时)等可以使用标准的重组DNA技术(例如,可以参照Molecular Cloning,Third Edition,1.84,Cold Spring Harbor Laboratory Press,New York的使用限制酶和DNA连接酶的公知方法)进行。
作为宿主细胞,从操作的容易性的方面考虑,优选使用大肠杆菌(Escherichiacoli)、丝状菌(Aspergillus oryzae)、放线菌(链霉菌属,Streptomyces lividans,Streptomyces mobaraensis)、枯草菌(Bacillus subtilis),酿酒酵母(Saccharomycescerevisiae)等微生物,但只要是可复制重组DNA并且能够表达本酶的基因的宿主细胞,就可以利用。作为大肠杆菌的例子,在利用T7系启动子时可以举出大肠杆菌BL21(DE3)pLysS,不是这样的情况下,可以举出大肠杆菌JM109。另外,作为酿酒酵母的例子,可以举出酿酒酵母SHY2、酿酒酵母AH22或酿酒酵母INVSc1(Invitrogen公司)。
可以使用保有重组DNA的微生物(即转化体)。微生物可以通过使用上述本发明载体的转染或转化而得到。例如,可以利用氯化钙法(Journal of Molecular Biology(J.Mol.Biol.),第53卷,第159页(1970))、Hanahan法(Journal of Molecular Biology,第166卷,第557页(1983))、SEM法(Gene,第96卷,第23页(1990)〕,Chung等人的方法(Proceedings of the National Academy of Sciences of the USA,第86卷,第2172页(1989))、磷酸钙共沉降法、电穿孔法(Potter,H.et al.,Proc.Natl.Acad.Sci.U.S.A.81,7161-7165(1984))、脂质转染法(Felgner,P.L.et al.,Proc.Natl.Acad.Sci.U.S.A.84,7413-7417(1984))等来实施。上述微生物可以用于生产本酶。
3.酶剂的用途
本发明还涉及本发明的酶剂的用途。
即,通过使本发明的酶剂作用于底物(蛋白质或肽),能够将蛋白质或肽改性。作为用途的具体例,通过将本发明的酶剂作用于食品或食品材料(含有蛋白质的食品材料),能够制造食品或食品材料(含有蛋白质的食品材料)。通过使本发明的酶剂作用于食品,能够改良食品的品质。根据本发明,提供用本发明的酶剂处理后的食品。另外,本发明的酶剂除了用于食品或食品材料(含有蛋白质的食品材料)以外,也可以用于工业用材料、医药原料的制造用途。
作为食品的具体例,没有特别限定,可举出畜肉加工食品(例如,火腿、培根等食用肉类的加工品;香肠、汉堡肉饼、肉丸等肉馅制品)、水产加工食品(例如,鱼肠、鱼糕、竹轮、鱼饼等)、米饭食品(例如,白米饭、红米饭、手抓饭、什锦饭、粥、意大利肉汁烩饭、饭团等)、面类(例如,乌冬面、意大利面、日本荞麦面、中式面条、炒面、方便面等棉类)、谷粉(例如,小麦粉、大麦粉、玉米粉、荞麦粉等)及其加工食品、乳制品(酸奶、奶酪、黄油、冰淇淋类等)、豆腐类及其加工品、植物性蛋白质食品(植物性奶、植物性酸奶(例如,豆奶酸奶等)、素肉等)等。作为食品材料,没有特别限定,可举出酪蛋白、大豆、豌豆、鹰嘴豆、蚕豆、绿豆、杏仁、燕麦、黑麦、小麦、椰子、奇亚籽和鸡蛋等。作为食品材料,特别优选大豆、豌豆、黑麦、小麦、椰子和奇亚籽。
使用本酶的食品的制造方法没有特别限定,例如可举出包含以下的工序(a)和(b)的方法。
(a)使本酶作用于食品或食品材料的工序,以及
(b)使得到的酶处理食品或酶处理食品材料中含有的本酶失活或将其除去的工序。
实施例
实施例1:吐鲁番长丝菌来源转谷氨酰胺酶的制备
将吐鲁番长丝菌的菌体(从独立行政法人制品评价技术基础机构(NITE)得到)(NBRC107726)用胰蛋白胨大豆肉汤培养基(日水制药株式会社制)在37℃下进行4天培养,回收上清。将得到的上清按照常规方法用20mM磷酸缓冲液(pH6)进行透析。透析后的样品利用用相同的缓冲液平衡后的阳离子交换柱(SP Sepharose FF,GE health care制)实施离子交换层析,将活性级分脱盐浓缩,得到粗纯化酶样品。这里,活性级分的确认利用后述实施例3中记载的方法进行。实施例3中使用的样品是通过将得到的粗纯化酶样品进一步用Superdex 200HR进行凝胶过滤而取得。
实施例2;吐鲁番长丝菌来源转谷氨酰胺酶的序列的确认
实施纯化酶的N末端分析,结果得到“ATSLPPIAPPLPRGVQSKS”这样的结果。根据得到的序列由基因组信息对蛋白质进行推断,结果与功能未知蛋白质(WP_189053072.1)的氨基酸序列一致。参考该氨基酸序列对包含上游和下游的区域由基因组利用PCR进行扩增,确认碱基序列,确定氨基酸序列。
氨基酸序列(仅成熟体序列)(序列号1)
ATSLPPIAPPLPRGVQSKSWSVPDYIAAWEKQHGRPMTAEERYHLARGCIGVTVVNLDREDAPNPPLNLSFGTYQRAMEVQAALNEIVATRPSPREYAEQVRKHPALQGVQNLVRAFPTFIDPANLHAAIFSKRFYSKQDPNWTDEQAAEMYRPNPRTGQVDMSTYRYRARPGYVNFDYGWYDEQTNNWWHANHAEPGMKVYQSTLRYYSRPLLDFDEQVFTVAFARVA
氨基酸序列(全长)*下划线部分为成熟体序列(序列号2)
MKKWLPRALVALFVLLGLPAGLAGTAHAAVVAHAAV
碱基序列(成熟体)(序列号3)
gccacgtcgctgccaccgatcgcaccgccgcttccccggggcgtgcagagcaagagctggtcggtgccggactacattgccgcctgggagaagcaacacggtaggccgatgacggccgaggagcggtaccacctcgcccggggctgcatcggcgtcaccgtggtcaacctcgaccgggaggacgcgccgaacccgccgctcaacctgtcgttcggcacttaccagcgggccatggaagtgcaggccgcgctgaacgagatcgtcgcgacccggccgtcgccgcgggagtacgccgagcaggtgcgcaagcacccggcgctgcagggcgtgcagaacctggtgcgggcgttccccacgttcatcgacccggcgaacctgcacgccgccatcttctccaagcggttctactcgaagcaggacccgaactggaccgacgagcaggcggccgagatgtaccggccgaatccgcggaccggccaggtcgacatgagcacctaccgctaccgggcgcggccgggttacgtgaacttcgactacggttggtacgacgagcagacgaacaactggtggcacgccaaccacgcggagccgggcatgaaggtctaccagagcacgttgcggtactactcccggccgctgctggatttcgacgagcaggttttcaccgtggcgttcgcgcgggtcgcctga
碱基序列(全长)(序列号4)
gtgaagaagtggttgccgcgcgccctggtcgcgctgttcgtgctcctggggttacccgccggcctggccggaacggcacatgccgcggtcgtcgcgcacgccgccgtcgccacgtcgctgccaccgatcgcaccgccgcttccccggggcgtgcagagcaagagctggtcggtgccggactacattgccgcctgggagaagcaacacggtaggccgatgacggccgaggagcggtaccacctcgcccggggctgcatcggcgtcaccgtggtcaacctcgaccgggaggacgcgccgaacccgccgctcaacctgtcgttcggcacttaccagcgggccatggaagtgcaggccgcgctgaacgagatcgtcgcgacccggccgtcgccgcgggagtacgccgagcaggtgcgcaagcacccggcgctgcagggcgtgcagaacctggtgcgggcgttccccacgttcatcgacccggcgaacctgcacgccgccatcttctccaagcggttctactcgaagcaggacccgaactggaccgacgagcaggcggccgagatgtaccggccgaatccgcggaccggccaggtcgacatgagcacctaccgctaccgggcgcggccgggttacgtgaacttcgactacggttggtacgacgagcagacgaacaactggtggcacgccaaccacgcggagccgggcatgaaggtctaccagagcacgttgcggtactactcccggccgctgctggatttcgacgagcaggttttcaccgtggcgttcgcgcgggtcgcctga
实施例3:吐鲁番长丝菌来源转谷氨酰胺酶的分子量的确认
将吐鲁番长丝菌来源转谷氨酰胺酶(凝胶过滤纯化样品)在NuPAGE(注册商标)Novex 4-12%Bis-Tris Gel w/MES上进行电泳,用Coomassie(注册商标)Blue R-250进行染色。作为分子量标记,使用Mark12
实施例4:酶的各种性质的确认
(使用酶)
茂原链霉菌来源转谷氨酰胺酶(对照品)
长丝菌来源的转谷氨酰胺酶(本发明)
(活性测定方法)
将酶溶解于含有0.4%半胱氨酸的200mM Tris-HCl pH6.0中在30℃下进行1小时处理后,用200mM Tris-HCl pH6.0稀释为适当浓度(样品溶液)。在样品溶液10μL中添加底物溶液(R-1)100μL进行混合后,在37℃下反应10分钟。加入显色溶液(R-2)100μL停止反应而形成Fe配合物后,测定525nm的吸光度。作为对照,测定使用预先热失活后的酶液同样进行反应后的溶液的吸光度,求出与样品溶液的吸光度差。另外,使用L-谷氨酸-γ-单羟肟酸代替酶液而制作标准曲线,根据上述吸光度差求出所生成的羟肟酸的量。将1分钟生成1微摩尔的羟肟酸的酶活性设为1个单位(1U)。
(底物溶液(R-1))
将2-氨基-2-羟甲基-1,3-丙二醇2.42g、盐酸羟胺0.70g、还原型谷胱甘肽0.31g、Z-Gln-Gly(苄氧羰基-L-谷氨酰胺甘氨酸)1.01g溶解于蒸馏水中使总量达到100mL(pH6.0)。
(底物溶液(R-2))
将3M盐酸溶液30mL、12%三氯乙酸溶液30mL、5%氯化铁(III)溶液30mL混合。
(性质的确认方法)
<最佳温度的确认方法>
测定中,将温度变更为各温度而实施活性测定。
<最佳pH的确认方法>
将活性测定中使用的底物溶液用20mM Britton-Robinson缓冲液(pH5-10)进行调整,实施测定。
<热稳定性的确认方法>
将样品在50℃下进行加热处理,测定残留活性。
将酶样品用20mM Britton-Robinson缓冲液(pH 2-10)进行2倍稀释后,在37℃下进行1小时处理,测定残留活性。
(结果)
将最佳温度的测定结果示于表1和图2。
将最佳pH的测定结果示于表2和图3。
将热稳定性的测定结果示于表3和图4。
将pH稳定性的测定结果示于表4和图5。
[表1]
将最佳温度(50℃)下的活性设为100%时的相对值
[表2]
将最佳pH下的活性设为100%时的相对值
[表3]
50℃处理时的经时残留活性
[表4]
pH处理后的残留活性
(考察)
根据表1~4和图2~图5可知:与现有的转谷氨酰胺酶相比,本发明的转谷氨酰胺酶的低温下的反应性高,热稳定性高。
实施例5:高分子交联活性的确认
以酪蛋白为底物而确认了利用转谷氨酰胺酶使高分子蛋白交联。
(方法)
在20μl酪蛋白5%溶液(用50mM磷酸缓冲液(pH7)制备)中混合10μL纯化酶溶液(0.1mg/mL),以5℃、37℃进行反应。适时实施取样并进行50倍稀释后,添加SDS-PAGE样品缓冲液煮沸使反应停止,供于SDS-PAGE。
(结果)
将确认转谷氨酰胺酶的交联反应性的结果示于图6。
图6中从左起示出反应时间为0小时、1小时、3小时、5小时的样品的SDS-PAGE的结果。
(考察)
根据图6所示的结果,表明在每单位相同重量时,即便在低温下吐鲁番长丝菌(L.tulufanese)来源酶的活性也高。表明本发明的转谷氨酰胺酶是低温反应性高的转谷氨酰胺酶。
实施例6:对天然原料的交联活性的确认(SDS-PAGE)
以以下原料为底物而确认了利用转谷氨酰胺酶使天然原料来源的蛋白质交联。
[表5]
(方法)
在1%底物溶液(用50mM磷酸缓冲液(pH7)制备)90μL中混合各浓度(0.01mg/mL,0.1mg/mL,1mg/mL)的纯化酶溶液10μL,在5℃、37℃下反应过夜。添加SDS-PAGE样品缓冲液煮沸使反应停止,供于SDS-PAGE。
(结果)
底物使用任一天然原料时都能够确认转谷氨酰胺酶的交联反应性。表明本发明的转谷氨酰胺酶能够对各种天然原料催化交联反应。
实施例7:对天然原料的交联活性的确认(游离氨量的定量)
为了对天然原料来源蛋白质定量交联反应而进行因交联反应而游离的氨量的定量。使用实施例6的表中记载的原料作为底物。
(方法)
在1%底物溶液(用50mM磷酸缓冲液(pH7)制备)1.35mL中混合1mg/mL纯化酶溶液0.15mL,在5℃、37℃下进行2、21小时反应。反应后,添加等量的三氯乙酸,停止反应。利用氨检测试剂盒(Ammonia Test Wako)来测定游离氨量。将反应前(0小时)的氨游离量设为0mM,对经时游离氨量进行定量。
(结果)
将测定的结果示于图7~13。另外,将图7~图13所示的各天然原料的21小时反应时的结果示于图14。
将任一原料作为底物时都能够看到氨游离量的经时增加。特别是对大豆、豌豆、黑麦、小麦、椰子、奇亚籽而言,与现有的转谷氨酰胺酶相比,氨游离量更多,暗示了交联反应性高的可能性。
此外,针对图7~图13所示的各天然原料,将在反应温度5℃下反应21小时时的结果示于图15。将任一原料作为底物时,与现有的转谷氨酰胺酶相比氨游离量都为同等以上,暗示了低温下的交联反应性高的可能性。
实施例8:豆腐的制造
确认了豆腐制造中的本酶的效果。
(方法)
将20mL的豆奶(有机豆奶无调整SUJAHTAMEIRAKU,蛋白质含量5%)在55℃下处理5分钟。添加20%氯化镁六水合物溶液0.6mL和稀释成每1g豆奶蛋白的酶量为25μg、50μg、100μg、250μg的纯化酶溶液1mL后,搅拌5秒。在55℃下进行1小时反应后,在4℃下保存2小时而制备豆腐。作为比较,也准备不添加酶而制备的豆腐。对得到的豆腐使用流变仪(COMPAC-100II,太阳科学株式会社)来测定强度(Firmness(N);具体而言为压缩强度)。测定条件为模式:20,适配器:No.13,重复:1次,压入距离:5mm。
(结果)
将测定的结果示于图16。
确认了通过使用本酶而使豆腐的强度提高。另外,还确认了与现有的转谷氨酰胺酶相比效果更高。
实施例9:豆奶酸奶的制造
确认豆奶酸奶制造中的本酶的效果。
(方法)
在100mL烧杯中加入50mL的豆奶(有机豆奶无调整SUJAHTAMEIRAKU,蛋白质含量5%)、种菌(王样的酸奶种菌,太田胃散)(乳脂链球菌BRF(DM-1,DM-2株)、嗜热链球菌(KI-1株))0.3g。添加稀释成每1g豆奶蛋白的酶量为50μg、100μg、250μg的纯化酶溶液1mL后,充分搅拌。用保鲜膜包好在28℃下静置20小时后,保存在4℃来制备豆奶酸奶。作为比较,也准备不添加酶而制备的豆腐。对得到的豆腐使用流变仪(COMPAC-100II,太阳科学株式会社)来测定强度(Firmness(N);具体而言为压缩强度)。测定条件为Mode:20,适配器:No.13,重复:1次,压入距离:5mm。
(结果)
将测定的结果示于图17。
确认了通过使用本酶而使豆奶酸奶的强度提高。
产业上的可利用性
本发明的酶剂以低温反应性高的转谷氨酰胺酶为有效成分。因此,适用于食品、医疗用途的领域,工业上的利用价值较高。
本发明不受上述发明的实施方式和实施例的说明的任何限定。在不脱离专利请求保护的范围的记载的情况下,本领域技术人员可容易想到的范围内的各种的变形方式也包含于该发明中。本说明书中写明的论文、公开专利公报和专利公报等内容通过援引而引用其全部内容。
序列表
<110> 天野酶制品株式会社
<120> 包含转谷氨酰胺酶的酶剂及其用途
<130> F22602A-WO
<160> 4
<170> PatentIn version 3.5
<210>1
<211>229
<212>PRT
<213>吐鲁番长丝菌
<400>1
Ala Thr Ser Leu Pro Pro Ile Ala Pro Pro Leu Pro Arg Gly Val Gln
1 5 1015
Ser Lys Ser Trp Ser Val Pro Asp Tyr Ile Ala Ala Trp Glu Lys Gln
202530
His Gly Arg Pro Met Thr Ala Glu Glu Arg Tyr His Leu Ala Arg Gly
354045
Cys Ile Gly Val Thr Val Val Asn Leu Asp Arg Glu Asp Ala Pro Asn
505560
Pro Pro Leu Asn Leu Ser Phe Gly Thr Tyr Gln Arg Ala Met Glu Val
65707580
Gln Ala Ala Leu Asn Glu Ile Val Ala Thr Arg Pro Ser Pro Arg Glu
859095
Tyr Ala Glu Gln Val Arg Lys His Pro Ala Leu Gln Gly Val Gln Asn
100 105 110
Leu Val Arg Ala Phe Pro Thr Phe Ile Asp Pro Ala Asn Leu His Ala
115 120 125
Ala Ile Phe Ser Lys Arg Phe Tyr Ser Lys Gln Asp Pro Asn Trp Thr
130 135 140
Asp Glu Gln Ala Ala Glu Met Tyr Arg Pro Asn Pro Arg Thr Gly Gln
145 150 155 160
Val Asp Met Ser Thr Tyr Arg Tyr Arg Ala Arg Pro Gly Tyr Val Asn
165 170 175
Phe Asp Tyr Gly Trp Tyr Asp Glu Gln Thr Asn Asn Trp Trp His Ala
180 185 190
Asn His Ala Glu Pro Gly Met Lys Val Tyr Gln Ser Thr Leu Arg Tyr
195 200 205
Tyr Ser Arg Pro Leu Leu Asp Phe Asp Glu Gln Val Phe Thr Val Ala
210 215 220
Phe Ala Arg Val Ala
225
<210>2
<211>265
<212>PRT
<213>吐鲁番长丝菌
<400>2
Met Lys Lys Trp Leu Pro Arg Ala Leu Val Ala Leu Phe Val Leu Leu
1 5 1015
Gly Leu Pro Ala Gly Leu Ala Gly Thr Ala His Ala Ala Val Val Ala
202530
His Ala Ala Val Ala Thr Ser Leu Pro Pro Ile Ala Pro Pro Leu Pro
354045
Arg Gly Val Gln Ser Lys Ser Trp Ser Val Pro Asp Tyr Ile Ala Ala
505560
Trp Glu Lys Gln His Gly Arg Pro Met Thr Ala Glu Glu Arg Tyr His
65707580
Leu Ala Arg Gly Cys Ile Gly Val Thr Val Val Asn Leu Asp Arg Glu
859095
Asp Ala Pro Asn Pro Pro Leu Asn Leu Ser Phe Gly Thr Tyr Gln Arg
100 105 110
Ala Met Glu Val Gln Ala Ala Leu Asn Glu Ile Val Ala Thr Arg Pro
115 120 125
Ser Pro Arg Glu Tyr Ala Glu Gln Val Arg Lys His Pro Ala Leu Gln
130 135 140
Gly Val Gln Asn Leu Val Arg Ala Phe Pro Thr Phe Ile Asp Pro Ala
145 150 155 160
Asn Leu His Ala Ala Ile Phe Ser Lys Arg Phe Tyr Ser Lys Gln Asp
165 170 175
Pro Asn Trp Thr Asp Glu Gln Ala Ala Glu Met Tyr Arg Pro Asn Pro
180 185 190
Arg Thr Gly Gln Val Asp Met Ser Thr Tyr Arg Tyr Arg Ala Arg Pro
195 200 205
Gly Tyr Val Asn Phe Asp Tyr Gly Trp Tyr Asp Glu Gln Thr Asn Asn
210 215 220
Trp Trp His Ala Asn His Ala Glu Pro Gly Met Lys Val Tyr Gln Ser
225 230 235 240
Thr Leu Arg Tyr Tyr Ser Arg Pro Leu Leu Asp Phe Asp Glu Gln Val
245 250 255
Phe Thr Val Ala Phe Ala Arg Val Ala
260 265
<210>3
<211>690
<212>DNA
<213>吐鲁番长丝菌
<400>3
gccacgtcgc tgccaccgat cgcaccgccg cttccccggg gcgtgcagag caagagctgg60
tcggtgccgg actacattgc cgcctgggag aagcaacacg gtaggccgat gacggccgag 120
gagcggtacc acctcgcccg gggctgcatc ggcgtcaccg tggtcaacct cgaccgggag 180
gacgcgccga acccgccgct caacctgtcg ttcggcactt accagcgggc catggaagtg 240
caggccgcgc tgaacgagat cgtcgcgacc cggccgtcgc cgcgggagta cgccgagcag 300
gtgcgcaagc acccggcgct gcagggcgtg cagaacctgg tgcgggcgtt ccccacgttc 360
atcgacccgg cgaacctgca cgccgccatc ttctccaagc ggttctactc gaagcaggac 420
ccgaactgga ccgacgagca ggcggccgag atgtaccggc cgaatccgcg gaccggccag 480
gtcgacatga gcacctaccg ctaccgggcg cggccgggtt acgtgaactt cgactacggt 540
tggtacgacg agcagacgaa caactggtgg cacgccaacc acgcggagcc gggcatgaag 600
gtctaccaga gcacgttgcg gtactactcc cggccgctgc tggatttcga cgagcaggtt 660
ttcaccgtgg cgttcgcgcg ggtcgcctga690
<210>4
<211>798
<212>DNA
<213>吐鲁番长丝菌
<400>4
gtgaagaagt ggttgccgcg cgccctggtc gcgctgttcg tgctcctggg gttacccgcc60
ggcctggccg gaacggcaca tgccgcggtc gtcgcgcacg ccgccgtcgc cacgtcgctg 120
ccaccgatcg caccgccgct tccccggggc gtgcagagca agagctggtc ggtgccggac 180
tacattgccg cctgggagaa gcaacacggt aggccgatga cggccgagga gcggtaccac 240
ctcgcccggg gctgcatcgg cgtcaccgtg gtcaacctcg accgggagga cgcgccgaac 300
ccgccgctca acctgtcgtt cggcacttac cagcgggcca tggaagtgca ggccgcgctg 360
aacgagatcg tcgcgacccg gccgtcgccg cgggagtacg ccgagcaggt gcgcaagcac 420
ccggcgctgc agggcgtgca gaacctggtg cgggcgttcc ccacgttcat cgacccggcg 480
aacctgcacg ccgccatctt ctccaagcgg ttctactcga agcaggaccc gaactggacc 540
gacgagcagg cggccgagat gtaccggccg aatccgcgga ccggccaggt cgacatgagc 600
acctaccgct accgggcgcg gccgggttac gtgaacttcg actacggttg gtacgacgag 660
cagacgaaca actggtggca cgccaaccac gcggagccgg gcatgaaggt ctaccagagc 720
acgttgcggt actactcccg gccgctgctg gatttcgacg agcaggtttt caccgtggcg 780
ttcgcgcggg tcgcctga 798
2
