编码基于FVIII-BDD和异源信号肽的融合蛋白的分离的核酸及其用途
文献发布时间:2024-04-18 20:01:30
发明领域
本申请涉及遗传学、基因疗法和分子生物学的领域。更具体地,本发明涉及编码基于FVIII-BDD(B-结构域缺失的凝血因子VIII)和异源信号肽的融合蛋白的核酸,涉及基于此的表达盒和载体,涉及用于生产基于FVIII-BDD和异源信号肽的融合蛋白的宿主细胞,并且进一步涉及上述载体的各种用途。
发明背景
血友病是一种隐性的、X-连锁的遗传障碍,其造成参与继发性止血的蛋白之一的缺乏。血友病A(或经典血友病)是最常见的血友病变体;每5000名新生男性中就有1人患此病(2019年全球年度调查报告,WFH https://www.wfh.org/en/our-work-research-data/annual-global-survey),并且它由凝血因子VIII蛋白的缺乏造成。根据俄罗斯血友病协会(Russian Haemophilia Society),在俄罗斯有超过6500名血友病A患者(2019年全球年度调查报告,WFH)。
凝血因子VIII(FVIII)是一种主要从窦状隙肝上皮细胞分泌到血液中的280kDa蛋白(Fahs SA,Hille MT,Shi Q,Weiler H,Montgomery RR.A conditional knockoutmousemodel reveals endothelial cells as the principal and possibly exclusivesource of plasma factorVIII/Blood.2014年6月12日;123(24):3706-13.doi:10.1182/blood-2014-02-555151.2014年4月4日电子公开.PMID:24705491和Everett LA,CleurenAC,Khoriaty RN,Ginsburg D.Murine coagulation factorVIII is synthesized inendothelial cells/Blood.2014年6月12日;123(24):3697-705.doi:10.1182/blood-2014-02-554501.2014年4月9日电子公开.PMID:24719406)。活化的FVIII作为异源二聚体在生物体中循环,所述异源二聚体由通过非共价金属依赖性相互作用彼此结合的重链(A1、A2、B结构域)和轻链(A3、C1、C3结构域)组成。作为FVIII加工的结果,只有A1-A3、C1、C2结构域存在于该蛋白的活化形式中。这一事实促进了B-结构域缺失的重组FVIII(FVIII-BDD)的产生,其活性不劣于全长FVIII(Pittman DD,Alderman EM,Tomkinson KN,Wang JH,GilesAR,Kaufman RJ.Biochemical,immunological,and in vivo functionalcharacterization of B-domain-deleted factor VIII/Blood.1993年6月1日;81(11):2925-35.PMID:8499631)。不同于主要属于蛋白酶的凝血级联的其它蛋白,FVIII是一种糖蛋白。但是,它在活化的凝血因子X(FXa)的产生所必需的tenase复合物的形成中起重要作用,FXa是最后的共同凝血途径的第一个成员,该途径最终导致交联纤维蛋白形成。
FVIII基因的内含子1或内含子22的倒位造成超过一半病例的重度血友病A(Habart D,Kalabova D,Novotny M,Vorlova Z.Thirty-four novel mutations detectedin factor VIII gene by multiplex CSGE:modeling of 13 novel amino acidsubstitutions/J Thromb Haemost.2003年4月;1(4):773-81.doi:10.1046/j.1538-7836.2003.00149.x.PMID:1287141)。在其它情况下,FVIII序列中的异常与各种突变有关,所述突变包括反义突变、读框移位、剪接位点突变、缺失和插入。
在血友病A中的出血倾向与定义的FVIII活性相关,并且被分类为轻度(0.05-0.40IU/mL)、中度(0.01-0.05IU/ml)或重度(<0.01IU/ml)。轻度血友病患者通常经历仅与医学干预或损伤有关的异常出血。相反,中度血友病患者对相对较轻的损伤表现出延长的出血反应,而重度疾病患者经常具有自发性出血。重度血友病A表现出自发性关节积血、软组织血肿、腹膜后出血、脑内出血和延迟术后出血。随着时间的推移,由复发性关节积血和软组织血肿引起的并发症可以导致严重的关节病、关节挛缩和假肿瘤,从而导致慢性疾病。具有血友病A的轻度、中度和重度变体的患者的比例尚不明确,但最近的流行病学研究报告称,约60%的血友病A患者具有重度变体(2019年全球年度调查报告,WFH)。
迄今为止,重组FVIII注射剂形式的终身替代疗法是血友病A患者的护理标准(2019年全球年度调查报告,WFH)。尽管在治疗血友病方面取得了成功,但这种方案仍具有严重问题。血友病A的预防性替代疗法包括在患有该疾病的重度变体的患者的一生中每3天一次静脉内注射重组FVIII。这种治疗方案是非常昂贵的,并且不能保证没有主要与关节积血相关的并发症。在某些情况下,患者产生抑制性抗体。血友病A的抑制性变体更常见于重度疾病的患者中,并且需要使用替代方案来治疗和预防该疾病(Eckhardt CL,van der BomJG,van der Naald M,Peters M,Kamphuisen PW,Fijnvandraat K.Surgery andinhibitor development in haemophilia A:a systematic review/J ThrombHaemost.2011年10月;9(10):1948-58.doi:10.1111/j.1538-7836.2011.04467.x.PMID:21838755)。
借助于编码FVIII基因的基于腺伴随病毒(AAV)的病毒(表达)载体的血友病A的基因疗法已经在一系列临床前和临床研究中显示出优秀结果(Bunting S,Zhang L,Xie L,Bullens S,Mahimkar R,Fong S,Sandza K,Harmon D,Yates B,Handyside B,Sihn CR,Galicia N,Tsuruda L,O'Neill CA,Bagri A,Colosi P,Long S,Vehar G,Carter B.GeneTherapywith BMN 270 Results in Therapeutic Levels of FVIII in Mice andPrimates and Normalization of Bleeding in Hemophilic Mice/Mol Ther.2018年2月7日;26(2):496-509.doi:10.1016/j.ymthe.2017.12.009.2017年12月14日电子公开.PMID:29292164和Peyvandi F,Garagiola I.Clinical advances in gene therapy updates onclinical trials of gene therapy in haemophilia/Haemophilia.2019年9月;25(5):738-746.doi:10.1111/hae.13816.2019年7月8日电子公开.PMID:31282050)。与治疗血友病的传统方案不同,使用AAV的基因疗法允许在给患者单次施用治疗剂后数年内将外源性FVIII的表达水平维持在足够的水平(Long BR,Veron P,Kuranda K,Hardet R,MitchellN,Hayes GM,Wong WY,Lau K,Li M,Hock MB,Zoog SJ,Vettermann C,Mingozzi F,Schweighardt B.Early Phase Clinical Immunogenicity of ValoctocogeneRoxaparvovec,an AAV5-Mediated Gene Therapy for Haemophilia A/Mol Ther.2021年2月3日;29(2):597-610.doi:10.1016/j.ymthe.2020.12.008.2020年12月10日电子公开.PMID:33309883)。
迄今为止,在世界上还没有注册用于治疗血友病A的基因治疗产品。
因此,需要开发用于治疗血友病A的基因治疗产品,以及将提高用于治疗血友病A的基因治疗产品的效力的解决方案。
发明内容
本发明的作者出人意料地发现,与使用编码具有天然存在的FVIII信号肽(野生型)的FVIII-BDD蛋白的核酸相比,使用编码以下融合蛋白的核酸造成增加的FVIII-BDD蛋白生产和活性水平:
1)具有SEQ ID NO:7的氨基酸序列的基于FVIII-BDD和FIX信号肽(SP-FIX)的融合蛋白,或
2)具有SEQ ID NO:8的氨基酸序列的基于FVIII-BDD和免疫球蛋白Gκ链信号肽(SP-IgGK)的融合蛋白,或
3)具有SEQ ID NO:9的氨基酸序列的基于FVIII-BDD和乳清蛋白信号肽(SP-乳清蛋白)的融合蛋白。
定义和一般方法
除非在本文中另外定义,否则结合本发明使用的所有技术和科学术语将具有本领域技术人员通常理解的相同含义。
此外,除非上下文另外要求,否则单数术语应包括复数术语,并且复数术语应包括单数术语。通常,本文描述的细胞培养、分子生物学、免疫学、微生物学、遗传学、分析化学、有机合成化学、医学和药物化学以及蛋白和核酸的杂交和化学的当前分类和方法是本领域技术人员众所周知的并且在本领域中被广泛使用。如本领域常见的,或如本文描述的,根据生产商的指南进行酶反应和纯化方法。
术语“天然存在的”、“天然的”或“野生型”用于描述可在自然界中发现的与人工生产的物体不同的物体。例如,存在于生物体(包括病毒)中的蛋白或核苷酸序列是天然存在的,所述序列可以从自然界中的来源分离出来并且没有在实验室中被人故意修饰。
如在本说明书和随后的权利要求书中所使用的,除非上下文另有规定,否则词语“包括(include)”和“包含(comprise)”或其变体,诸如“包括”(includes)、“包括”(including)、“包含(comprises)”或“包含(comprising)”应理解为暗示包括所述的整数或整数集合,但是不排除任何其它整数或整数集合。
蛋白(肽)
如在本说明书中使用的,术语“肽”、“多肽”和“蛋白”可互换使用,并且它们表示由通过肽键共价连接的氨基酸残基组成的化合物。多肽包括天然肽、重组肽、合成肽或其组合。
核酸分子
在本说明书中可互换使用的术语“核酸”、“核酸序列(nucleic sequence)”、“核酸序列(nucleic acid sequence)”、“多核苷酸”、“寡核苷酸”、“多核苷酸序列”和“核苷酸序列”是指精确的核苷酸序列(无论是否修饰),其决定核酸的片段或区域(无论是否含有非天然核苷酸),并且是双链DNA或RNA、单链DNA或RNA、或所述DNA的转录产物。
如在本说明书中使用的,作为非限制性例子,多核苷酸包括通过本领域可用的任何方式获得的所有核酸序列,作为非限制性例子,所述方式包括重组方式,即使用普通克隆技术和PCR等从重组文库或细胞基因组克隆核酸序列,以及通过合成方式。
这里还应包括,本发明不涉及在其天然染色体环境中(即在天然状态下)的核苷酸序列。本发明的序列已经被分离和/或纯化,即它们被直接或间接采样,例如通过复制,它们的环境已经被至少部分地改变。因此,本文还应提及通过重组遗传学(例如借助于宿主细胞)或通过化学合成而获得的分离的核酸。
除非另外指出,否则术语核苷酸序列涵盖其互补物。因此,具有特定序列的核酸应被理解为涵盖具有其互补序列的其互补链的核酸。
载体
本文中使用的术语“载体”是指能够运输已经与其连接的另一种核酸的核酸分子。此外,术语“载体”在本文中表示能够运输核酸的重组病毒颗粒。
在本说明书中使用的术语“表达”被定义为由其启动子驱动的特定核苷酸序列的转录和/或翻译。
用途
“基因疗法”是将基因插入受试者的细胞和/或组织中,以治疗疾病,通常是遗传性疾病,其中有缺陷的突变体等位基因被功能性等位基因替换。
“治疗(Treat)”、“治疗(treatment)”和“疗法(therapy)”表示减轻或消除生物障碍和/或至少一种其附随症状的方法。
术语”受试者”、“患者”、“个体”等在本说明书中可互换使用,并且它们表示适用于在本说明书中描述的方法的任何动物。在某些非限制性的实施方案中,所述受试者、患者或个体是人。所述受试者可以是任何年龄的雄性或雌性。
“治疗有效量”或“有效量”表示正在施用的治疗剂的量,该量将在某种程度上缓解正在治疗的疾病的一种或多种症状。
发明详述
核酸
在一个方面,本发明涉及一种分离的核酸,其编码包括选自SEQ ID NO:7、SEQ IDNO:8或SEQ ID NO:9的氨基酸序列的基于FVIII-BDD(B-结构域缺失的凝血因子VIII)和异源信号肽的融合蛋白。
“分离的”核酸分子是从至少一种核酸分子-杂质中鉴定和分离出的核酸分子。分离的核酸分子不同于在自然条件下发现的形式或集合。因此,分离的核酸分子不同于存在于在自然条件下的细胞中的核酸分子。
信号肽提供在细胞内的目标蛋白向靶细胞器的运输,或促进目标蛋白向细胞间隙中的分泌。
在某些实施方案中,所述分离的核酸编码融合蛋白,其基于具有SEQ ID NO:5的氨基酸序列的FVIII-BDD和具有SEQ ID NO:2的氨基酸序列的FIX信号肽。
在某些实施方案中,所述分离的核酸编码融合蛋白,其基于具有SEQ ID NO:5的氨基酸序列的FVIII-BDD和具有SEQ ID NO:3的氨基酸序列的免疫球蛋白Gκ链信号肽。
在某些实施方案中,所述分离的核酸编码融合蛋白,其基于具有SEQ ID NO:5的氨基酸序列的FVIII-BDD和具有SEQ ID NO:4的氨基酸序列的乳清蛋白信号肽。
在某些实施方案中,所述分离的核酸编码具有SEQ ID NO:7的氨基酸序列的基于FVIII-BDD和异源信号肽的融合蛋白。具有SEQ ID NO:7的氨基酸序列的给定融合蛋白包括具有SEQ ID NO:5的氨基酸序列的FVIII-BDD和具有SEQ ID NO:2的氨基酸序列的FIX信号肽。
在某些实施方案中,所述分离的核酸编码具有SEQ ID NO:8的氨基酸序列的基于FVIII-BDD和异源信号肽的融合蛋白。具有SEQ ID NO:8的氨基酸序列的给定融合蛋白包括具有SEQ ID NO:5的氨基酸序列的FVIII-BDD和具有SEQ ID NO:3的氨基酸序列的免疫球蛋白Gκ链信号肽。
在某些实施方案中,所述分离的核酸编码具有SEQ ID NO:9的氨基酸序列的基于FVIII-BDD和异源信号肽的融合蛋白。具有SEQ ID NO:9的氨基酸序列的给定融合蛋白包括具有SEQ ID NO:5的氨基酸序列的FVIII-BDD和具有SEQ ID NO:4的氨基酸序列的乳清蛋白信号肽。
在某些实施方案中,所述分离的核酸是SEQ ID NO:11的核苷酸序列。所述给定的核酸编码具有SEQ ID NO:7的氨基酸序列的基于FVIII-BDD和FIX信号肽的融合蛋白。
在某些实施方案中,所述分离的核酸是SEQ ID NO:12的核苷酸序列。所述给定的核酸编码具有SEQ ID NO:8的氨基酸序列的基于FVIII-BDD和免疫球蛋白Gκ链信号肽的融合蛋白。
在某些实施方案中,所述分离的核酸是SEQ ID NO:13的核苷酸序列。所述给定的核酸编码具有SEQ ID NO:9的氨基酸序列的基于FVIII-BDD和乳清蛋白信号肽的融合蛋白。
表达盒、表达载体
在一个方面,本发明涉及一种表达盒,其包括编码基于FVIII-BDD和异源信号肽的融合蛋白的上述核酸。
本文中使用的术语“表达……的盒”或“表达盒”特别表示能够在适当的条件下触发编码目标多肽的多核苷酸的表达的DNA片段,所述多核苷酸的序列被包括在所述表达盒中。当引入宿主细胞中时,表达盒尤其能够衔接细胞机制以将编码目标多肽的多核苷酸转录成RNA,所述RNA然后通常进一步加工并最终翻译成目标多肽。表达盒可以被包含在表达载体中。
本发明的表达盒包含启动子作为元件。本文中使用的术语“启动子”特别表示促进启动子可操作地连接的多核苷酸的转录的DNA元件。启动子可以进一步形成启动子/增强子元件的一部分。尽管“启动子”和“增强子”元件之间的物理边界并不总是明确的,但术语“启动子”通常表示在核酸分子上被RNA聚合酶和/或任何相关因子结合并且在该处开始转录的位点。增强子在时间上以及在空间上增强启动子活性。本领域已知许多启动子在广泛的细胞类型中具有转录活性。启动子可以分为两类,即组成性地起作用的启动子和通过诱导或去抑制来调节的启动子。这两类都适合用于蛋白表达。用于在真核细胞中、特别是在哺乳动物细胞中高水平生产多肽的启动子应当是强的并且优选地在广泛的细胞类型中具有活性。能够在许多细胞类型中驱动表达的强组成型启动子是本领域众所周知的,并且因此,本文没有必要详细描述它们。
根据本发明的一个实施方案,将HLP启动子用在本发明的表达盒中。
在某些实施方案中,所述表达盒在5’端到3’端方向包括以下元件:
左侧(第一个)ITR(反向末端重复序列);
启动子;
编码基于FVIII-BDD和异源信号肽的融合蛋白的上述核酸中的任一种;
聚腺苷酸化信号;
右侧(第二个)ITR。
表达盒的上述结构元件彼此可操作地连接。
本文中使用的术语“可操作地连接的”表示发生功能关联的多核苷酸(或多肽)元件的连接。当一个核酸存在与另一个核酸序列的功能关联条件时,所述核酸是“可操作地连接的”。例如,如果转录调节序列影响编码序列的转录,则其可操作地连接至所述编码序列。术语“可操作地连接的”是指,被连接的DNA序列通常是连续的,并且在需要连接两个蛋白编码区的情况下,也是连续的并存在于读码框中。
在某些实施方案中,所述表达盒包括具有SEQ ID NO:14的核苷酸序列的左侧(第一个)ITR。
在某些实施方案中,所述表达盒包括具有SEQ ID NO:15的核苷酸序列的HLP启动子。
在某些实施方案中,所述表达盒包括具有SEQ ID NO:16的核苷酸序列的聚腺苷酸化信号。
在某些实施方案中,所述表达盒包括具有SEQ ID NO:17的核苷酸序列的右侧(第二个)ITR。
在某些实施方案中,所述表达盒在5’端到3’端方向包括以下元件:
具有SEQ ID NO:14的核苷酸序列的左侧(第一个)ITR(反向末端重复序列);
具有SEQ ID NO:15的核苷酸序列的启动子;
编码基于FVIII-BDD和异源信号肽的融合蛋白的上述核酸中的任一种;
具有SEQ ID NO:16的核苷酸序列的聚腺苷酸化信号;
具有SEQ ID NO:17的核苷酸序列的右侧(第二个)ITR。
在一个方面,本发明涉及一种表达载体,其包括编码基于FVIII-BDD和异源信号肽的融合蛋白的上述核酸中的任一种或上述表达盒中的任一种。
在本发明的某些实施方案中,所述载体是质粒,即可以在其中插入额外DNA区段的环状双链DNA段。
在本发明的某些实施方案中,所述载体是病毒(表达)载体,其中可以将额外DNA区段插入病毒基因组中。
在本发明的某些实施方案中,载体能够在其被引入的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和附加型载体)。在本发明的进一步实施方案中,载体(例如非附加型载体)可以在引入宿主细胞后整合到宿主细胞的基因组中,并从而与宿主基因一起复制。此外,某些载体能够指导与其可操作地连接的基因的表达。这样的载体在本文中被称作“重组表达载体”(或简单地称作“表达载体”)。
表达载体包括质粒、逆转录病毒、腺病毒、腺伴随病毒(AAV)、植物病毒,诸如花椰菜花叶病毒、烟草花叶病毒、粘粒、YAC、EBV等。可以将DNA分子插入载体中,使得载体内的转录和翻译控制序列发挥其调节DNA的转录和翻译的预期功能。可以选择与所使用的表达宿主细胞相容的表达载体和表达控制序列。通过标准方法(例如互补限制位点的连接,或者如果不存在限制位点则进行平头末端连接)可以将DNA分子引入表达载体中。
在某些实施方案中,所述表达载体是重组腺伴随病毒(AAV)。
在某些实施方案中,所述AAV选自包括下述AAV血清型的集合:AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9、AAV10、AAV11、AAV12、AAV13、AAV14、AAV15、AAV16、rAAV.rh8、rAAV.rhlO、rAAV.rh20、rAAV.rh39、rAAV.Rh74、rAAV.RHM4-l、AAV.hu37、rAAV.Anc80、rAAV.Anc80L65、rAAV.7m8、rAAV.PHP.B、rAAV2.5、rAAV2tYF、rAAV3B、rAAV.LK03、AAV.HSC1、AAV.HSC2、AAV.HSC3、AAV.HSC4、AAV.HSC5、AAV.HSC6、AAV.HSC7、AAV.HSC8、AAV.HSC9、AAV.HSC10、AAV.HSC11、AAV.HSC12、AAV.HSC13、AAV.HSC14、AAV.HSC15或AAV.HSC16。
在本发明的某些实施方案中,所述载体或盒可以包括表达控制序列。在本说明书中使用的术语“表达控制序列”表示引起其插入的编码序列的表达和加工所必需的多核苷酸序列。本领域技术人员将理解,表达载体或盒的设计(包括表达控制序列的选择)可能取决于诸如要转化的宿主细胞的类型的选择、所需的蛋白表达水平等因素。表达控制序列包括合适的转录起始、终止、启动子和增强子序列;有效的RNA加工信号诸如剪接和聚腺苷酸化信号;稳定细胞质mRNA的序列;提高翻译效率的序列(即,Kozak共有序列);增强蛋白稳定性的序列;以及当需要时,增强蛋白分泌的序列。这样的控制序列的性质随宿主生物而变化;在原核生物中,这样的控制序列通常包括启动子、核糖体结合位点和转录终止序列;在真核生物中,这样的控制序列通常包括启动子和转录终止序列。在哺乳动物中的表达宿主细胞的优选表达控制序列包括确保在哺乳动物细胞中的高蛋白表达水平的病毒元件,诸如从逆转录病毒LTR、巨细胞病毒(CMV)(诸如CMV启动子/增强子)、猿猴病毒40(SV40)(诸如SV40启动子/增强子)、腺病毒(例如主要晚期启动子腺病毒(AdMLP))、多瘤病毒衍生出的启动子和/或增强子,和强哺乳动物启动子诸如TTR启动子、天然免疫球蛋白启动子、肌动蛋白启动子和HLP(杂合的肝特异性启动子)。表达控制序列至少涵盖其存在对于表达和加工而言重要的所有组分。
除了上述基因和表达控制序列之外,本发明的重组表达载体还可以携带额外的序列,诸如调节载体在宿主细胞中的复制的序列(例如复制起点)和可选择标志物基因。可选择标志物基因有助于在其中已经引入载体或盒的宿主细胞的选择。
在本发明的一个实施方案中,所述表达载体涉及包含侧接细小病毒序列或反向末端重复(ITR)序列的一个或多个目标多核苷酸序列、目标基因或转基因的载体。
本发明的盒和载体都不包含编码腺伴随病毒的非结构蛋白(Rep)和结构蛋白(Cap)的基因的核苷酸序列。
宿主细胞
在一个方面,本发明涉及一种宿主细胞,其用于生产基于FVIII-BDD和异源信号肽的融合蛋白,或用于生产上述表达载体中的任一种,所述宿主细胞包含编码基于FVIII-BDD和异源信号肽的融合蛋白的上述核酸中的任一种。
本文中使用的术语“宿主细胞”表示已将根据本发明的重组表达载体或盒引入其中的细胞。本发明涉及宿主细胞,其可以包括例如根据本发明的上述载体。应当理解,“宿主细胞”不仅指特定的受试细胞,而且还指这样的细胞的后代。因为修饰可能由于突变或环境影响而发生在后代中,因此这样的后代可能实际上与亲本细胞不相同;但是,这样的细胞仍然被包括在本文所使用的术语“宿主细胞”的范围内。
根据本发明的表达载体或盒可以用于哺乳动物细胞、植物细胞、细菌或酵母宿主细胞的转染。通过将多核苷酸引入宿主细胞中的任何已知技术,可以完成转染。用于将异源多核苷酸引入哺乳动物细胞中的方法是本领域众所周知的,并且包括葡聚糖介导的转染、阳离子聚合物-核酸复合物转染、磷酸钙沉淀、聚凝胺介导的转染、原生质体融合、将多核苷酸包封在脂质体中以及将DNA直接显微注射到细胞核中。此外,可以通过病毒(表达)载体将核酸分子引入哺乳动物细胞中。
用作转化用的宿主的哺乳动物细胞系是本领域众所周知的,并且包括多个可用的永生化细胞系。这些包括例如中国仓鼠卵巢(CHO)细胞、NS0细胞、SP2细胞、HEK-293T细胞、FreeStyle 293细胞(Invitrogen)、NIH-3T3细胞、HeLa细胞、幼仓鼠肾(BHK)细胞、非洲绿猴肾细胞(COS)、人肝细胞癌细胞(例如,Hep G2)、A549细胞、SK-HEP1、HUH7、Hep-RG和许多其它细胞系。通过确定哪些细胞系具有高表达水平并提供所生产的蛋白的必要特征来选择细胞系。可以使用的其它细胞系是昆虫细胞系,诸如Sf9或Sf21细胞。当将本发明的重组表达载体引入哺乳动物宿主细胞中时,通过将宿主细胞培养足以在宿主细胞中表达融合蛋白的时间段来生产融合蛋白,或者更优选地,将融合蛋白分泌到在其中培养宿主细胞的培养基中。使用标准的蛋白纯化技术,可以从培养基中分离融合蛋白。植物宿主细胞包括例如烟草(Nicotiana)、拟南芥(Arabidopsis)、浮萍、玉米、小麦、马铃薯等。细菌宿主细胞包括埃希氏菌属(Escherichia)和链霉菌属(Streptomyces)物种。酵母宿主细胞包括粟酒裂殖酵母(Schizosaccharomyces pombe)、酿酒酵母(Saccharomyces cerevisiae)和巴斯德毕赤酵母(Pichia pastoris)。
上述宿主细胞不表示使用人胚胎生产的宿主细胞。
上述宿主细胞不表示通过修饰人种系细胞的遗传完整性而生产的宿主细胞。
药物组合物
在一个方面,本发明涉及用于将FVIII-BDD基因递送给靶细胞的药物组合物,其包括上述表达载体或盒中的任何一种。
在某些实施方案中,用于将FVIII-BDD基因递送给靶细胞的药物组合物包括与一种或多种药学上可接受的赋形剂组合的上述表达载体或盒中的任何一种。
上述组合物中的活性物质以有效量存在,例如以生物有效量存在。
“药物组合物”是指这样的组合物:其包含根据本发明的上述表达载体中的任一种和至少一种选自由药学上可接受的和药理学上相容的赋形剂、填充剂、溶剂、稀释剂、载剂、助剂、分配剂或递送剂组成的集合的组分。
本发明的药物组合物及其制备方法对本领域技术人员来说无疑是显而易见的。所述药物组合物应优选按照GMP(良好生产规范)要求来制备。
在药物组合物的某些实施方案中,它可以包括缓冲组合物、张度剂(渗透调节剂或渗透剂)、稳定剂和/或增溶剂。
“药学上可接受的”是指不具有生物学或其它负面副作用的材料,例如,该材料可以施用给受试者而不造成任何不希望的生物学作用。因此,这样的药物组合物可以用于例如细胞的离体转染或本发明的上述表达载体中的任一种直接向受试者的体内施用。
术语“赋形剂”在本文中用于描述除了本发明的以上成分以外的任何成分。这些是无机或有机性质的物质,其用于药物生产/制备中以便赋予药物产品必要的物理化学性能。
根据本发明的药物组合物是一种稳定的组合物。
如果活性剂在指定的贮存期限中在例如2-8℃的贮存温度保持其物理稳定性和/或化学稳定性和/或生物活性,那么药物组合物是“稳定的”。优选地,活性剂保持物理和化学稳定性、以及生物活性。基于在加速或天然老化条件下的稳定性试验的结果调节贮存期。
在某些实施方案中,所述药物组合物是用于静脉内施用的溶液。
在某些实施方案中,所述药物组合物是用于制备用于静脉内施用的溶液的浓缩物。
用途
在一个方面,本发明涉及上述表达盒或载体中的任一种或上述组合物将FVIII-BDD基因递送给靶细胞的用途。
在一个方面,本发明涉及上述表达盒或载体中的任一种或上述组合物将FVIII-BDD蛋白提供给受试者的用途,所述受试者具有血友病A和/或不具有FVIII基因的功能性拷贝。
FVIII基因的功能性拷贝的缺失表示在基因组的FVIII基因的所有拷贝中的灭活突变或缺失,这导致FVIII基因的功能的丧失或缺陷。
在一个方面,本发明涉及一种向具有血友病A的受试者提供FVIII-BDD蛋白的方法,其包含将治疗有效量的上述表达载体中的任一种或上述组合物引入有此需要的受试者的细胞中。
在一个方面,本发明涉及一种将FVIII-BDD基因递送给具有血友病A的受试者的靶细胞的方法,其包含将上述表达载体中的任一种或上述组合物引入所述受试者的细胞中。
需要将FVIII-BDD基因递送给靶细胞的受试者,或需要提供FVIII-BBD蛋白的受试者表示具有血友病A的受试者,或表示具有凝血因子FVIII缺乏症的受试者,或表示在FVIII基因中具有导致FVIII基因的功能丧失或缺陷的灭活突变或缺失的受试者。
在一个方面,本发明涉及上述表达载体中的任一种或上述组合物用于在具有血友病A的受试者中治疗血友病A的用途。
在一个方面,本发明涉及一种用于治疗受试者中的血友病A的方法,其包含将治疗有效量的上述表达载体中的任一种或上述组合物施用给具有血友病A的受试者中。
在某些实施方案中,血友病A是重度血友病A(<1%因子VIII活性)或中度血友病A(1-5%因子VIII活性)。
示例性施用模式包括局部应用、鼻内、吸入、透粘膜、透皮、肠内(例如口服、直肠)、胃肠外(例如静脉内、皮下、真皮内、肌肉内)施用、以及直接组织或器官注射。
在所述用途的某些实施方案中,将上述表达载体中的任一种或上述组合物作为静脉内输注施用给受试者。
将上述表达载体中的任一种以有效量施用给生物体中。优选地将上述表达载体中的任一种以生物有效量施用给生物体中。表达载体的“生物有效”量是足以造成细胞转导和核酸序列在细胞中的表达的量。如果将表达载体施用至体内细胞中,则表达载体的“生物有效”量是足以造成靶细胞的转导和核酸序列在靶细胞中的表达的量。
根据本发明的上述表达载体中的任一种的剂量将取决于特定载体的施用模式,并且可以以常规方式确定它们。
用于施用根据本发明的上述表达盒或载体中的任一种的细胞可以是任何类型的细胞,包括但不限于上皮细胞(例如皮肤、呼吸道和肠道上皮细胞)、肝细胞、肌细胞、胰腺细胞(包括胰岛细胞)、肝细胞、脾细胞、成纤维细胞、内皮细胞等。
根据本发明的上述表达盒或载体中的任一种不用于修饰人种系细胞的遗传完整性。
在所述用途的某些实施方案中,根据本发明的上述表达载体中的任一种以及基于此的产品被用作单一疗法。
在所述用途的某些实施方案中,将根据本发明的上述表达载体中的任一种以及基于此的产品与使用凝血因子浓缩物、去氨加压素和/或纤维蛋白溶解抑制剂的替代疗法联合使用。
在所述用途的某些实施方案中,将根据本发明的上述表达载体中的任一种以及基于此的产品与单克隆抗体(例如,emicizumab)联合使用。
在所述用途的某些实施方案中,将根据本发明的上述表达载体中的任一种以及基于此的治疗剂与RNA干扰治疗剂(例如,fitusiran)联合使用。
在所述用途的某些实施方案中,将根据本发明的上述表达载体中的任一种以及基于此的产品施用给受试者中一次。
在所述用途的某些实施方案中,将根据本发明的上述表达载体中的任一种以及基于此的产品重复地施用给受试者中。
附图简述
图1的图显示了与编码具有野生型FVIII信号肽的FVIII-BDD的核酸相比,在用编码基于FVIII-BDD(B-结构域缺失的凝血因子VIII)和异源信号肽之一的融合蛋白的核酸转染以后,在培养液中增加的FVIII-BDD蛋白生产水平。
1是用核酸转染细胞以后的FVIII-BDD蛋白水平,所述核酸编码具有SEQ ID NO:6的氨基酸序列的基于人FVIII-BDD和天然存在的FVIII信号肽的融合蛋白(SP-FVIII-FVIII-BDD)。
2是用核酸转染细胞以后的FVIII-BDD蛋白水平,所述核酸编码具有SEQ ID NO:7的氨基酸序列的基于FVIII-BDD和FIX信号肽的融合蛋白(SP-FIX-FVIII-BDD)。
3是用核酸转染细胞以后的FVIII-BDD蛋白水平,所述核酸编码具有SEQ ID NO:9的氨基酸序列的基于人FVIII-BDD和乳清蛋白信号肽的融合蛋白(SP-乳清蛋白-FVIII-BDD)。
4是用核酸转染细胞以后的FVIII-BDD蛋白水平,所述核酸编码具有SEQ ID NO:8的氨基酸序列的基于人FVIII-BDD和免疫球蛋白Gκ链信号肽的融合蛋白(SP-IgGK-FVIII-BDD)。
图2的图显示了与编码具有野生型FVIII信号肽的FVIII-BDD的核酸相比,在用编码基于FVIII-BDD(B-结构域缺失的凝血因子VIII)和异源信号肽之一的融合蛋白的核酸转染以后在培养液中增加的FVIII-BDD蛋白活性水平。
1是在用核酸转染细胞以后的FVIII-BDD活性水平,所述核酸编码具有SEQ ID NO:6的氨基酸序列的基于人FVIII-BDD和天然存在的FVIII信号肽的融合蛋白(SP-FVIII-FVIII-BDD)。
2是在用核酸转染细胞以后的FVIII-BDD活性水平,所述核酸编码具有SEQ ID NO:7的氨基酸序列的基于FVIII-BDD和FIX信号肽的融合蛋白(SP-FIX-FVIII-BDD)。
3是在用核酸转染细胞以后的FVIII-BDD活性水平,所述核酸编码具有SEQ ID NO:9的氨基酸序列的基于人FVIII-BDD和乳清蛋白信号肽的融合蛋白(SP-乳清蛋白-FVIII-BDD)。
4是在用核酸转染细胞以后的FVIII-BDD活性水平,所述核酸编码具有SEQ ID NO:8的氨基酸序列的基于人FVIII-BDD和免疫球蛋白Gκ链信号肽的融合蛋白(SP-IgGK-FVIII-BDD)。
图3的图显示了与包含编码具有野生型FVIII信号肽的FVIII-BDD的核酸的rAAV表达载体相比,当以包含编码基于FVIII-BDD和异源信号肽之一的融合蛋白的核酸的rAAV表达载体的形式在体外递送核酸时增加的FVIII-BDD蛋白生产水平。
1是在用表达载体转导细胞以后的FVIII-BDD蛋白水平,所述表达载体包含编码具有SEQ ID NO:6的氨基酸序列的基于人FVIII-BDD和天然存在的FVIII信号肽的融合蛋白(SP-FVIII-FVIII-BDD)的核酸。
2是在用表达载体转导细胞以后的FVIII-BDD蛋白水平,所述表达载体包含编码具有SEQ ID NO:7的氨基酸序列的基于FVIII-BDD和FIX信号肽的融合蛋白(SP-FIX-FVIII-BDD)的核酸。
3是在用表达载体转导细胞以后的FVIII-BDD蛋白水平,所述表达载体包含编码具有SEQ ID NO:9的氨基酸序列的基于人FVIII-BDD和乳清蛋白信号肽的融合蛋白(SP-乳清蛋白-FVIII-BDD)的核酸。
图4的图显示了与包含编码具有野生型FVIII信号肽的FVIII-BDD的核酸的rAAV表达载体相比,当以包含编码基于FVIII-BDD和异源信号肽之一的融合蛋白的核酸的rAAV表达载体的形式在体外递送核酸时增加的FVIII-BDD蛋白活性水平。
1是在用表达载体转导细胞以后的FVIII-BDD活性水平,所述表达载体包含编码具有SEQ ID NO:6的氨基酸序列的基于人FVIII-BDD和天然存在的FVIII信号肽的融合蛋白(SP-FVIII-FVIII-BDD)的核酸。
2是在用表达载体转导细胞以后的FVIII-BDD活性水平,所述表达载体包含编码具有SEQ ID NO:7的氨基酸序列的基于FVIII-BDD和FIX信号肽的融合蛋白(SP-FIX-FVIII-BDD)的核酸。
3是在用表达载体转导细胞以后的FVIII-BDD活性水平,所述表达载体包含编码具有SEQ ID NO:9的氨基酸序列的基于人FVIII-BDD和乳清蛋白信号肽的融合蛋白(SP-乳清蛋白-FVIII-BDD)的核酸。
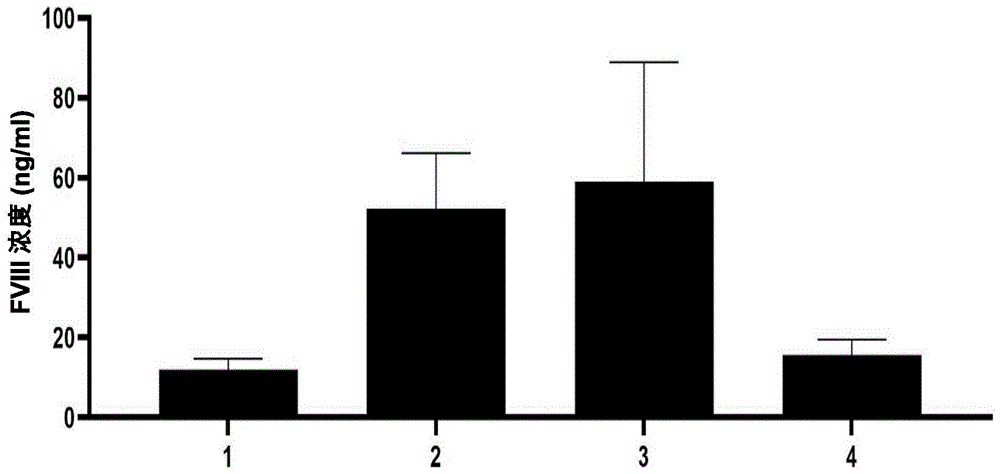
图5的图显示了当以rAAV表达载体的形式将编码基于FVIII-BDD和异源信号肽之一的融合蛋白的核酸在体内递送给B6.129S-F8tm1Smoc(HemA)小鼠时增加的FVIII-BDD蛋白水平。
1是注射不含AAV的对照溶液以后在动物血浆中的FVIII-BDD蛋白水平(阴性对照)。
2是在注射表达载体以后在动物血浆中的FVIII-BDD蛋白水平,所述表达载体包含编码具有SEQ ID NO:7的氨基酸序列的基于FVIII-BDD和FIX信号肽的融合蛋白(SP-FIX-FVIII-BDD)的核酸。
3是在注射表达载体以后在动物血浆中的FVIII-BDD蛋白水平,所述表达载体包含编码具有SEQ ID NO:9的氨基酸序列的基于人FVIII-BDD和乳清蛋白信号肽的融合蛋白(SP-乳清蛋白-FVIII-BDD)的核酸。
实施例
为了更好地理解本发明,提供以下实施例。这些实施例只是用于说明的目的,不应解释为以任何方式限制本发明的范围。
在本说明书中引用的所有出版物、专利和专利申请通过引用并入本文。尽管为了理解清楚的目的已经通过说明和实施例对前述发明进行了比较详细的描述,但是本领域普通技术人员考虑到本发明的教导会容易地明白,可以对其做出某些改变和修改而不脱离所附实施方案的精神或范围。
材料和一般方法
重组DNA技术
如在Sambrook,J.等人,Molecular cloning:A laboratory manual;Cold SpringHarbor Laboratory Press,Cold Spring Harbor,New York,1989中所描述的,使用标准方法操作DNA。根据生产商的方案使用分子生物学试剂。简而言之,在选择性抗生素压力下生长的大肠杆菌细胞中生产质粒DNA以供进一步操作,使得所述质粒不会在细胞群体中丢失。我们使用商业试剂盒从细胞中分离质粒DNA,测量浓度,并通过限制性内切核酸酶处理或PCR扩增将其用于克隆。使用连接酶将DNA片段彼此连接,并转化到细菌细胞中用于克隆的选择和进一步生产。所有得到的遗传构建体都通过限制性模式和完整Sanger测序得到了证实。
基因合成
从通过化学合成制备的寡核苷酸制备期望的基因区段。通过将寡核苷酸在彼此顶部复性,随后从边界引物进行PCR扩增,收集300-1000bp长的基因片段(其侧接独特的限制位点)。结果,产生片段的混合物,包括期望的片段。将所述片段在限制位点处克隆到中间载体中,随后通过DNA测序确认亚克隆片段的DNA序列。
DNA序列确定
通过Sanger测序确定DNA序列。分析DNA和蛋白序列,并在SnapGene Viewer 4.2或更高版本中处理序列数据,用于序列创建、绘制、分析、注释和说明。
培养细胞培养物
实验使用了以下细胞系:HEK293(人胚胎肾克隆293)、HUH7(人肝细胞癌细胞系)和HepG2(人肝细胞癌细胞系)。将用于生产AAV的悬浮HEK293细胞在37℃和5%CO
细胞培养物的转染
为了评价在转染后融合蛋白的新变体的功能,我们使用了质粒,其包含用于表达hFVIII-BDD转基因的各种变体的表达盒。将HepG2细胞系以10000个细胞/cm
基于AAV的表达载体的组装和纯化
为了组装包含FVIII-BDD基因的密码子优化变体的AAV表达载体,我们使用了HEK293生产细胞,其被如下3种质粒转染:
1)包含用于表达hFVIII-BDD转基因的各种变体的AAV表达盒的质粒;
2)用于表达AAV6血清型Cap基因和AAV2血清型Rep基因的质粒。每个基因使用替代性读码框,编码几种蛋白产物;
3)用于表达AAV衣壳的组装和包装所需的腺病毒Ad2基因的质粒。
72小时以后,裂解细胞,并使用过滤、色谱法和超速离心方法纯化和浓缩颗粒。使用对重组病毒基因组的区域具有特异性的引物和样品,通过定量PCR来确定颗粒的滴度,并表示为每1ml中的病毒基因组拷贝数。
细胞培养物的转导
将HUH7细胞系以10000个细胞/cm
通过ELISA确定凝血因子VIII-BDD蛋白的量
通过非竞争性固相酶免疫测定(ELISA)的夹心法评估在HepG2细胞系转染和HUH7细胞系转导以后在培养液中以及在给动物(小鼠)注射靶候选物以后在血浆中血液凝血因子VIII-BDD蛋白的含量。简而言之,将在稀释缓冲液中稀释的样品引入用对凝血因子VIII-BDD特异性的一级抗体敏化的96-孔平板孔中。给相同平板加载用于绘制校正曲线的标准品,即对照品。将平板在37℃的温度温育1小时。在引入生物素化的抗体、链霉亲和素过氧化物酶缀合物的溶液和TMB之前,用洗涤缓冲液洗涤平板孔。引入含有对因子VIII-BDD特异性的生物素化检测抗体的溶液,并将平板在37℃的温度温育30分钟。然后将链霉亲和素过氧化物酶缀合物溶液加入所得复合物中,并将平板在37℃的温度温育30分钟。引入TMB溶液以观察酶反应。在达到所需的染色强度后,向所有孔中加入停止溶液以停止反应。然后测量平板孔中溶液的光密度。考虑样品的初步稀释,通过校正曲线确定试验样品中凝血因子VIII-BDD的浓度。
通过ELISA确定凝血因子VIII-BDD蛋白的活性水平
通过产色测定评估在用靶候选物转染HepG2细胞和转导HUH7细胞以后培养液中凝血因子VIII蛋白的活性。该测定基于这样的事实,即在钙离子、磷脂和因子IXa存在下,因子X转化为活化形式Xa,因子VIII在反应中作为辅因子起作用,并且因子X活化的速率与因子VIII的水平线性相关。简而言之,将在稀释缓冲液中稀释的培养液样品、用于绘制校正曲线的标准品和对照品引入96-孔平板的孔中。将平板在37℃的温度温育3分钟。将包含因子IXa、因子X、凝血酶、СаCl
对实验动物的体内研究
将缺乏FVIII的В6.129S-F8tm1Smoc(HemA)小鼠(6-8周龄的雄性)用于实验。经由向尾静脉中的单次静脉内注射,将产品施用给动物。将不含AAV的缓冲溶液施用给阴性对照组的动物。在施用产品前的注射当天进行血浆取样,然后在引入表达载体后的第14天和第56天进行血浆取样。
统计数据分析
结果指示,采用平均值±标准偏差(SD)、单向方差分析(ANOVA)接着Dunnett多重配对比较来比较实验结果,并确定它们是统计学显著的。
实施例1
为了增加蛋白FVIII-BDD(B-结构域缺失的凝血因子VIII)的分泌水平,通过将野生型FVIII信号肽的序列置换为与在SEQ ID NO:2(SP-FIX)或SEQ ID NO:3(SP-IgGK)或SEQID NO:4(SP-乳清蛋白)中指定的氨基酸序列对应的信号肽来修饰SEQ ID NO:6(SP-FVIII-FVIII-BDD)的序列,从而导致与SEQ ID NO:7(SP-FIX-FVIII-BDD)、SEQ ID NO:8(SP-IgGK-FVIII-BDD)和SEQ ID NO:9(SP-乳清蛋白FVIII-BDD)的氨基酸序列对应的融合蛋白的产生。
在由与SEQ ID NO:14的序列对应的左侧(第一个)ITR(反向末端重复序列)、HLP启动子(SEQ ID NO:15)、目标基因、聚腺苷酸化信号(SEQ ID NO:16)、右侧(第二个)ITR(SEQID NO:17)组成的表达盒中,在体外细胞转染过程中试验了得到的核酸,其编码包括选自SEQ ID NO:7、SEQ ID NO:8或SEQ ID NO:9的氨基酸序列的基于FVIII-BDD和异源信号肽之一的融合蛋白,其中所述目标基因是SEQ ID NO:10-13的序列之一。作为对照,我们使用了与SEQ ID NO:10的序列对应的编码包括天然存在的FVIII-BDD信号肽的人FVIII-BDD蛋白(SP-FVIII-FVIII-BDD)的核酸。
与使用编码SEQ ID NO:6的具有天然存在的信号肽的FVIII-BDD蛋白(SP-FVIII-FVIII-BDD)的SEQ ID NO:10的核酸相比,使用编码具有SEQ ID NO:7-9的序列的基于FVIII-BDD和异源信号肽之一的融合蛋白的SEQ ID NO:11-13的所有核酸导致增加的FVIII-BDD蛋白的生产(图1)和活性(图2)水平。进一步,与使用SEQ ID NO:10的核酸(SP-FVIII-FVIII-BDD)相比在转染后生产的培养液中FVIII-BDD蛋白生产水平的惊人增加被以下序列证实:具有4.3倍增加的SEQ ID NO:11的序列(SP-FIX-FVIII-BDD),具有1.3倍增加的SEQ ID NO:12的序列(SP-IgGK-FVIII-BDD),和具有4.9倍增加的SEQ ID NO:13的序列(SP-乳清蛋白-FVIII-BDD)。我们在转染后生产的培养液中观察到FVIII-BDD活性的类似结果:当将SEQ ID NO:10的核酸(SP-FVIII-FVIII-BDD)与SEQ ID NO:11(SP-FIX-FVIII-BDD)(8.6倍增加)、SEQ ID NO:12(SP-IgGK-FVIII-BDD)(1.9倍增加)和SEQ ID NO:13(SP-乳清蛋白FVIII-BDD)(7.2倍增加)的核酸进行比较时,观察到惊人增加。在FVIII-BDD蛋白生产结果和活性结果之间观察到的一致性指示,天然存在的FVIII-BDD信号肽置换为与SEQ IDNO:2(SP-FIX)或SEQ ID NO:3(SP-IgGK)或SEQ ID NO:4(SP-乳清蛋白)的氨基酸序列对应的信号肽导致FVIII-BDD蛋白生产和活性的显著增加,并且不会影响FVIII-BDD蛋白功能性。
因而,编码包括选自SEQ ID NO:7、SEQ ID NO:8或SEQ ID NO:9的氨基酸序列的基于FVIII-BDD和异源信号肽之一的融合蛋白的所得核酸能够造成在宿主细胞中的FVIII-BDD蛋白体外表达,并且具有在生产细胞中生产重组FVIII-BDD蛋白用于治疗血友病A的高潜力。
实施例2
我们生产了包含SEQ ID NO:11-13的核酸的rAAV表达载体,所述核酸编码包括选自SEQ ID NO:7-9的氨基酸序列的基于FVIII-BDD和异源信号肽的融合蛋白。通过体外转导HUH7细胞来检查所述表达载体。作为对照,我们使用了包含SEQ ID NO:10的核酸的rAAV表达载体,所述核酸编码与SEQ ID NO:6的序列对应的人FVIII-BDD蛋白(SP-FVIII-FVIII-BDD),其包括天然存在的FVIII信号肽。
与使用包含SEQ ID NO:10的核酸(SP-FVIII-FVIII-BDD)的表达载体相比,使用包含SEQ ID NO:11-13的核酸的表达载体导致增加的FVIII-BDD蛋白生产(图3)和活性(图4)水平。进一步,与使用具有SEQ ID NO:10的核酸(SP-FVIII-FVIII-BDD)的表达载体相比,在转导后生产的培养液中FVIII-BDD蛋白生产水平的惊人增加被以下表达载体证实:具有2.7倍增加的具有SEQ ID NO:11的序列(SP-FIX-FVIII-BDD)的表达载体,具有2.4倍增加的具有SEQ ID NO:13的序列(SP-乳清蛋白-FVIII-BDD)的表达载体。我们在转导后生产的培养液中观察到FVIII-BDD活性的类似结果。当将具有SEQ ID NO:10的核酸(SP-FVIII-FVIII-BDD)的表达载体与具有SEQ ID NO:11(SP-FIX-FVIII-BDD)(3.9倍增加)和SEQ ID NO:13(SP-乳清蛋白-FVIII-BDD)(3.5倍增加)的核酸的表达载体进行比较时,我们观察到惊人增加。结果与根据通过转染HepG2细胞所产生的数据一致。
因而,所开发的rAAV表达载体能够造成体外FVIII-BDD蛋白表达,所述rAAV表达载体编码包括选自SEQ ID NO:7、SEQ ID NO:8或SEQ ID NO:9的氨基酸序列的基于FVIII-BDD和异源信号肽之一的融合蛋白。
实施例3
为了在体内研究包含选自SEQ ID NO:11或SEQ ID NO:13的核酸的rAAV表达载体,所述核酸编码包括选自SEQ ID NO:7或SEQ IDNo.9的氨基酸序列的基于FVIII-BDD和异源信号肽之一的融合蛋白,我们使用了缺乏FVIII的B6.129S-F8tm1Smoc(HemA)实验室小鼠。在研究中使用的rAAV产品的剂量为6x10
体内研究(图5)表明,使用包含选自SEQ ID NO:11或SEQ ID NO:13的核酸的两种rAAV表达载体在第14天和第56天表现出动物血浆中因子VIII-BDD的水平的显著增加(图5)。当使用包含SEQ ID NO:11的核酸的表达载体时,我们在注射后第14天和第56天分别在动物血浆中观察到296和504ng/ml的FVIII-BDD表达。当使用包含SEQ ID NO:13的核酸的表达载体时,我们在注射后第14天和第56天分别在动物血浆中观察到270和381ng/ml的FVIII-BDD表达。
因此,所开发的包含选自SEQ ID NO:11或SEQ ID NO:13的核酸的rAAV表达载体能够造成体内FVIII-BDD蛋白表达并且具有用于基因治疗血友病A的高潜力,所述核酸编码包括选自SEQ ID NO:7或SEQ ID NO 9的氨基酸序列的基于FVIII-BDD和异源信号肽之一的融合蛋白。
