一种利用食气菌发酵高效固碳产醇的方法
文献发布时间:2024-04-18 20:01:30
技术领域
本发明属于微生物发酵技术领域,具体涉及一种利用双梭菌共培养体系高效生物固碳产醇的方法。
背景技术
绿色生物制造已成为全球性的战略性新兴产业。根据世界经合组织预测,到2030年约有35%的化学品和其他工业产品来自生物制造。其中,丁酸和丁醇作为重要的原料,被广泛应用于化工、食品、和医药领域,目前主要通过化学法合成。由于化石燃料的枯竭和对环境问题的关注,生物丁醇等生物燃料越来越受到关注。目前国内的生物丁醇的生产主要以玉米等粮食作为原料,当前这些原料已被国家政策限制使用,而且原料的成本较高。产溶剂梭菌的ABE发酵其丙酮、丁醇、乙醇的质量比例为3:6:1,其中丁醇和乙醇可以作为燃料,而丙酮由于沸点低会对管道和橡胶有抑制作用,不适合燃料使用,后期需要进行精馏分离增加了生产成本。最近,一些非产溶剂的微生物,包括模式微生物,如大肠杆菌和酿酒酵母等,以及其他非模式微生物,已被探索用于生产生物丁醇。当前,丁酸主要的生产方法可分为化学合成法和微生物发酵法。其中,微生物发酵法相较于化学合成法在环境保护、资源再利用等方面更具优势,更符合可持续发展战略,受到国内外学者普遍关注。厌氧条件下,丁酸是酪丁酸梭菌(Clostridium tyrobutyricum)、丁酸梭菌(C.butyricum)、杨木梭菌(C.populeti)等菌株主要代谢产物。其中,C.tyrobutyricum因丁酸产量大、产率高、纯度高、稳定性好等优势,被认为是发酵生产丁酸最具商业化潜力的菌株。然而,C.tyrobutyricum在糖酵解的过程中碳以CO
在自然界中,微生物存在于复杂的、经常是同营养的混合培养体中,其生长速度快,底物利用率高,微生物群体稳定,可实现最佳碳和电子利用,然而,关于利用双梭菌共培养体系高效生物固碳产醇的相关研究还未见报道。
发明内容
为了解决酪丁酸梭菌生物发酵生产丁酸过程中CO
本发明提供如下技术方案:
一种利用食气菌发酵高效固碳产醇的方法,包括以下步骤:
(1)将活化的永达尔梭菌接种至装有改良的CGM发酵培养基的发酵罐中,厌氧发酵6-10h;
(2)将活化的酪丁酸梭菌接种至步骤(1)得到的发酵液中;
(3)向步骤(2)的发酵罐中补充H
基于上述技术方案,进一步地,步骤(1)中所述永达尔梭菌为永达尔梭菌(Clostridium ljungdahlii)DSMZ 13528。
基于上述技术方案,进一步地,所述的永达尔梭菌的活化培养基的配方包括:硫酸铵1.0~3.0g/L,磷酸氢二钾0.5~1.5g/L,磷酸二氢钾0.4~0.6g/L,七水合硫酸镁0.05~0.15g/L,胰蛋白胨3.0~5.0g/L,酵母浸粉1.0~3.0g/L,L-半胱氨酸盐酸盐0.4~0.6g/L,果糖4.0~6.0g/L。
基于上述技术方案,进一步地,所述的永达尔梭菌的活化培养基的配方还包括矿物质溶液0.5~1.5%v/v,维他命溶液0.5~1.5%v/v;
矿物质溶液的组成为:氮三乙酸1~2g/L,七水合硫酸镁2.5~3.5g/L,一水合硫酸锰0.5~1g/L,氯化钠0.5~1.5g/L,七水合硫酸铁0.05~0.15g/L,七水合硫酸钴0.15~0.20g/L,二水合氯化钙0.05~0.15g/L,七水合硫酸锌0.15~0.20g/L,五水合硫酸铜0.01~0.02g/L,十二水硫酸铝钾0.01~0.03g/L,硼酸0.01~0.02g/L,二水合钼酸钠0.01~0.02g/L,六水合氯化镍0.02~0.04g/L,pH调至6.5~7.0;
维他命溶液的组成为:生物素1.0~3.0mg/L,叶酸1.0~3.0mg/L,磷酸吡哆醇5~15mg/L,盐酸硫胺素2~8mg/L,核黄素2~8mg/L,烟酸2~8mg/L,D-泛酸钙2~8mg/L,维生素B
基于上述技术方案,进一步地,步骤(1)中所述的永达尔梭菌的接种量为发酵液总体积的1~10%。
基于上述技术方案,进一步地,步骤(1)中所述的改良的CGM发酵培养基的配方包括:硫酸铵1.0~3.0g/L,磷酸氢二钾0.5~1.5g/L,磷酸二氢钾0.4~0.6g/L,七水合硫酸镁0.05~0.15g/L,胰蛋白胨3.0~5.0g/L,酵母浸粉1.0~3.0g/L,碳酸钙5~15g/L,L-半胱氨酸盐酸盐0.4~0.6g/L,果糖1.0~10.0g/L,葡萄糖0~50.0g/L。
基于上述技术方案,进一步地,所述的改良的CGM发酵培养基的配方还包括矿物质溶液0.5~1.5%v/v,维他命溶液0.5~1.5%v/v;
矿物质溶液的组成为:氮三乙酸1~2g/L,七水合硫酸镁2.5~3.5g/L,一水合硫酸锰0.5~1g/L,氯化钠0.5~1.5g/L,七水合硫酸铁0.05~0.15g/L,七水合硫酸钴0.15~0.20g/L,二水合氯化钙0.05~0.15g/L,七水合硫酸锌0.15~0.20g/L,五水合硫酸铜0.01~0.02g/L,十二水硫酸铝钾0.01~0.03g/L,硼酸0.01~0.02g/L,二水合钼酸钠0.01~0.02g/L,六水合氯化镍0.02~0.04g/L,pH调至6.5~7.0;
维他命溶液的组成为:生物素1.0~3.0mg/L,叶酸1.0~3.0mg/L,磷酸吡哆醇5~15mg/L,盐酸硫胺素2~8mg/L,核黄素2~8mg/L,烟酸2~8mg/L,D-泛酸钙2~8mg/L,维生素B
基于上述技术方案,进一步地,步骤(1)和步骤(3)中厌氧发酵的条件为pH5.0~6.5、30~38℃、50~200rpm。
基于上述技术方案,进一步地,步骤(2)中所述酪丁酸梭菌为酪丁酸梭菌(Clostridium tyrobutyricum)ATCC 25755。
基于上述技术方案,进一步地,所述的酪丁酸梭菌的活化培养基的配方为:蛋白胨9.0~11.0g/L,牛肉浸粉9.0~11.0g/L,酵母浸粉2.0~4.0g/L,葡萄糖4.0~6.0g/L,可溶性淀粉0.5~1.5g/L,氯化钠4.0~6.0g/L,L-半胱氨酸盐酸盐0.4~0.6g/L。
基于上述技术方案,进一步地,步骤(2)中所述酪丁酸梭菌的接种量为发酵液总体积的1~10%。
基于上述技术方案,进一步地,步骤(3)中发酵罐中气体压力为15~40psig,气体经分布器分散为直径≤500μm的气泡。
基于上述技术方案,进一步地,步骤(3)中H
基于上述技术方案,进一步地,步骤(3)中所述发酵的方式包括分批发酵、间歇补料分批发酵、连续补料分批发酵和连续发酵。
本发明相对于现有技术具有的有益效果如下:
(1)本发明通过运用混菌发酵的手段,使酪丁酸梭菌糖酵解产生的气体被永达尔梭菌利用生产乙酸和乙醇,从而提高底物的利用效率及产物的得率。
(2)永达尔梭菌单独培养无法生成丁醇,而酪丁酸梭菌需通过复杂的生物工程技术才能生产丁醇,本发明仅采用简单的混菌发酵便可获得高附加值产物丁醇。
(3)该发明成果将丰富和发展丁醇等醇类的生物合成的理论和实践,实现醇类的绿色和高效合成;同时也为生物发酵法合成其它短链脂肪酸或脂肪醇提供新的思路和借鉴,在理论和实际应用方面均具有重要价值。
附图说明
为了更清楚地说明本发明实施例,下面将对实施例涉及的附图进行简单地介绍。
图1为酪丁酸梭菌(Cty)、永达尔梭菌(Clj)单培养以及共培养发酵性能的考察结果,其中,a表示酪丁酸梭菌(Cty)-永达尔梭菌(Clj)共培养与Cty和Clj单培养代谢结果的比较;b表示Cty单培养和Cty-Clj共培养每摩尔糖的H
图2是不同糖浓度对混菌发酵代谢结果的影响。
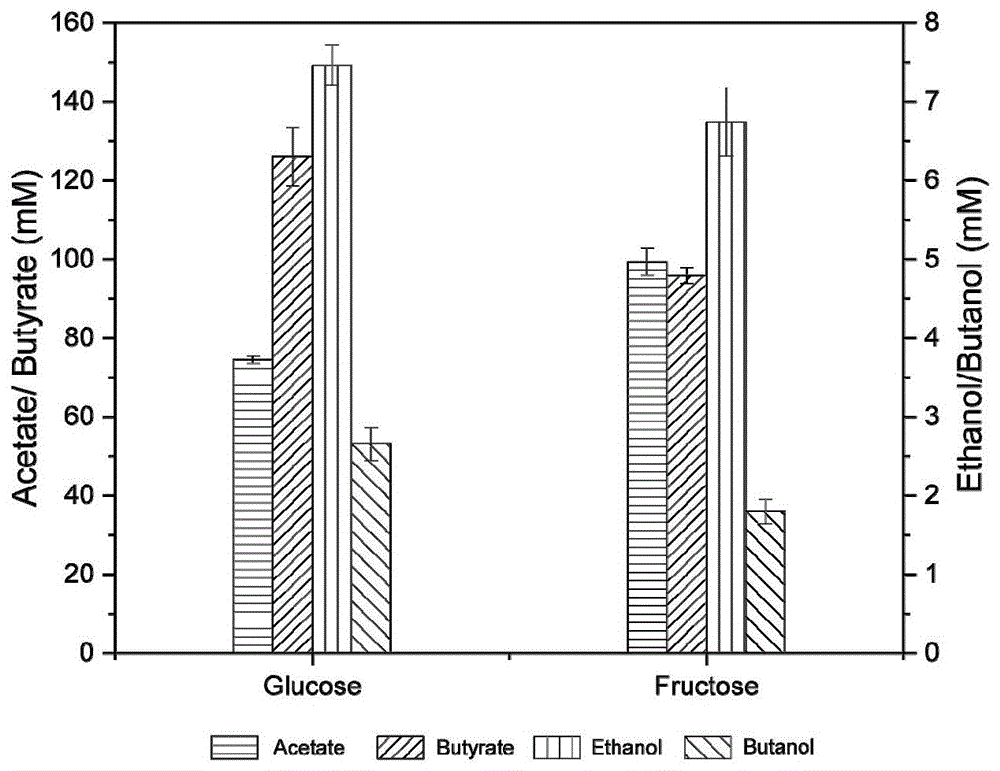
图3是以果糖为碳源的酪丁酸梭菌(Cty)、永达尔梭菌(Clj)单培养以及共培养的发酵结果,其中,a表示酪丁酸梭菌(Cty)-永达尔梭菌(Clj)共培养与Cty和Clj单培养代谢结果的比较;b表示Cty单培养和Cty-Clj共培养每摩尔糖的H
图4是在补充H
图5是永达尔梭菌与酪丁酸梭菌间隔接种时间为0、8、16、24h对混菌发酵产丁醇的影响。
图6是在气举生物反应器中补充合成气的混菌分批发酵的代谢物分布结果。
图7为间歇补料分批发酵(a)和连续补料分批发酵(b)的混菌发酵的代谢物分布结果。
具体实施方式
下面结合实施例对本发明进行详细的说明,但本发明的实施方式不限于此,显而易见地,下面描述中的实施例仅是本发明的部分实施例,对于本领域技术人员来讲,在不付出创造性劳动性的前提下,获得其他的类似的实施例均落入本发明的保护范围。
实施例中所述永达尔梭菌为永达尔梭菌(Clostridium ljungdahlii)DSMZ13528,能够通过Wood-Ljungdahl途径(WLP)进行自养生长,其中H
实施例中所述酪丁酸梭菌为酪丁酸梭菌(Clostridium tyrobutyricum)ATCC25755,革兰氏阳性菌,是一种有机化能异养型专性厌氧菌,对强酸、高温、高盐等恶劣环境具有较高的耐受性,生命力较强,并且具有培养条件相对简单,丁酸产量、得率、纯度相对较高,发酵稳定性好等优点。此外,其发酵产物H
实施例1
构建酪丁酸梭菌与永达尔梭菌共培养体系发酵高效固碳产醇,包括以下步骤:
(1)将永达尔梭菌以5%v/v的接种量接种到活化培养基中,37℃、150rpm厌氧条件下培养;活化培养基配方为:硫酸铵2.0g/L,磷酸氢二钾1.0g/L,磷酸二氢钾0.5g/L,七水合硫酸镁0.10g/L,胰蛋白胨4.0g/L,酵母浸粉2.0g/L,L-半胱氨酸盐酸盐0.5g/L,果糖5.0g/L,矿物质溶液1%v/v,维他命溶液1%v/v,培养基连续通入20分钟N
(2)将酪丁酸梭菌以5%v/v的接种量接种到活化培养基中,37℃、150rpm厌氧条件下培养;活化培养基配方为:蛋白胨10.0g/L,牛肉浸粉10.0g/L,酵母浸粉3.0g/L,葡萄糖5.0g/L,可溶性淀粉1.0g/L,氯化钠5.0g/L,L-半胱氨酸盐酸盐0.5g/L;培养基连续通入20分钟N
(3)将OD
(4)56h后结束发酵,取上清液12000rpm离心10min,过0.22um滤膜除去杂质,稀释5倍用高效液相色谱测残糖浓度,检测条件为:液相色谱(Agilent 1260B,AgilentTechnologies,USA),配备紫外检测器、折射率检测器和Aminex HPX-87H柱(Bio-Rad,USA),在50℃的温度下进行,流动相为5mM硫酸,流速为0.5ml/min。
用气相色谱检测乙酸、乙醇、丁酸和丁醇的浓度,检测条件为:使用安捷伦气相色谱(Agilent 8860GC System,USA),进样体积为0.5-1μL,进样口温度250℃,色谱柱为DB-FFAP毛细管色谱柱(30m×0.32mm×0.5μm),检测器温度300℃,载气(氮气)流速30mL/min,空气流速300mL/min,氢气流速30mL/min,分流比20:1。柱温箱温度程序为:起始60℃,然后按5℃/min速率增大至110℃(10min),再按10℃/min增大至170℃(6min),并保持1min。
发酵后的尾气用50ml注射器量取体积,用气相色谱测CO
本实施例还考察了酪丁酸梭菌单培养和永达尔梭菌单培养的代谢情况,具体如下:
酪丁酸梭菌单培养:取2ml于-80℃保藏的菌种接种至100ml活化培养基中,37℃静置培养24h,菌株处于对数生长期以5%的接种量传代两次活化培养基后,以5%的接种量接入发酵培养基,37℃,150rpm厌氧发酵,60h后结束发酵。活化培养基和发酵培养基同上文。
永达尔梭菌单培养:取2ml于-80℃保藏的菌种接种至100ml活化培养基中,37℃静置培养24h,菌株处于对数生长期以5%的接种量传代两次活化培养基后,以5%的接种量接入发酵培养基(密封的血清瓶),在血清瓶的顶空充入23psig体积比为80:20的H
永达尔梭菌以2g/L果糖为碳源的发酵培养基中(与步骤3中的发酵培养基配方相同),在含有H
永达尔梭菌单培养产生80.6±2.6mM乙酸和8.3mM±0.7乙醇,碳回收率为302.5%。
酪丁酸梭菌单培养产生57.9±3.6mM乙酸和110.6±2.1mM丁酸,碳回收率为50.1%。
在加入丁酸和H
本发明构建的双梭菌混菌体系中酪丁酸梭菌将糖有效转化为酸,永达尔梭菌捕获糖发酵过程中释放的CO
实施例2以不同浓度糖为碳源对混菌发酵产丁醇的影响
以实施例1中的发酵培养基2g/L果糖为基础,配制20、50、70、100g/L葡萄糖,将永达尔梭菌种子液以5%v/v的接种量(OD
以20g/L葡萄糖为碳源,产生了34.1±4.1mM乙酸,45.3±8.1mM丁酸,7.1±1.0mM乙醇和0.77±0.08mM丁醇,碳回收率为40.6%。
以50g/L葡萄糖为碳源,产生了75.2±4.9mM乙酸、102.5±1.8mM丁酸、7.0±0.4mM乙醇、1.8±0.2mM丁醇,碳回收率为64.7%。
以70g/L葡萄糖为碳源,产生了71.8±5.2mM乙酸,109.7±13.9mM丁酸,7.2±1.0mM乙醇和0.41±0.14mM丁醇,碳回收率为54.7%。
以100g/L葡萄糖为碳源,产生了116.4±7.0mM乙酸,131.9±4.7mM丁酸,6.4±0.2mM乙醇和0.54±0.01mM丁醇,碳回收率为57.0%(图2)。
实施例3以果糖为碳源对混菌发酵产醇的影响
方法同实施例1,其中将发酵培养基的葡萄糖改成果糖,永达尔梭菌对照组充23psig体积比为80:20的H
永达尔梭菌和酪丁酸梭菌均可利用果糖发酵:
永达尔梭菌单培养产生115.3±6.4mM乙酸和12.0±0.2mM乙醇,碳回收率为87.5%。
酪丁酸梭菌单培养产生57.5±3.8mM乙酸和112.0±8.1mM丁酸,碳回收率为46.6%。
共培养产生了89.2±5.6mM丁酸、104.6±7.7mM乙酸、6.8±0.3mM乙醇和1.62±0.14mM丁醇(图3a),碳回收率为57.8%。
每消耗1mol果糖,酪丁酸梭菌产生2.47±0.02mol H
实施例4H
方法同实施例1和实施例3,其中酪丁酸梭菌接入发酵培养基后,在血清瓶的顶空充23psig的H
以葡萄糖为主要碳源的共培养体系补充H
以果糖为碳源的共培养体系补充H
实施例5永达尔梭菌与酪丁酸梭菌间隔接种时间对混菌发酵产醇的影响
方法同实施例1,永达尔梭菌优先于酪丁酸梭菌接种至发酵培养基的时间设置为0、8、16、24h。
接种时间间隔0h,混菌发酵产生了55.9±6.2mM乙酸、126.0±2.2mM丁酸、5.14±0.13mM乙醇,碳回收率为49.6%。
接种时间间隔8h,混菌发酵产生了75.2±4.9mM乙酸、102.5±1.8mM丁酸、7.0±0.4mM乙醇、1.8±0.2mM丁醇,碳回收率为64.7%。
接种时间间隔16h,混菌发酵产生了63.4±1.8mM乙酸、104.7±7.2mM丁酸、12.0±0.7mM乙醇、2.57±0.41mM丁醇,碳回收率为49.8%。
接种时间间隔24h,混菌发酵产生了74.2±5.8mM乙酸、108.4±1.5mM丁酸、14.20±2.52mM乙醇、2.03±0.57mM丁醇(图5),碳回收率为59.6%。
实施例6混菌发酵的气举生物反应器中合成气的分批发酵研究
混菌发酵方法同实施例1,区别在于,使用原位灭菌圆柱形搅拌罐生物反应器(KLF3.7L,Bioengineering AG,Wald,Switzerland),内径为12.5cm,高度为30cm。连续供气使用标准烧结单点气体分布器,气体为体积比80:20的H
混菌发酵在气举生物反应器中合成气的分批发酵的代谢物分布结果如图6所示,经计算,碳回收率为64.5%。
实施例7间歇补料和连续补料分批发酵对混菌发酵的影响
混菌发酵方法同实施例6,区别在于,间歇补料所用发酵培养基的葡萄糖浓度为5%,在发酵过程中补加20%的葡萄糖500ml,即将100g葡萄糖配制成500ml,从发酵12h开始流加,每间隔4h流加100ml。连续补料所用发酵培养基的葡萄糖浓度为5%,在发酵过程中补加20%的葡萄糖500ml,即将100g葡萄糖配制成500ml,从发酵12h开始流加,保持25mL/h的流加速度。
间歇补料和连续补料混菌发酵的代谢物分布结果分别如图7a和图7b所示,经计算,碳回收率分别为58.6%和59.8%。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
