一种工程化细胞的核酸提取方法
文献发布时间:2024-04-18 20:01:55
技术领域
本披露涉及从工程化细胞中提取核酸的方法。
背景技术
细胞疗法已被用于治疗疾病,其涉及采用基因工程化的方法将外源核酸引入细胞以及严格的细胞检测过程。然而,外源核酸的引入使得细胞更容易受到污染,从而干扰检测。如何在去除污染的同时保持高检测效率仍是需要解决的技术问题。
发明内容
本披露提供了一种提取工程化细胞内核酸的方法。该方法包括核酸提取步骤前的预处理步骤。该预处理步骤能在去除外源核酸污染的同时,保持核酸提取的效率。
在一个方面,本披露的方法包含:a) 预处理步骤,包括使工程化细胞与核酸酶接触的接触步骤;b) 提取细胞内核酸的步骤。在一个方面,本披露还提供了一种工程化细胞的预处理方法,其包含预处理步骤,包括使工程化细胞与核酸酶接触的接触步骤。
在一个方面,如前所述的方法,所述核酸酶是核酸内切酶、核酸外切酶或其组合。在一个方面,所述核酸酶是脱氧核糖核酸酶、核糖核酸酶或全能核酸酶。在一个方面,所述核酸酶是Benzonase或DnaseI。
在一个方面,如前所述的方法,其中所述接触的时间为不超过2小时。在一个方面,所述接触的时间为15分钟至60分钟。在一个方面,所述接触的时间为约30分钟。在一个方面,所述接触时工程化细胞的密度为1×10
在一个方面,如前所述的方法,其中所述预处理步骤包括在接触步骤前,冷冻-解冻工程化细胞的步骤。在一个方面,所述冷冻工程化细胞的温度不超过-20°C。在一个方面,所述冷冻工程化细胞的温度不超过-80°C。
在一个方面,如前所述的方法,其包含a) 预处理步骤,包括使工程化细胞与核酸酶接触15分钟至60分钟,接触时工程化细胞的密度为5×10
在一个方面,如前所述的方法,其包含a) 预处理步骤,包括冷冻-解冻所述工程化细胞的步骤,和使所述工程化细胞与核酸酶接触的接触步骤;b) 提取细胞内核酸的步骤。在一个方面,所述核酸酶是Benzonase。在一个方面,所述接触的时间为30分钟至60分钟。在一个方面,所述接触的时间为30分钟。在一个方面,所述接触时工程化细胞的密度为5×10
在一个方面,如前所述的方法,其中所述工程化细胞是工程化哺乳动物细胞。在一个方面,所述工程化细胞是所述工程化免疫细胞或工程化肿瘤细胞。在一个方面,所述工程化细胞是工程化T细胞或工程化NK 细胞。在一个方面,所述工程化细胞包含经病毒载体、非病毒载体或物理方法引入的外源核酸。在一个方面,所述外源基因是经慢病毒载体、逆转录病毒载体、腺病毒载体、腺相关病毒载体、阳离子脂质体、聚合物纳米颗粒、转座子、电穿孔或显微注射引入工程化细胞的。在一个方面,所述外源基因是经慢病毒载体引入工程化细胞的。
在另一个方面,本披露还提供一种用于提取工程化细胞的核酸的试剂盒,其包含预处理试剂和核酸提取试剂,所述预处理试剂包含核酸酶。在一个方面,所述核酸酶是脱氧核糖核酸酶、核糖核酸酶或全能核酸酶;在一个方面,所述核酸酶是Benzonase或DnaseI。
在另一个方面,本披露还提供核酸酶在制备用于工程化细胞内核酸提取预处理试剂中的用途。在一个方面,所述核酸酶是脱氧核糖核酸酶、核糖核酸酶或全能核酸酶;在一个方面,所述核酸酶是Benzonase或DnaseI。
附图说明
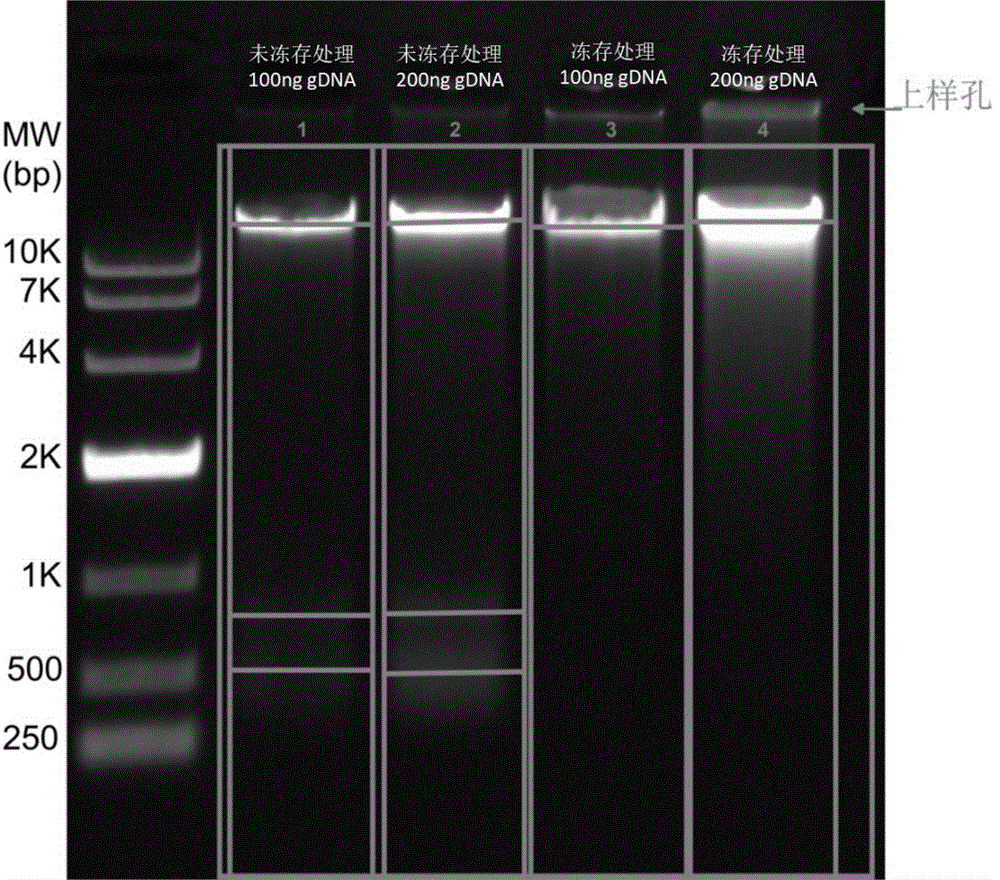
图1采用琼脂糖电泳检测了细胞冻存对核酸酶预处理的影响;
图2A至图2D分别显示了琼脂糖电泳第1-4泳道的DNA分子量分布。
具体实施方式
在阅读本说明书之后,对于本领域的技术人员而言,如何在各个替代性实施例和替代性应用中实施本发明将变得显而易见。然而,此处的实施例仅通过举例而非限制的方式进行呈现。如此,这种详细描述不应被解释为限制如下文所阐述的本发明的范围或广度。
I. 术语
“一种”或“一个”(a或an)可指一种或多种或者一个或多个。“约”指其相对应的数据值增加或减少至多5%的范围。“包含”、“包括”和“含有”应理解为除所包含的要素外,还可以含有其他任何可行的要素,只要该要素的增加不会使包含该要素的技术方案不能实施。“由……组成”指仅具有由“……”所描述的要素。“包含”涵盖了“由……组成”的情形。
术语“工程化细胞”是指包含外源核酸或遗传修饰的细胞。
术语“预处理”是指能提高细胞内核酸提取效率的任何预处理,例如在本文中,预处理使核酸酶、表面活性剂等与细胞接触。预处理不会或基本上不会导致细胞裂解。
术语“核酸酶”是指能够催化DNA或RNA分子内核酸之间的键水解的酶。
术语“接触”是指将两种以上的物质相互作用、反应或物理接触。例如在本文中,接触包括使工程化细胞与核酸酶混合的过程。在接触的过程中,一种物质的浓度或密度是在接触介质(如混合液)中,这种物质的浓度或密度。
术语“免疫细胞”是指参与旨在保护生物体免受外来物质、病毒和细胞的侵害的免疫应答的细胞。免疫细胞可以来源于许多器官和组织,如胸腺、脾脏、淋巴结、淋巴组织簇(如在胃肠道和骨髓中)。此类细胞包含T细胞、B细胞、自然杀伤细胞、巨噬细胞、嗜中性粒细胞、肿瘤浸润淋巴细胞、树突细胞、肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞、以及发育成这些细胞的祖细胞。在本文中,免疫细胞在提取核酸前经改造(如引入外源核酸)成为工程化细胞。
II. 细胞处理方法
本披露提供了提取细胞内核酸的方法,其包含预处理步骤和提取步骤。本披露还提供了一种工程化细胞的预处理方法,其包含预处理步骤。在一个方面,所述细胞内核酸是细胞内DNA。在一个方面,所述细胞内核酸是细胞的基因组DNA。令人吃惊地,本披露的方法相比未包含预处理步骤的细胞内核酸提取方法,能够大大降低杂质对细胞内核酸的污染,并保留较高的回收率。
2.1. 预处理步骤
在一个方面,所述预处理步骤包括使工程化细胞与核酸酶接触的接触步骤。在一个方面,所述核酸酶是核酸内切酶、核酸外切酶或其组合。在一个方面,所述核酸酶是脱氧核糖核酸酶、核糖核酸酶或全能核酸酶。所述全能核酸酶具有DNase和RNase活性。在一个方面,所述核酸酶不具有或基本不具有降解蛋白质或破坏细胞膜结构的活性。在一个方面,所述核酸酶是Benzonase或DnaseI。在一个方面,所述核酸酶是Benzonase。
在一个方面,其中所述接触的时间为不超过6小时,例如不超过1、2、3、4、5或6小时。在一个方面,其中所述接触的时间为1-60分钟,例如1、5、15、20、25、30、35、40、45、50、55或60分钟。在一个方面,所述接触的时间为5分钟至60分钟。在一个方面,所述接触的时间为15分钟至60分钟。在一个方面,所述接触的时间为20分钟至40分钟。在一个方面,所述接触的时间为约30分钟或30分钟。在一个方面,所述接触是在25至42°C条件下进行的。在一个方面,所述接触是在25、37或42°C条件下进行的。在一个方面,所述接触是在约37°C或37°C条件下进行的。
在一个方面,所述接触时工程化细胞的密度为1×10
在一个方面,所述接触时核酸酶的浓度为10至5000 U/mL。在一个方面,所述接触时核酸酶的浓度为50至2000 U/mL。在一个方面,所述接触时核酸酶的浓度为50至1500 U/mL。在一个方面,所述接触时核酸酶的浓度为100至1500 U/mL。在一个方面,所述接触时核酸酶的浓度为50 U/mL、75 U/mL、100 U/mL、200 U/mL、300 U/mL、400 U/mL、500 U/mL、600U/mL、700 U/mL、800 U/mL、900 U/mL、1000 U/mL、1500 U/mL、2000 U/mL、3000 U/mL、4000U/mL、5000 U/mL。在一个方面,所述接触时核酸酶的浓度为100-1000 U/mL。在一个方面,所述接触时核酸酶的浓度为约100、500或1000 U/mL。在一个方面,所述接触时核酸酶的浓度为约1000 U/mL。
在一个方面,所述接触时核酸酶与细胞的比例为每1000U核酸酶1×10
在一个方面,所述接触是在液体介质中进行的。在一个方面,所述接触是在适宜细胞存活的液体介质中进行的。在一个方面,所述接触是在适宜细胞存活的缓冲液中进行的。在一个方面,所述接触是在磷酸盐缓冲液中进行的。在一个方面,所述接触是在杜氏磷酸盐缓冲液(DPBS)中进行的。在一个方面,所述缓冲液中包含1至10mM的Mg
在一个方面,所述方法包括在所述接触步骤前冷冻-解冻工程化细胞的步骤。在一个方面,冷冻是在保存细胞的适宜条件下进行的。在一个方面,冷冻的温度是不超过-20°C、-30°C、-40°C、-50°C、-60°C、-70°C、-80°C、-90°C或-100°C。在一个方面,冷冻的温度是-20°C至-100°C。在一个方面,冷冻的温度是-60°C至-80°C。在一个方面,冷冻的温度是约-80°C或-80°C。在一个方面,冷冻是在液氮条件下进行的。在一个方面,冷冻的时间是1、2、3、6、12、24、48或72小时,或5天、7天或14天。在一个方面,冷冻的时间是6小时至7天。在一个方面,冷冻的时间是24小时至3天。在一个方面,解冻是在0°C至37°C条件下进行的。在一个方面,解冻是在室温、约25°C或25°C下进行的。在一个方面,工程化细胞存在于冷冻保护液中。在一个方面,所述冷冻保护液可以以本领域公知的任何方式配制。在一个方面,所述冷冻保护液是DMEM培养基。在一个方面,所述冷冻保护液包含0-20% DMSO、0-40% 血清和50-100%DMEM培养基。在一个方面,所述冷冻保护液包含5-10% DMSO、10-20% 血清和70-85% DMEM培养基。一个方面,所述冷冻保护液包含10% DMSO、20% 胎牛血清和70% DMEM培养基。
在一个方面,所述预处理步骤还包括在接触步骤后的洗涤步骤。在一个方面,所述洗涤步骤包括采用缓冲液离心洗涤细胞。在一个方面,所述缓冲液是本领域适用于细胞洗涤的任意缓冲液。在一个方面,所述缓冲液是PBS或DPBS。在一个方面,用于单次洗涤的缓冲液的体积是0.5、1、2、3、4、5、6、7、8、9或10 mL。在一个方面,洗涤细胞1、2、3、4、5、6、7、8、9或10次。在一个方面,采用1 mL的 DPBS 溶液离心洗涤细胞2次。
2.2. 提取步骤
在一个方面,所述提取步骤可以使用本领域技术人员已知的多种技术。一种示例的提取方法包括(i)破坏细胞膜(即裂解细胞),和(ii)提取细胞内核酸。裂解细胞的方法是本领域技术人员公知的,例如,可以使用多种机械剪切或超声波技术破坏细胞膜。细胞裂解步骤还包括使用去污剂和表面活性剂来溶解细胞膜和核膜上的脂质。在一个方面,裂解步骤可以进一步包括使用蛋白酶以分解蛋白质,和/或使用RNA酶来消化样品中的RNA。核酸提取的方法也是公知的,例如,使用使用有机溶剂(如苯酚和氯仿的混合物)提取,随后用乙醇沉淀。其他适宜的方法还包括盐析DNA提取、三甲基溴化铵盐DNA提取和硫氰酸胍DNA提取。多种试剂盒可商购获得用于从生物样品中提取DNA,例如, Qiagen (Germantown, MD)的QIAamp,或来自Promega (Madison, WI)的Maxwell
III. 试剂盒
在一个方面,本披露提供了一种用于细胞内核酸提取的试剂盒,其包含预处理试剂和细胞内核酸提取试剂。在另一个方面,本披露提供了核酸酶在制备用于细胞内核酸提取预处理试剂中的用途。在一个方面,所述核酸酶是脱氧核糖核酸酶、核糖核酸酶或全能核酸酶。所述全能核酸酶具有DNase和RNase活性。在一个方面,所述核酸酶不具有或基本不具有降解蛋白质或破坏细胞膜结构的活性。
在一个方面,所述核酸酶在预处理试剂中的浓度为10至5000 U/mL。在一个方面,所述核酸酶在预处理试剂中的浓度为50至2000 U/mL。在一个方面,所述核酸酶在预处理试剂中的浓度为50至1500 U/mL。在一个方面,所述核酸酶在预处理试剂中的浓度为100至1500 U/mL。在一个方面,所述核酸酶在预处理试剂中的浓度为50 U/mL、75 U/mL、100 U/mL、200 U/mL、300 U/mL、400 U/mL、500 U/mL、600 U/mL、700 U/mL、800 U/mL、900 U/mL、1000 U/mL、1500 U/mL、2000 U/mL、3000 U/mL、4000 U/mL、5000 U/mL。在一个方面,所述核酸酶在预处理试剂中的浓度为100-1000 U/mL。在一个方面,所述核酸酶的浓度为约100、500或1000 U/mL。在一个方面,所述核酸酶的浓度为约1000 U/mL。
在一个方面,所述试剂盒包含细胞内核酸提取试剂。此类核酸提取试剂是本领域技术人员熟知的,例如,可裂解细胞的去污剂、可溶解细胞膜和核膜上的脂质的表面活性剂、蛋白酶、RNA酶、以及用于提取核酸的机溶剂(如苯酚和氯仿的混合物)、盐、三甲基溴化铵盐、硫氰酸胍等。在一个方面,所述试剂盒包含可商购的试剂,例如,Qiagen的QIAamp,或来自Promega的Maxwell
IV 细胞
在一个方面,本披露的方法所涉及的细胞是工程化的,包含了外源基因。在一个方面,所述细胞是哺乳动物细胞。在一个方面,所述细胞是人细胞。在一个方面,所述细胞是免疫细胞或富集的免疫细胞。在一个方面,所述细胞是肿瘤细胞。在一个方面,所述细胞是T细胞或富集的T细胞。在一个方面,所述细胞是CD4
在一个方面,所述工程化细胞的制备方法包括了细胞分离、选择、激活、转导、培育、扩增、洗涤、悬浮、稀释、浓缩和/或配制。在一个方面,所述方法包括分离细胞,以及在刺激条件下制备、加工、培养细胞。在一个方面,所述方法包括将细胞从生物样品中分离,将分离的细胞与病毒载体一起孵育以将外源核酸转导入细胞。在一个方面,所述方法包括将细胞从生物样品中分离,将分离的细胞与病毒载体一起孵育以将外源核酸转导入细胞,培养所转导的细胞。在一个方面,所述分离包括了选择细胞的步骤。在一个方面,所述转导是在采用刺激试剂刺激所分离的细胞后进行的。
在一个方面,所述制备方法包括以下各项中的一个或多个:(a) 预洗涤含有细胞的生物样品(例如,全血样品、血沉棕黄层样品、外周血单核细胞(PBMC)样品、未分级T细胞样品、淋巴细胞样品、白细胞样品、单采术产物或白细胞单采术产物);(b) 从所述样品分离(例如选择)所需的细胞(例如,CD4
在一个方面,所述细胞培养方法包括基因工程化的步骤。在一个方面,该步骤将外源核酸引入细胞。在一个方面,所述基因工程化步骤包括通过载体将重组蛋白引入细胞。此类载体包括病毒和非病毒系统。在一个方面,所述病毒系统包括重组感染性病毒颗粒,例如腺病毒、腺相关病毒(AAV)和人免疫缺陷病毒(HIV)的载体,以及重组慢病毒载体或逆转录病毒载体(如γ逆转录病毒载体)。在一个方面,所述非病毒系统包括转座子的系统,如PiggyBac或Sleeping Beauty的基因转移系统。在一个方面,该步骤是通过电穿孔进行的。在一个方面,该步骤是通过转导、转座子、电穿孔或其组合进行的。在免疫细胞中引入和表达遗传物质的其他方法包括磷酸钙转染、原生质体融合、阳离子脂质体介导的转染、钨颗粒促进的微粒轰击和磷酸锶DNA共沉淀。
V. 外源核酸
在一个方面,本披露的方法所涉及的细胞包含外源核酸,该外源核酸编码重组蛋白。在一个方面,所述重组蛋白是嵌合受体、嵌合抗原受体(CAR)、T细胞受体(TCR)、嵌合抗体-T细胞构筑体(caTCR)、嵌合信号传导受体(CSR)或其组合。
在一个方面,所述重组蛋白是嵌合抗原受体(CAR)。在一个方面,与正常或非靶向细胞相比,所述抗原在疾病或病症的细胞(例如,肿瘤或致病细胞)上选择性地表达或过表达。在一个方面,所述疾病和病症包括增殖性、肿瘤性和恶性疾病和障碍,包括癌症和肿瘤,包括血液癌、免疫系统癌症,如淋巴瘤、白血病和/或骨髓瘤,如B型白血病、T型白血病和骨髓性白血病、淋巴瘤和多发性骨髓瘤。在一个方面,所述的CAR含有与抗原特异性结合的细胞外抗原识别域。因此,所述与抗原特异性结合的细胞外抗原识别域包括一种或多种抗原结合分子,如一种或多种抗原结合片段、结构域或部分,或者一种或多种抗体可变结构域,和/或抗体。在一个方面,所述抗原结合分子是全长抗体,例如单域抗体、单特异性抗体或多特异性抗体;或抗体片段,例如scFv。在一个方面,所述的CAR包括间隔子,所述间隔子可以是或包括免疫球蛋白恒定区的至少一部分或其变体或经修饰形式,如铰链区和/或CH1/CL和/或Fc区。在一个方面,所述间隔子位于细胞外抗原识别结构域与跨膜域之间。在一个方面,所述的CAR包括跨膜域。在一个方面,跨膜域源自天然来源或源自合成来源。在来源是天然的情况下,所述跨膜域源自任何膜结合蛋白或跨膜蛋白。跨膜域包括以下的一种或多种,T细胞受体的α、β或ζ链,CD28,CD3ε,CD45,CD4,CD5,CD8,CD9,CD16,CD22,CD33,CD37,CD64,CD80,CD86,CD134,CD137,CD154。在一个方面,所述跨膜域是合成的。在一些方面,合成跨膜域主要包含疏水性氨基酸残基,如亮氨酸和缬氨酸。在一个方面,所述的CAR含有细胞内信号传导域,所述细胞内信号传导域包括细胞质信号传导域,例如能够在T细胞中诱导初级激活信号的胞内域,例如,CD3ζ链的ζ链;和/或所述细胞内信号传导域包含基于免疫受体酪氨酸的激活基序(ITAM)。在一个方面,所述的CAR含有共刺激域。在一个方面,所述共刺激域是CD28、4-1BB、OX40、DAP10或ICOS的信号传导区域和/或跨膜部分。在一些方面,同一CAR包括初级激活信号传导区域和共刺激组分两者。在一个方面,同一CAR包括初级激活信号传导域和共刺激域两者。
VI. 实施例
在阅读本说明书之后,对于本领域的技术人员而言,如何在各个替代性实施例和替代性应用中实施本发明将变得显而易见。然而,此处的实施例仅通过举例而非限制的方式进行呈现。如此,这种详细描述不应被解释为限制如下文所阐述的本发明的范围或广度。
以下实施例中,除非另行说明,冻存液包含10% DMSO、20% 胎牛血清和70% DMEM培养基。DNA抽提的过程为:裂解细胞,蛋白酶K处理去除DNA上吸附的蛋白;使用硅胶柱或磁珠吸附游离的DNA;使用乙醇溶液对DNA进行洗涤,去除杂质;使用低盐溶液洗脱吸附在硅胶柱或磁珠上的DNA。采用本领域公知的技术或市售试剂盒检测基因的拷贝数。
实施例1
该实施例描述了不同处理方式对DNA抽提效率和细胞检测的影响。本实施例的细胞是工程化T细胞。在检测前,采用慢病毒载体将外源核酸引入该细胞。将该细胞以1×10
抽提DNA并采用紫外分光光度计定量DNA浓度。以组1的DNA浓度为基准,计算各处理方式的相对回收率。VSV-G(疱疹性口腔炎病毒糖蛋白G)可在慢病毒转导过程中吸附于细胞膜表面。ACTB(人β肌动蛋白)基因存在于细胞基因组中。取20ng/μL的DNA,采用荧光定量PCR检测不同处理方式对细胞核内DNA和细胞外吸附DNA检测的影响。以组1的VSV-G含量为基准,计算各处理方式的相对杂质去除率。结果见表2。
结果表明,相比常规的表面活性剂和缓冲液洗涤,采用核酸酶处理可以更有效地去除表面吸附的杂质。令人吃惊的是,采用核酸酶处理30分钟不仅能有效地去除杂质,还能保持与未经核酸酶处理组相当的回收率。并且,各处理方式均未导致ACTB基因Ct值的变化,表明各组细胞的基因组DNA未降解。
实施例2
该实施例评价了不同检测条件对细胞检测的影响。本实施例的细胞是人T细胞。在检测前,采用慢病毒载体将外源核酸引入该细胞。将该细胞以1×10
实施例3
该实施例评价了细胞冻存对细胞检测的影响。本实施例的细胞是人T细胞。在检测前,采用慢病毒载体将外源核酸引入该细胞。将转导后的细胞分为两部分。一部分细胞以1×10
采用qPCR方法对ALB(Albumin,人白蛋白)进行定量检测。结果见表4。冻存后的细胞表现出对核酸酶更强的抗性,其基因组DNA稳定性较未冻存组更高。
实施例4
该实施例评价了细胞冻存对细胞检测的影响。本实施例的细胞是HT1080。在检测前,采用慢病毒载体将外源核酸引入该细胞。将转导后的细胞分为两部分。一部分细胞以1×10
琼脂糖电泳结果如图1所示,未进行细胞冻存的样本(第1,2泳道)显示三条带,分别位于10kb以上,500-1000bp和200bp-500bp;而进行细胞冻存的样本(第3,4泳道)仅显示位于10kb 以上的一条带。使用凝胶成像仪软件进行图像处理,第1-4泳道的处理结果分别如图2A-2D所示。图2A、2B显示,80%的DNA分子量大于10kb,20%左右的DNA位在<1000bp小片段区域;图2C、2D显示,DNA的分子量100%大于10kb。采用核酸酶处理未经冻存的细胞,易导致基因组DNA的降解,并影响检测结果。
