一种提高里氏木霉表达外源蛋白表达水平的方法
文献发布时间:2024-04-18 20:01:55
技术领域
本发明涉及生物技术领域,具体涉及一种提高里氏木霉表达外源蛋白表达水平的方法。
背景技术
里氏木霉作为主要的丝状真菌之一,具有强大的分泌纤维素酶的能力。工业上,经改造后的里氏木霉,其产纤维素酶的产量可达到100 g/L以上,在分泌的蛋白中,CBH1占到了总蛋白含量的60%,随着丝状真菌基因组学领域的快速发展,利用里氏木霉表达异源蛋白也越来越受到重视,目前,已成功表达和生产了多种酶制剂。
丝状真菌表达系统作为细胞工厂,具有高表达量、高分泌率,发酵成本低等优势,同时蛋白质分子折叠和修饰系统接近高等真核细胞等特点,为其投入工业化生产奠定了良好基础,另外米曲霉、黑曲霉和里氏木霉都是FDA认证的食品安全菌株,并已长期应用于食品及食品加工业。
虽然里氏木霉已作为细胞工厂广泛用于重组蛋白的生产,但与内源蛋白相比,外源蛋白的生产水平往往很低。影响外源蛋白生产的因素包括宿主的防御系统,外源基因在宿主中转录、翻译及翻译后修饰及分泌途径等多个方面。
信号肽是广泛存在于真核和原核生物中的一条长度为3到30个氨基酸的短肽,一般位于蛋白质的N端,其中包括疏水区、信号肽的C端和N端等3部分,具有负责引导蛋白跨膜运输的功能。目前在里氏木霉中广泛使用的信号肽有外切葡聚糖酶Ⅰ基因cbh1信号肽、外切葡聚糖酶Ⅱ基因cbh2信号肽、内切葡聚糖酶Ⅱ基因eg2信号肽。使用这些基因的信号肽是因为这些基因在里氏木霉分泌的蛋白中表达水平比较高,但是,目前没有对信号肽序列进行过系统化、规模化的筛选研究。因此,里氏木霉中广泛使用的信号肽可能并非是外源蛋白的最适分泌信号。
发明内容
本发明的目的是提供一种提高里氏木霉表达外源蛋白表达水平的方法。
根据本发明的提高里氏木霉表达外源蛋白表达水平的方法,所述方法包括使用里氏木霉的hfb2信号肽、cel74A信号肽以及构巢曲霉来源的果胶裂解酶A前体信号肽作为在里氏木霉中表达外源蛋白的信号肽的步骤,其中,所述hfb2信号肽的氨基酸序列如SEQ IDNO:2所示,所述cel74A信号肽的氨基酸序列如SEQ ID NO:3所示,果胶裂解酶A前体信号肽的氨基酸序列如SEQ ID NO:4所示。
根据本申请的提高里氏木霉表达外源蛋白表达水平的方法,其中,所述外源蛋白为黑曲霉来源的甘露聚糖酶
本发明通过在里氏木霉中将
附图说明
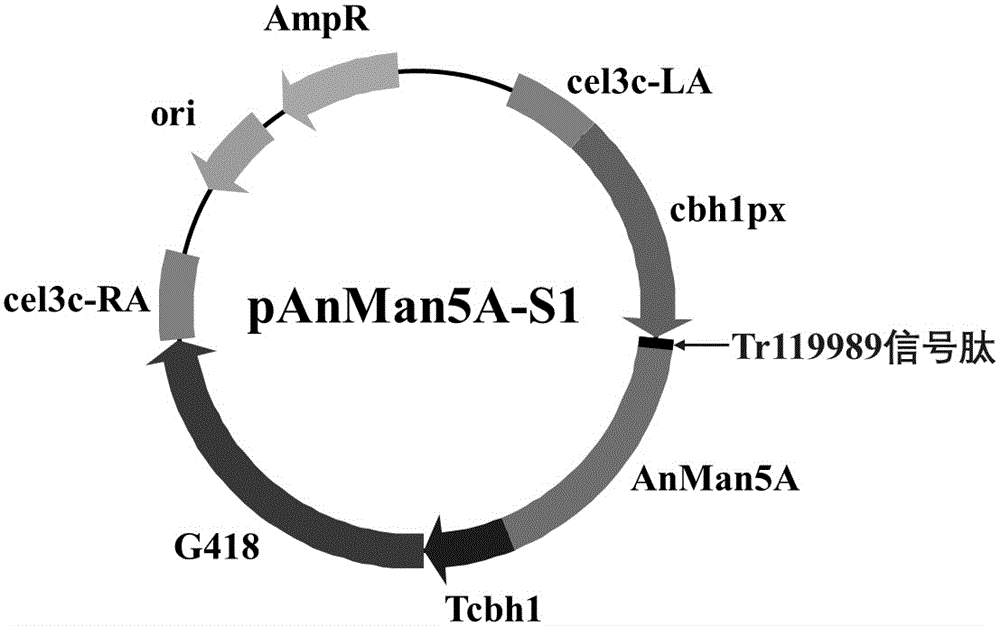
图1-1、图1-2、图1-3、图1-4、图1-5分别为pAnMan5A-S1、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5重组表达质粒图谱;
图2显示PCR鉴定cel3c(LA)-AnMan5A-G418-cel3c(RA)片段定点整合至里氏木霉基因组中
图3为 SUS7-P1和SUS7-S1、SUS7-S2、SUS7-S3、SUS7-S4、SUS7-S5的甘露聚糖酶活性汇总图。
具体实施方式
根据本发明的具体实施方式,以黑曲霉来源的甘露聚糖酶
pAnMan5A-S1、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5质粒构建是通过无缝拼接的方法,将线性化的pAnMan5A-S1、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5片段重组连接。pAnMan5A-S1 、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5的质粒构建示意图如图1-1、图1-2、图1-3、图1-4、图1-5所示。其中,对于pAnMan5A-S1,
所述构建方法为:设计引物,以质粒pAnMan5A-P1为模板扩增线性化的载体片段pAnMan5A-S1、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5。PCR结束后,通过琼脂糖凝胶电泳粗略鉴定PCR扩增的片段是否正确,回收该片段,再参照无缝拼接试剂盒的说明方法,分别将线性化的载体片段进行重组连接。挑取筛选平板上的阳性克隆,通过PCR及质粒测序的方法验证质粒pAnMan5A-S1 、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5是否构建成功。
所述发酵重组转化子以生产
所述MM培养基的成分包括:(NH
实施例1.重组质粒pAnMan5A-S1 、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5的构建
以质粒pAnMan5A-P1为模板,该质粒中
以质粒pAnMan5A-P1为模板,以引物对man5A-F和S2-R(SEQ ID No:9)扩增线性化载体pAnMan5A-S2,得到
以质粒pAnMan5A-P1为模板,以引物对man5A-F和S3-R(SEQ ID No:10)扩增线性化载体pAnMan5A-S3,得到
以质粒pAnMan5A-P1为模板,以引物对man5A-F和S4-R(SEQ ID No:11)扩增线性化载体pAnMan5A-S4,得到
以质粒pAnMan5A-P1为模板,以引物对man5A-F和S5-R(SEQ ID No:12)扩增线性化载体pAnMan5A-S5,得到
在1 %琼脂糖胶上电泳,切下PCR产物中的目的条带,纯化DNA。纯化片段后,并按照无缝拼接试剂盒说明书将线性化的载体片段自我连接。连接片段转化至Trans1-T1感受态细胞 ,在含有100 μg/ml氨苄青霉素的固体LB培养基平板上筛选获得阳性转化子。挑克隆至5 ml含有100 μg/ml的氨苄青霉素的液体LB培养基上过夜培养,提取质粒,测序验证获得pAnMan5A-S1 、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5质粒。
分别以pAnMan5A-S1 、pAnMan5A-S2、pAnMan5A-S3、pAnMan5A-S4、pAnMan5A-S5质粒为模板,用LA(cel3c)-F(SEQ ID No:13)/RA(cel3c)-R(SEQ ID No:14)扩增cel3c(LA)-AnMan5A(S1)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S2)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S3)-G418-cel3c(RA)片段、cel3c(LA)-AnMan5A(S4)-G418-cel3c(RA)片段、cel3c(LA)-AnMan5A(S5)-G418-cel3c(RA)片段。
其中cel3c(LA)-AnMan5A(S1/S2/S3/S4/S5)-G418-cel3c(RA)片段包括
在1 %琼脂糖胶上电泳,切下PCR产物中的目的条带,纯化DNA片段备用于转化。
实施例2. 将片段cel3c(LA)-AnMan5A(S1/S2/S3/S4/S5)-G418-cel3c(RA)转化入里氏木霉及筛选
里氏木霉SUS7的转化
将里氏木霉SUS7接种于土豆培养基(PDA)平板上,28 ℃培养箱培养5 d待其产孢,将孢子刮下并接种于铺有玻璃纸的PDA平板上,28 ℃培养16h。刮取萌发的菌丝,加入10mg/ml的Lysing enzymes,30 ℃消化2小时。收集原生质体后,将片段cel3c(LA)-AnMan5A(S1)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S2)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S3)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S4)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S5)-G418-cel3c(RA)分别转入里氏木霉SUS7菌株。
转化子在含100 μg/mL G418、0.44M蔗糖的MM-2%glucose琼脂培养基上生长、选择。挑取单个克隆,接种到含100 μg/mL G418的PDA培养基上,28 ℃、培养2 d。提取基因组DNA,通过PCR验证cel3c(LA)-AnMan5A(S1)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S2)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S3)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S4)-G418-cel3c(RA)、cel3c(LA)-AnMan5A(S5)-G418-cel3c(RA)片段已经成功定点整合至里氏木霉基因组
在1 %琼脂糖胶上电泳,有多个转化子出现和预期一致大小的DNA条带(如图2所示)。因此,这些转化子是将
实施例3. 转化子的诱导培养和甘露聚糖酶活性测定
将对照菌株SUS7-P1(该菌株中
甘露聚糖酶酶活的测定:
由图3可知,在里氏木霉中异源表达AnMan5A时,将里氏木霉广泛使用的cbh1信号肽替换成里氏木霉的hfb2(Tr119989)信号肽、cel74A(Tr49081)信号肽以及构巢曲霉来源的果胶裂解酶A前体(An2331)信号肽后,与出发菌株SUS7-P1相比较,SUS7-S1、SUS7-S2、SUS7-S3菌株的AnMan5A活性分别是出发菌株SUS7-P1的2.76倍、3.06倍和2.81倍。
而将AnMan5A信号肽替换成来源于
以上实施例仅用于解释本申请的技术方案,不限定本申请的保护范围。
