ZmFd3基因在提高植物抗病毒中的应用
文献发布时间:2024-04-18 20:02:18
技术领域
本发明涉及植物基因工程技术领域,尤其涉及ZmFd3基因在提高植物抗病毒中的应用。
背景技术
铁氧还蛋白(Ferredoxin,Fd)是一种水溶性、低分子量酸性电子传递蛋白。在植物中Fd主要是从PSI中获得电子,传给各种与之关联的酶,如铁氧还蛋白-NADP还原酶(FNR)、铁氧还蛋白亚硝酸还原酶、亚硫酸还原酶、谷氨酸合酶、铁氧还蛋白/硫氧还蛋白还原酶等,参与许多光依赖的代谢和调节反应,其中尤以传递电子还原NADP
植物病毒病被称为植物癌症,占所有植物病害的近一半。植物病毒不能侵染人类和其他高等动物,然而一旦农作物被植物病毒侵染,产量和品质将受到严重影响。玉米褪绿斑驳病毒病是由玉米褪绿斑驳病毒(MCMV)引起的、发生在玉米上的病害。MCMV侵染玉米引起褪绿和斑驳,严重时可以引起叶片坏死。甘蔗花叶病毒(SCMV)主要危害叶片,尤以新叶基部症状最为明显,植株在苗期一旦被病毒侵染,植株生长矮小,叶片上表现典型的褪绿和花叶症状。当MCMV与马铃薯Y病毒科的一些病毒复合侵染玉米时(如SCMV),会引起一种严重性的玉米病害(玉米致死性坏死病,MLN),可以引起整株玉米死亡,造成绝产。
RNA干扰(RNAi)是由双链RNA(dsRNA)诱发同源RNA高效特异性降解的基因沉默机制。由于RNAi技术可以特异性抑制特定基因的表达,因此,基于RNAi技术可以抵抗植物病毒侵染。寻找关键的分子靶标基因并获得特异高效的dsRNA片段序列是基于RNAi技术植物病毒防控策略核心。相较于化学农药,RNA干扰技术使用生物学手段,有效避免环境污染,是一种绿色、友好、可持续的植物病害防治手段。而玉米ZmFd3基因对玉米抗植物病毒的影响未见报道。
纳米脂质体由脂质纳米材料组成,是农药给药系统中的潜在选择之一。因为它们比传统材料具有更大的比表面积和更大的溶解度和生物利用度,纳米脂质体被视为一种有前途的载体材料。然而,迄今为止,还没有报道通过纳米递送系统递送ZmFd3-dsRNA来控制植物病毒病害。
发明内容
本发明的目的在于提供ZmFd3基因在提高植物抗病毒中的应用。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了ZmFd3基因在提高植物抗病毒中的应用,通过抑制ZmFd3基因的表达,从而提高作物对病毒的抗病性。
优选的,通过向植物中导入用于抑制ZmFd3基因表达的载体。
优选的,所述抑制ZmFd3基因表达的载体包括dsRNA、siRNA、shRNA、CRISPRi、CRISPR/Cas9载体或病毒介导的基因沉默载体。
本发明还提供了一种抑制ZmFd3基因表达的ZmFd3-dsRNA,所述ZmFd3-dsRNA的序列如SEQ ID NO.1所示。
本发明还提供了一种FPH-dsRNA,所述FPH-dsRNA抑制ZmFd3、SCMV-HC-Pro和MCMV-p7b基因表达,所述FPH-dsRNA的序列如SEQ ID NO.18所示。
本发明还提供了一种dsRNA核酸脂质体,所述dsRNA核酸脂质体为脂质纳米粒子内包裹有dsRNA,所述dsRNA包括所述的ZmFd3-dsRNA或所述的FPH-dsRNA。
优选的,所述dsRNA核酸脂质体包括阳离子脂质体或阴离子脂质体。
所述的ZmFd3-dsRNA或所述的FPH-dsRNA在植物抗病毒中的应用。
本发明还提供了所述的dsRNA核酸脂质体在植物抗病毒中的应用。
优选的,向植株喷施含有所述dsRNA核酸脂质体的溶液,所述溶液中包含dsRNA核酸脂质体50~100μg。
通过采用上述技术方案,本发明具有如下有益效果:本发明首次发现了沉默ZmFd3基因能够提高植物对病毒的抗性,本发明的ZmFd3-dsRNA、FPH-dsRNA能够降低植物ZmFd3基因的表达,进而有利于植株抵抗MCMV和SCMV侵染。本发明的ZmFd3-dsRNA和FPH-dsRNA脂质体在玉米植株中具有有效的转运能力,并防止dsRNA在外部环境中降解,在4~28℃时,脂质体较为稳定。本发明的dsRNA脂质体还能有效降低ZmFd3长时间沉默对植物生长产生的有害影响,为植物抵抗MCMV和SCMV侵染提供了新思路。
附图说明
图1为沉默ZmFd3对MCMV和SCMV侵染的影响(p<0.05;**,p<0.01;***,p<0.001),其中:
A为CMV-ZmFd3玉米与CMV-GFP对照玉米感染SCMV和MCMV病毒6天后的叶片情况;
B为CMV-ZmFd3玉米与CMV-GFP对照玉米感染MCMV和SCMV病毒6天后SCMV/MCMV RNA的相对积累量;
C为CMV-ZmFd3玉米与CMV-GFP对照玉米感染MCMV和SCMV病毒6天后SCMV/MCMV外壳蛋白的表达量;
D为CMV-ZmFd3玉米与CMV-GFP对照玉米感染SCMV和MCMV病毒6天后ZmFd3基因的相对表达量。
图2为18日龄的CMV-ZmFd3植物以及18日龄的CMV-GFP和CMV-ZmFd3植物高度,其中:A为18日龄的CMV-ZmFd3植物;B为18日龄的CMV-GFP和CMV-ZmFd3植物高度。
图3为体外合成ZmFd3-dsRNA的电泳检测图。
图4为ZmFd3-dsRNA在烟草叶片中的沉默效率,其中:A为共聚焦显微镜下ZmFd3-dsRNA在烟草叶片中的沉默效率;B为蛋白质印迹分析的ZmFd3-dsRNA的沉默效率。
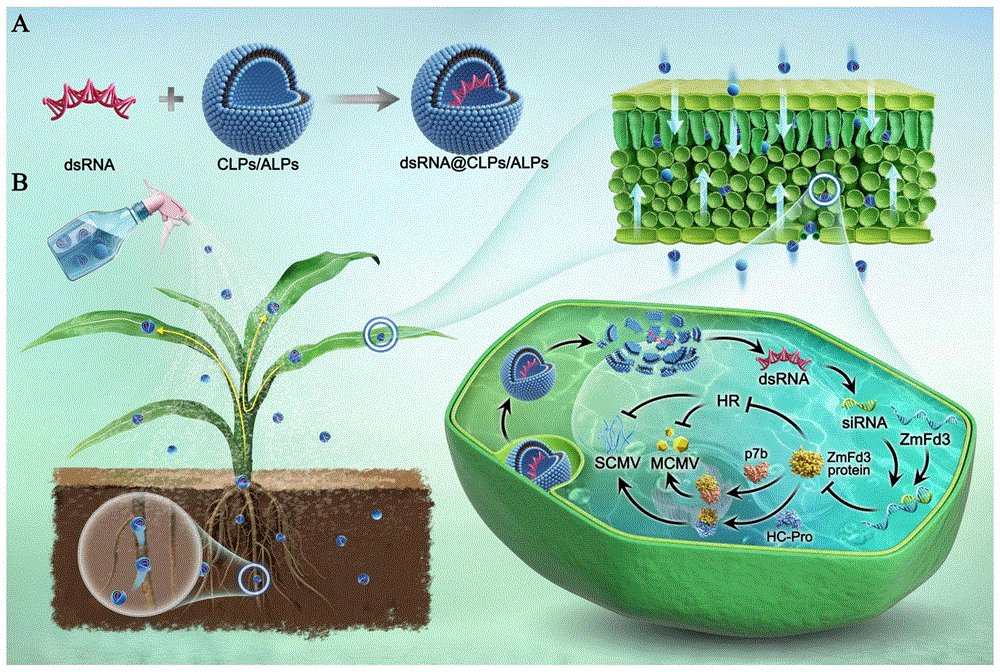
图5为dsRNA@CLPs/ALPs合成模式图。
图6为CLPs、ALPs、ZmFd3@CLPs,和ZmFd3@ALPs的透射电镜图。
图7为CLPs、ALPs、ZmFd3@CLPs和ZmFd3@ALPs的粒径,分散性指数和Zeta电位。
图8为ZmFd3-dsRNA、ZmFd3@CLPs和ZmFd3@ALPs经核酸酶处理0.5h和1h后的电泳图。
图9为ZmFd3@CLPs和ZmFd3@ALPs分别在4、28和37℃的保存情况,其中:A为平均尺寸变化;B为多分散指数变化;C为Zeta电位变化,D为ZmFd3@ALPs在37℃保存21d的透射电镜图像。
图10为ZmFd3@CLPs和ZmFd3@ALPs(稀释5倍)在4、28和37℃保存21天的形态。
图11为使用叶片摩擦或根系浸泡法对植物施加ZmFd3@CLPs/ALPs 12h后的根系、第二叶和系统叶的共聚焦显微照片。
图12为使用叶片摩擦或根系浸泡法对植物施加ZmFd3@CLPs/ALPs 24h后的根系、第二叶和系统叶的共聚焦显微照片。
图13为使用叶片摩擦或根系浸泡的方法对植物施加ZmFd3-dsRNA 12h和24h后的根系、第二叶和系统叶的共聚焦显微照片。
图14为喷施ZmFd3@CLPs/ALPs的玉米叶片在SCMV和MCMV复合侵染玉米时的第一片系统叶侵染情况,其中:A为SCMV和MCMV复合侵染第6天时,玉米植株的第一片系统侵染叶片的症状;B为SCMV和MCMV复合侵染第6天时,玉米植株中MCMV和SCMV CP蛋白的积累量;C~E为SCMV和MCMV复合侵染第6天时,玉米植株中MCMV、SCMV RNA的积累量和ZmFd3表达量。
图15为用不同脂质体处理玉米植株6天玉米植株的生长情况和植株高度,其中:A为用不同脂质体处理玉米植株6天玉米植株的生长情况;B为用不同脂质体处理玉米植株6天玉米植株的高度。
图16为ZmFd3与病毒蛋白互作的酵母双杂交结果图。
图17为ZmFd3分别与HC-Pro和p7b互作的BiFC结果图。
图18为喷施FHP@CLPs/ALPs的玉米叶片对MCMV和SCMV复合侵染的抗性,其中:A为在SCMV和MCMV复合侵染第6天时,侵染玉米植株的第一片系统侵染叶片的症状;B为在SCMV和MCMV复合侵染第6天时,玉米植株中MCMV和SCMV CP蛋白的积累量;C~E为在SCMV和MCMV复合侵染第6天时,MCMV和SCMVRNA在玉米植株中的积累和ZmFd3的表达情况;F为在SCMV和MCMV复合侵染第9~21天时,不同处理的玉米对MCMV和SCMV复合侵染的植株状态;G为在SCMV和MCMV复合侵染第9~21天时,不同处理的玉米植株死亡率。
图19为高粱喷施FPH@CLPs/ALP对SCMV的抗性,其中:A为不同组别高粱植株中花叶症状的发生率;B为不同组别高粱叶片情况,C为westernblot检测结果图。
图20为dsRNA@CLPs/ALPs合成模式图和作用方式示意图,其中:A为dsRNA@CLPs/ALPs合成模式图,B为dsRNA@CLPs/ALPs作用方式示意图。
具体实施方式
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1沉默ZmFd3有利于植株抵抗MCMV和SCMV侵染
1.构建特异性靶向ZmFd3基因CMV-ZmFd3的沉默载体
采用逆转录-聚合酶链反应(RT-PCR)扩增玉米ZmFd3(Zm00001d034760)的CDS序列。
本发明的ZmFd3基因在GenBank中的ID号为:Zm00001d034760。
以CMV-ZmFd3-F/R为引物,以玉米B73的基因组序列为模板进行PCR扩增,目的片段为ZmFd3cDNA的部分片段(138bp),如SEQ ID NO.1所示。
SEQ ID NO.1:
TTCGCTACTTCCTGCACGCTGTTGGGCAATGTTAGAACAACGCAGGCCTCCCAGACAGCGGTGAAGAGCCCTTCGTCTCTAAGCTTCTTCAGCCAAGTTACGAAGGTTCCAAGCCTGAAGACCTCCAAGAAACTGGAT
表1扩增ZmFd3 cDNA的部分片段的引物
扩增体系:1μl cDNA;0.5μl/0.5μl正反向引物(CMV-ZmFd3-F/R);10μlPrimeSTARMax Premix;
8μl ddH
扩增程序:98℃10sec;55℃5sec;72℃5sec。30个循环。
扩增获得138bp的目的片段后,使用Kpn I和Xba I双酶切ZMBJ-CMV-2bN81质粒,借助同源重组的方法将ZmFd3的138bp片段插入ZMBJ-CMV-2bN81载体中,获得重组载体。
酶切体系为:4μl ZMBJ-CMV-2bN81载体;1μl/1μl的Kpn I和Xba I限制性内切酶;2μl 10X缓冲液;12μl ddH
同源重组反应体系为:8μl线性化ZMBJ-CMV-2bN81载体;2μl回收的扩增片段;4μl的5×CE II Buffer;2μl Exnase II;4μl ddH
并将相同长度的GFP序列克隆到载体中作为对照(引物为:CMV-GFP-F/R),如表2所示。
表2CMV-GFP-F/R引物
2.农杆菌转化
将-80℃保存的农杆菌GV3101感受态细胞置于冰上融化;将1μg质粒加入到已经解冻的50μL的感受态细胞中,轻柔混匀,冰浴10min;在冰浴结束后将上述感受态细胞迅速在液氮中速冻5min;将第3步中的离心管置于37℃水浴锅内,水浴5min;水浴结束后冰浴5min;加入800μLLB液体培养基,28℃下,200rpm培养2~3h;将离心管置于离心机中5,000rpm离心1min,保留100μL涂布到含有50μg/mL Kan和Rif的LB培养基平板上。
3.农杆菌浸润
挑取新鲜划线或涂板的农杆菌单克隆置于提前加入1mL的50μg/mL Kan和Rif的LB液体培养基的1.5mL离心试管中,随后放置于28℃摇床下170rpm过夜培养10~16h。在无菌操作台中吸取80μL新鲜培养的菌液加入到含有15mL 50μg/mLKan和Rif的LB液体培养基的50mL离心管中,放置于28℃摇床下180rpm过夜培养12~16h。室温下5,000rpm离心15min,充分倒掉上清收集菌体,使用浸润缓冲液(10mmol/L MgCl
pCMV101和pCMV301质粒按照文献R.Wang,X.Yang,N.Wang,X.Liu,R.S.Nelson,W.Li,Z.Fan,T.Zhou,An efficient virus-induced gene silencing vector for maizefunctional genomics research,Plant J.86(1)(2016)102-115.
4.CMV-VIGS针刺玉米
(1)取浸润有ZMBJ CMV-VIGS载体系统农杆菌3d的本氏烟叶片;
(2)称量接种叶片,1.5:10(w/v)的比例加入0.01M的磷酸盐缓冲液(4℃冰箱保存);
(3)使用液氮预冷研砵,加入少许石英砂充分研磨,将匀浆转移至新的1.5mL离心管中,4℃下3,000rpm离心5min,小心收集上清液;
(4)挑选扁平合适的B73玉米种子,每个处理50粒,将种子在去离子水中室温浸泡40min,将其放置于铺有湿润吸水纸的托盘上,种胚向上;
(5)使用移液器将15μL的病毒粗提液滴在种子的种胚上,并在胚芽的两侧使用三排接种针沿60°角插入种子1~2mm。提前不同处理的玉米种子做好标记,将托盘使用保鲜膜密封保湿,置于培养箱中25℃黑暗条件下培养3d;
(6)挑选出芽且长势一致的玉米种子,将其小心种到营养土中(因为扎胚的缘故这个时候的种子需要小心操作),继续放置在光照培养箱中培养,培养条件变为光照16h/20℃和黑暗8h/18℃。
5.挑战接毒:
将已经进行VIGS的玉米在培养箱中培养12~14d,选取完全展开的第一片真叶上进行挑战接种SCMV、MCMV和SCMV+MCMV病毒粗提取液,进行摩擦接种。将接种后的玉米植株置于16h/24℃光照和8h/22℃黑暗培养条件下继续培养,在SCMV、MCMV和SCMV+MCMV接种后6天检测ZmFd3的沉默效率和对应的SCMV和MCMV的RNA和病毒外壳蛋白的积累量。
(1)Westernblot测定病毒外壳蛋白的积累量
a.取新鲜或者-80℃冰箱中保存的叶片,在液氮预冷的研砵中充分研磨。按照0.1g叶片粉末加入1mL裂解液(PMSF的最终浓度为1mM)的比例加入裂解液。冰上裂解15min。将其转移到旋转混匀仪中4℃混匀2h。裂解结束,4℃离心机14,000g离心5min,使用移液器将上清小心转移到灭菌的1.5mL离心管中,-80℃保存待用。参照碧云天BCA蛋白浓度测定的说明书,计算样品中的蛋白浓度。
b.蛋白样品的制备,按照4:1(v/v)比例加入适量体积的蛋白液和5×SDS-PAGE蛋白上样缓冲液,100℃金属浴下反应5min使蛋白充分变性;
c.将样品依次加入到PAGA胶的上样孔中,150V电泳,约45~55min至溴酚蓝染料跑至末尾,结束电泳;
d.考马斯亮蓝(CBB)的染色:将凝胶条浸于配置好考马斯亮蓝染色液,在摇床上染色直到可见清晰的蛋白条带,后使用清水浸泡胶条,清除背景后取出在白色背景下拍照作为内参对照;
e.转膜:剪取稍大于凝胶的PVDF膜,甲醇浸泡1~2min进行激活(时间不能太长),随后将PVDF膜和凝胶浸润置入转膜buffer中浸润5min。取出湿转仪夹子,使用“三明治法”依次放入浸湿滤纸、PVDF膜、凝胶、浸湿滤纸,借助工具小心清除PVDF膜和凝胶之间的气泡,120V转膜150min;
f.封闭:将转膜完成的PVDF膜放入小心放入盒子中,加入可以完全浸润的封闭液(5%BSA)缓冲液,室温封闭(约25℃,若室温过低可适当延长封闭时间)1.5h;
g.一抗孵育:使用3%BSA中稀释单克隆抗体,SCMV一抗稀释5,000倍,MCMV一抗稀释20,000倍。将封闭结束的PVDF膜置于稀释完成的一抗中室温孵育1.5h或4℃封闭过夜(12h以上)。使用TBST缓冲液清洗PVDF膜5min,重复4次;
h.二抗孵育:将PVDF膜置入使用TBST稀释2,000倍的二抗中,室温下孵育1h。用TBST缓冲液清洗PVDF膜5min,重复4次;
i.显色:将PVDF膜用吸水纸吸去多余水分,加入适量CDP-Star显色液(A液和B液等比例混合),室温下遮光孵育5min,通过上海天能生命科学有限公司化学发光成像系统显色至条带清晰。
(2)RT-qPCR检测SCMV、MCMV病毒基因的相对表达水平
使用ABI 7500FAST Real Time System实时荧光定量PCR仪,参照说明书检测相关基因的表达量的相对水平。使用Primer-blast(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)和Primer 5软件设计RT-qPCR相关引物,具体引物请参照附录。ZmUBI基因的表达作为内参对照,使用2
反应体系如下:10μL 2×ChamQ SYBR qPCR Master Mix(LowROX Premixed);0.45μL正/反向引物(10μmol·L
反应程序:步骤1(预变性),95℃反应30sec,1个循环;
步骤2(循环反应),95℃反应10sec,60℃反应30sec,40个循环;
步骤3(熔解曲线),95℃反应15sec,60℃反应60sec,
95℃反应15sec,1个循环。
Westernblot和RT-qPCR检测结果如图1所示。由图1可知,与CMV-GFP对照组相比,MCMV和SCMV的侵染导致ZmFd3沉默植物的局部和全身侵染叶片的黄化症状减少(图1中的A)。这与ZmFd3沉默植物中MCMV或SCMV的RNA和病毒的外壳蛋白的积累水平显著降低一致(图1中的B和C)。此外,ZmFd3在沉默植物中的沉默效率分别为88%和63%(图1中的D)。综上结果表明,沉默ZmFd3有利于植株抵抗MCMV和SCMV侵染。
但与对照组相比,生长18d的CMV-ZmFd3植物表现出显著的发育迟缓作用,如图2所示。可见,敲除或降低的ZmFd3基因表达有利于植物对抗病毒侵染,但ZmFd3长时间沉默对植物生长有害影响,所以构建了ZmFd3-dsRNA脂质体递送方案。
实施例3ZmFd3-dsRNA的合成
1.ZmFd3-dsRNA的合成
利用ZmFd3的siRNA靶向作用,体外合成了与CMV-ZmFd3相同长度的ZmFd3-dsRNA,具体步骤为:以T7-ZmFd3/FHP-dsRNA-F和T7-ZmFd3-dsRNA-R为引物,如表3所示。玉米自交系B73的cDNA作ZmFd3-dsRNA合成的模板扩增ZmFd3基因。
表3ZmFd3-dsRNA合成引物
扩增体系:
1μl cDNA;0.5μl/0.5μl正反向引物(T7-ZmFd3/FHP-dsRNA-F和T7-ZmFd3-dsRNA-R);10μlPrimeSTARMax Premix;8μl ddH
扩增程序:98℃10sec;55℃5sec;72℃5sec。30个循环。
产物回收后作为体外合成模板。
体外合成体系:10×Transcription Buffer2μl,A/G/C/UTP Solution各2μl,RNase Inhibitor 0.5μl,T7 RNAPolymerase 2μl,RNase free H
反应程序:42℃反应2h,体外合成ZmFd3-dsRNA的电泳检测结果如图3所示,图3显示,ZmFd3基因的片段为138bp,达到了预期的长度。
2.激光共聚焦评估沉默效率
将合成的ZmFd3-dsRNA与OD600=1.0的含有pGD-ZmFd3-EGFP质粒的农杆菌共同注射到本生烟中,每片烟草叶片中分别施用40μg或80μg的dsRNA,以不施用ZmFd3-dsRNA的烟草作为对照,并在三天后利用激光共聚焦评估沉默效率。共聚焦观察结果如图4显示,当每片烟草叶片中施用40μg或80μg的dsRNA后,激光共聚焦证明了其对ZmFd3的沉默效率分别达到55%和64%,该结果也通过westernblot得到证实。
实施例4ZmFd3-dsRNA的脂质体纳米颗粒(LNPs)的合成
1.阳离子脂质体(CLPs)的合成:分别将实施例3制备的1mg ZmFd3-dsRNA溶于8mL无核酸水中备用。将23mg卵磷脂、4mg胆固醇、54.2mg 1,2-二油氧基丙基三甲基氯化铵和0.8mg Cy5.5荧光染料通过超声溶解在2mL三氯甲烷和1mL无水乙醇中。然后将该溶液引入蒸发瓶中,并在70℃的水浴中以20rpm的转速混合,直到三氯甲烷完全蒸发并在瓶壁上形成薄膜。然后将溶解有dsRNA的无核酸水加入到蒸发瓶中,获得的ZmFd3@CLPs,在60℃的水浴中将转速降低至17rpm,直到LNPs(脂质纳米粒子)膜从蒸发瓶完全分离。最后,超声处理15min,并将溶液调节至8mL的体积。
2.阴离子脂质体(ALPs)的合成:dsRNA的ALPs吸附方法具体为:将10mL的PEI溶液(0.484mg/mL)逐渐添加到100μl的ZmFd3-dsRNA(0.446mg/mL)中,同时剧烈涡旋2min,然后在室温下孵育15min。然后,通过超声将53mg卵磷脂、3.4mg DMPG、24.2mg CHEMS和0.8mgCy5.5溶解在2mL三氯甲烷和1mL无水乙醇中。后续步骤与ZmFd3@CLPs一致。
实施例5ZmFd3@CLPs和ZmFd3@ALPs的性能
1.dsRNA脂质体的微观结构
使用透射电子显微镜(TEM)分析CLPs、ALPs、ZmFd3@CLPs和ZmFd3@ALPs的粒径,分散性指数和Zeta电位等微观结构,将CLPs、ALPs、ZmFd3@CLPs和ZmFd3@ALPs溶液附着到铜网上,使用磷钨酸负染10min,并在120kV下观察。结果如图6、图7所示。图6显示,CLPs与带负电荷的dsRNA进行静电相互作用,产生39.77mV的正电荷,对于ZmFd3@ALPs,中间状态是通过带正电的PEI和带负电的磷酸基团之间的初始静电相互作用建立的,从而产生正电荷的复合物。由图7所示,ALPs的后续封装和压缩会导致ZmFd3@ALPs粒子转变为-34.67mV负电荷。图7显示,CLPs、ALPs、ZmFd3@CLPs和ZmFd3@ALPs复合物表现出均匀的分布,总体微观结构表现为90~400nm范围内的椭球体,CLPs、ALPs、ZmFd3@CLPs和ZmFd3@ALPs之间不存在颗粒聚集,LNPs囊泡结构清晰可辨。由于负载dsRNA引起LNPs外涂层的轻微增大,特别是在ZmFd3@ALPs中包含PEI分子,平均粒径增加得更显著。这进一步证明了构建的LNPs颗粒成功地包裹了dsRNA。
2.ZmFd3@CLPs或ZmFd3@ALPs对核酸的保护性能
外部环境和植物叶片表面核酸酶的丰富性使dsRNA极易降解,因此,需要评估载体分子对dsRNA的保护能力。
方法:将10U核酸酶分别加入到含有1000ng dsRNA的dsRNA@CLPs或dsRNA@ALPs溶液中,然后在37℃下孵育。然后,加入总体积1/10的3MNaAc,并在0.5h和1h内加入总体积两倍的无水乙醇,混合,并在-80℃下沉淀1h。
对照组将10U核酸酶加入到1000ng ZmFd3-dsRNA中,后续步骤与上述相同。
然后将提取的dsRNA并将其储存在-80℃下。将所得样品进行琼脂糖凝胶电泳,并使用ImageJ软件进行定量分析。
结果如图8所示,图8显示,未经处理的ZmFd3-dsRNA在150bp处显示出不同的条带,0.5h和1h后150bp处条带发生缺失,表明ZmFd3-dsRNA完全降解。相反,CLPs和ALPs处理组在0.5h的处理后,在150bp处发现出可辨别的条带。定量分析后,观察到ALPs对dsRNA表现出最有效的保护作用,在0.5h保留了初始浓度的89.78%,在1h时仍保留了68.88%。尽管与ALPs相比,CLPs中的dsRNA含量较低,但30min后,CLPs中dsRNA的浓度保持在初始的65.42%,1h后保持在52.12%。这些结果表明,即使在核酸酶处理后,CLPs和ALPs也能保护ZmFd3-dsRNA免受核酸酶降解,并且由于核酸酶在自然环境中的存在达不到实验中的浓度,构建的LNPs递送系统能够满足大田使用条件。
3.ZmFd3@CLPs和ZmFd3@ALPs在不同温度下的保存情况
为了评估在自然环境中使用CLPs和ALPs的适用性,对LNPs的稳定性进行了测量。将合成的ZmFd3@CLPs/ALPs在分别在4、28和37℃下储存21d,并测量其平均尺寸、多分散指数(PDI)和Zeta电位的变化。
通过马尔文粒度仪观察不同储存期内颗粒尺寸和Zeta电位的变化来评估LNPs的稳定性,结果如图9所示。图9的A~C显示,在4℃的温度下储存17d后,ZmFd3@CLPs和ZmFd3@ALPs的尺寸、多分散指数以及Zeta电位没有观察到显著变化。然而,在第21天,两个LNPs的所有三个指标都表现出下降趋势。当在37℃的储存条件下储存时,LNPs的变化尤其明显,主要是多分散指数的显著波动,并且ALPs试管底部出现的部分沉淀(图10)。储存在28℃下的ZmFd3@LNPs表现出与储存在4℃温度的ZmFd3@LNPs相类似的状态。其中ZmFd3@ALPs,表现出相对大的粒径变化。相反,CLPs由于其较小的颗粒尺寸而在不同温度下表现出显著改善的状态(图9)。ZmFd3@CLPs和ZmFd3@ALPs在4~28℃时,平均尺寸、多分散指数(PDI)和Zeta电位较为稳定。
4.ZmFd3@CLPs和ZmFd3@ALPs能够在玉米植株中运输
本发明为了研究dsRNA@CLPs和dsRNA@ALPs在玉米植株中能否运输,采用了叶片摩擦和根系浸泡两种方法。
①使用Cy3-UTP标记ZmFd3@CLPs和ZmFd3@ALPs中的ZmFd3-dsRNA,制备方法与实施例3不同的是,在合成dsRNA时,将UTP替换为带有Cy3标记的Cy3-UTP。
②使用Cy5.5荧光染料标记步骤①中制备的ZmFd3@CLPs和ZmFd3@ALPs中的脂质体,制备方法同实施例4。
叶片摩擦方法:使用棉球将步骤②合成的ZmFd3@CLPs或ZmFd3@ALPs温和的涂抹在玉米的第二片上。处理后12h和24h,观察ZmFd3-dsRNA和脂质体荧光。
根浸泡法:将玉米的根浸泡在含有步骤②制备的ZmFd3@CLPs或ZmFd3@ALPs的溶液中。每株玉米植株用含有80μg dsRNA的CLPs或ALPs处理,没有脂质体包裹的dsRNA作为对照。使用共焦显微镜在使用LNPs(ZmFd3@CLPs或ZmFd3@ALPs)处理后12h和24h分别观察荧光强度。
采用叶片摩擦法通过观察第二叶和系统叶的荧光强度研究脂质体和dsRNA在不同叶片上的运输;采用根系浸泡法观察根和系统叶的荧光强度研究脂质体和dsRNA从根到系统叶的运输。
处理12h后,利用根浸泡法观察ZmFd3-dsRNA和脂质体荧光,结果如图11所示。图11显示,与其他处理相比,用CLPs处理的植物均检测出相对较高的荧光强度。在这些植物的系统叶片中尽管荧光强度相对较低,也观察到了类似的结果。
当采用叶片施用方法时,在第二片叶(施用的叶片)中检测到大量的红色和染色的荧光,而在系统叶片中没有检测到ZmFd3-dsRNA,仅检测到少量的LNPs的荧光(图11)。说明在12h时ZmFd3-dsRNA还没有系统运输到系统叶。
用CLPs和ALPs处理玉米24h后,玉米的根系、第二叶和系统叶的共聚焦显微照片如图12所示。图12显示,在叶片摩擦处理的叶片和系统叶片以及根浸泡法处理的根和系统叶片中均检测到强荧光信号。并且与用ALPs处理的植物相比,用CLPs处理的植物的三个位置均表现出更高的荧光强度。
在12h,使用单独dsRNA的摩擦叶中检测到低水平的荧光信号,而在根中观察的荧光信号更低,并且在系统叶片中均未检测到荧光信号。24h后,这三个位置均未检测到荧光信号,这表明dsRNA完全降解(图13)。
综上,ZmFd3@CLPs/ALPs在玉米植株中具有有效的转运能力,并防止dsRNA在外部环境中降解。ZmFd3@CLPs由于颗粒尺寸较小、带有正电荷,所以性能优于ZmFd3@ALPs。
5.ZmFd3@CLPs和ZmFd3@ALPs的抗病毒活性测定
将2日龄B73玉米幼苗分为5组,分别为blank control组、CLPs组、ALPs组、ZmFd3@CLPs和ZmFd3@ALPs组。
ZmFd3@CLPs组使用喷壶向每株植物喷施含有80μg ZmFd3-dsRNA的CLPs;
ZmFd3@ALPs组使用喷壶向每株植物喷施含有80μg ZmFd3-dsRNA的ALPs;
CLPs组使用喷壶向每株植物喷施等体积的不含有ZmFd3-dsRNA的CLPs;
ALPs组使用喷壶向每株植物喷施等体积的不含有ZmFd3-dsRNA的ACLPs;
blank control组使用喷壶向每株植物喷施等体积的水。
在喷施24h后,每株玉米幼苗分别混合接种SCMV和MCMV两种病毒,然后分别在接种病毒后的第6天收集玉米叶片,观察叶片并使用实时定量RT-qPCR和蛋白质印迹进行分析。实时定量RT-qPCR和蛋白质印迹分析步骤与实施例1相同,结果如图14所示。
由图14中的A可知,9d日龄的B73玉米幼苗在复合侵染的第6天时,施用ZmFd3@CLPs或ZmFd3@ALPs表现出减少的褪绿和黄化面积,而仅用CLPs或ALPs处理的植物没有表现出变化,与仅喷洒水的植物相当。由图14中的B可知,B73玉米幼苗在复合侵染的第6天时,与blank control组相比,ZmFd3@CLPs处理的植株叶片中MCMV和SCMV外壳蛋白的积累水平分别降低了52.44%和87.95%,ZmFd3@ALPs处理的植物也表现出相似的抗病毒活性;由图14中的C、D可知,ZmFd3@CLPs与ZmFd3@ALPs组中的玉米植株MCMV和SCMV病毒RNA表达水平降低。由图14中的E可知,ZmFd3@CLPs与ZmFd3@ALPs组中的玉米植株ZmFd3的表达水平分别降至16.00%或17.20%,单独喷施CLPs或ALPs没有检测到沉默效果。
脂质体处理玉米植株6天时,玉米的长势如图15所示。由图15可知,喷施ZmFd3-dsRNA脂质体的玉米并未发生矮化现象,说明ZmFd3-dsRNA脂质体能有效降低ZmFd3长时间沉默对植物生长产生的有害影响。
实施例6验证ZmFd3与病毒编码蛋白互作
1.酵母双杂交验证ZmFd3与病毒编码蛋白的互作
以玉米B73的cDNA为模板克隆完整的ZmFd3基因CDS序列,共456bp。
扩增引物:
ZmFd3-CDS-F:ATGTCGACCAGCACATTC;(SEQ ID NO.8)
ZmFd3-CDS-R:CTAGTACAGGTCGCCTTCCTT(SEQ ID NO.9)
扩增体系:1μl cDNA;0.5μl/0.5μl正反向引物(ZmFd3-CDS-F/R);10μlPrimeSTARMax Premix;
8μl ddH
扩增程序:98℃10sec;55℃5sec;72℃5sec。30个循环。
利用pGADT7和pGBKT7在酵母双杂交(Y2H)实验中构建N端GAL4AD或GAL4 DNABD融合结构。
本发明中酵母感受态细胞的制备及AD和BD质粒的转化均参照Clontech公司酵母双杂交试剂盒说明手册指导手册提供的方法进行。
使用同源重组的方法将ZmFd3基因的CDS序列构建到BD上,随后将BD-ZmFd3与pGADT7-SCMV病毒蛋白(10个)和MCMV病毒蛋白(7个)系列载体进行点对点杂交试验。同时设置阴性对照(AD-T7与BD-Lam)和阳性对照(AD-T7和BD-53)。
10个SCMV蛋白:p1,HC-Pro,p3,6K1,CI,6K2,NIa-VPg,NIa-Pro,NIb,SCMV-CP。
7个MCMV蛋白:p32,p50,p111,p7a,p7b,p31,MCMV-CP。
将共转的酵母细胞分别涂布于SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade的培养基中,在30℃下恒温培养3~5d。结果如图16所示。图16显示,AD-T7与BD-53的阳性对照、ZmFd3和SCMV的HC-Pro、ZmFd3和MCMV的p7b能够在SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade的培养基上生长,而AD-T7与BD-Lam的阴性对照和其他组合只能够在SD/-Trp/-Leu培养基上生长,表明ZmFd3能够分别与SCMV的HC-Pro和MCMV的p7b在酵母中互作,其他基因如MCMV的p7a和p31不能与ZmFd3互作。
2.BiFC验证ZmFd3与病毒编码蛋白的互作
为了进一步分析ZmFd3与SCMV的HC-Pro和MCMV的p7b的互作,分别构建了YFP(荧光蛋白)的C端的ZmFd3与YFP的N端SCMV的HC-Pro、MCMV的p7b和MCMV的p31融合质粒。划线摇菌培养后,将重组质粒转化农杆菌后划线培养,最终将菌体全部调OD600为0.6,将携带有pSPYCE(M)-ZmFd3质粒的GV3101农杆菌分别和与携带有pSPYNE173-SCMV-HC-Pro或pSPYNE173-MCMV-p7b质粒的GV3101农杆菌混合,并加入携带沉默抑制子P19质粒的农杆菌(1:1:1),将上述充分混合的农杆菌注射到生长至5~6叶期本氏烟完全展开的第3和4片真叶上。混合组合如表4所示。
表4BiFC注射组合
浸润3天后使用激光共聚焦显微镜观察YFP的表达情况。其中,pSPYCE(M)-ZmFd3和pSPYNE173-MCMV-P31一组作为阴性对照。结果如图17所示。图17显示,分别注射ZmFd3与SCMV的HC-Pro和MCMV的p7b的烟草叶片上有YFP的荧光出现,而阴性对照ZmFd3和MCMV的p31组合未见YFP荧光,说明ZmFd3分别与SCMV的HC-Pro和MCMV的p7b在烟草体内能够互作,而不能跟阴性对照MCMV的p31互作。这与酵母双杂交结果一致。
实施例6FPH@CLPs/ALP在植物中的抗病毒活性
1.FPH-dsRNA@CLPs/ALP的制备
(1)FHP-dsRNA的合成
FHP-dsRNA为靶向ZmFd3、MCMV-p7b和SCMV-HC-Pro的dsRNA(FPH-dsRNA)。
选择ZmFd3、SCMV-HC-Pro和MCMV-p7b基因的特定区域(分别为138bp、120bp和120bp,如SEQ ID NO.1,SEQ ID NO.10和SEQ ID NO.11所示),均以SCMV和MCMV复合侵染的B73玉米的cDNA为模版,分别用FHP-dsRNA-F1/R1、FHP-dsRNA-F2/R2和FHP-dsRNA-F3/R3引物进行扩增,合成FHP-dsRNA。
SEQ ID NO.10
CGGTGTAACCCAAAATTTTCACATTTGCCTTTACTATGGCAAGTGGCTGAAACAGTAGGACA TTACACTGACAACCAATCGAAACAAATAATTGATATCAGTGAGGCGCTCATCAAAGTT
SEQ ID NO.11
TTCGTCCTGGCCTCAGTGGTTAAGGAATTTAATCTTGGGGATTTTGATCTCCTCGATTCTGTT CATCTTGACGAAGACACAGGACACCGTTGCCGTTTATCACGAGCCATCGGTGTACTC
表5合成FHP-dsRNA的引物
随后,使用引物对T7-ZmFd3/FHP-dsRNA-F和T7-FHP-dsRNA-R以SEQ ID NO.1、SEQID NO.10、SEQ ID NO.11为模板扩增融合基因FHP-dsRNA,如SEQ ID NO.18所示。
SEQ ID NO.18:
TTCGCTACTTCCTGCACGCTGTTGGGCAATGTTAGAACAACGCAGGCCTCCCAGACAGCGGTGAAGAGCCCTTCGTCTCTAAGCTTCTTCAGCCAAGTTACGAAGGTTCCAAGCCTGAAGACCTCCAAGAAACTGGATCGGTGTAACCCAAAATTTTCACATTTGCCTTTACTATGGCAAGTGGCTGAAACAGTAGGACATTACACTGACAACCAATCGAAACAAATAATTGATATCAGTGAGGCGCTCATCAAAGTTTTCGTCCTGGCCTCAGTGGTTAAGGAATTTAATCTTGGGGATTTTGATCTCCTCGATTCTGTTCATCTTGACGAAGACACAGGACACCGTTGCCGTTTATCACGAGCCATCGGTGTACTC
使用T7试剂盒进行体外转录,去除DNA模板,在dsRNA产物中加入不含rRNA的DNA酶。通过酶切和电泳评估dsRNA的质量,并确定FHP-dsRNA的浓度。
(2)FHP@CLPs/ALP的合成
含有FHP-dsRNA的CLPs/ALP的制备参照实施例4中ZmFd3@CLPs/ALP的制备。
2.验证FPH@CLPs/ALP在玉米中的抗病毒活性
将玉米植株分为3组,每组15株,分别为blank control组、FHP@CLPs和FHP@ALPs组。
FHP@CLPs组使用喷壶向每株植物喷施含有80μg FHP-dsRNA的CLPs;
FHP@ALPs组使用喷壶向每株植物喷施含有80μg FHP-dsRNA的ALPs;
blank control组使用喷壶向每株植物喷施等体积的水。
在喷施24h后,每株玉米幼苗分别接种SCMV和MCMV,然后分别在接种病毒后的第6天收集玉米叶片,观察叶片并使用实时定量RT-qPCR和蛋白质印迹进行分析结果,如图18所示。图18的A显示,在玉米感染SCMV和MCMV的第6天时,与blank control组玉米相比,在病毒侵染的第6天时,喷施负载FHP-dsRNA的CLPs/ALPs的植物表现出较少的褪绿面积;图18中的B-D分别为western blot和RT-qPCR检测结果,显示FPH@CLPs/ALPs处理的植物中病毒水平显著降低;图18中的E为MCMV和SCMV病毒侵染第6天时,ZmFd3的表达情况,ZmFd3在玉米叶片中的沉默效率分别为52.98%和55.78%。
由图18中的F和G可知,MCMV和SCMV病毒侵染的第11天时,blankcontrol组的初始植株表现出完全的萎蔫,到第15天时,blank control组的所有植株都已死亡,而FPH@CLPs/ALP处理后植物症状减轻且延缓死亡。说明FPH@CLPs/ALP在玉米植株中的具有抗MCMV和SCMV病毒活性。
3.验证FPH@CLPs/ALP在高粱中的抗病毒活性
将高粱植株分为3组,每组15株,分别为blank control组、FHP@CLPs和FHP@ALPs组。
FHP@CLPs组使用喷壶向每株植物喷施含有80μg FHP-dsRNA的CLPs;
FHP@ALPs组使用喷壶向每株植物喷施含有80μg FHP-dsRNA的ALPs;
blank control组使用喷壶向每株植物喷施等体积的水。
在喷施24h后,每株高粱幼苗接种SCMV,然后分别在接种病毒后的第6天收集高粱叶片,观察叶片并使用蛋白质印迹进行分析,结果如图19所示。由图19中的A可知,FPH@CLPs组的高粱植株中花叶症状的发生率从70.00%下降到20.00%,FPH@ALPs组的高粱植物的叶片中没有发现有黄化植株的出现,westernblot分析显示,与blank control组相比,喷施FPH@CLPs的植物中SCMV CP蛋白的积累显著减少了91.90%。并且,在喷施FPH@ALPs的植物中未检测到病毒蛋白。证明了FPH@CLPs/ALP纳米递送系统在高粱抗病毒中的成功应用。
由以上实施例可知,本发明提供了ZmFd3基因在提高植物抗病毒中的应用和一种ZmFd3-dsRNA、FPH-dsRNA及其脂质体和应用,其作用方式示意图如图20所示,为植物抵抗MCMV和SCMV侵染提供了新思路。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
