一种富马酸酶突变体及应用
文献发布时间:2024-05-31 01:29:11
技术领域
本发明涉及生物工程技术领域,具体涉及一种富马酸酶突变体及应用。
背景技术
富马酸是重要的四碳有机酸,作为一种潜在的平台化学品,在食品、制药、生物聚合物、涂料、绿色溶剂和增塑剂中有广泛的应用。现有技术报道的用于生产富马酸的方法是顺酐(又称马来酸酐)异构法。此外,生产富马酸的工艺还包括:糠醛氧化法、马来酸酶催化异构法、假丝酵母发酵法以及生物质原料发酵法等,上述方法都未能实现富马酸最大得率,据相关文献报道,还原TCA途径是富马酸最大得率的实现途径,而富马酸酶(FumR)的最大酶活力是保证其高效合成的关键。整个TCA胞质循环反应中限速反应的最大酶活力对促进丁二酸的生成具有重要作用。然而,富马酸酶的酶活力较低,催化效率低是阻碍其广泛生产的主要因素之一。为了更好的适应工业化的需求,实现丙酮酸羧化酶和苹果酸脱氢酶对富马酸前体苹果酸的持续供应,富马酸酶在相同的生产条件下,必须具有更高的酶活和充分的稳定性。
现有技术中,Kang以紫外和Y射线诱变米根霉,筛选获得了一株富马酸产量提升1.9倍的突变株,5L发酵罐水平为32.1g/L。闻建平等利用飞秒激光诱变技术,选育出米根霉富马酸高产菌株,突变株正突变率8%-21%,发酵单位比原始菌株提高15%-50%。然而,由于根霉属真菌的复杂的生长形态,限制了发酵过程的可控性和工业化规模;陈修来等以光滑球拟酵母为宿主,针对于靠近酶表面的B位点的四个氨基酸残基进行不同氨基酸取代,最终过表达P160A突变体,获得了工程菌株T.G-PMS-P160A,且能够产生5.2g/L的富马酸盐。基因工程手段在其菌种改造方面仍很困难,限制了富马酸酶活性的进一步提高。
因此,亟待研发一种高催化率的富马酸酶,以能极大限度地提高天然酶的性能,使之更适用于工业应用。
发明内容
本发明提供一种富马酸酶突变体及应用,目的在于克服现有技术中TCA还原途径中富马酸合成过程中富马酸酶催化效率低的问题,进而实现还原TCA途径中对苹果酸的高效转化。
为实现上述目的,本发明采取的技术方案如下:
第一方面,本发明提供了一种富马酸酶突变体,由氨基酸序列如SEQ ID NO:1所示的富马酸酶中第108位、第222位、第323位中的至少一个位点进行突变而得。
本发明通过对米根霉来源的富马酸酶进行分子改造,获得高底物亲和力的突变酶,其与苹果酸底物的结合力强,进而促进富马酸酶催化苹果酸转化成富马酸,实现富马酸酶的单向催化苹果酸转换成富马酸。本发明分别对其108、222、323位等位点进行点突变并筛选,获得催化效率提高且最适pH值低的富马酸酶突变体。与野生型富马酸酶的催化效率相比,本发明的富马酸酶突变体的催化效率较优化前提高了1.4-3.2倍,比酶活较野生型提升164.2%。
作为本发明所述的富马酸酶突变体的优选实施方式,所述突变为以下至少一种:
i、富马酸酶中第108位的苏氨酸突变为谷氨酰胺;
ii、富马酸酶中第222位的丙氨酸突变为天冬氨酸;
iii、富马酸酶中第323位的谷氨酸突变为赖氨酸。
第二方面,本发明提供了一种编码所述富马酸酶突变体的核酸。
作为本发明所述的核酸的优选实施方式,其核苷酸序列为SEQ ID NO:2-7中所示的任意一种。
第三方面,本发明提供了一种重组质粒,包括所述的核酸。
作为本发明所述的重组质粒的优选实施方式,其骨架载体为pET表达载体。
第四方面,本发明提供了一种重组菌,包括所述的重组质粒。
作为本发明所述的重组菌的优选实施方式,其宿主细胞为大肠杆菌或酵母。
第五方面,本发明将所述富马酸酶突变体、所述核酸、所述重组质粒、所述重组菌在催化L-苹果酸中应用。
与现有技术相比,本发明的有益效果为:
本发明的通过理性设计改造富马酸酶底物亲和力获得突变酶,其与苹果酸底物的结合力强,进而促进富马酸酶催化苹果酸转化成富马酸,实现富马酸酶的单向催化苹果酸转换成富马酸,从而提高富马酸产量。与野生型富马酸酶的催化效率相比,本发明提供的富马酸酶突变体的催化效率较优化前提高了1.4-3.2倍,比酶活较野生型提升了124.0-211.2%。其中富马酸酶突变体T108Q/A222D的最适pH从7.0下降到5.0,生产时无需再添加中和剂,降低固废处理成本,且便于后续分离纯化;在5.0环境下低温放置24小时,其相对酶活仍然在90%以上,稳定性好。本发明解决了富马酸酶催化效率低的问题,为其工业化应用奠定了基础。
附图说明
图1为本发明的实施例3中纯化后突变体的SDS-PAGE电泳图;其中,条带1-6依次代表:T108Q、A222D、E323K、T108Q/E323K、T108Q/A222D、A222D/E323K。
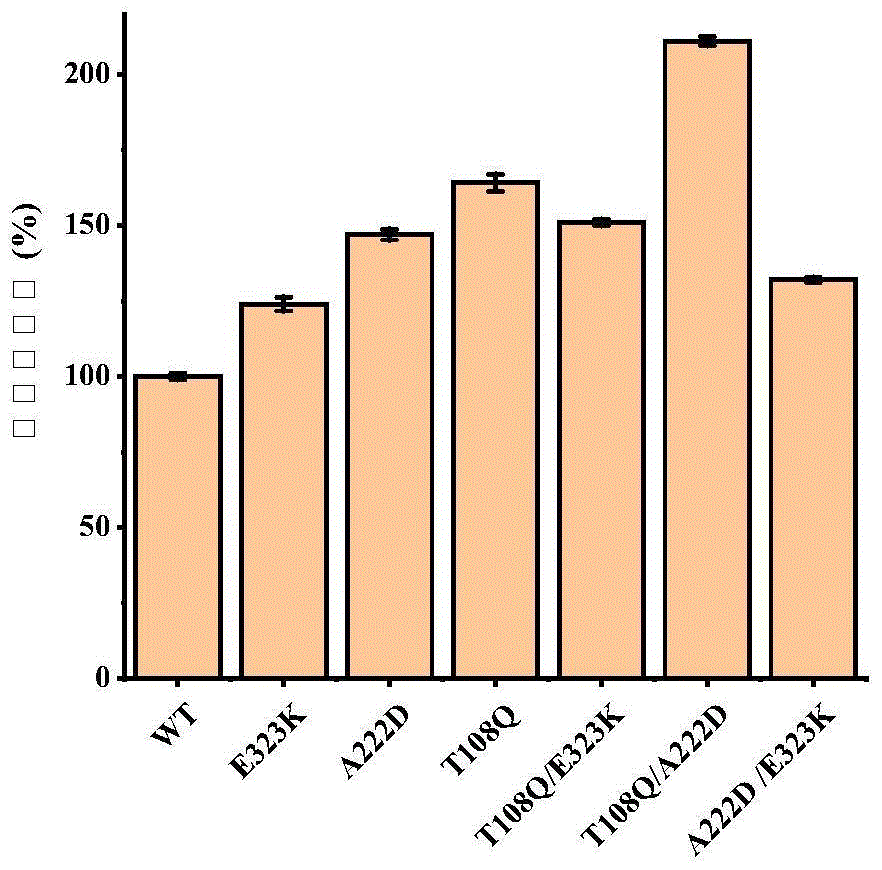
图2为本发明的实施例4中野生型与单点突变、双突变体的相对比酶活。
图3为本发明的实施例4中野生型与单点突变、双突变体的最适pH值。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
下述实施例和对比例中,所用的试验方法如无特殊说明,均为常规方法;所用的材料、试剂等,如无特殊说明,均可从商业途径得到。所述pET28a(+)-WT购自擎科生物公司。
实施例1:富马酸酶突变体的构建
基于米根霉Rhizopus oryzae ATCC 10260来源的富马酸酶(RoFumR)(GenBank:P55250.1,即SEQ ID NO:1)进行突变改造设计,分别对其108、222、323位等多个位点进行突变并筛选,筛选酶活力提高的突变体,所选的位点为富马酸酶中第108位的苏氨酸突变为谷氨酰胺(记为T108Q)、第222位的丙氨酸突变为天冬氨酸(记为A222D)和第323位的谷氨酸突变为赖氨酸(记为E323K)。
以米根霉富马酸酶基因为基础,对每个突变位点设计引物如下:
T108Q-F:5'-CAGACTGGTTCTGGTCAACAGACCAAGATGAAC-3',
T108Q-R:5'-GTTCATCTTGGTCTGCAAACCAGAACCAGTCTG-3';
A222D-F:5'-ACTCACCTCCAGGACGACACTCCGCTGACTCTG-3',
A222D-R:5'-CAGAGTCAGCGGAGTGACGTCCTGGAGGTGAGT-3';
E323K-F:5'-AGCCTGCCGGAGAACAAACCAGGTTCTTCTATC-3',
E323K-R:5'-GATAGAAGAACCTGGAAAGTTCTCCGGCAGGCT-3'。
以米根霉富马酸酶基因为模板进行定点PCR扩增,获得单位点突变的突变体,筛选酶活力提高的突变体,所选的位点为T108Q、A222D和E323K。
以pET28a(+)-WT为模板,按照上述引物序列,利用全质粒PCR引入定点突变的方法对突变位点进行突变质粒的构建。其中双突变是在单突变的基础上,利用相应的引物序列构建制备得到。
PCR反应体系均为:
2×pfx mix 25μL,正向引物(10μmol·L
PCR扩增程序为:
首先,98℃预变性4min;然后进入30个循环:98℃变性30s,55℃退火30s,72℃延伸8min;最后72℃延伸10min,4℃保温。PCR产物用1%琼脂糖凝胶电泳进行检测。
在验证正确的PCR产物中加入Dpn I,37℃,水浴2h,降解模板,之后转化E.coliJM109感受态细胞,将转化产物涂布于含有50mg·mL
测序正确的突变体,从甘油管接种至LB培养基,过夜培养,提取质粒,将质粒转化表达宿主E.coli BL21感受态细胞,得到能够表达富马酸酶突变体T108Q、A222D、E323K以及双突变体T108Q/A222D;T108Q/E323K;A222D/E323K的重组大肠杆菌。
富马酸酶突变体T108Q的核苷酸序列如SEQ ID NO:2所示;富马酸酶突变体A222D的核苷酸序列如SEQ ID NO:3所示;富马酸酶突变体E323K的核苷酸序列如SEQ ID NO:4所示;富马酸酶双突变体T108Q/A222D的核苷酸序列如SEQ ID NO:5所示;富马酸酶双突变体T108Q/E323K的核苷酸序列如SEQ ID NO:6所示;富马酸酶双突变体A222D/E323K的核苷酸序列如SEQ ID NO:7所示。
实施例2:富马酸酶突变体的表达
分别接种实施例1制备的表达富马酸酶突变体T108Q、A222D、E323K以及双突变体T108Q/A222D、T108Q/E323K、A222D/E323K的重组菌,于LB液体培养基(含30mg·mL
实施例3:富马酸酶突变体的纯化
分别将实施例2收集的重组菌的破壁上清液中加入175g的固体硫酸铵盐析12h;将盐析后的粗酶液4℃、10000rpm离心20min,取沉淀用含50mM磷酸钠、0.5M氯化钠、20mM咪唑、pH 7.4的缓冲液A溶解,并在缓冲液A中透析10h后,通过0.22μm膜过滤后制成上样样品;
Ni亲和柱用缓冲液A平衡后,将上样样品吸入Ni柱,使之完全吸附后,按顺序分别用100mL缓冲液A、100mL含有25mM咪唑的缓冲液A、100mL含50mM咪唑的缓冲液A、100mL含75mM咪唑的缓冲液A、100mL含500mM咪唑的缓冲液A,流速为1mL·min
实施例4:富马酸酶突变体的酶活测定
以富马酸酶野生型为对照,取实施例3制备的富马酸酶突变体的酶制品检测酶活。
酶活的测定方法为:以L-苹果酸为底物测定酶活,使用不同浓度L-苹果酸与野生型及不同突变体纯化酶在30℃下反应10min,测定其在290nm下的吸光值,并计算其酶活。
酶活定义为:在30℃,pH 7.0条件下,每分钟转化生成1μmol富马酸的酶量定义为1个单位(1U)。
以碧云天蛋白浓度测定试剂盒测定野生型酶与突变体酶的蛋白浓度,根据下述比活力测定公式计算各酶的比活力(简称比酶活):比活力=活力单位数/mg蛋白。
其中,定义野生型酶的比活力大小为100%。
结果如图2所示,从测定结果来看,突变体T108Q/A222D比酶活较野生型提高2.11倍,效果显著;突变体T108Q提升效果次之,其余突变体比酶活虽有提升,但效果不明显。
实施例5:富马酸酶突变体的最适pH值和pH稳定性
以富马酸酶野生型为对照,取实施例3制备的富马酸酶突变体的酶制品检测最适pH值和pH稳定性。
为测定突变酶最适pH:分别配制pH 3.0、4.0、5.0、5.5、6.0、6.5、7.0、8.0和9.0的缓冲液,并将其用于溶解L-苹果酸,根据野生型及突变体的最适温度条件,利用酶活测定条件,确定野生型及突变体的最适反应pH,相对酶活计算方式如下:
为评估突变酶在不同pH下的稳定性,使用不同pH值的缓冲液,对野生型及突变体的酶液进行稀释或者直接用不同pH缓冲液进行破壁获取酶液,并将其放在4℃的冰箱中,24h后根据酶活测定方法对该酶在不同pH下放置一段时间后的酶活进行测定。
当野生型酶突变为T108Q/A222D后,最适pH为5.0,与野生型酶最适pH相比发生变化。在pH 4.5-7.0的弱酸性范围内,突变体酶的催化活性较高,相对酶活高于80%。比较突变体酶的pH稳定性,可以发现突变体酶的pH稳定性与原始酶相一致,没有发生十分明显的变化。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 一种真菌α-L-阿拉伯呋喃糖苷酶合成调控蛋白突变体及其应用
- 一种催化性能提高的角蛋白酶突变体及应用
- 一种蔗糖水解酶突变体及其制备方法与应用
- 一种生麦芽糖淀粉酶突变体的制备及其应用
- 一种麦芽糖淀粉酶突变体的制备及其应用
- 提高谷氨酸棒杆菌L-苹果酸产量的富马酸酶突变体及构建方法和应用
- 一种7α-HSDH酶突变体和7β-HSDH酶突变体及其编码基因和应用
