基于DDX19A促进宫颈鳞状细胞癌转移的应用
文献发布时间:2023-06-19 11:03:41
技术领域
本发明涉及医药产品技术领域,更具体地,涉及基于DDX19A促进宫颈鳞状细胞癌转移的应用。
背景技术
宫颈癌是最常见的妇科恶性肿瘤之一,也是全世界妇女癌症相关死亡的第二大主要原因。尽管在外科手术、化学治疗、放射治疗和免疫治疗方面取得了进步,宫颈癌患者的5年生存率已提高到80%。然而,一旦发生局部转移或远处转移,5年生存率将降低至约50%。转移是宫颈癌患者死亡的主要原因。宫颈鳞状细胞癌是最常见的病理类型,约占所有病例的80%。因此,阐明宫颈鳞状细胞癌转移的潜在机制并确定新的靶标极为重要。
DEAD-box家族以保守的Asp-Glu-Ala-Asp(DEAD)基序为特征,代表由37个成员组成的RNA解旋酶家族。DEAD-box蛋白参与各种RNA代谢过程,包括转录,RNA转运和RNA降解。最近的研究表明,许多DEAD-box蛋白在各种癌症中异常表达并在转移中起关键作用。例如,DDX39可以通过激活Wnt/β-catenin途径来促进肝癌的发生和转移;而DDX3可以激活CBC-eIF3介导的含uORF的致癌mRNA的翻译,从而促进头颈部鳞状细胞癌的转移;DDX1可以调节microRNA的成熟并抑制卵巢肿瘤的转移。但是,DEAD-box蛋白在宫颈鳞状细胞癌中的表达和功能尚不明确。
发明内容
本发明所要解决的技术问题是克服现有技术存在的上述问题,首先提供DDX19A基因或其表达产物的应用。本发明的第二个目的是提供一种包括但不限于提高宫颈鳞状细胞癌患者临床预后准确率的药盒或试剂盒。
本发明的目的通过以下技术方案实现:
首先,本发明提供DDX19A基因或其表达产物在开发、筛选宫颈鳞状细胞癌功能产品方面的应用,所述功能产品对DDX19A基因或其表达产物具有抑制作用。
其次,本发明还提供对DDX19A基因或其表达产物具有抑制作用的功能产品在制备预防或/和缓解或/和治疗宫颈鳞状细胞癌的产品方面的应用。
另外,本发明对公共数据库临床样品的生物信息学分析表明,DDX19A在宫颈鳞状细胞癌组织中的表达升高,并且高表达的DDX19A与转移和临床预后不良呈正相关。在功能上,发现DDX19A促进了宫颈鳞状细胞癌细胞体外的迁移和侵袭以及体内的肺转移。
最后,本发明通过体外细胞迁移和侵袭实验表明了敲低DDX19A可抑制宫颈鳞癌细胞的迁移和侵袭,而过表达DDX19A可显著增强宫颈鳞状细胞癌细胞的迁移和侵袭;另外,还研究了对体内肿瘤转移的影响,结果发现:敲低DDX19A细胞在裸鼠中可明显抑制肿瘤细胞的肺转移,相反,过表达DDX19A细胞可显著促进肿瘤细胞的肺转移。
因此,本发明还提供包括但不限于DDX19A基因或其表达产物在开发、筛选抑制宫颈鳞状细胞癌细胞的迁移和侵袭的功能产品方面的应用,所述功能产品对DDX19A基因或其表达产物具有抑制作用。或者,本发明还提供对DDX19A基因或其表达产物具有抑制作用的功能产品在制备抑制宫颈鳞状细胞癌细胞的迁移和侵袭的产品方面的应用。同样,所述功能产品具有包括但不限于下调DDX19A基因的表达、转录、或其表达产物的功能。
本发明通过肺转移结节数和肿瘤重量测定,发现DDX19A敲低细胞在裸鼠中表现出较少数量的转移性肺结节的数目,以及更低的裸鼠体重,因此,所述功能产品用于抑制宫颈鳞状细胞癌细胞远处转移,同样也可以用于抑制宫颈鳞状细胞癌细胞转移引起的转移性肺结节的生长。因此更优选的,所述功能产品包括但不限于DDX19A核酸抑制剂,DDX19A蛋白抑制剂,DDX19A基因缺陷或沉默的免疫相关细胞、其分化细胞或者基因重组构建体中的一种或多种。
研究结果表明,DDX19A影响宫颈鳞状细胞癌细胞系中的NOX1表达,而DDX19A表达与宫颈鳞状细胞癌标本中的NOX1表达呈正相关。通过敲低和过表达DDX19A验证分析促进宫颈鳞状细胞癌细胞的迁移和侵袭的功能。此外,过表达的NOX1恢复了稳定DDX19A导致宫颈鳞状细胞癌细胞的迁移和侵袭的功能。总之,我们的数据表明DDX19A可以通过调控NOX1的表达在体外促进宫颈鳞状细胞癌癌细胞的迁移和侵袭,并在体内促进癌细胞的转移。在这项研究中,可以确定DDX19A是宫颈鳞状细胞癌转移的新型调节剂,它通过NOX1/ROS途径发挥促转移作用。目前的研究表明,DDX19A通过诱导NOX1介导的ROS产生而促进了宫颈鳞状细胞癌的转移。此外,DDX19A/NOX1可能作为宫颈鳞状细胞癌患者转移的生物标志物和新的治疗靶标。
本发明通过研究机制发现:NOX1/ROS轴在DDX19A的下游发挥转移促进作用,因此本发明还提供NOX1/ROS在包括但不限于开发、筛选宫颈鳞状细胞癌功能产品方面的应用,所述功能产品对NOX1/ROS基因或其表达产物具有抑制作用。
本发明还提供对NOX1/ROS基因或其表达产物具有抑制作用的功能产品在制备预防或/和缓解或/和治疗宫颈鳞状细胞癌的产品方面的应用。
再优选地,所述功能产品包括以下任一种:
(i)包括但不限于以DDX19A/NOX1转录本为靶序列,且能够提供抑制DDX19A/NOX1基因表达产物的表达或基因转录的小干扰RNA、dsRNA、shRNA、微小RNA、反义核酸;
(ii)包括但不限于能表达或形成(i)中所述小干扰RNA、dsRNA、shRNA、微小RNA、反义核酸构建体;
(iii)包括但不限于含有DDX19A/NOX1互补序列,且能够在转入体内后形成抑制DDX19A/NOX1基因表达产物的表达或基因转录的干扰分子的构建体;
(iv)抑制或敲除DDX19A/NOX1基因序列后包括但不限于免疫相关细胞、其分化细胞或构建体。
本发明在上述研究发现的基础上,列举出了上述功能产品,上述功能产品均具有下调/抑制/DDX19A/NOX1基因表达的特性,当然,除了上述功能产品,分子生物学技术领域中一些常规方法也可以实现下调/抑制/DDX19A/NOX1基因表达,例如:基于CRISPR/Cas9技术实现的基因敲低或敲除。
本发明通过研究发现:DDX19A敲低可以减少SiHa细胞中ROS的产生,而过表达在SiHa细胞中产生了相反的作用,因此,可以确定DDX19A是新型的ROS生产调节剂,因此,本发明还提供DDX19A基因或其表达产物作为非治疗目的的ROS生产调节剂的应用。
DDX19A促进了宫颈鳞状细胞癌细胞体外的迁移和侵袭以及体内的肺转移。从机制上讲,过表达DDX19A增加了NOX1的表达,增强了活性氧(ROS)的产生,并诱导了宫颈鳞状细胞癌细胞的迁移和侵袭。挽救实验表明,DDX19A诱导的宫颈鳞状细胞癌功能通过调控NOX1介导的ROS产生,进一步发现,ROS的抑制剂N-乙酰半胱氨酸(NAC)又可抑制DDX19A诱导的宫颈鳞状细胞癌细胞转移。
因此,本发明还提供包括但不限于ROS抑制剂在制备预防或/和缓解或/和治疗宫颈鳞状细胞癌的产品方面的应用,优选地,所述ROS抑制剂为N-乙酰半胱氨酸。
根据TCGA和GEO数据库,与正常宫颈组织相比,宫颈鳞状细胞癌样品中DDX19A高表达,并且高表达的DDX19A与患者的转移和不良的临床预后呈正相关;另外,我们的实验数据也表明了NOX1可以作为宫颈鳞状细胞癌的预后指标。这些结果表明DDX19A和NOX1的联合分析为提高检测宫颈鳞状细胞癌患者临床预后的准确性提供了可能。
因此,本发明还提供一种提高宫颈鳞状细胞癌患者临床诊断或预后准确率的药盒或试剂盒,所述药盒或试剂盒包括:用于检测DDX19A和/或NOX1表达水平的物质。
具体的,上述药盒或者试剂盒包括但不限于以下成分:
(i)用于检测DDX19A表达水平的物质;
(ii)用于检测NOX1表达水平的物质;
(iii)用于检测DDX19A和NOX1表达水平的物质。
当然,一些免疫组化、定量PCR等相关检测手段,如果检测目标是DDX19A和/或NOX1表达水平,则也在本发明的保护范围内。
与现有技术相比,本发明具有以下有益效果:
本发明对公共数据库临床样品的生物信息学分析表明,DDX19A在宫颈鳞状细胞癌组织中的表达升高,并且高表达的DDX19A与转移和临床预后不良呈正相关。在功能上,我们发现DDX19A促进了宫颈鳞状细胞癌细胞体外的迁移和侵袭以及体内的肺转移。从机制上讲,过表达的DDX19A增加了NOX1的表达,增强了活性氧(ROS)的产生,并诱导了宫颈鳞状细胞癌细胞的迁移和侵袭。挽救实验表明,DDX19A诱导的宫颈鳞状细胞癌功能通过调控NOX1介导ROS的产生,进一步发现,ROS抑制剂N-乙酰半胱氨酸又可抑制DDX19A诱导的宫颈鳞状细胞癌细胞转移。我们的结果表明,DDX19A通过诱导NOX1介导ROS的产生促进宫颈鳞状细胞癌转移。阻断NOX1/ROS轴可能是DDX19A的宫颈鳞状细胞癌患者的潜在治疗靶点。
附图说明
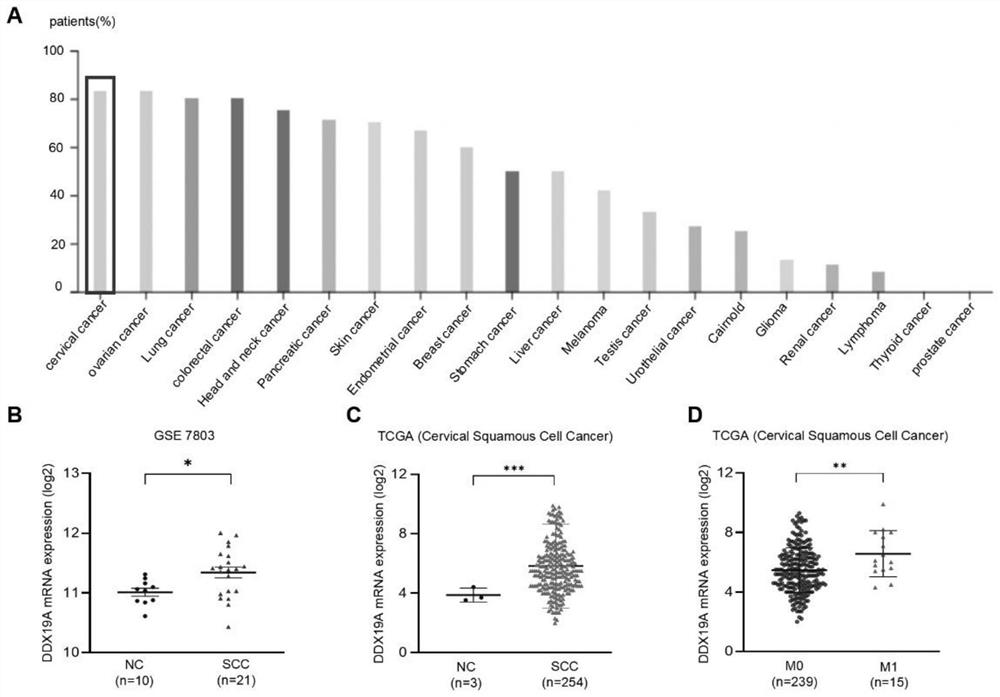
图1显示DDX19A在宫颈鳞状细胞癌组织中表达上调,可预测CSCC患者预后不良;图1A为DDX19A在20种人类癌症组织中的表达情况[人类蛋白质图谱网站(https://www.proteinatlas.org/)];图1B和图1C为DDX19A mRNA分别在GSE7803数据库和TCGA数据库中的表达水平(NC代表正常组织,CSCC代表宫颈鳞状细胞癌组织);图1D为TCGA数据库(CSCC)中远处转移的标本(M1)与非转移标本(M0)间DDX19A mRNA的表达水平;所有的结果取平均值±SD,*p<0.05,**p<0.01,***p<0.001(t检验),NS代表没有显著性;
图2A为DDX19A在人宫颈鳞状细胞癌组织(CSCC tissue)及邻近非癌的正常组织(Adjacent non-tumor tissue)中的代表性免疫组化图像(上排放大倍数200X,下排放大倍数400X);图2B为76对宫颈鳞状细胞癌组织和邻近非癌组织TMA组织切片中DDX19A表达的IHC评分(P<0.001);图2C为CSCC患者淋巴结转移与DDX19A表达的关系(采用卡方检验),其中LN
图3为DDX19A在体外和体内促进CSCC细胞的转移;图3A采用qRT-PCR和westernblot方法评估DDX19A mRNA和蛋白敲低在SiHa细胞中的效果;其中,Si-NC代表对照组,Si-DDX19A-1和Si-DDX19A-2分别代表干扰DDX19A表达序列1和干扰DDX19A表达序列2;图3B是采用qRT-PCR和western blot方法评价DDX19A mRNA和蛋白在SiHa细胞中过表达的效果;其中,Vector代表对照组,DDX19A-OE代表过表达DDX19A对照组;图3C是采用细胞迁移实验和细胞体外侵袭实验研究DDX19A敲低对SiHa细胞迁移、侵袭的影响,其中Fold change代表实验组比对照组细胞的变化倍数;图3D是采用细胞迁移实验和细胞体外侵袭实验研究过表达DDX19A对SiHa细胞迁移和侵袭的影响;
图4A和图4B分别采用DDX19A敲低和过表达DDX19A的稳定SiHa细胞系所建立的肺转移裸鼠模型,并考察模型鼠的肺转移情况,其中,肺组织上的箭头展示了肺转移结节,H&E染色证实肿瘤细胞肺转移的结节染色,(H&E染色中,上排放大倍数200X,下排放大倍数400X),点状图给出了肺转移结节数和肺重量;所有的结果取平均值±SD,*p<0.05,**p<0.01,***p<0.001(t检验),NS代表没有显著性;
图5显示DDX19A调节NOX1的表达,增加CSCC中ROS的产生;图5A采用qRT-PCR和western blot方法评价SiHa细胞中,敲低DDX19A对NOX1的mRNA和蛋白表达的影响;图5B采用qRT-PCR和western blot方法评价SiHa细胞中,过表达DDX19A对NOX1的mRNA和蛋白表达的影响;图5C为采用免疫组化染色研究宫颈鳞状细胞癌组织中DDX19A和NOX1蛋白水平的相关性;图5D为病人DDX19A表达与NOX1表达的相关性研究(采用卡方检验),图5E为采用Spearman rank analysis评估DDX19A蛋白和NOX1蛋白的IHC评分之间的相关性,图5F为采用DCFH-DA荧光实验检测在SiHa细胞中,敲低DDX19A对ROS生成的影响,图5G为采用DCFH-DA荧光实验研究在SiHa细胞中,过表达DDX19A对ROS生成的影响;所有的结果取平均值±SD,*p<0.05,**p<0.01,***p<0.001(t检验),NS代表没有显著性;
图6显示NOX1促进宫颈鳞状细胞癌细胞的转移和ROS产生,并可能作为宫颈鳞状细胞癌患者的预后标志物;图6A是采用qRT-PCR和western blot方法评价SiHa细胞中,NOX1mRNA和蛋白敲低的影响;其中,Si-NC代表敲低NOX1的对照组,Si-NOX1-1和Si-NOX1-2分别代表干扰NOX1表达的序列1和序列2,图6B是采用qRT-PCR和western blot方法评价SiHa细胞中,NOX1 mRNA和蛋白过表达的影响;其中,Vector代表空载质粒对照组,NOX1-OE代表过表达NOX1蛋白的载体;图6C是采用细胞迁移实验和细胞体外侵袭实验研究了NOX1敲低对SiHa迁移侵袭的影响;图6D是采用细胞迁移实验和细胞体外侵袭实验研究了NOX1过表达对SiHa迁移、侵袭的影响;图6E显示NOX1敲低减少了SiHa细胞中ROS的量;图6F显示NOX1过表达增加了SiHa细胞中ROS的量;图6G为NOX1在人宫颈鳞状细胞癌组织(CSCC tissue)及邻近非癌组织(Adjacent non-tumor tissue)中的代表性免疫组化图像(上排放大倍数200X,下排放大倍数400X);图6H(点状图)为76对宫颈鳞状细胞癌组织和邻近非肿瘤组织TMA组织切片中NOX1表达的IHC评分(P<0.001);图6J为CSCC患者淋巴结转移与NOX1表达的关系(采用卡方检验),其中LN
图7显示NOX1/ROS轴在DDX19A下游发挥促转移作用;图7A是采用western blot检测在稳定敲低DDX19A的SiHa细胞中过表达的NOX1的蛋白效果;图7B显示采用细胞迁移实验和细胞侵袭实验研究稳定敲低DDX19A的SiHa细胞中过表达的NOX1所引起的细胞迁移、侵袭的影响;其中,sh-NC代表短发夹RNA干扰对照组,shDDX19A代表发夹RNA干扰DDX19A敲低组,shDDX19A+vector代表发夹RNA干扰DDX19A敲低+过表达NOX1的空载组,shDDX19A+NOX1 OE代表发夹RNA干扰DDX19A敲低+过表达NOX1组;图7C是采用DCFH-DA荧光实验研究在SiHa细胞中,稳定敲低DDX19A的SiHa细胞中过表达的NOX1后ROS的生成;图7D是采用DCFH-DA荧光实验研究在稳定过表达DDX19A的SiHa细胞中,用ROS的抑制剂NAC抑制ROS生成的影响;其中,Vector代表对照组,DDX19A-OE代表过表达DDX19A组,DDX19A-OE+NAC代表过表达DDX19A+ROS抑制剂组,图7E是采用细胞迁移实验和细胞侵袭实验研究稳定过表达DDX19A的SiHa细胞中,用ROS的抑制剂NAC抑制ROS后细胞迁移、侵袭的影响;所有的结果取平均值±SD,*p<0.05,**p<0.01,***p<0.001(t检验),NS代表没有显著性。
具体实施方式
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
下述实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
临床组织标本:利用中山大学附属第五医院于2008年1月至2016年2月获得的临床标本构建了76对宫颈鳞状细胞癌组织,相邻非癌正常组织和10例非配对宫颈鳞状细胞癌组织的组织微阵列(TMA)。宫颈鳞状细胞癌的诊断得到病理学家的确认,该研究得到中山大学附属第五医院机构研究伦理委员会的批准。在手术切除之前,患者未接受任何化学疗法或放射治疗。
细胞培养:人宫颈鳞状细胞癌细胞系,CaSki,C33A,SiHa和MS751购自美国模式培养物研究所(ATCC,美国)。HCC94,CaSki,C33A,SiHa细胞在补充有10%胎牛血清(FBS,LifeTechnologies)的Dulbecco改良的Eagle培养基(DMEM)中生长。MS751细胞在补充有青霉素G(100U/ml),链霉素(100mg/ml)和10%胎牛血清(FBS,Life Technologies)的RPMI-1640培养基(Life Technologies,Carlsbad,CA,美国)中生长。所有细胞系均在37℃,5%CO
统计分析:结果表示为平均值±SEM。所有统计分析均使用GraphPad Prism 5软件。来自3个独立实验的数据表示为平均值±SD。p<0.05的值被认为是显著的,p<0.05,p<0.01和p<0.001分别被指定为*,**和***。
实施例1 DDX19A与宫颈鳞状细胞癌的相关性
1、生物信息学和数据分析
根据癌症基因组图谱(TCGA;https://gdc.cancer.gov/)和基因表达库(GEO)数据集(GSE7803)检查了正常宫颈组织和宫颈鳞状细胞癌(宫颈鳞状细胞癌)组织中DDX19AmRNA的表达(参阅https://www.ncbi.nlm.nih.gov/geo)。基因表达表示为log2转化后每个基因的多个探针的平均值。通过Mann-Whitney U检验分析比较(正常宫颈组织与宫颈鳞状细胞癌组织),p<0.05被认为具有统计学意义。
2、免疫组织化学染色
宫颈鳞状细胞癌和邻近的正常组织(76对)和10个未配对的宫颈鳞状细胞癌组织用于制备TMA。DDX19A抗体或NOX1抗体分别检测DDX19A和NOX1蛋白的表达。最后评估了阳性肿瘤细胞的百分比和染色强度。DDX19A和NOX1染色强度的值分配如下:0(阴性),1(弱阳),2(中阳)和3(强阳)。阳性肿瘤细胞百分比的值得分如下:(1)0~5%,(2)26~50%,(3)51~75%和(4)76~100%。通过染色强度和肿瘤细胞百分比的乘积来计算每个切片的免疫反应评分(IRS)。
3、实时定量PCR(qRT-PCR)
使用Trizol,然后用DNase处理分离总RNA。使用SYBR Green预混液在Bio-RadiCycler上进行qRT-PCR。用于qRT-PCR的引物如下:
DDX19A正向引物:5'-CATGGGCTTCAATCGACCCT-3',
DDX19A反向引物:5'-GCACAGACACTGGGGGTATC-3';
NOX1正向引物:5'-GTTTTACCGCTCCCAGCAGAA-3',
NOX1反向引物:5'-GGATGCCATTCCAGGAGAGAG-3';
GAPDH正向引物:5'-AGGGCTGCTTTTAACTCTGGT-3',
GAPDH反向引物:5'-CCCCACTTGATTTTGGAGGGA-3'。
4、结果
查阅人类蛋白质图谱网站(https://www.proteinatlas.org/)的IHC染色数据表明,在所有常见癌症类型中,DDX19A蛋白的表达在宫颈癌中最高(图1A),表明DDX19A在这种妇科恶性肿瘤中起到关键作用。此外,微阵列分析[基因表达库(GEO)数据集,GSE7803和癌症基因组图谱(TCGA)(宫颈鳞状细胞癌数据)]显示,与正常宫颈相比,DDX19A mRNA在宫颈鳞状细胞癌组织中表达上调(图1B和图1C)。TCGA数据库的深入分析表明,与无转移的标本(M0)相比,具有远处转移(M1)的宫颈鳞状细胞癌中DDX19A的表达更高(图1D)。
为了验证这些发现,通过TMA检查了宫颈鳞状细胞癌和邻近非癌组织(76对)和10个未配对的宫颈鳞状细胞癌组织中DDX19A的蛋白表达。我们的结果表明宫颈鳞状细胞癌组织的DDX19A染色强度明显高于邻近的非癌组织(图2A和2B)。
为进一步评估DDX19A表达的临床意义,我们将86例宫颈鳞状细胞癌患者分为低表达(n=31)组和高表达(n=55)组,其临界值定义为IHC免疫反应评分的中位数(IRS=6)。结果如表1,有趣的是,高表达的DDX19A与淋巴结转移和肿瘤大小有关(图2C)。此外,Kaplan-Meier存活率表明,相对于低DDX19A表达水平的患者,高DDX19A表达水平的患者预后不良(图2D)。总之,这些数据表明DDX19A可能在宫颈鳞状细胞癌中起促癌的作用。
表1 DDX19A表达与宫颈鳞癌患者临床参数的相关性分析
实施例2 DDX19A在体内和体外促进宫颈鳞状细胞癌细胞的转移
使用生物信息学分析和临床标本中的验证性实验,我们发现DDX19A的表达与肿瘤转移呈正相关。此外,转移的发生是宫颈鳞状细胞癌患者预后不良的重要原因。为了验证DDX19A在宫颈鳞状细胞癌转移中的功能,我们在体外和体内进行了功能研究。
1、利用蛋白质分离和蛋白质印迹分析的方法从细胞水平中DDX19A和NOX1蛋白表达。
2、利用DDX19A特异性短发夹RNA(shRNA,5'-GTACTCGGTGAAGTCGTTT-3'和5'-CTGTCAAGTCGATGACCAA-3')、DDX19A特异性siRNA(5'-CTGTCAAGTCGATGACCAA-3'和5'-GGCAGTATATCTTTGTTAA-3')、NOX1特异性siRNA(5'-GATCGTGACTCCCACTGTA-3'和5'-CCCTTTGCTTCTATCTTGA-3')对宫颈鳞状细胞癌细胞进DDX19A和NOX1的RNA进行干扰。
3、利用细胞迁移和侵袭实验方法对宫颈癌细胞的迁移和侵袭能力进行检测。
4、以BALB/c裸鼠为实验模型,利用尾静脉注射的方法检测干扰DDX19A表达后宫颈癌细胞经血液途径转移到肺的能力。
5、结果
在细胞系SiHa(图3A)中敲低了DDX19A,并在SiHa(图3B)中过表达了DDX19A。侵袭实验表明,敲低DDX19A抑制了宫颈鳞状细胞癌细胞的迁移和侵袭(图3C),而DDX19A的上调显著增强了这些功能(图3D)。
进一步研究了DDX19A是否可以影响体内肿瘤转移。建立并验证了具有DDX19A敲低或过表达的稳定SiHa细胞系(图4A和图4B)。通过将上述细胞系尾部静脉内注射到裸鼠中来建立肺转移裸鼠模型。如图4A所示,与对照组相比,通过结节数和肿瘤重量测定,DDX19A敲低细胞在裸鼠中表现出较少的肺转移。相反,DDX19A的过表达显著促进了肺转移(图4B)。
总的来说,这些结果表明过表达的DDX19A可以在体外促进宫颈鳞状细胞癌细胞的迁移和侵袭,并且可以在体内促进宫颈鳞状细胞癌细胞的转移。
实施例3 DDX19A促进宫颈鳞状细胞癌细胞转移的机制
(1)DDX19A调节宫颈鳞状细胞癌中NOX1的表达并增加ROS的产生。
实验方法:利用活性氧(ROS)试剂盒对细胞ROS的检测
我们检测了NOX1在DDX19A敲低的细胞中的表达。由于在SiHa中DDX19A的表达受到抑制,NOX1 mRNA和蛋白均降低(图5A),反之,NOX1 mRNA和蛋白在DDX19A过表达的细胞中升高(图5B)。接下来,我们检查了NOX1在宫颈鳞状细胞癌组织中的表达。如图5C和5D所示,与敲低DDX19A表达的那些相比,具有较高DDX19A表达的宫颈鳞状细胞癌组织显示出NOX1蛋白的染色强度显著增加。相关分析表明,DDX19A的IHC得分与NOX1的IHC得分呈正相关(图5E)。在SiHa中敲低DDX19A导致的ROS产生减少(图5F),而在SiHa中过表达DDX19A能够导致ROS增加(图5G)。总的来说,这些结果证实了DDX19A调控宫颈鳞状细胞癌中的NOX1表达并增强ROS的产生。
(2)NOX1促进宫颈鳞状细胞癌细胞的转移和ROS的产生,并可作为宫颈鳞状细胞癌患者的预后指标。
实验方法:利用siRNA计数对NOX1进行干扰,检测宫颈癌细胞的侵袭和迁移的能力。
我们进一步探讨了NOX1对宫颈鳞状细胞癌功能的影响。通过用NOX1 siRNA转染了SiHa(图6A)。NOX1表达的抑制阻止了SiHa细胞的迁移和侵袭(图6C),而增强的NOX1表达(图6B)则促进了细胞迁移和侵袭(图6D)。ROS的产生趋势与NOX1相同(图6E和6F)。综上所述,这些数据表明NOX1可以促进细胞迁移和侵袭并增强宫颈鳞状细胞癌细胞中的ROS产生。
为了探讨NOX1的临床意义,我们在宫颈鳞状细胞癌TMA中对NOX1进行了IHC染色(图6G),并表明了与相邻的非肿瘤组织相比,宫颈鳞状细胞癌组织中NOX1的表达水平显著升高(图6H)。此外,NOX1的表达与肿瘤的大小和淋巴结转移有关(图6J;表2)。NOX1的高表达显著降低了总生存期(图6K)。总体而言,这些数据表明NOX1可以作为宫颈鳞状细胞癌的预后指标。
表2 NOX1表达与宫颈鳞状细胞癌患者临床参数的相关性分析
(3)NOX1/ROS轴在DDX19A下游发挥促转移作用
为了进一步研究NOX1/ROS信号是否在DDX19A下游调控宫颈鳞状细胞癌转移中起作用,我们进行了针对性的挽救实验。蛋白质印迹分析用于评估在DDX19A基因敲低的SiHa细胞中过表达NOX1的效果(图7A)。过表达NOX1逆转了由DDX19A敲低诱导的细胞迁移和侵袭的减少(图7B)以及ROS的量的减少(图7C)。此外,我们用ROS抑制剂N-乙酰半胱氨酸(NAC)处理了SiHa细胞,这有效地减弱了DDX19A过表达诱导的ROS产生(图7D)。因此,NAC处理可抑制和SiHa细胞中DDX19A过表达诱导的迁移和侵袭(图7E)。这些数据表明,NOX1/ROS轴在DDX19A的下游发挥转移促进作用。
序列表
<110> 中山大学附属第五医院
<120> 基于DDX19A促进宫颈鳞状细胞癌转移的应用
<130> ZM211006ZL
<160> 12
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> Mouse
<400> 1
catgggcttc aatcgaccct 20
<210> 2
<211> 20
<212> DNA
<213> Mouse
<400> 2
gcacagacac tgggggtatc 20
<210> 3
<211> 21
<212> DNA
<213> Mouse
<400> 3
gttttaccgc tcccagcaga a 21
<210> 4
<211> 21
<212> DNA
<213> Mouse
<400> 4
ggatgccatt ccaggagaga g 21
<210> 5
<211> 21
<212> DNA
<213> Mouse
<400> 5
agggctgctt ttaactctgg t 21
<210> 6
<211> 21
<212> DNA
<213> Mouse
<400> 6
ccccacttga ttttggaggg a 21
<210> 7
<211> 19
<212> DNA
<213> Mouse
<400> 7
gtactcggtg aagtcgttt 19
<210> 8
<211> 19
<212> DNA
<213> Mouse
<400> 8
ctgtcaagtc gatgaccaa 19
<210> 9
<211> 19
<212> DNA
<213> Mouse
<400> 9
ctgtcaagtc gatgaccaa 19
<210> 10
<211> 19
<212> DNA
<213> Mouse
<400> 10
ggcagtatat ctttgttaa 19
<210> 11
<211> 19
<212> DNA
<213> Mouse
<400> 11
gatcgtgact cccactgta 19
<210> 12
<211> 19
<212> DNA
<213> Mouse
<400> 12
ccctttgctt ctatcttga 19
- 基于DDX19A促进宫颈鳞状细胞癌转移的应用
- 基于DDX19A促进宫颈鳞状细胞癌转移的应用
