报告磁珠组合物及其制备方法和应用、检测试剂盒以及检测方法
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及生物检测技术领域,尤其是涉及一种报告磁珠组合物及其制备方法和应用、检测试剂盒以及检测方法。
背景技术
CRISPR技术,即CRISPR核酸检测技术,其可以用于植物、动物、微生物、病毒等来源的DNA或RNA分子的检测。CRISPR/Cas体系对核酸具有高选择性和特异性,可以检测到仅一个碱基的突变。CRISPR/Cas系统由可轻松编程的引导RNA(crRNA)和Cas蛋白组成,可以根据crRNA与目标序列特异性互补来顺式切割靶标DNA或RNA。除了特异性结合和顺式切割靶标分子外,一些Cas蛋白(包括Cas12和Cas13等)的反式切割活性也被发现。即在Cas-crRNA复合物与靶标结合后激活反式切割活性,对附近非靶标的单链DNA或RNA进行无差异的切割。这种机制可以被用于裂解外源性引入的、自猝灭的荧光DNA或RNA报告体,并且具有极高周转率,从而实现信号放大。该现象被发现之后,基于CRISPR/Cas的新型诊断技术被广泛开发并用于核酸检测。
目前,基于CRISPR技术的核酸检测方法,通常在电极上结合带有高催化活性酶的核酸,Cas-crRNA复合物与待测靶标结合后置于电极表面,Cas-crRNA复合物激活反式切割活性后对单链核酸进行切割,一定时间后清洗并加入催化底物,一定时间后检测电极上的电信号,实现对待测靶标的检测。
然而,上述检测方法受限于电极的平面特性,连接在电极上的单链核酸彼此之间容易因为位置阻碍,导致切割位点被阻挡,特别是当电极上连接的单链核酸较长时,上述情况更容易发生。
发明内容
基于此,有必要提供一种可以解决上述问题的基于CRISPR技术的报告磁珠组合物。
此外,还有必要提供一种上述报告磁珠组合物的制备方法、上述报告磁珠组合物在核酸检测领域的应用、包括该报告磁珠组合物的检测试剂盒以及一种采用上述报告磁珠组合物的检测方法。
一种报告磁珠组合物,基于CRISPR技术,包括报告磁珠和酶,所述报告磁珠包括依次连接的磁珠和单链核酸,所述单链核酸远离所述磁珠的一端连接有第一配体,所述酶上连接有第二配体,所述第一配体和所述第二配体可以结合在一起。
在一个实施例中,所述单链核酸远离所述磁珠的一端为5’端,所述第一配体为生物素,所述第二配体为亲和素或链霉亲和素。
在一个实施例中,所述单链核酸的5’端连接有-三甘醇-生物素。
在一个实施例中,所述磁珠上连接有-COOH,所述单链核酸的3’端连接有-(CH
所述报告磁珠的结构为:磁珠-COO-NH-(CH
在一个实施例中,所述单链核酸的序列如SEQ ID NO.1所示或如SEQ IDNO.2所示。
一种上述的报告磁珠组合物的制备方法,包括如下步骤:
提供磁珠、单链核酸和酶,所述磁珠的表面连接有-COOH,所述单链核酸的3’端连接有-(CH
将所述磁珠分散到活化缓冲液中,并依次加入EDC溶液和NHS溶液,混匀后充分反应,接着进行第一次磁分离并保留第一沉淀,所述第一沉淀即为活化后的所述磁珠;
用偶联缓冲液对活化后的所述磁珠进行清洗和重悬,接着加入所述单链核酸,混匀后充分反应,接着进行第二次磁分离并保留第二沉淀,
所述第二沉淀即为报告磁珠,所述报告磁珠的结构为:磁珠-COO-NH-(CH
一种上述的报告磁珠组合物或上述的制备方法制得的报告磁珠组合物,在核酸检测领域的应用。
一种检测试剂盒,包括上述的报告磁珠组合物或如权利要求6所述的制备方法制得的报告磁珠组合物。
一种检测方法,包括如下步骤:
提供上述的报告磁珠组合物或上述的制备方法制得的报告磁珠组合物,所述报告磁珠组合物包括报告磁珠和酶,所述报告磁珠包括依次连接的磁珠和单链核酸,所述单链核酸远离所述磁珠的一端连接有第一配体,所述酶上连接有第二配体,所述第一配体和所述第二配体可以结合在一起;
将待测靶标、Cas试剂和所述报告磁珠在电极表面混匀,经过第一时间后,
加入所述酶,经过第二时间后,磁分离并保留沉淀;
用清洗缓冲液对所述沉淀进行清洗,磁分离去除上清并加入催化底物,经过第三时间反应后进行电化学信号检测。
一种检测方法,包括如下步骤:
提供上述的报告磁珠组合物或如权利要求6所述的制备方法制得的报告磁珠组合物,所述报告磁珠组合物包括报告磁珠和酶,所述报告磁珠包括依次连接的磁珠和单链核酸,所述单链核酸远离所述磁珠的一端连接有第一配体,所述酶上连接有第二配体,所述第一配体和所述第二配体可以结合在一起;
将待测靶标、Cas试剂以及所述报告磁珠在液相体系中混匀,经过第一时间后,
加入所述酶,经过第二时间后,磁分离并保留沉淀;
用清洗缓冲液对所述沉淀进行清洗,磁分离去除上清并加入催化底物,去除磁场并混匀,经过第三时间后,终止反应,得到反应混合物;
对所述反应混合物的进行光学信号检测。
本发明的报告磁珠组合物基于CRISPR技术,包括报告磁珠和酶,所述报告磁珠包括依次连接的磁珠和单链核酸,磁珠具有高比表面积、单分散性可控粒径等特点,磁珠上连接的单链核酸具有更大的空间伸展,不容易因为位置阻碍,导致切割位点被阻挡。相比于传统的电极的方案,磁珠表面可修饰更长的单链核酸来暴露更多切割位点。
此外,传统的方案中,电极上连接的长序列单链核酸时,还会有电子传输距离变长,电信号偏低的问题,而本发明中,在磁珠上连接长序列单链核酸,可以通过磁吸将磁珠聚集在电极表面,保证较短的电信号传递距离,从而可以在连接长序列单链核酸时,有效的提高了电信号的强度。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
其中:
图1为一实施方式的报告磁珠组合物的结构图。
图2为如图1所示报告磁珠组合物应用于CRISPR技术的检测原理对比图。
图3为实施例1制备的报告磁珠组合物应用到CRISPR/Cas体系中的ELISA检测结果图。
图4为实施例2制备的报告磁珠组合物应用到CRISPR/Cas体系中的ELISA检测结果图。
图5为实施例1制备的报告磁珠组合物应用到CRISPR/Cas体系中的电化学检测结果图。
图6为实施例2制备的报告磁珠组合物应用到CRISPR/Cas体系中的电化学检测结果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
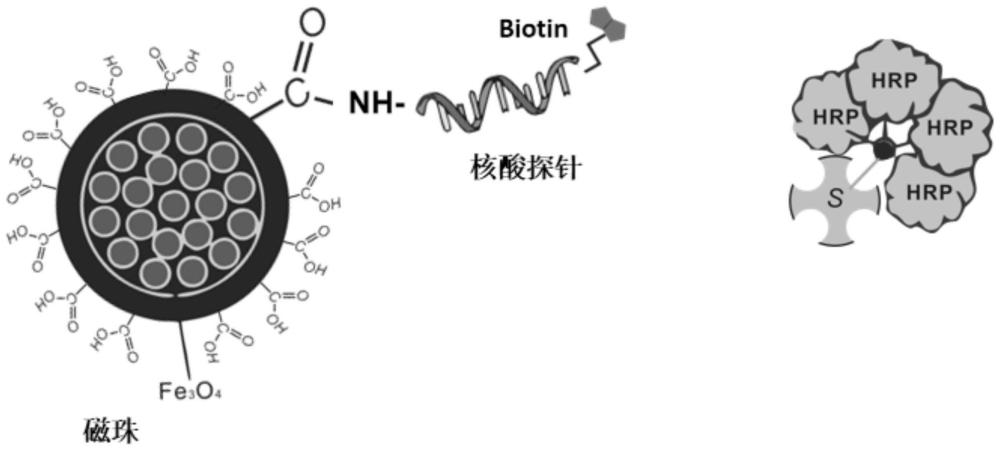
结合图1,本发明公开了一实施方式的报告磁珠组合物,基于CRISPR技术,包括报告磁珠和酶,报告磁珠包括依次连接的磁珠(Microspheres,MP)和单链核酸,单链核酸远离磁珠的一端连接有第一配体,酶上连接有第二配体,第一配体和第二配体可以偶联在一起。
本发明的报告磁珠组合物基于CRISPR技术,包括报告磁珠和酶,所述报告磁珠包括依次连接的磁珠和单链核酸,磁珠具有高比表面积、单分散性可控粒径等特点,磁珠上连接的单链核酸具有更大的空间伸展,不容易因为位置阻碍,导致切割位点被阻挡。相比于传统的电极的方案,磁珠表面可修饰更长的单链核酸来暴露更多切割位点。
此外,传统的方案中,电极上连接的长序列单链核酸时,还会有电子传输距离变长,电信号偏低的问题,而本发明中,在磁珠上连接长序列单链核酸,可以通过磁吸将磁珠聚集在电极表面,保证较短的电信号传递距离,从而可以在连接长序列单链核酸时,有效的提高了电信号的强度。
此外,磁珠具有高比表面积、单分散性可控粒径等特点。相比于传统的电极的方案,磁珠表面可修饰更长的单链核酸来暴露更多切割位点。
结合图1,优选的,本实施方式中,单链核酸远离磁珠的一端为5’端,第一配体为生物素(Biotin),第二配体为链霉亲和素(Streptavidin)。
一般来说,第二配体还可以为亲和素。
生物素-亲和素以及生物素-链霉亲和素体系,可以轻易的实现报告磁珠和酶的结合。
在其他的实施方式中,第一配体和第二配体也可以选择其他物质。
结合图1,具体来说,本实施方式中,单链核酸的5’端连接有-三甘醇-生物素(-teg-Biotin)。
Biotin上连接teg后可以延长Biotin和单链核酸之间的距离,减少生物素与链霉亲和素结合时的位阻。
结合图1,具体来说,本实施方式中,磁珠上连接有-COOH,单链核酸的3’端连接有-(CH
报告磁珠的结构为:磁珠-COO-NH-(CH
-(CH
具体来说,n可以为7。
磁珠和单链核酸之间通过-COO-NH-连接,通过化学键实现磁珠和单链核酸的结合。与物理吸附不同的是,化学键结合相对牢固,不易受到温度、湿度的影响,报告磁珠组合物的稳定性要相对较优。
具体来说,本实施方式中,磁珠为二氧化硅磁珠或聚苯乙烯磁珠,磁珠的粒径为1μm~5μm,酶为辣根过氧化酶(HRP)或聚合辣根过氧化物酶(Poly-HRP)。
本实施方式中,单链核酸可以为单链DNA或RNA。
由于Cas12a蛋白对富含C的DNA序列具有更好的切割活性,因此,SEQ IDNO.1所示的单链DNA富含C。
具体来说,单链DNA的序列如SEQ ID NO.1所示。
由于Cas13a蛋白对富含C的RNA序列具有较好的切割活性,因此,SEQ IDNO.2所示的RNA富含C。
具体来说,RNA序列如SEQ ID NO.2所示。
本发明还公开了一实施方式的报告磁珠组合物的制备方法,包括如下步骤:
S110、提供磁珠、单链核酸和酶。
其中,磁珠的表面连接有-COOH,单链核酸的3’端连接有-(CH
优选的,n可以为7。
S120、将磁珠分散到活化缓冲液中,并依次加入EDC溶液和NHS溶液,混匀后充分反应,接着进行第一次磁分离并保留第一沉淀,第一沉淀即为活化后的磁珠。
磁珠表面的羧基基团,会与EDC(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐)生成不稳定的氨基活性O-酰基脲中间体,该中间体接着与NHS(N羟基琥珀酰亚胺)反应生成半稳定的氨基反应活性NHS酯。
优选的,EDC溶液的溶质可以为NHS或其可溶性化合物。具体来说,EDC溶液的溶质可以为Sulfo-NHS。
优选的,NHS溶液溶液的溶质可以为NHS或其可溶性化合物。具体来说,NHS溶液的溶质可以为EDC·HCl。
S130、用偶联缓冲液对活化后的磁珠进行清洗和重悬,接着加入单链核酸,混匀后充分反应,接着进行第二次磁分离并保留第二沉淀,第二沉淀即为报告磁珠,报告磁珠和酶组成所需要的报告磁珠组合物。
S120得到的活化后的磁珠半稳定的氨基反应活性NHS酯,进一步与单链核酸上的氨基反应生成稳定的酰胺键。磁珠和单链核酸通过-COO-NH-(CH
报告磁珠的结构为:磁珠-COO-NH-(CH
优选的,得到的报告磁珠还需要用封闭缓冲液进行封闭,以便于保存。
上述的报告磁珠组合物或上述的制备方法制得的报告磁珠组合物,可以应用于核酸检测领域。
具体来说,可以作为核酸检测试剂应用到核酸检测仪器和/或核酸检测试剂盒中。
本发明还公开了一实施方式的检测试剂盒,包括上述的报告磁珠组合物或上述的制备方法制得的报告磁珠组合物。
结合图2,上述的报告磁珠组合物或上述的制备方法制得的报告磁珠组合物,可以应用于基于CRISPR技术的电化学检测体系。
基于CRISPR技术的电化学检测体系可以通过电化学伏安法先进行氧化态TMB(oxTMB)在电极上的还原反应。经HRP催化的oxTMB在电极表面的反应则可由多种电化学分析方法进行检测与对比,如循环伏安法、方波伏安法、微分脉冲伏安法以及电化学阻抗等。
具体来说,以报告磁珠(MP-COO-NH-(CH
结合图2,当Cas12a蛋白未识别靶标核酸时,反式切割活性未被激活,ssDNA未被切割,报告磁珠和酶结合,报告磁珠上的HRP催化引入的TMB底物溶液,被氧化的TMB(oxTMB)在电极表面经施加电压重新被还原,形成较强的电化学信号。结合图2,当Cas12a蛋白识别靶标核酸后,激活反式切割活性并切断ssDNA,报告磁珠和酶(链霉亲和素-HRP)无法结合,酶在经过清洗步骤后离开反应体系,产生较弱的电化学信号。
具体来说,本发明还公开了一实施方式的基于CRISPR技术的电化学检测体系的检测方法,包括如下步骤:
提供报告磁珠组合物,报告磁珠组合物包括报告磁珠和酶,报告磁珠包括依次连接的磁珠和单链核酸,单链核酸远离磁珠的一端连接有第一配体,酶上连接有第二配体,第一配体和第二配体可以偶联在一起。
将待测靶标、Cas试剂和报告磁珠在电极表面中混匀,经过第一时间后,
加入所述酶,经过第二时间后,磁分离并保留沉淀;
用清洗缓冲液对所述沉淀进行清洗,磁分离去除上清并加入催化底物,经过第三时间反应后进行电化学信号检测。
Cas试剂包括Cas蛋白以及包含激活Cas蛋白的靶标核酸的样本。
需要说明的是,为了避免过量反应,上述的第一时间需要根据实际情况设置。
具体来说,需要确保激活后的Cas蛋白切断了部分的单链核酸,但是不能全部切完。
类似的,为了避免超出电化学信号检测的检测阈值,第三时间也需要根据实际情况设置。
报告磁珠组合物应用于电化学检测体系时,酶后期加入可以更加灵活,任何链霉亲和素(Streptavidin,SA)修饰的酶都可以使用。
此外,上述的报告磁珠组合物或上述的制备方法制得的报告磁珠组合物,还可以应用于基于CRISPR技术的ELISA检测体系。
通过TMB(3,3',5,5'-四甲基联苯胺)显色反应(HRP催化TMB生成可溶的蓝色产物,主要吸收峰在370nm和620nm。当显色反应被酸性溶液(如0.5-2MH
具体来说,本发明还公开了另一实施方式的基于CRISPR技术的ELISA检测体系的一种检测方法,包括如下步骤:
提供上述的报告磁珠组合物或上述的制备方法制得的报告磁珠组合物,报告磁珠组合物包括报告磁珠和酶,报告磁珠包括依次连接的磁珠和单链核酸,单链核酸远离磁珠的一端连接有第一配体,酶上连接有第二配体,第一配体和第二配体可以结合在一起。
将待测靶标、Cas试剂以及报告磁珠在液相体系中混匀,经过第一时间后,
加入酶,经过第二时间后,磁分离并保留沉淀;
用清洗缓冲液对沉淀进行清洗,磁分离去除上清并加入催化底物,去除磁场并混匀,经过第三时间后,终止反应,得到反应混合物;
对所述反应混合物的进行光学信号检测。
Cas试剂包括Cas蛋白以及包含激活Cas蛋白的靶标核酸的样本。
需要说明的是,为了避免过量反应,上述的第一时间需要根据实际情况设置。
具体来说,需要确保激活后的Cas蛋白切断了部分的单链核酸,但是不能全部切完。
类似的,为了避免超出ELISA检测的检测阈值,第三时间也需要根据实际情况设置。
报告磁珠组合物应用于ELISA检测体系时,酶后期加入可以更加灵活,任何链霉亲和素(Streptavidin,SA)修饰的酶都可以使用。
以下为具体实施例。
实验材料如下:
磁珠:磁珠-COOH(苏州海狸生物);
丝网印刷碳电极片:青岛波碳科技有限公司
ssDNA或者RNA:Biotin-TEG-5’-nt-3’-NH
Streptavidin-HRP(西安瑞禧生物);
Sulfo-NHS(CAS:106627-54-7):sigma;
EDC·HCl(CAS:25952-53-8):sigma;
活化缓冲液:50mM MES pH5.0-6.0;
偶联缓冲液:1×PBS pH 7.2;
封闭缓冲液:50mM Tris pH8.0+2%BSA;
保存缓冲液:50mM Tris pH8.0+0.05% Tween-20;
清洗缓冲液:50mM Tris+0.05%Tween-20pH 8.0-8.5;
TMB单组分催化底物:索莱宝
TMB终止液:索莱宝
10×HOLMES Buffer:20mM Spermidine,400mM Tris-HCl,60mM MgCl
Cas12a和Cas13a:吐露港生物
crRNA(Cas12a):生工生物,crRNA序列如SEQ ID NO.3所示,靶标核酸序列(双链DNA)如SEQ ID NO.4所示。
crRNA(Cas13a):生工生物,crRNA序列SEQ ID NO.5所示,靶标核酸序列(RNA)如SEQ ID NO.6所示。
需要说明的是,本发明中未注明双链的所有DNA,均为单链DNA,注明双链的DNA,仅给出其一条链的序列。
实验设备如下:
1、恒温振荡器
https://www.tansoole.com/upload/detail/05/83Z3_IVE5_05027159.html
2、旋转孵育仪
https://www.tansoole.com/upload/detail/05/POLC_3YAD_05039190.html
3、磁力架,磁力板
4、天平:赛多利斯
5、电化学工作站:Palm Sens4
实施例1:DNA
1.取10μL的磁珠磁分离,活化缓冲液500μL清洗2次,磁分离,弃上清后重悬至180μL活化缓冲液中;
2.用活化缓冲液配制100mM的NHS和40mM的EDC,按NHS/EDC先后顺序分别取10μL加入到上述磁珠中,迅速混匀,室温孵育30min,磁分离,弃上清;
3.加400μL偶联缓冲液,清洗两次,重悬至400μL偶联缓冲液中,涡旋混匀;
4.分别取10μL 100μM ssDNA(序列SEQ ID NO.1所示)加入磁珠管中,迅速混匀,室温孵育1.5h;
5.加入400μL封闭液缓冲液封闭2h;
6.磁分离,弃上清,得到报告磁珠,500μL保存缓冲液清洗3次;
7.报告磁珠重悬至200μL保存缓冲液中,报告磁珠(MP-COO-NH-(CH
实施例2:RNA
1.取10μL的磁珠磁分离,活化缓冲液500μL清洗2次,磁分离,弃上清后重悬至180μL活化缓冲液中;
2.用活化缓冲液配制100mM的NHS和40mM的EDC,按NHS/EDC先后顺序分别取10μL加入到上述磁珠中,迅速混匀,室温孵育30min,磁分离,弃上清;
3.加400μL偶联缓冲液,清洗两次,重悬至400μL偶联缓冲液中,涡旋混匀;
4.分别取10μL 100μM RNA(序列SEQ ID NO.2所示)加入磁珠管中,迅速混匀,室温孵育1.5h;
5.加入400μL封闭液缓冲液封闭2h;
6.磁分离,弃上清,得到报告磁珠,500μL保存缓冲液清洗3次;
7.报告磁珠重悬至200μL保存缓冲液中,报告磁珠(MP-COO-NH-(CH
测试例1
ELISA-Cas12a
1、按照比例进行反应液配制,恒温37℃,振荡器调节为800rpm,振荡反应15min;其中,总反应体积40μL,实施例1制备的报告磁珠5μL,10×buffer4μL,crRNA终浓度100nM,Cas12a终浓度100nM,靶标核酸样本倍比稀释,每个反应的终浓度为10nM,1nM,100pM,10pM,1pM,0,其余体积用水补齐;
2、分别加入终浓度2μg/ml SA-HRP恒温37℃,振荡器调节为800rpm,振荡反应10min;
3、磁分离去上清后,160μL清洗缓冲液清洗3次后,加入100μL TMB,去除磁场,振荡催化显色2min;
4、加入100μL终止液,酶标仪450nm读取数据,得到图3。
由图3可以看出,实施例1制备的报告磁珠组合物应用到CRISPR/Cas体系中,在进行ELISA检测时,具有良好的检测灵敏度。
ELISA-Cas13a
1、按照比例进行反应液配制,恒温37℃,振荡器调节为800rpm,振荡反应15min;其中,总反应体积40μL,实施例2制备的报告磁珠5μL,10×buffer4μL,crRNA终浓度100nM,Cas13a终浓度100nM,靶标核酸样本倍比稀释,每个反应的终浓度为10nM,1nM,100pM,10pM,1pM,0,其余体积用水补齐;
2、分别加入终浓度2μg/ml SA-HRP恒温37℃,振荡器调节为800rpm,振荡反应10min;
3、磁分离去上清后,160μL清洗缓冲液清洗3次后,加入100μL TMB,去除磁场,振荡催化显色2min;
4、加入100μL终止液,酶标仪450nm读取数据,得到图4。
由图4可以看出,实施例2制备的报告磁珠组合物应用到CRISPR/Cas体系中,在进行ELISA检测时,具有良好的检测灵敏度。
测试例2
电化学-Cas12a
1、按照比例进行反应液配制,恒温37℃,振荡器调节为800rpm,振荡反应15min;其中,总反应体积40μL,实施例1制备的报告磁珠5μL,10×buffer4μL,crRNA终浓度100nM,Cas12a终浓度100nM,靶标核酸样本倍比稀释,每个反应的终浓度为10nM,1nM,100pM,10pM,1pM,0,其余体积用水补齐;
2、分别加入终浓度2μg/ml SA-HRP恒温37℃,振荡器调节为800rpm,振荡反应10min;
3、160μL清洗缓冲液清洗3次后,磁分离去上清,继续保留磁场;
4、加入100μL TMB,反应60s后,电化学工作站读取数据,得到图5。
由图5可以看出,实施例1制备的报告磁珠组合物应用到CRISPR/Cas体系中,在进行电化学检测时,具有良好的检测灵敏度。
电化学-Cas13a
1、按照比例进行反应液配制,恒温37℃,振荡器调节为800rpm,振荡反应15min;其中,总反应体积40μL,实施例2制备的报告磁珠5μL,10×buffer4μL,crRNA终浓度100nM,Cas13a终浓度100nM,靶标核酸样本倍比稀释,每个反应的终浓度为10nM,1nM,100pM,10pM,1pM,0,其余体积用水补齐;
2、分别加入终浓度2μg/ml SA-HRP恒温37℃,振荡器调节为800rpm,振荡反应10min;
3、160μL清洗缓冲液清洗3次后,磁分离去上清,继续保留磁场;
4、加入100μL TMB,反应60s后,电化学工作站读取数据,得到图6。
由图6可以看出,实施例2制备的报告磁珠组合物应用到CRISPR/Cas体系中,在进行电化学检测时,具有良好的检测灵敏度。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对申请专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种胰岛素纳米磁微粒化学发光测定试剂盒及其制备方法与检测方法
- 检测腹泻病毒的核酸组合物、试剂盒及试剂盒的使用方法
- 同时检测四种肠道病毒的核酸组合物及试剂盒和检测方法
- 应用AlphaLISA检测登革病毒的方法及对应的组合物、试剂盒
- 一种检测人CYP3A4基因多态性的组合物、试剂盒、样品处理方法和应用
- 报告核酸组合物及其制备方法和应用、检测试剂盒以及检测方法
- 磁珠包被物及其制备方法和应用、检测试剂盒
