三角帆蚌外套膜细胞的培养方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于细胞培养技术领域,具体涉及一种三角帆蚌外套膜细胞的培养方法。
背景技术
细胞培养技术广泛应用于染色体分析、细胞代谢、癌变机制、病毒的分离和鉴定以及药物筛选等研究领域(薛庆善.体外培养的原理与技术[M].科学出版社,2000,pp:16-23)。如果能够建立贝类的细胞系,必将为深入研究贝类病害机理,实现人工育珠的人工控制等方面提供极大便利。但到目前为止,在水生的无脊椎动物的细胞培养中,也仅建立了一种淡水蜗牛担轮幼虫胚胎(Biomphalaria glabrata embryonic,BGE)细胞系。而在贝类的细胞培养中还尚未建立起成功的细胞系。这仍然是当前国际上的攻关课题。
贝类的外套膜组织不仅作为贝类的保护性器官,而且具有分泌有机基质、形成碳酸钙结晶的功能,是形成贝壳和珍珠最重要的组织(李云娟,盛军庆,王军花等.池蝶蚌外套膜的组织学观察[J].南昌大学学报(理科版),2009,33(03):279-284.),因此外套膜细胞的培养对水生贝类具有重要意义。但贝类外套膜组织属于高度分化的器官,在体外游离培养过程中分裂增殖能力较弱,会出现细胞不贴壁不增殖,同时培养过程中极易沾染细菌微生物等影响细胞生长的生物。因此,若要深入进行贝类病害机理、人工育珠、基因功能分析等研究,有必要对三角帆蚌外套膜细胞的培养方法和培养基进行改进,以延长细胞培养时间,提高细胞增殖活力,甚至建立起细胞系。
发明内容
针对现有技术中的不足,本发明的目的是提供一种三角帆蚌外套膜细胞的培养方法。即通过对组织的充分消毒处理,减少细菌和微生物的污染,从而采用胰蛋白酶对组织块进行消化,将消化后细胞接种到培养瓶中,加入细胞增殖培养基中进行原代和传代培养。
为达到上述目的,本发明的解决方案是:
一种三角帆蚌外套膜细胞的培养方法,其包括如下步骤:
(1)、自体血清的获取和处理:使用无菌的1mL注射器从三角帆蚌血窦部位抽取非抗凝淋巴血,置于15mL无菌离心管中离心,先使用0.45μm滤膜过滤两次上清液,后56℃孵育30min,最后使用0.22μm滤膜过滤两次,封口放置-20℃冰箱储存,得到三角帆蚌自体血清;
(2)、组织的获取和处理:使用75%酒精喷洒其表面,对外壳进行杀菌处理,时间为20min左右,开壳后用棉球擦拭两侧三角帆蚌壳的外套膜部位,并用灭菌的滤纸去除外套膜表面粘液,然后放置在预冷的PBS缓冲液中暂时保存;PBS缓冲液清洗3-5遍,75%酒精溶液清洗10s,依次用2%、10%、20%、10%、2%的梯度三抗清洗外套膜组织,最后将清洗的外套膜组织置PBS缓冲液中进行涮洗;
(3)、剪碎处理:使用无菌剪刀将外套膜组织剪至1mm左右大小,剪碎后加入两倍体积的0.25%胰蛋白酶和0.1%胶原蛋白酶混合液(美国Gibco)进行消化;
(4)、组织消化:4-6℃低温过夜消化外套膜组织8-15h,然后在35-38℃条件下继续消化20-25min,最后加入完全培养基终止反应,其中,完全培养基包含:10%三角帆蚌自体血清和RPMI-1640培养基;
(5)、收集细胞:分别用200目、400目细胞筛对消化后的细胞悬液过滤到无菌离心管中,收集细胞悬液,离心,弃上清,收集细胞沉淀;
(6)、配制细胞增殖培养基,其包括以下组分和浓度:将RPMI-1640培养基(美国Gibco)、10%三角帆蚌自体血清、2%三抗(中国Solarbio)、1%丙酮酸钠(美国Gibco)、1%非必需氨基酸(L-丙氨酸、L-谷氨酸、L-天门冬酰胺、L-天门冬氨酸、L-脯氨酸、L-丝氨酸、甘氨酸,美国Gibco)、2ng/mL表皮生长因子(美国Gibco)、15ng/mL碱性成纤维生长因子(美国Gibco)、1ng/mL胰岛素样生长因子-1(美国Gibco)和0.1%2-巯基乙醇(中国杭州吉诺)混合得到;
(7)、细胞接种:将步骤(5)离心收集的细胞沉淀用细胞增殖培养基分散并孵育,然后接种到细胞培养瓶中进行细胞培养;
(8)、传代培养:观察三角帆蚌外套膜细胞增殖到约培养瓶底80%密度,使用胰蛋白酶和胶原蛋白酶消化,传代培养继续扩增。
进一步地,步骤(1)中,离心的转速可以为1000-1500rpm,优选为1200rpm(1000rpm离心速度下,上清液细胞存留量多,1200rpm离心会在上清液中残留少量细胞,而随着离心转速的增大,对细胞所产生伤害加大,故选用1200rpm);离心的温度为4℃;离心的时间可以为10-15min,优选为12min(12min能够充分保证细胞离心完全,时间过长可能会对某些具有生物活性的物质产生影响)。
进一步地,步骤(2)中,每个浓度梯度的清洗时间为1-3min,优选为2min(2min能充分保证细胞清洗干净,时间过长会损伤组织细胞)。
进一步地,步骤(4)中,低温过夜消化的温度优选为4℃(4℃下组织细胞基本保持代谢停滞,胰蛋白酶活力较低、作用缓和,对细胞损伤更小);时间可以为8-15h,优选为12h(外套膜组织的细胞分离较为困难,12h既可以保证冷消化作用完全,又不延误后续热消化时间)。
进一步地,步骤(4)中,继续消化的温度可以为35-38℃,优选为37℃(37℃最适胰蛋白酶消化,消化效率较高,温度过高细胞死亡率较高);时间可以为20-25min,优选为20min(热消化的消化效率较高,消化25min可能会造成消化时间过长,细胞容易凝聚成团,影响细胞状态);终止的时间可以为8-15min,优选为10min(10min可以保证终止消化完全,终止液并不最适合细胞存活,时间过长会造成一定损伤)。
进一步地,步骤(5)中,离心的转速可以为1000-1500rpm,优选为1200rpm(离心速度达到1500rpm,造成细胞破裂的几率增加,导致细胞死亡,1000rpm会造成细胞沉淀速率较慢);离心的时间可以为8-10min,优选为10min(离心10min,有利于细胞收集完全)。
进一步地,步骤(7)和步骤(8)中,培养的过程为:加入细胞增殖培养基,每隔24h半数换液。
由于采用上述方案,本发明的有益效果是:
第一、本发明的细胞增殖培养基中添加了三角帆蚌自体血清、表皮生长因子、碱性成纤维生长因子和胰岛素样生长因子-1,能够提供类似于体内的培养环境,提高细胞的存活能力和增殖活性,经过4-5天的培养即可长满培养瓶,从而有效缩短培养时间。其中,本发明的三角帆蚌自体血清与细胞培养常使用的胎牛血清相比,降低了实验成本。目前,已连续培养至16代,已能初步满足在细胞水平的功能研究。故该方法能够促进三角帆蚌外套膜细胞快速稳定增殖,维持细胞增殖能力,同时降低成本。
第二、本发明的培养方法不仅可用于三角帆蚌外套膜细胞的培养,该方法还可适用于其他部位的细胞培养(如鳃等),本发明所培养的传代细胞为细胞水平展开病害机理、细胞工程育种以及基因功能分析等提供了基础。
第三、本发明的细胞增殖培养基配方简单,而且相比现有的培养基,可以有效降低杂菌污染的概率,更有效维持外套膜细胞的增殖能力。
附图说明
图1为本发明的实施例1中显微镜下的三角帆蚌外套膜细胞原代培养第3天的细胞效果图(200X)。
图2为本发明的实施例1中显微镜下三角帆蚌外套膜细胞刚消化传代(第8代)的细胞效果图(200X)。
图3为本发明的实施例1中显微镜下三角帆蚌外套膜细胞传代(第8代)24h后的细胞培养效果图(200X)。
图4为本发明的实施例1中三角帆蚌外套膜细胞COI基因PCR鉴定图(注:①:原代细胞;②:第2代细胞;③:第4代细胞;④:第6代细胞;⑤:第8代细胞;⑥:第10代细胞)。
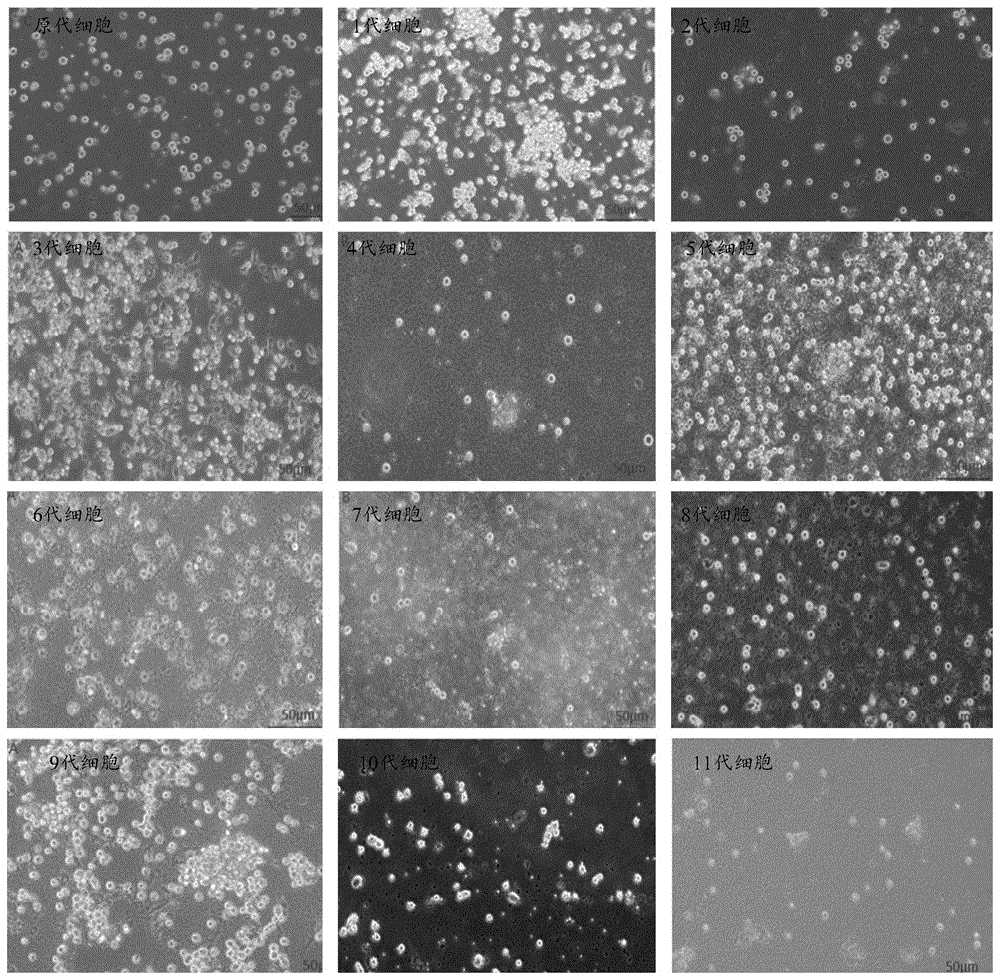
图5为本发明的实施例1中三角帆蚌外套膜细胞体外原代及传代培养显微图。
具体实施方式
本发明提供了一种三角帆蚌外套膜细胞的培养方法。
下面结合实施例对本发明的技术内容做进一步的说明。下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
以下结合实施例和附图对本发明作进一步的说明。
实施例1:
本实施例的三角帆蚌外套膜细胞的培养方法包括如下步骤:
(1)、自体血清的获取和处理:使用无菌的1mL注射器从三角帆蚌血窦部位抽取非抗凝淋巴血,置于15mL无菌离心管中离心(离心的转速为1200rpm,温度为4℃,时间为12min),先使用0.45μm滤膜过滤两次上清液,后56℃孵育30min,最后使用0.22μm滤膜过滤两次,封口放置-20℃冰箱储存,得到三角帆蚌自体血清。
(2)、组织的获取和处理:使用75%酒精喷洒其表面,对外壳进行杀菌处理,时间为20min左右,开壳后用棉球擦拭两侧三角帆蚌壳的外套膜部位,并用灭菌的滤纸去除外套膜表面粘液,然后放置在预冷的PBS缓冲液中暂时保存;PBS缓冲液清洗3-5遍,75%酒精溶液清洗10s,依次用2%、10%、20%、10%、2%的梯度三抗清洗外套膜组织,每个梯度各2min,最后将清洗的外套膜组织置PBS缓冲液中进行涮洗。
(3)、剪碎处理:使用无菌剪刀将外套膜组织剪至1mm左右大小,剪碎后加入两倍体积的0.25%胰蛋白酶和0.1%胶原蛋白酶混合液进行消化。
(4)、组织消化:4℃过夜消化外套膜组织12h,结束后,在37℃条件下继续消化20min;最后加入完全培养基终止消化10min,,其中,完全培养基包含:10%三角帆蚌自体血清和RPMI-1640培养基。
(5)、收集细胞:分别用200目、400目细胞筛对消化后的细胞悬液过滤到无菌离心管中,1200rpm离心10min,弃上清,收集细胞沉淀。
(6)、配制细胞增殖培养基,其包括以下组分和浓度:基础培养基RPMI-1640、10%三角帆蚌自体血清、2%三抗、1%丙酮酸钠、1%非必需氨基酸(L-丙氨酸、L-谷氨酸、L-天门冬酰胺、L-天门冬氨酸、L-脯氨酸、L-丝氨酸、甘氨酸)、2ng/mL表皮生长因子、15ng/mL碱性成纤维生长因子、1ng/mL胰岛素样生长因子-1和0.1%2-巯基乙醇混合得到。
(7)、细胞接种:将步骤(5)离心收集的细胞沉淀用细胞增殖培养基分散并孵育,然后接种到细胞培养瓶中进行细胞培养。
(8)、传代培养:观察三角帆蚌外套膜细胞增殖到约培养瓶底80%密度,使用胰蛋白酶和胶原蛋白酶消化,传代培养继续扩增。
其中,在步骤(7)和步骤(8)中,培养的过程为:加入细胞增殖培养基,每隔24h半数换液。
在步骤(8)中,胰蛋白酶的浓度为0.25%,胶原蛋白酶的浓度为0.1%。
启动原代培养第3天,在显微镜下可以观察到细胞数量明显增多,胞质明亮,有明显的增殖现象(图1)。
传代培养后,5-6天可铺满80%培养瓶底,传代后,细胞呈现不规则形(图2),24h后恢复成圆形细胞,并伴随着大量细胞的增殖(图3)。目前,已培养至第11代(图5)。
对比例1:
将接种外套膜细胞的培养瓶中分别加入10%三角帆蚌自体血清的RPMI-1640、DMEM/F12、M199、L15、DMEM培养基至5mL/瓶,置于25℃下培养,观察细胞生长速度情况。
对比例2:
在RPMI-1640培养基的基础上,配置10%胎牛血清、5%胎牛血清和5%自体血清、10%自体血清3种不同血清培养基,置于25℃下培养,观察细胞生长速度情况。
对比例3:
在已接种外套膜的培养瓶中分别加入浓度为5%、10%、15%、20%三角帆蚌自体血清的RPMI-1640培养基,置于25℃下培养,观察细胞生长速度情况。
实验结果:
1.对比例1中,三角帆蚌外套膜细胞分别在RPMI-1640、DMEM/F12、M199、L15、DMEM培养基中原代培养3天后,结果显示(表1),除了L15培养基中的细胞大量死亡外,其他基础培养基均能满足外套膜细胞的需求,其中RPMI-1640相较于其他培养基来说,细胞的增殖速度更快,可见RPMI-1640培养基更适合三角帆蚌外套膜细胞的体外培养。
表1不同基础培养基下生长密度
2.对比例2中,三角帆蚌外套膜细胞在不同血清的RPMI-1640培养基中原代培养3天后,结果显示(表2),在10%自体血清的培养基中培养的细胞增长速度更快,细胞形态更好,而10%胎牛血清组、5%胎牛血清和5%自体血清组的细胞大量死亡。可见三角帆蚌自体血清最适合三角帆蚌外套膜细胞的体外培养。
表2不同血清下生长密度
3.对比例3中,三角帆蚌外套膜细胞在不同自体血清的RPMI-1640培养基中原代培养3天后,结果显示(表3),在浓度为10%自体血清的培养基中培养的外套膜细胞增殖速度最快,明显优于其他组的培养基。可见培养基中自体血清为10%最适合三角帆蚌外套膜细胞的体外培养。
表3不同自体血清浓度下生长密度
将实施例1的细胞COI基因进行鉴定:
(一).实验方法
1.细胞DNA的提取
(1)消化获取原代、第2代、第4代、第6代、第8代、第10代细胞。
(2)加入等体积的PBS缓冲液,混合均匀,以8000rpm离心5min,弃上清。
(2)加入20μL Proteinase K(20mg/mL)溶液,涡旋混匀,在56℃放置3h。
(3)加入200μL缓冲液GB,充分颠倒混匀,70℃放置10min,溶液应变清亮,简短离心以去除管盖内壁的水珠。
(4)加人200μL无水乙醇,充分颠倒混匀,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。
(5)将上一步所得溶液和絮状沉淀都加入一个吸附柱中(吸附柱放入收集管中),12,000rpm离心30s,倒掉废液,将吸附柱放回收集管中。
(6)向吸附柱中加入500μL缓冲液GD,12,000rpm离心30s,倒掉废液,将吸附柱放入收集管中。
(7)向吸附柱中加入600μL漂洗液PW,12,000rpm离心30s,倒掉废液,将吸附柱放入收集管中。
(8)重复操作步骤(7)。
(9)将吸附柱放回收集管中,12,000rpm离心2min,倒掉废液。将吸附柱置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
(10)将吸附柱转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μL洗脱缓冲液TE,室温放置2-5min,12,000rpm离心2min,将溶液收集到离心管中。
2.PCR验证
(1)PCR扩增引物
上游引物COI-F(5’-3’):ACAGCATGAAAGGTCACCCC;
下游引物COI-R(5’-3’):GTTGGGACTGGTTGGACAGT。
反应体系:
(2)PCR反应条件:
94℃预变性3min,94℃变性30s,65℃复性30s,72℃延伸1min,34个循环,最后72℃延伸10min。
(3)琼脂糖凝胶电泳
配置:1.0%琼脂糖胶(20mL TAE buffer,0.2g琼脂糖粉)摇匀,微波炉1min左右沸腾,冷却降温后加入2μL GeneGreen核酸染料,混合均匀后倒至跑胶板中,放置好梳子,室温至胶凝固;
上样:将样品对应加入上样孔中,记录好顺序。
(4)跑胶120V、30min
(5)观察拍照记录结果。
(二).实验结果
PCR验证结果见图4,各细胞样本均能扩增得到片段为860bp左右的PCR条带,符合目的条带大小。
以上结果表明,培养的细胞为三角帆蚌外套膜细胞。
上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
/>
/>
