一种用于乙型肝炎病毒治疗性mRNA疫苗及其制备方法与应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于mRNA疫苗技术领域,具体一种用于乙型肝炎病毒治疗性mRNA疫苗及其制备方法与应用。
背景技术
乙型肝炎是世界性公共卫生问题,全球约有2.57亿慢性HBV感染者,每年约有88.7万人死于HBV相关疾病。目前临床上的治疗药物包括干扰素和核苷(酸)类似物,可有效抑制HBV转录或复制,但无法彻底清除HBV,且存在治疗响应率低或抗原阴转率低等问题,难以实现乙型肝炎治愈。目前还没有一个由中国公司研发的抗乙肝创新药。
大多数慢乙肝患者是由母婴传播或1周岁前感染导致,病毒长期潜伏导致免疫抑制分子过表达,共刺激分子缺失或Treg细胞水平的异常升高导致免疫机体的抗病毒免疫处于耗竭状态,导致病毒特异性免疫无应答。因此,激活固有免疫或适应性免疫应答,诱导T细胞和B细胞抗病毒免疫,是乙肝治愈的新策略。
mRNA疫苗技术可以作为快速灵活的技术平台。随着化学修饰mRNA和纳米脂质载体技术的发展和成熟,mRNA在多种病毒疫苗研发中的优势愈发凸显。其中新冠mRNA疫苗因其在有效性和安全性方面的卓越表现预示该技术在疫苗领域具有良好前景。由于免疫反应的特异性,靶抗原表位序列(包括B细胞表位和T细胞表位)直接决定了免疫反应的种类。鉴于B细胞免疫和T细胞免疫都在HBV病毒的清除中不可或缺,尽可能去选择合适的免疫原性片段,是mRNA疫苗设计的关键一步。
申请公布号为CN114903987A的文件公开了一种用于治疗慢性乙型肝炎病毒感染的mRNA药物及其制备方法和应用,根据IL-21基因制备IL-21mRNA,再将IL-21mRNA与脂质混合,制得LNP-IL-21。能够有效诱导体内CD8T细胞免疫和体液免疫。其以鼠源基因IL-21编码IL-21蛋白,并采用1-甲基假UTP来取代UTP、加帽结构来提高IL-21mRNA的翻译效率,但是最后验证得到的IL-21蛋白表达,依旧具有转染时间长、表达效率不高的缺陷。
真核生物mRNA的UTR上存在大量的顺式元件和特殊结构,与多种特定的RNA结合蛋白(RBP)互作并进而招募其他蛋白形成复合物,帮助细胞根据不同的信号通路对mRNA的翻译进行精密调控。为了最大程度的提高mRNA疫苗的翻译效率和稳定性,本发明在优化序列SFORF的基础上,还对非编码区(5’UTR和3’UTR)进行了筛选和优化,能在相同接种量的条件下翻译出更多mRNA,发挥更大的生物学效应。
发明内容
在一方面,本发明公开一种重组mRNA,其编码了与乙型肝炎病毒包膜蛋白的大蛋白区域氨基酸序列相同的蛋白质,所述乙型肝炎病毒包膜蛋白的大蛋白区域的氨基酸序列如SEQIDNO:1所示。
在一方面,本发明公开提供了重组mRNA在制备治疗乙型肝炎病毒感染的药品中的用途。
在一方面,本发明公开提供了一种重组mRNA,包含如SEQIDNO:2所示的核酸序列。
在一些实施方式中,所述重组mRNA还包括5'‐UTR序列和/或3'‐UTR序列,所述UTR序列包括HIF2序列、GAPDH序列、ACTA1序列、CKMM序列、MYLPF序列、TNNC2序列、RPS27A-201序列。
在一些实施方式中,所述UTR序列进一步优选包括HIF2序列、GAPDH序列。
在一些实施方式中,所述重组mRNA还经过3'加尾修饰,和/或至少一个5'加帽修饰。
在一方面,本发明公开提供了一种DNA分子,其编码了本技术的重组mRNA。
在一方面,本发明公开提供了一种重组质粒,其包含本技术的DNA分子。
在一方面,本发明公开提供了一种表达载体,其包含本技术的重组mRNA和药学上可接受的载体。
在一方面,本发明公开提供了一种本技术的重组mRNA在制备治疗乙型肝炎病毒感染的药品中的用途。
在一些实施方式中,治疗乙型肝炎病毒感染的药品可包含药学上可接受的赋形剂。所述药学上可接受的赋形剂可以是载体、稀释剂、佐剂或编码佐剂核苷酸序列、增溶剂、粘合剂、润滑剂、助悬剂、转染促进剂等。所述转染促进剂包括但不限于表面活性剂如免疫刺激复合物、费氏(Freunds)不完全佐剂、LPS类似物(例如单磷酰酯A)、胞壁肽、苯醌类似物、角鲨烯、透明质酸、脂质、脂质、钙离子、病毒蛋白质、阳离子、聚阳离子(例如聚L谷氨酸(LGS))或纳米粒子或其他已知的转染促进剂。
在一方面,本发明公开提供了一种用于慢性乙型肝炎病毒感染的治疗性疫苗,其包含本技术的重组mRNA和脂质制成的脂质纳米颗粒mRNA-LNP。
在一些实施方式中,所述脂质纳米颗粒mRNA-LNP包括mRNA和脂质,其中,所述脂质包括:(a)正电荷脂质和/或可离子化脂质中的一种或多种;(b)中性辅助脂质;(c)胆固醇;(d)PEG修饰的脂质。
在一些实施方式中,治疗性疫苗的制备方法包括以下步骤:(1)合成编码大蛋白区域天然结构域肽段的DNA片段,并克隆到质粒作为模板;(2)转录制备得到目标mRNA;(3)制备上述的脂质纳米颗粒mRNA-LNP。
在一些实施方式中,步骤(2)中的目标mRNA是经纯化的mRNA分子。
在一些实施方式中,步骤(3)中制备脂质纳米颗粒mRNA-LNP的流程包括:将目标mRNA分子溶解在枸橼酸盐缓冲液组成的水相中,采用冲击式射流或微流控等方法与溶解在乙醇相中的脂质成分混合,制备负载有mRNA的脂质纳米颗粒。
在一方面,本发明公开提供了一种用于诱导对象中针对乙型肝炎病毒的免疫应答的方法,其包括向所述对象施用上述的治疗性疫苗。
在一些实施方式中,所述对象的免疫应答包括产生了针对乙型肝炎病毒的保护性抗体。
与现有技术相比,本发明采用上述技术方案具有以下有益效果:
本发明提供的mRNA乙肝治疗性疫苗可以产生激活体液免疫及T细胞免疫双重机制,以对抗乙肝病毒,是首次制备的一种能够有效诱导针对HBV的特异性中和抗体(保护性抗体)的治疗性mRNA疫苗。
本发明通过核酸序列的优化,可以在相同接种量的条件下翻译出更多mRNA,发挥更大的生物学效应。
附图说明
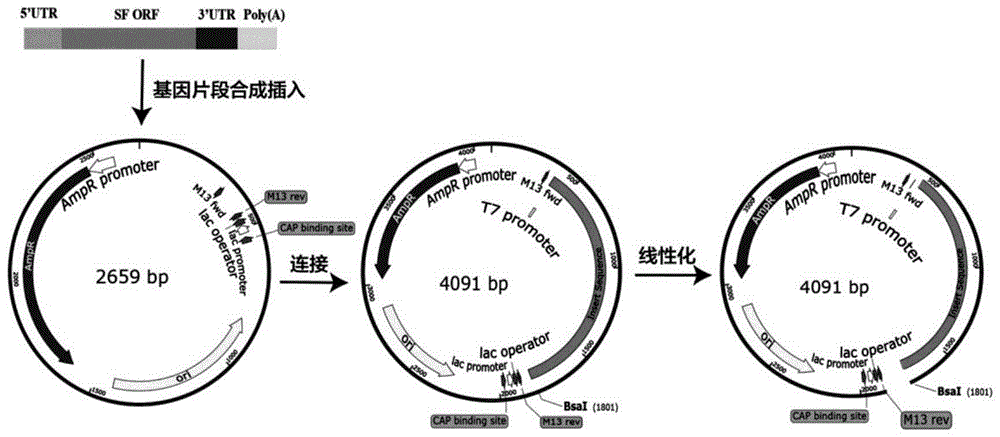
图1显示本发明使用的DNA转录模板构建策略示意图。
图2显示本发明实施例一中双荧光素酶报告基因实验筛选UTR的结果。
图3显示本发明实施例一中酶切得到的DNA线性化产物。
图4显示本发明实施例一中所制备得到的mRNA的大小,降解程度测试结果。
图5显示本发明实施例二中实验鼠的S抗原水平。
图6显示本发明实施例二中实验鼠的E抗原水平。
图7显示本发明实施例二中实验鼠的S抗体水平。
图8显示本发明实施例二中实验鼠的S抗原水平和S抗体水平的关系。
图9显示本发明实施例二中实验鼠的HBVDNA水平。
图10显示本发明实施例二中实验鼠的ALT水平。
图11显示本发明实施例二中实验鼠的体重状况。
图12显示本发明实施例二中临床治愈小鼠的S抗原水平。
图13显示本发明实施例二中临床治愈小鼠的HBVDNA水平。
图14显示本发明实施例二中实验鼠的免疫激活情况。
图15显示本发明的mRNA疫苗诱导抗体的中和活性。
具体实施方式
Ⅰ、概要
乙型肝炎病毒(Hepatitis B,HBV)是引起乙型肝炎(简称乙肝)的病原体。HBV是一个包裹着的部分双链环状DNA分子,其基因组含有4个开放读码框架。分别称为S、C、P、X区。S区又分为S基因、preS1基因和preS2基因三段,分别编码S蛋白、preS1蛋白和preS2蛋白,三者合称大S蛋白。由于免疫反应的特异性,靶抗原表位序列(包括B细胞表位和T细胞表位)直接决定了免疫反应的种类。鉴于B细胞免疫和T细胞免疫都在HBV病毒的清除中不可或缺,尽可能去选择合适的免疫原性片段,是mRNA疫苗设计的关键一步。
本发明通过前期的研究确定以大S蛋白(S蛋白、preS1蛋白和preS2蛋白)作为疫苗的活性成分,刺激机体产生中和性抗体或称为保护性抗体。
mRNA的UTR序列也同样影响mRNA的稳定性和翻译效率,且是调控最终蛋白表达水平的关键因素。本发明为了最大程度的提高mRNA疫苗的翻译效率和稳定性,本发明在优化HBVS蛋白全长编码区(SFORF)的基础上,还对非编码区(5’UTR和3’UTR)进行了筛选和优化。通过双荧光素酶报告基因实验,筛选出最优UTR,能在相同接种量的条件下翻译出更多mRNA,发挥更大的生物学效应。
Ⅱ、HBV疫苗
本发明在设计针对HBV病毒的靶抗原时,首先对目的基因的氨基酸序列进行优化,主要优化策略是针对在人体内表达时的密码子偏好性进行调整、常用密码子的使用频率进行调整、提高了序列的G/C含量,使得mRNA结构更稳定,在哺乳动物和人体内的目标蛋白翻译效率更高。具体的氨基酸序列如下所示:
。
在优化序列SFORF的基础上,根据目标mRNA序列特点设计基因序列,主要包括优化后的HBVS蛋白全长编码区(SFORF)、非编码区(UTR)和polyA。该序列从5’-3’分别含有5’UTR、SFORF、3’UTR、polyA。DNA转录模板上的关键功能性元件包括T7promoter(转录启动子)、5’UTR、SFORF、3’UTR以及polyA尾。
Ⅲ、制备方法
本发明先通过对乙型肝炎病毒(HBV)进行抗原表位分析,确定以HBV大S蛋白为抗原靶点,LNP为递送载体,免疫方式为皮下注射的mRNA疫苗剂型,同时通过UTR和密码子优化、体外转录方法合成编码病毒抗原片段的mRNA,最终实现人源细胞高效表达;整个mRNA疫苗生产周期短、工艺操作简单、生产成本低,保存时间久。本发明设计的mRNA疫苗,能在相同接种量的条件下,引起更强的中和抗体效应。
在本发明的一些实施方案中,制备方法主要包括:合成编码大S蛋白天然结构域肽段的DNA片段,并克隆到质粒作为模板,最后转录制备得到目标mRNA分子。
其中,合成编码大S蛋白天然结构域肽段的DNA片段的过程可自行合成或委托合成。
其中,根据药典中对质粒抗性的要求,DNA转录模板的质粒骨架包括卡那霉素Kana抗性、CMV真核表达元件和T7promoter序列等关键元件。
其中,可按照如下反应制备目标mRNA分子:
a.三步法:体外转录得到未加帽未加尾的mRNA,在RNA聚合酶和ATP的条件下,在mRNA尾部加上polyA结构(polyA结构中间可插入连接子或不插入连接子),在加帽酶催化下,以给未加帽的mRNA的5'端加上帽子结构,得到加帽加尾的mRNA分子;
b.两步法:体外转录得到加尾未加帽的mRNA;在加帽酶催化下,以给未加帽的mRNA的5'端加上帽子结构,得到加帽加尾的mRNA分子;
c.一步法:进行体外转录和加帽,得到加帽加尾的mRNA分子。
在本发明的一些具体实施方案,制备所述mRNA分子的方法还包括mRNA的纯化过程:将所述的mRNA进行氯化锂/乙醇沉淀、离心柱、氯萃取/乙醇沉淀或凝胶纯化,以获得纯化后的mRNA。mRNA的核酸序列如下所示:
。
实施例1:制备mRNA疫苗
步骤一、双荧光素酶报告基因实验筛选UTR
根据前期预实验结果结合研究经验,选择在多组织蛋白中表达量高H1F2、GAPDH、RPS27A-201以及在肌肉表达量高ACTA1、CKMM、MYLPF、TNNC2等7种基因的UTR,将这7种基因的3’UTR和3’+5’UTR克隆至目的载体Psicheck。准备293T细胞,完成质粒转染。
使用GenePharma公司的双荧光素酶报告实验试剂盒。
制备被动裂解缓冲液1×PLB:将1倍体积的5×Passive Lysis Buffer(PLB)加到4倍体积的蒸馏水中,混合均匀,4℃储存待用;
配制LARII:用Luciferase Assay Buffer II溶解冻干粉Luciferase AssaySubstrate,储存于-20℃待用;
配制1×Stop&Glo®试剂(现用现配):按本次实验所需用量,取一定量的50×Stop&Glo®加入到相应量的Stop&Glo® Buffer中,配种成终浓度为1×浓度,待用。
(1)倾去24孔板中的培养液,用PBS洗涤细胞两次,此过程必须仔细,不接触贴壁细胞。
(2)将1×PLB加入到培养孔中,在室温下细胞在培养板中被动裂解,把裂解液转移到检测试板中。实验设计3复孔。
(3)打开 tecan M1000 酶标仪,预热,选择双荧光素酶检测系统。
(4)每孔加入LARII试剂,选择1-2秒延迟,5-10读数,酶标仪上检测萤火虫荧光素酶活性。
(5)取出测试板,每孔加入Stop&Glo®试剂,选择1-2秒延迟,5-10读数,酶标仪上检测海肾荧光素酶活性。
(6)结果统计与分析如图2所示,根据双荧光素酶报告基因实验的结果,HIF2-5’UTR和GAPDH-5’UTR具有最高的翻译效率和稳定性,因此选用HIF2-5’UTR和GAPDH-5’UTR作为mRNA疫苗的UTR序列,具体如下所示:
。
步骤二、从大肠杆菌中提取质粒
属特异性的共同抗原决定簇“a”位于101-172位氨基酸序列,根据对大表面蛋白氨基酸序列的分析,大表面蛋白能够完整的保留该抗原表位,因此选择乙肝大表面蛋白基因作为编码mRNA的模版。
根据筛选的UTR序列和经过前期研究结合数据库中显示的乙肝大表面蛋白的核苷酸序列,在5’UTR序列之前加上T7启动子序列(Taatacgactcactatagg),在CDS区后依次添加polyA尾、3’UTR、Basl酶切位点(GTCTGGAGACC),合成对应的DNA片段,并将所述DNA片段克隆至表达质粒获得重组质粒,将所述重组质粒转入宿主细胞获得重组细胞。从扩繁后的重组细胞中提取质粒。
使用TIANGEN无内毒素质粒大提试剂盒提取质粒,试剂盒内产品组成:平衡液BL、溶液P1、溶液P2、溶液P4、漂洗液PW、洗脱缓冲液TB、RNA酶A、过滤器CS1、吸附柱CP6、收集管。
(1)柱平衡步骤:向吸附柱CP6中(吸附柱放入50毫升收集管中)加入2.5毫升的平衡液BL,8000rpm(-8228×g)离心,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(2)取过夜培养的菌液加入离心管,室温8000rpm离心。
(3)吸除上清。
(4)向留有菌体沉淀的离心管中加入溶液P1(TIANGEN无内毒素质粒大提试剂盒中P1溶液)(已加入RNaseA),彻底悬浮细菌细胞沉淀。
(5)向离心管中加入溶液P2(TIANGEN无内毒素质粒大提试剂盒中P2溶液),立即温和地上下翻转6-8次,使菌体充分裂解,室温放置5分钟。
(6)向离心管中加入溶液P4(TIANGEN无内毒素质粒大提试剂盒中P4溶液),立即温和地上下翻转6-8次,充分混匀,至溶液出现白色分散絮状沉淀,然后室温放置10分钟左右。8000rpm(-8228×g)离心,使白色沉淀离至管底,将全部溶液倒入过滤器CS1中,过滤,收集滤液在收集管中。
(7)向滤液中加入0.3倍滤液体积的异丙醇,混匀后转移到吸附柱CP6中(吸附柱放入收集管中)。
(8)室温8000rpm(-8228×g)离心,倒掉收集管中的废液,将吸附柱CP6重新放回收集管中。
(9)向吸附柱CP6中加入漂洗液PW(已加入无水乙醇),8000rpm(-8228×g)离心2分钟,弃掉收集管中的废液,将吸附柱重新放回收集管中。
(10)重复操作步骤(9)。
(11)向吸附柱CP6中加入无水乙醇,室温8000rpm(-8228×g)离心2分钟,倒掉废液。
(12)将吸附柱CP6重新放回收集管中,8000rpm(-8228×g)离心。
(13)将吸附柱CP6置于一个干净的收集管中,向吸附膜的中间部位悬空滴加1-2毫升洗脱缓冲液TB(洗脱缓冲液TB预热),室温放置5分钟,然后室温8000rpm离心;将离心液全部移入一个干净的1.5毫升离心管, -20℃保存。
步骤三、对构建好的质粒进行酶切线性化
酶切反应体系如下:
质粒DNA:1微克;
10x酶缓冲液:5微升;
Bsal酶(购买自NewEnglandBiolab)10Unit
无酶ddH2O补水至50微升;
将上述酶切体系置于37℃反应15分钟。
步骤四、对酶切线性化后的DNA进行纯化
按TIANGENDNA纯化试剂盒说明书纯化DNA。
(1)柱平衡步骤:向吸附柱CB2中(吸附柱放入收集管中)加入平衡液BL,12000rpm(-13400×g)离心,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(2)估计PCR反应液或酶切反应液的体积,向其中加入等倍体积溶液PC(TIANGENDNA纯化试剂盒),充分混匀。
(3)将上一步所得溶液加入一个吸附柱CB2中(吸附柱放入收集管中),室温放2分钟,12000rpm(-13,400×g)离心1分钟,倒掉收集管中的废液,将吸附柱放入收集管中。
(4)向吸附柱CB2中加入漂洗液PW(TIANGENDNA纯化试剂盒)(使用前请先检查是否已加入无水乙醇),12000rpm(-13400×g)离心,倒掉收集管中的废液,将吸附柱CB2放入收集管中。
(5)重复操作(4)。
(6)将吸附柱CB2放回收集管中,12000rpm(-13400×g)离心2分钟,除去漂洗液。将吸附柱CB2置于室温放置直至晾干。
(7)将吸附柱CB2放入一个干净的离心管中,向吸附膜中间位置悬空滴加适量洗脱缓冲液EB(TIANGENDNA纯化试剂盒),室温放置2分钟。12000rpm(-13,400×g)离心2分钟,收集DNA溶液。
步骤五、DNA胶检查
待纯化反应结束后,取酶切反应前后体系各1微升进行DNA琼脂糖凝胶电泳(1.5%琼脂糖凝胶,5V/分钟,40分钟)。根据电泳结果比较显示,重组质粒是否酶切完全。
合格标准:电泳检测出现单一条带;与酶切前的超螺旋质粒比较,条带位于超螺旋质粒上方;大小符合预期要求。
测定结果:如图3所示,条带单一;大小符合预期且条带位于超螺旋质粒上方。
步骤六、 mRNA的体外合成
使用NEB公司S1404系列m7G(5')ppp(5')G RNA Cap Structure Analog,配合E2040系列使用。这里有两种选择,一种是合成mRNA的过程中加帽,一种是合成完之后加帽。采取合成过程中加帽:
按照如下合成体系进行(反应试剂按照先后顺序添加):
反应体积,20微升(置于1.5毫无RNA酶管中,为单个管的反应体积,一次同时反应多管):
无酶ddH2O (4-X)微升;
ATP(100mM)2微升 10mMfinal;
UTP(100mM)2微升 10mMfinal;
CTP(100mM)2微升 10mMfinal;
GTP(20mM) 2微升 2mMfinal;
CapAnalog(40mM) 4微升 8mMfinal;
模版DNA X微升 1微克;
10X反应缓冲液 2微升;
T7 RNA Polymerase Mix 2微升;
总反应体积20微升;
所述RNA体外合成的程序为37℃,2小时。
产出:1微克DNA,在如上条件下,2小时可产出40微克-50微克mRNA,其中80%的mRNA会带有m7G帽子。
步骤七、 DNaseI消化去除DNA模板
向mRNA体外合成后的每个离心管中各加入2微升DNaseI。
上下颠倒混匀,1000rpm离心。
重新置于恒温反应器(37℃)中进行反应。
反应结束后,将反应液合并到RNase-free1.5毫升离心管中,检测DNA片段的残留。三次测量结果为a纳克,b纳克,c纳克每dμgmRNA(待测)。
步骤八、纯化mRNA
NEB公司Monarch®RNACleanupKit,T2040系列试剂盒纯化mRNA。
(1)向50微升待纯化mRNA中加入100微升RNACleanup Binding Buffer。
(2)向混合液中加入150微升95%乙醇充分混合。
(3)将吸附柱放入收集管中,混合液加入吸附柱,然后离心,弃滤液。
(4)将吸附柱放入收集管中,加入500微升RNACleanup Wash Buffer,离心,弃滤液。
(5)重复步骤(4)。
(6)将吸附柱转移到新的无RNA酶1.5毫升离心管中。
(7)向吸附柱中央加入规定体积的无酶水,离心,洗脱mRNA,纯化后的mRNA -70℃保存。
步骤九、RNA胶检查
取纯化后的mRNA稀释10倍,进行RNAScreenTapeassay以及琼脂糖凝胶电泳检测其片段完整性。如图4示合成的mRNA大小及降解程度。
检测结果显示,条带符合大小,片段完整。
步骤十、LNP制备
在乙醇中混合一体积的新型阳离子脂DLin-MC3-DMA(4-(N,N-二甲基氨基)丁酸(6Z,9Z,28Z,31Z)-庚三十碳-6,9,28,31-四稀-19-基脂)(上海艾韦特医药科技有限公司)、DSPC(二硬酯酰磷脂酰胆碱)(上海艾韦特医药科技有限公司)、胆固醇、DMG-PEG2000 (1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000)(上海艾韦特医药科技有限公司),混合的克分子比率为50:10:38.5:1.5,混合三体积的mRNA(mRNA与脂质的质量比为1:25,氮磷比为6),缓冲体系为枸橼酸盐缓冲液(PH4.0,10mM)。将脂质和mRNA注入微流体混合装置(ZX-LS-32,FluidicLab),混合速率为1.5毫升/分钟。合成的混合物在磷酸盐缓冲液(PBS,pH7.4,10mM)中透析16小时以去除乙醇。
实施例2. mRNA疫苗的治疗效果评价
构建小鼠模型
C57BL/6小鼠(6-8周,雄性),尾静脉注射1x1010vg(viralgenome)AAV-HBV1.3(购自北京五加和分子医学研究所有限公司)。在感染之后4周建立稳定的HBV耐受及慢性HBV感染模型。每组5只随机分为4组:疫苗单用组、抗病毒药物单药组、抗病毒药物+疫苗联用组、生理盐水组。
在第1天和第14天,以皮下注射或肌肉注射或尾静脉注射的方式,给予疫苗单用组、抗病毒药物+疫苗联用组每只小鼠乙肝病毒mRNA疫苗。抗病毒单药组,抗病毒药物+疫苗组规律给抗病毒新药,生理盐水组同时注射生理盐水。每周眼眶采血一次,取血清,直至试验结束。检测血清中HBVDNA、S抗原、E抗原、ALT、抗S蛋白特异性抗体的滴度。
S抗原、E抗原、S抗体使用安图试剂盒检测
1.实验前准备
(1)将试剂盒(安图试剂盒)放置室温(18-25度)下平衡。
(2)将恒温箱或水浴锅调至反应温度,待温度稳定后使用。
(3)配制洗液:1包固体洗液用500毫升纯化水溶解。
(4)提前60分钟将发光底物A、B液等比例混合至本次试验所需体积。
2.实验步骤
(1)取出一定量的包被孔,编号,每孔分别加入50微升校准品及样本。
(2)每孔分别加入酶结合物50微升。
(3)在微型振荡器上振荡60秒使孔内液体混合均匀。
(4)贴上板贴,置37℃下温育60分钟。
(5)洗板:①手洗:甩净孔内液体,然后加入洗液350微升/孔,停留5秒钟后甩去,重复5次,最后在吸水纸上拍干。②机洗:每孔中注入洗液量350微升,洗板6次,最后在吸水纸上拍干。
(6)每孔加入混合后的发光底物50微升,震荡10秒后,室温(18℃-25℃)避光反应10分钟。
(7)化学发光检测仪检测发光强度。
小鼠血清中HBsAg,HBeAg,anti-HBs滴度测试结果参见图5,6,7示。HBsAg和anti-HBs滴度的关系图如图8所示。.
结果表明,mRNA联合疫苗组,HBsAg下降约3个Log
DNA检测使用圣湘乙型肝炎病毒核酸测定试剂盒(PCR-荧光探针法)
1.反应体系配置:
(1)取出样本释放剂(圣湘公司,与乙型肝炎病毒核酸测定试剂盒配套使用),待平衡至室温后充分混匀,吸取5微升样本释放剂至96孔PCR板中。
(2)每孔加入待测样本5微升,用移液器吹打3-5次充分混匀,室温静置10分钟充分裂解。
(3)按照每个反应需要PCR反应液38微升,酶混合液2微升,内标0.2微升的比例根据测量样本的数量吸取各溶液,充分混匀成PCR混合液,瞬时离心后备用。
(4)每孔加入PCR混合液40微升,贴qPCR专用压敏封板膜后弹击充分混匀并去气泡,瞬时离心后进行PCR扩增。
2. PCR反应:
(1)将PCR板放入反应槽,并在软件中设置阴性对照、阳性对照、标准品及未知样品,标准品浓度为:标准品A:4X10
(2)荧光通道选择FAM通道检测HBV-DNA,选择VIC通道检测内标,选择ROX通道作为参比荧光。
(3)循环参数设定:
。
3.数据处理:
利用分析软件通过对标准品Ct值的测量拟合标准曲线,并利用该标准曲线求得未知样品的HBV-DNA浓度。
4. 质量控制:
a)阴性对照:无Ct值显示;但内标检测为阳性(Ct值≤40);
b)阳性对照:检测浓度值介于1.26X105-1.26X106IU/mi;
c)定量标准品:均检测为阳性,且标准曲线相关系数r≥0.98。
小鼠血清中HBVDNA测试结果参见图9示。
结果显示,mRNA联合疫苗组HBVDNA下降约6个Log
ALT检测使用Elabscience丙氨酸氨基转移酶(ALT)活性荧光法试剂盒
1.试剂准备
(1)检测前,所有试剂需平衡至室温。
(2)酶试剂工作液的配制:每支酶试剂粉剂用1.2毫升缓冲液充分溶解,置于冰盒上待用。
(3)1毫摩尔/升丙酮酸标准品储备液的配制;取10微升100mmol/L丙酮酸标准品加入到990微升缓冲液中,配制成1毫摩尔/升的丙酮酸标准品储备液。
(4)50微摩尔/升丙酮酸标准品溶液的配制:按照1毫摩尔/升丙酮酸标准品储配液:缓冲液体积比为1:19的比例稀释20倍,即得50微摩尔/升标准品溶液,按需配制,置于冰盒上待用。
(5)反应工作液的配制:按缓冲液:探针:酶试剂工作液:底物体积比为56:4:20:20的比例混匀,避光保存。
2.操作步骤
(1)标准孔:向酶标板对应的标准孔中加入20微升的不同浓度标准品;测定孔:向酶标板对应的测定孔中加入20微升的待测样本。
(2)向步骤(1)各孔中加入100微升的反应工作液。
(3)酶标仪上振板5秒,室温静置3分钟,荧光酶标仪上设置激发光波长535nm,发射光波长587nm,测定各孔荧光值,记为F1,然后于室温下避光静置反应60分钟,相同波长条件下测定各孔荧光值,记为F2,则ΔF=F2-F1(注:标准孔不需要求差值,直接取反应60分钟后测定的荧光值做标准曲线即可)。
小鼠血清中ALT水平如图10示。小鼠体重如图11所示。
结果显示,ALT水平和小鼠体重无明显变化,说明mRNA疫苗无明显毒性。
综上所述,本实施例验证了具有以下效果:
本发明的mRNA疫苗能有效降低血清中HBVDNA、S抗原、E抗原。
具有良好的免疫原性,诱导产生了针对S蛋白的特异性抗体,对照组注射生理盐水的小鼠不能产生针对S蛋白的特异性抗体。
mRNA候选疫苗对ALT水平无影响,对小鼠体重无影响,显示mRNA疫苗无明显肝脏毒性,安全性良好。其中,抗病毒药物+mRNA疫苗联用组有两只小鼠实现乙肝临床治愈。分别是,D85小鼠表面抗原清零,HBV DNA清零,产生高滴度抗体,达896.69,D40小鼠表面抗原清零,HBV DNA清零,出现S抗原血清学转换,抗体达194.175。
实现完全治愈的小鼠的HBsAg与HBV DNA如图12,13所示,HBsAg与HBV DNA降低到检测线以下。
实施例3. mRNA疫苗对T细胞和B细胞的免疫激活作用验证
本实施例中,通过实验考察了乙肝mRNA疫苗对T细胞和B细胞的免疫激活作用。
采用实施例2中的小鼠,给药15周后处死,取其肝脏、脾脏、外周血。肝脏进行质谱流式分析肝脏原位免疫,脾脏、外周血进行流式实验分析外周免疫。
具体按照以下操作进行:从肝脏和脾脏组织中用percoll密度梯度离心法分离单细胞形式的淋巴细胞,从新鲜血液中用Ficoll分离PBMC,进行计数后,将细胞用培养液稀释后加入24孔板中。培养板中加入适量S蛋白pepmix刺激物和阻断剂孵育12小时;将24孔板在37℃ CO
质谱流式和流式细胞术的结果如图14所示,肝脏原位免疫显示,抗病毒药物+疫苗组,效应记忆CD8+T、CD4+T细胞明显多于其他三组且差异有统计学意义;免疫激活指标IL-2,TNFα增高。脾脏和外周血的外周免疫显示,抗病毒药物+疫苗组,记忆CD8+T、CD4+T细胞明显多于其他三组且差异有统计学意义,免疫抑制指标PD-1减少。抗病毒药物+疫苗组原位免疫和外周免疫的细胞免疫均被激活,打破免疫耐受状态,乙肝mRNA疫苗与抗病毒药物联合使用有免疫激活的作用。
实施例4. mRNA疫苗的中抗体滴度验证
本实施例中,通过实验考察了乙肝mRNA疫苗的中抗体滴度。具体按照以下操作进行:
接种疫苗,分别在0d、14d时,对6-8周龄的C57小鼠接种乙肝病毒mRNA疫苗(皮下注射或肌肉注射或尾静脉注射);每周取小鼠外周血,取血清。
准备HepAD38细胞产生的病毒,将HepAD38细胞养在10厘米皿中,用含四环素的F12培养基养3-4代,改用不含四环素的培养基,收集细胞上清,上清液-80℃保存。测上清液中HBV DNA浓度,选择HBV DNA滴度高于1×10
在48孔板里铺HepG2-NTCP细胞,用含G418的培养基铺板。铺板后3小时,弃上清,加适量PMM溶液,37℃培养箱过夜。血清热灭活,75微升血清—培养基混合液与75微升病毒-PEG8000—培养基混合液储存液等体积混匀,同时DMEM与病毒液等体积混匀,作为阴性对照。37℃孵育1-2小时。将上述病毒—抗体血清—培养基混合液转移至48孔板HepG2-NTCP细胞,室温摇板2-5小时,间隔10秒,摇板完成后置于37℃培养箱静置过夜。24h后,弃掉培养基,用无血清DMEM将细胞洗3次,加入PMM继续培养,Day3,5,7,收集细胞上清液,加入PMM继续培养检测HBVDNA,HBsAg。
实验结果如图15所示,使用mRNA疫苗的小鼠,上清液中HBV DNA明显低于对照组,表明使用mRNA疫苗的小鼠的血清中存在具有中和活性的抗体。中和实验结果说明,mRNA疫苗可诱导产生中和抗体,并具有良好的中和活性和免疫原性。
本文中所描述的具体实施例仅仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
