一株防治番茄灰霉病的贝莱斯芽孢杆菌及其应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于微生物技术领域;具体涉及一株防治番茄灰霉病的贝莱斯芽孢杆菌及其应用。
背景技术
番茄灰霉病作为番茄在生产种植实践中最严重的病害之一,影响了番茄果实的品质和产量,通常会导致大片的番茄作物受害。目前,针对番茄灰霉病的防治,主要以化学试剂为主,但由于化学试剂的过度使用影响了土壤环境和周边环境产生了影响,甚至破坏了当地农业生态系统,导致番茄品质的下降,对人和牲畜有一定的危害,其弊端远远多于单纯的对灰霉病的防治。基于现状的需求,生物农药越来受大家的关注,相比于化学试剂的化学农药来说,生物农药能够在有效的治疗病害的同时对能够对环境和人非常的友好,所产生的危害远远小于化学农药。因此,能够筛选出一种能够针对番茄灰霉病防治的菌株,为后续制作生物农药提供一定的基础,是非常重要的。
发明内容
本发明目的是提供了生防效果良好的一株防治番茄灰霉病的贝莱斯芽孢杆菌及其应用。
本发明通过以下技术方案实现:
一株防治番茄灰霉病的贝莱斯芽孢杆菌,它为贝莱斯芽孢杆菌(Bacillusvelezensis)D4,已在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为CGMCCNo.25089,保藏日期为2022年6月15日,保藏地址为北京市朝阳区北辰路1号院3号。
本发明所述的一株防治番茄灰霉病的贝莱斯芽孢杆菌,所述贝莱斯芽孢杆菌的16S rDNA的核苷酸序列如SEQ ID No:1所示。
本发明所述的一株防治番茄灰霉病的贝莱斯芽孢杆菌,所述一株防治番茄灰霉病的贝莱斯芽孢杆菌按照2.41wt%蔗糖、1.25wt%酵母浸粉、0.17wt%氯化钠、0.014wt%硫酸镁配比制备液体培养基,最大活菌数达到2.18×10
本发明所述的一株防治番茄灰霉病的贝莱斯芽孢杆菌,所述一株防治番茄灰霉病的贝莱斯芽孢杆菌在蛋白酶检测平板上培养3d后分泌蛋白酶、纤维素酶和嗜铁素,产生生长素IAA,形成生物膜。
本发明所述的一株防治番茄灰霉病的贝莱斯芽孢杆菌,所述一株防治番茄灰霉病的贝莱斯芽孢杆菌经过乙酸乙酯的处理,产生32种高度匹配的化合物。
本发明所述的一株防治番茄灰霉病的贝莱斯芽孢杆菌的应用,稀释后胞子浓度为3×10
本发明所述的一株防治番茄灰霉病的贝莱斯芽孢杆菌的应用,用于番茄灰霉病的防治。
本发明的有益效果为:
1.试验以番茄灰霉病为病原菌的平板对峙出发,筛选出一株生防细菌D4,能够有效抑制番茄灰霉病,通过形态观察、生理生化鉴定和16SrDNA序列分析,该菌株鉴定为贝莱斯芽孢杆菌(Bacillusvelezensis)。
2.通过对菌株D4的耐干旱和耐紫外线研究,发现D4能在90d的干旱环境中和180min紫外线照射下,依旧有活性,能够生长,说明菌株D4有较好的抗逆性。
3.通过对菌株D4的液体培养基组分进行了优化,确定了当按照2.41%蔗糖、1.25%酵母浸粉、0.17%氯化钠、0.014%硫酸镁配比制备液体培养基其最大活菌数达到2.18×10
4.菌株D4对番茄种子和幼苗有很好的促生效果,在菌悬液浓度为3×10
5.通过菌株D4处理后的番茄果实,与对照组相比,果实的腐烂率和失重率均有明显的降低;处理后的果实品质的硬度和可溶性固形物没有发生明显变化,说明菌株D4对番茄果实有好的保鲜作用。
6.在叶片离体实验中,对番茄灰霉病的防治效果到了58.62%,温室栽培中,先接种菌株D4防治效果达到了73.64%,先侵染番茄灰霉病防治效果达到了69.37%,与生物制剂没有显著差异。
7.菌株D4能分泌蛋白酶、纤维素酶和嗜铁素,能产生生长素IAA,能够形成生物膜。不能产生HCN和几丁质酶。
8.通过GC-MS发现菌株D4能够产生32种挥发性化合物。其中有5种化合物被报道有抑菌活性。
附图说明
图1为菌株D4对病原菌的抑菌效果照片;
图2为菌株D4显微镜下抑菌带部位番茄灰霉病菌丝生长状况对比照片;
图3为菌株D4挥发性物质抑制番茄灰霉病菌的效果对比照片;
图4为菌株D4形态照片;
图5为菌株D4的16SrDNAPCR扩增产物;
图6为菌株D4的16SrDNA序列系统发育树;
图7为菌株D4的液体发酵培养基碳源的利用情况对比图;
图8为菌株D4的液体发酵培养基氮源的利用情况对比图;
图9为菌株D4的液体发酵培养基无机盐的利用情况对比图;
图10为蔗糖和酵母浸粉的互作对菌株D4活菌数的响应面曲线;
图11为蔗糖和氯化钠的互作对菌株D4活菌数的响应面曲线;
图12为蔗糖和硫酸镁的互作对菌株D4活菌数的响应面曲线;
图13为酵母浸粉和氯化钠的互作对菌株D4活菌数的响应面曲线;
图14为酵母浸粉和硫酸镁的互作对菌株D4活菌数的响应面曲线;
图15为各因素对菌株D4活菌数优化最佳的预测结果;
图16为菌株D4的菌液浓度对番茄胚根的影响对比图;
图17为菌株D4的不同稀释倍数菌液浓度对番茄胚根的影响对比图;
图18为菌株D4的对番茄幼苗植株作用后的对比图;
图19为菌株D4对番茄幼苗根系影响的对比扫面照片;
图20为菌株D4对番茄幼苗光合作用光合效率对比图;
图21为菌株D4对番茄幼苗光合作用光化学猝灭对比图;
图22为菌株D4对番茄幼苗光合作用非光化学猝灭对比图;
图23为菌株D4对番茄幼苗光合作用光系统Ⅱ的相对电子传递速度对比图;
图24为菌株D4对番茄幼苗光合作用叶绿素荧光Y(NPQ)荧光成像对比图;
图25为菌株D4对番茄果实的腐烂程度影响对比图;
图26为菌株D4对番茄果实的失重程度影响对比图;
图27为菌株D4对番茄果实的品质影响对比图;
图28为菌株D4对番茄果实的外观影响对比照片;
图29为菌株D4对番茄灰霉病离体叶片防效结果对比照片;
图30为菌株D4对对番茄灰霉病温室栽培防治效果对比照片;
图31为接种菌株D4的植物叶片其POD活性对比曲线;
图32为接种菌株D4的植物叶片其SOD活性对比曲线;
图33为接种菌株D4的植物叶片其PPO活性对比曲线;
图34为接种菌株D4的植物叶片其MDA活性对比曲线;
图35为菌株D4的胞外酶活性检测照片,图a:蛋白酶,图b:嗜铁素,图c:纤维素酶;
图36为菌株D4的分泌IAA检测照片;
图37为菌株D4的生物膜检测照片。
具体实施方式
下面结合附图对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
本发明提供的一株防治番茄灰霉病的贝莱斯芽孢杆菌,它为贝莱斯芽孢杆菌(Bacillus velezensis)D4,已在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为CGMCCNo.25089,保藏日期为2022年6月15日,保藏地址为北京市朝阳区北辰路1号院3号。
一、生防菌株的筛选
土样采集:菌株分离材料来海南省崖城区东北农业大学南繁基地,从番茄、玉米、水稻、南瓜、大豆、芒果、香蕉等植物根际土壤中采集土样10分。选取植长势健壮无病害根际周围部位,除去表面土,采集5-10cm深处土样。
菌株的分离采用浓度梯度涂布法进行对土样中的微生物进行分离:将所采集的10分土样分别称取1g放入带有
9mL无菌水的试管中充分震荡至悬浊,浸泡30min后进行浓度梯度稀释:取悬浊液1mL加入新的灭菌带有9mL无菌水试管中浓度为10
菌株的纯化采用平板划线方法:待分离的平板培养基上长出单菌落,用接种针挑取单菌落放入300mLLB液体培养基中,在28℃,200r/min培养24h后,在LB固体培养基上进行划线培养,并进行编号存放在4℃备用。
生防菌株的初筛::将灭菌培养基PDA到入平板中,晾干凝固;在平板中心接番茄灰霉病菌,在离中心3cm等距4处用接种环蘸取需筛选的4种菌株;28℃恒温箱培养7d,观察平板上在番茄灰霉病病原菌和待试菌株生长的中间区域,是否有明显的抑制区域,是否产生透明抑菌带。每组3次重复。将能够产生抑菌带的菌株标记出进行后续的复筛。
初筛结果:从10份土样中,利用梯度稀释涂布法和平板划线法进行了分离纯化出176份菌株,保存在LB试管斜面,待后续进行筛选。以番茄灰霉病病原菌为对峙对象,通过平板对峙实验,对176份菌株进行初步筛选,根据对番茄灰霉病菌的抑制程度,进行初步筛选,结果表明:编号4、43、59、86、99、108的菌株对番茄灰霉病菌有抑制效果。
生防菌株的复筛:将初筛出的菌株制备菌悬液,首先在PDA平板培养基上中心位置接种番茄灰霉病病原菌菌块(Φ5mm),在距离中心位置3cm处放置一个灭菌圆滤纸(Φ5mm),滴加20μL待试菌株菌悬液;番茄枯萎病对峙方式同番茄灰霉病;经28℃培养7d后,测量病原菌和待试菌株之间的透明抑菌带宽度。每组3次重复。
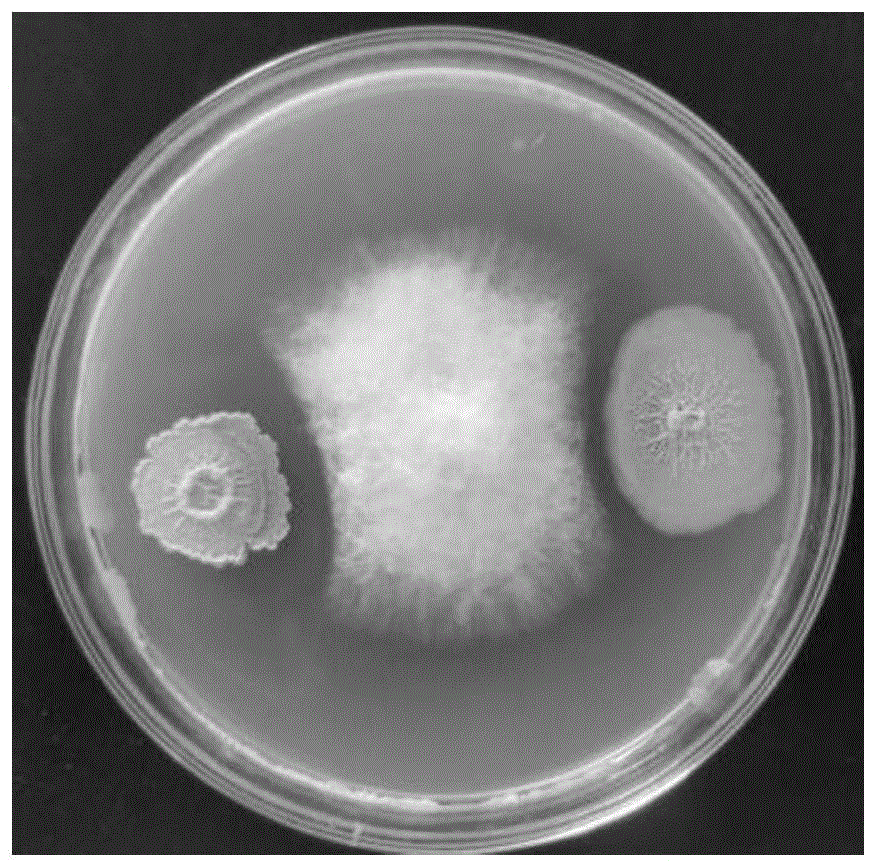
将初筛的6份菌株,利用接种环接种进行对峙,与番茄灰霉病病原菌、番茄枯萎病病原菌进行平板对峙试验,结果表1和图1所示。结果表明,所筛选出的6份菌株中,其中标记为4号菌株的细菌对番茄灰霉病有较强的抑制作用,并且对番茄枯萎病也有一定的抑制作用,最终选定标记为4号的菌株为本实验所定的生防菌株,将其命名为D4。
表1菌株对峙结果
将最后筛选出的生防菌株与番茄灰霉病原菌做对峙培养7d后,在超净台中,取一盖玻片,轻轻放置在病原菌与生防菌株抑菌带上,轻轻蘸取一下,然后放置在载玻片上,放在显微镜下观察抑菌带边缘灰霉病菌丝生长情况,取正常生长的一侧的灰霉病菌丝作对照,如图2所示:左侧为正常发育的番茄灰霉病病菌的菌丝,长势丰满,强壮有活力,右侧为抑菌带中间的电镜图,发现在抑菌边缘,菌丝生长开始停滞,不再向外生长,菌丝密度降低,菌丝末端不再向外延伸,表明生防菌株D4很好的抑制了灰霉病菌丝的生长,使其不再延伸扩散,达到了抑菌的效果。
使用二分平板,两侧分别加入LB培养基和PDA培养基,用接种环在LB培养基上面接菌待试菌株,在PDA培养基上面接种灰霉病菌,对照组采用接种灰霉病菌但不接种待试菌株处理。28℃恒温培养7d后观察灰霉病菌生长状况。实验重复3次。通过28℃恒温培养7d后,如图3所示,可以观察到相比于对照二分板,接菌的二分板PDA培养基上的番茄灰霉病菌生长受到了抑制,没有对照组长势丰满,说明菌株D4所产生的挥发性物质能够抑制番茄灰霉病菌的生长。
二、生防菌株的鉴定
从图4可知,利用浓度梯度稀释法,取5mL已在28℃,200r/min培养24h小时菌悬液于灭菌试管中,进行浓度梯度稀释,稀释到10
参照伯杰氏细菌鉴定手册,通过葡萄糖氧化发酵试验、接触酶反应试验、甲基红反应试验等鉴定菌株D4生理生化特性。结果如表2所示,
表2特性鉴定结果
表3-3菌株D4耐干旱结果
表3中对比菌株WZ-37已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCCNo.15766。
从表3可知,通过对菌株D4和WZ-37为期90d的观察测定,发现菌株在30℃的干燥培养下,到第90d菌株依旧还有活性,平板划线结果显示菌株依旧能够正常的生长。
表4菌株D4耐紫外线结果
从表4可知,通过对菌株D4和WZ-37为期240min的测定,结果显示,两株菌株在365nm紫外线照射不同时间下,平板划线结果依旧能够看到菌株有活性,240min的照射时间后能够正常的生长。
以菌株D4基因组DNA为模板,用16SrDNA的通用引物对菌株D4进行扩增,得到约1400bp的的PCR产物。由图5可以看出,扩增出的片段符合常规的16SrDNA序列长度。采用常规的柱式PCR产物纯化回收试剂盒对PCR扩增产物进行回收,得到1457bp大小的片段,将纯化回收产物送到华大基因测序公司进行测序。将测出的菌株的DNA序列和NCBI上的其他模式菌株进行BLAST比对。利用软件构建菌株D4及其同源相关性的系统发育树。进行1000次算法重复计算减少误差。其中发育树接点只显示展开值Bootstrap大于50%的结果。可以从图6中得出,菌株D4与Bacillusvelezensis亲源关系最近,所以确定该菌株为一株贝莱斯芽孢杆菌D4。
三、菌株D4的液体发酵优化
从图7可知,通过对菌株D4进行的最佳碳源的利用测定,如图7所示,所试验的8种成分中当蔗糖为碳源时D4的活菌数最高达到1.49×10
从图8可知,通过对菌株D4进行的最佳氮源的利用测定,所试验的8种成分中当酵母浸粉为氮源时D4的活菌数最高达到1.56×10
从图9可知,通过对菌株D4进行的最佳无机盐的利用测定,D4对不同无机盐的利用情况也均不同,其中菌株D4对氯化钠的利用率最高,其活菌数能够达到1.58×10
通过试验培养基各组分最佳来源的优选,筛选出了D4菌株的最佳活菌数的4个因素为:蔗糖A、酵母浸粉B、氯化钠C、硫酸镁D。
从图10可知,所示为蔗糖与酵母浸粉相互作用的结果,图片表明,蔗糖与酵母浸粉相互作用呈近似正圆形,表明蔗糖与酵母浸粉两者对于D4的活菌数来说同增同减。当取2%蔗糖和1%酵母浸粉时,可显著提高D4的活菌数。
从图11可知,所示为蔗糖与氯化钠相互作用的结果,图片表明,蔗糖与氯化钠相互作用呈近似椭圆形,类似抛物线形状,表明氯化钠的量对菌株D4活菌数的变化有着一定这作用。当取2%蔗糖和0.15%氯化钠时,可显著提高D4的活菌数。
从图12可知,所示为蔗糖与硫酸镁相互作用的结果,图片表明,蔗糖与硫酸镁相互作用呈近似正圆形,表明蔗糖与硫酸镁两者对于D4的活菌数来说同增同减。当取2%蔗糖和0.02%硫酸镁时,可显著提高D4的活菌数。
从图13可知,酵母浸粉与氯化钠相互作用的结果,图片表明,酵母浸粉与氯化钠相互作用呈近似椭圆形,类似抛物线形状,表明相对于酵母浸粉,氯化钠的量对菌株D4活菌数的变化有着一定这作用。当取1%酵母浸粉和0.15%氯化钠时,可显著提高D4的活菌数。
从图14可知,所示为酵母浸粉与硫酸镁相互作用的结果,图片表明,酵母浸粉与硫酸镁相互作用呈近似椭圆形,类似抛物线形状,表明相对于酵母浸粉,硫酸镁的量对菌株D4活菌数的变化有着一定着作用。当取2%蔗糖和0.15%氯化钠时,可显著提高D4的活菌数。
根据以上各因素水平之间的相互影响效果,以活菌数的最大值为目标,进行分析预测得知,综合各因素对菌株D4活菌数液体发酵条件的最佳优化方案为:2.41%蔗糖、1.25%酵母浸粉、0.17%氯化钠、0.014%硫酸镁、最大活菌数达到2.18×1010cfu/mL,通过预测的配比,按照相应的量进行实际的发酵的活菌数测量,测得的活菌数为2.22×1010cfu/mL,与预测值相近,基本符合。
四、菌株D4对番茄促生作用的影响
由图16可知,当对菌株D4和WZ-37的菌悬液稀释到原来的10
由图17可知,进一步测定最佳浓度,将D4和WZ-37菌液稀释到500、1000、5000倍处理后,菌株D4能够在稀释1000倍的时候,其对番茄幼苗培根长的促生作用最强,相比于对照组和对应浓度的WZ-37有较强的效果,最终确定出菌株D4的最佳促生浓度大约为稀释1000倍(孢子浓度3×10
表5番茄幼苗相关测定参数
菌株D4对番茄最佳的促生浓度为稀释1000倍(孢子浓度为3.0×10
表6不同菌株对番茄幼苗根系指标的影响
从表6和图19可知,经过菌株D4处理的番茄幼苗根部的相关指标要好于菌株WZ-37处理组和对照组,D4处理的根长、节点数、根尖数明显高于其他处理组,经D4处理的番茄幼苗的根系根长是对照组(CK)的1.5倍,表面积是对照组的1.67倍;节点数是对照组的1.8倍;根尖数是对照组的1.73倍。从照片可以看出来D4处理组的根部扫描照片相对比较丰满,根系长而多且分散,能够更好的吸收土壤中营养,生长环境更好,使其植物自身的抗性能力增加。
如图20所示为各处理对番茄幼苗光合作用时最大光合效率(Fv/Fm)影响程度,结果对照组、菌株D4、菌株WZ-37的最大光合效率分别为0.60、0.66、0.62。菌株D4组与菌株WZ-37、对照组均有显著性差异,并且菌株D4显著性高于对照组。说明菌株D4能够提高番茄幼苗在光合作用时的最大光合效率。
如图21所示为各处理对番茄幼苗光合作用时对光化学猝灭(qP)的影响程度,对照、菌株D4、菌株WZ-37的光化学猝灭值分别为0.56、0.67、0.65,可以看出菌株D4显著高于菌株WZ-37高于对照组为最强。说明菌株D4在番茄幼苗生长阶段能提高光电子传递活性。
如图22所示为各处理对番茄幼苗光合作用时对非光化学猝灭(qN)的影响程度,对照、菌株D4、菌株WZ-37的非光化学猝灭值分别为0.47、0.56、0.49,可以看出菌株D4显著高于菌株WZ-37和对照组为最强。说明菌株D4在番茄幼苗生长阶段能够增加番茄幼苗消耗过剩的光能,用来保护光合系统。
如图23所示为各处理对番茄幼苗光合作用时对光系统Ⅱ的相对电子传递的影响,对照、菌株D4、菌株WZ-37的ERT(Ⅱ)值分别19.22、23.60、22.14,可以看出菌株D4处理组显著高于对照组,略显著高于菌株WZ-37处理组。说明被菌株D4处理后,能够促进幼苗对光能的利用和传递。
如图24所示,为各处理对番茄幼苗光合作用时对Y(NPQ)影响,Y(NPQ)较高说明植物对光的保护能力越更强,所对应的数值越高,说明幼苗对环境的抗逆性越强,菌株D4的Y(NPQ)最大值为0.437、菌株WZ-37Y(NPQ)最大值为0.367、对照组的Y(NPQ)最大值为0.349,能够表明在菌株D4处理后,幼苗对光的保护能力增强,提高了幼苗的抗逆性能力。
五、菌株D4对采后番茄果实品质的影响
如图25所示,各处理在经过21天的贮藏后,其均有果实腐烂,其中对照组腐烂率大约为40%、菌株D4处理组腐烂率大约为30%、菌株WZ-37处理组腐烂率大约为33%。用生防菌株D4和WZ-37处理的果实的腐烂率显著低于对照组处理,同时有略低于菌株WZ-37的处理组,说明菌株D4有一定的防腐作用。
如图26所示,随着贮藏时间的延长,番茄果实的失重率也随之增加上升,根据图示,在贮藏第6d和第18d时,失重率有两个急剧上升状况,当达到27d时,菌株D4、WZ-37和对照组的之中率分别大约为13%、15%、19%。表明,菌株D4处理后,番茄的失重率会下降,保证番茄果实的品质。
如图27所示,不同番茄果实作为市场畅销产品,其品质备受关注,其中对果实的硬度和果实所含的可溶性固形物及其甜度等指标非常的重视,试验测量了各组处理贮藏21d后的硬度和可溶性固形物指标如图27所示,发现无论是对照组还是生防菌株处理组,在贮藏21d后,其硬度的下降率基本上持平,没有显著性的差异,可溶性固形物含量下降率也没有显著性的差异,说明对番茄果实进行生防菌株处理后,并不影响其营养品质,也不会对成分带来不良反应。
如图28所示,展现了各组处理的番茄果实在贮藏了21d后剩余未腐烂果实的形态观察,发现被生防菌株处理过的番茄明显比对照组的番茄圆润光滑,仍然有一定的观赏性,在保证营养品质的情况下,依旧能够进行销售,能够延长番茄销售的货架期。
六、菌株D4对番茄灰霉病叶片离体防治效果的影响
取大小均一长势相同的番茄叶片,进行5min用3%次氯酸钠表面消毒后灭菌水冲洗干净风干,将叶片放置在带有2层湿润滤纸的灭菌平板中,叶柄部用大小相同的润湿脱脂棉团包裹。实验共四组处理,每个处理10片番茄叶,3次重复。分别用干净的脱脂棉团分别蘸取D4菌悬液(1.0×108cfu/mL)、WZ-37菌悬液(1.0×108cfu/mL)、40%嘧霉胺800倍稀释液、灭菌水均匀的在番茄叶部进行涂抹,待风干后,全部接种番茄灰霉病菌块,在室温24℃下培养,每7d进行观察,计算病情指数和防治效果。
表7对番茄灰霉病离体叶片防效结果
/>
从表7和图29可知,番茄灰霉病最容易侵染的部位有叶片,通过生防菌株处理离体叶片来观察对番茄灰霉病的防治效果,实验结果如表7和图29所示,结果显示,菌株D4处理的叶片,对于灰霉病叶片的病情指数来说D4相对于对照组和WZ-37有显著性差异,高于生物制剂嘧霉胺。对于叶片番茄灰霉病的防效来说,相对于生物制剂,没有太大的显著性差异,说明D4菌株也有很好的对番茄灰霉病的防治效果。
七、菌株D4对番茄灰霉病温室栽培防治效果的影响
试验使用普通栽培番茄(AC),对番茄种子进行消毒催芽后,播种到穴盘中,培养15d后分苗到营养钵中,30d后调查温室防效试验效果,试验一共设计4个处理:
(1)用化学药剂40%嘧霉胺(800倍稀释)作为阳性对照,先喷施化学试剂,1d后,再喷施番茄灰霉病菌悬液(孢子浓度1.0×10
(2)先喷施番茄灰霉病菌悬液(孢子浓度1.0×10
(3)先喷施菌株D4菌悬液(1.0×10
(4)只喷施番茄灰霉病菌悬液(孢子浓度1.0×10
各处理均在25℃保湿下培养,在第20d观察番茄植株的发病情况,参考番茄离体叶片的病情指数等级,计算其病情指数和防治效果。
表8菌株D4温室栽培防治效果
从表8和图30可知,通过调查和统计生防菌株对番茄灰霉病温室栽培防治效果,进行温室人工接种番茄灰霉病试验,结果表8和图30所示,通过调查统计发现,根据对照组发现,番茄幼苗接种灰霉病后,病情指数达到了33.94%,先接种菌株D4再接种灰霉病能够有效控制番茄灰霉病的发病,其病情指数降低到20.36%,但显著高于化学制剂嘧霉胺的处理组的16.35%。
八、菌株D4诱导番茄叶部相关酶的测定
前期土播一批普通栽培番茄(AC),待幼苗长至三叶一心将其作为试验材料,试验共设计5组处理:
(1)菌株D4菌悬液(1.0×108cfu/mL)喷施处理;
(2)番茄灰霉病菌悬液(1.0×106cfu/mL)喷施处理;
(3)先菌株D4菌悬液(1.0×108cfu/mL)喷施处理,再番茄灰霉病菌悬液(1.0×106cfu/mL)喷施处理;
(4)先番茄灰霉病菌悬液(1.0×106cfu/mL)喷施处理,再菌株D4菌悬液(1.0×108cfu/mL)喷施处理;
(5)无菌水空白对照。
按照以上分组处理后,采用连续每天取样的方式进行观察处理后番茄叶部各种酶的活性变化,连续7d取样,同一天取样同一时间段取样,要求每天取样,所选取的番茄叶子需在一直的生长部位,生长高度,保证其生长状态一直。样品放入5mLEP管中液氮速冻,-80℃冰箱保存。
本实验测定生防菌株对诱导番茄叶部抗性相关防御酶的活性时,采用了试剂盒检测方法,所用试剂盒均来自苏州科铭生物技术有限公司提供。
如图31所示为叶片中过氧化物酶POD在7d内的活性变化,各处理组POD活性均显示出了先上升后下降的趋势,各处理在第4d或第5d达到峰值。其中变化最大的为只接种D4的处理组,能够显著提升植物叶部的POD活性,对于接种了灰霉和菌株D4的植物叶片其POD活性变化也很显著。最终各组处理的POD水平在第七天时回到了与之前水平相当,说明植物在受到刺激后POD的在一段时间内会改变,但是待系统稳定了将会回到最初水平状态。
如图32所示,各处理在7d内番茄叶部的超氧化物歧化酶SOD活性有着不同的变化程度,菌株D4处理的番茄叶部在不侵染番茄灰霉病时,在能够在在一段时间内SOD值上升,并且在第4天达到最大,随后下降;在接种灰霉与菌株D4时,先接种菌株D4其叶部的SOD的上升幅度比后接种菌株D4的大,但是均比对照组上升强度大。
如图33所示,为番茄叶部多酚氧化酶PPO活性,在各组处理事,均都表现出了较大幅度的上升,相比较上升幅度,先接种菌株D4的PPO活性变化幅度最大,在第4d达到峰值;只接种菌株D4的番茄叶部PPO含量上升幅度相比较对照和只接种灰霉病的要上升幅度大,在第5d达到峰值。
如图34所示,为番茄叶部丙二醛(MDA)活性变化,其含量高低可以作为考察细胞受到胁迫严重程度的指标之一,含量可以反映植物遭受逆境伤害的程度,MDA含量越高,对膜和细胞造成一定的伤害越高。可以看出,在各组处理后,植物受到番茄灰霉病的侵染后,其含量增加,在菌株D4处理后,无论是后续是否侵染番茄灰霉病,其MDA含量均没有发生明显的变化,表菌株D4能够在番茄幼苗受到侵害时起到保护作用。同时可以看出,植物在收到侵害时,其MDA含量均有上升,但是会缓慢的下降。
九、菌株D4对番茄灰霉病的作用机制初步探究
生防菌株的胞外酶活性检测:通过特定的检测培养基,用于检测蛋白酶、几丁质酶、纤维素酶、氢氰酸(HCN)、嗜铁素活性。
蛋白酶活性检测:将菌株D4用接种环蘸取接种在固氮检测培养基上,28℃恒温培养3d,观察菌落周围是否有透明圈,有则表明该菌株能够产生蛋白酶,实验重复3次。
几丁质酶活性检测:将菌株D4用接种环蘸取接种在几丁质诱导培养基上,28℃恒温培养3d,观察菌落周围是否有透明圈,有则表明该菌株能够产生几丁质酶,实验重复3次。
纤维素酶活性检测:将菌株D4用接种环蘸取接种在CMC-Na培养基上,28℃恒温培养3d,用1g/L刚果红溶液倒入培养皿中充分浸泡1h后,加入1mol/L的NaCl溶液进行浸泡漂洗1h后,观察菌落周围是否有透明圈,有则表明该菌株能够产生纤维素酶。实验重复3次。
氢氰酸(HCN)活性检测:将菌株D4用接种环蘸取接种在KMB培养基上,上方贴上HCN敏感试纸,密封28℃恒温培养3d,观察试纸显色情况,若由橘黄色转变为红色或更深颜色则产生氢氰酸,实验重复3次。
嗜铁素活性检测:将菌株D4用接种环蘸取接种在铬天青CAS培养基上,28℃恒温培养3d,观察菌落周围是否有橘黄色圈出现,有责表明,有则表明该菌株能够产生嗜铁素,实验重复3次。
图35可知,菌株D4在蛋白酶检测平板上培养3d后就出现透明圈,并且随着菌株的生长,透明圈也在不断的扩大;在几丁质诱导培养基上没有观察到透明圈;在CMC-Na培养基上面,通过刚果红的浸染和氯化钠溶液的漂洗,发现在菌落周围出现了一圈透明圈,随着时间的发展圈会缓慢扩大;在氢氰酸的活性检测中,发现氢氰酸敏感试纸没有转变颜色;在铬天青CAS培养基上,很明显的能看到橘黄色的圈出现,随着时间的增加缓慢的扩大。以上现象说明了菌株D4能够产生蛋白酶、纤维素酶、嗜铁素,但不能产生氢氰酸(HCN)和几丁质酶。
生防菌株对番茄促生能力的测定,分泌IAA活性检测:将菌株D4用接种环蘸取接种在铬含有1%L-色氨酸的LB液体培养基中,28℃,200r/min条件下培养3d,在12,000rpm下离心10min,取2mL上清液放入灭菌试管中,加入4mLSalkowaski试剂和两滴正磷酸。充分混匀,LB液体培养基作对照,灭菌水作参考,28℃下温浴2h后观察试管中液体颜色变化,若变红,则表明该菌株能够产生IAA,实验重复3次。
如图36所示,所示,在加入4mLSalkowaski试剂和两滴正磷酸,28℃下温浴2h后,观察到菌株D4的试管颜色由原来的黄色变为红色,说明了菌株D4能够分泌产生生长素IAA。表明菌株D4能够促进植物生长。
生防菌株生物膜形成能力的测定,将菌株D4用接种环蘸取接种在LB液体培养基中,28℃,200r/min条件下培养24h后,用紫外分光光度计调节菌液浓度,调至OD600=0.2、0.4、0.6三个浓度,分别取4mL不同浓度菌液放入灭菌的试管中,无菌水做对照,封口,28℃恒温培养48h。倒掉试管中菌液,用灭菌水清洗试管后加入5mL的0.1%结晶紫染液,28℃恒温放置20min。倒掉结晶紫染液,灭菌水清晰试管。观察试管壁上是否有蓝紫色出现,有则表明该菌株可产生生物膜。在试管中加入95%乙醇溶液4mL,使生物膜充分溶解在乙醇中,观察评估生物膜形成的强度,实验重复3次。
从图37可知,不同浓度的菌悬液经过28℃恒温培养48h后,加入5mL的0.1%结晶紫染液,28℃恒温放置20min。倒掉结晶紫染液清洗试管后,看到玻璃试管内壁上有蓝紫色环状物,对照试管内壁无色透明未发现蓝紫色环状物,表明菌株D4能够产生生物膜,加入酒精观察后发现,随之菌悬液浓度的增加,溶液颜色越深,菌株D4产生生物膜的能力越强。
十、菌株D4挥发性物质GC-MS检测
生防菌株挥发性物质(VOCs)GC-MS检测:萃取:按照2%接种量,接菌于灭菌的300mLLB液体培养基中,180r/min、28℃培养24h后,加入300mL乙酸乙酯,放入磁性转子,搅拌24h萃取后,静置4h后用分液漏斗萃取,有机相保存待处理,上层再次按照余量的体积的1:1加入乙酸乙酯再次萃取,重复3次。将收集到的3次有机相进行旋转蒸发,旋蒸剩余2ml左右液体装入液相瓶中用乙酸乙酯进行1000倍的稀释后再次装入新的液相瓶中待后续上机检验。
GC-MS条件:色谱柱为HP-5MS(30mx0.25mm,0.25μm),初始温度50℃保持2min,以5℃/min升温至240℃后,保持15min,运行时间55min;汽化室温度250℃;载气为高纯He(纯度99.999%);柱前压7.65psi,载气流量1.0mL/min,不分流,溶剂延迟时间5.0min。离子源为电子轰击离子源,离子源温度230℃,四极杆温度150℃,电子能量70eV,发射电流34.6μA,倍增器电压1624V,接口温度280℃,质量范围29~500amu。
检测的数据经过GC-MS分析,经过乙酸乙酯的处理,一共发现了32种高度匹配的化合物,其中有5种化合物已经被报道有相关的抑菌效果。如表9所示,32种化合物中,占比最高的10种化合物为:Cyclotrisiloxane,hexamethyl-、Benzaldehyde、Butylbenzoate、Di-sec-butylphthalate、Hexadecanoicacid,methylester、Pentadecanoicacid,14-methyl-,methylester、Dodecanamide、Pyrrolo[1,2-a]pyrazine-1,4-dione,hexahydro-3-(phenylmethyl)-、Bis(2-ethylhexyl)phthalate、Phthalicacid,di(2-propylpentyl)ester。这10种中就有1种Bis(2-ethylhexyl)phthalate为被报道有抑菌作用的化合物。
表9菌株D4产生的挥发性物质
/>
/>
