细辛脂素或含有细辛脂素的细辛提取物在制备预防和/或治疗胃癌前病变的药物中的用途
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于制药技术领域,具体涉及细辛脂素或含有细辛脂素的细辛提取物在制备预防和/或治疗胃癌前病变的药物中的用途。
背景技术
消化道肿瘤的发病率及死亡率均居高不下,其中胃癌处于我国各类恶性肿瘤死亡率的首位。1975年,Correa提出胃癌发生的多步骤假设,即慢性胃炎→慢性萎缩性胃炎→胃黏膜肠上皮化生→胃黏膜异型增生→胃癌,这一发展模式现已为国内外多数学者所认同。根据该理论,胃癌前病变(GPL)是先于胃癌发生的消化系统疾病,主要包括慢性萎缩性胃炎、胃黏膜肠上皮化生、胃黏膜异型增生这一类容易癌变的胃黏膜病理组织学变化。研究发现,胃癌前病变增加的严重程度会显著增加胃癌的发病风险。肠黏膜出现微小变化的患者在随后20年中罹患胃癌的风险是健康人群的1.8倍,而出现肠黏膜异型增生的患者患癌风险几乎是健康人群的11倍。因此,早期及时治疗胃癌前病变有极大可能逆转胃上皮恶性转化、阻遏胃癌发生。
细辛为马兜铃科植物北细辛、汉城细辛或华细辛的干燥全草,其性辛、温,入心、肺、肾经,具有解表散寒,祛风止痛,通窍,温肺化饮的功效,临床长用于治疗风寒感冒,鼻渊,头痛,牙痛及风湿痹痛等病症。细辛脂素(Asarinin)是细辛中的主要成分之一,可用于治疗风寒感冒、头痛、牙痛、鼻塞鼻渊、风湿。但是,目前未见将细辛提取物或细辛脂素用于治疗胃癌前病变的报道。
发明内容
本发明的目的在于提供细辛脂素或含有细辛脂素的细辛提取物在制备预防和/或治疗胃癌前病变的药物中的用途。
本发明提供了细辛脂素在制备预防和/或治疗胃癌前病变的药物中的用途。
本发明还提供了含有细辛脂素的细辛提取物在制备预防和/或治疗胃癌前病变的药物中的用途。
进一步地,所述胃癌前病变为慢性萎缩性胃炎。
进一步地,所述胃癌前病变为胃黏膜肠上皮化生。
进一步地,所述胃癌前病变为胃黏膜异型增生。
进一步地,所述药物是能够抑制胃癌前病变细胞的活性,抑制胃癌前病变细胞的克隆形成能力,抑制胃癌前病变细胞的迁移和侵袭能力,和/或促进胃癌前病变细胞凋亡的药物。
进一步地,所述药物是能够引起胃癌前病变细胞线粒体损伤的药物。
进一步地,所述药物是能够改善胃癌前病变细胞的抗氧化能力的药物。
进一步地,所述药物是以细辛脂素为活性成分,加上药学上可接受的辅料制备而成的制剂。
进一步地,所述制剂为口服制剂。
进一步地,所述制剂为注射制剂。
进一步地,所述胃癌前病变为慢性萎缩性胃炎。
进一步地,所述胃癌前病变为胃黏膜肠上皮化生。
进一步地,所述胃癌前病变为胃黏膜异型增生。
通过细辛脂素对胃癌前病变模型细胞的作用研究,本发明首次发现细辛脂素能够降低胃癌前病变细胞线粒体膜电位,引起线粒体的损伤,使线粒体通透性转换孔张开,触发线粒体的功能障碍,降低胃癌前病变细胞ATP含量,引起胃癌前病变细胞凋亡。
进一步通过细辛脂素的对胃癌前病变动物模型的疗效研究,本发明发现细辛脂素能够显著改善胃癌前病变小鼠胃黏膜上皮的异型增生病变,改善胃癌前病变小鼠的胃黏膜肠上皮化生,诱导胃癌前病变小鼠胃黏膜病变细胞凋亡,升高胃癌前病变小鼠组织ROS水平,改善胃癌前病变小鼠的病变细胞生长及抗氧化能力。
细辛脂素或含有细辛脂素的细辛提取物在制备预防和/或治疗胃癌前病变(包括慢性萎缩性胃炎,胃黏膜肠上皮化生、胃黏膜异型增生)的药物中具有广阔的应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
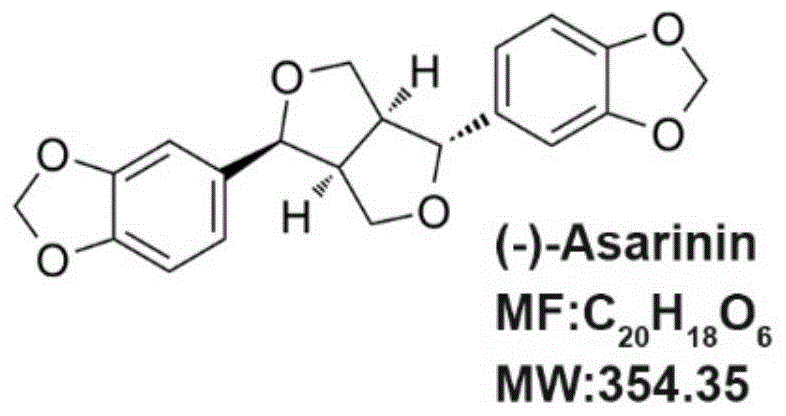
图1.细辛脂素的结构示意图。
图2.胃癌前病变细胞活力图。A为MNNG对GES-1细胞的活力趋势;B为MNNG引起的GES-1细胞EMT相关蛋白变化;C为E-cadherin蛋白表达趋势;D为N-cadherin蛋白表达趋势;E为Vimentin蛋白表达趋势;F为细辛脂素对MC和GES-1细胞的活力趋势;G为细辛脂素在24h和48h对MC细胞的活力趋势。
图3.胃癌前病变细胞恶性行为趋势图。A和B为细辛脂素对MC细胞克隆形成能力的影响趋势;C和D为细辛脂素对MC细胞迁移能力的影响趋势;E和F为细辛脂素对MC细胞侵袭能力的影响趋势。
图4.胃癌前病变细胞凋亡周期结果图。A和B为细辛脂素对MC细胞周期变化的影响趋势;C和D细辛脂素对MC细胞凋亡发生的影响趋势。
图5.胃癌前病变细胞线粒体功能趋势图。A、B和C为细辛脂素对MC细胞线粒体功能损伤的影响趋势;D、E和F为细辛脂素对MC细胞线粒体通透性转换孔的影响趋势;G、H和I为细辛脂素对MC细胞膜电位的影响趋势;J为细辛脂素对MC细胞ATP含量的影响趋势。
图6.胃癌前病变细胞ROS及恶性行为趋势图。A、B和C为细辛脂素对MC细胞内ROS含量的影响趋势;D、E和F为细辛脂素对MC细胞线粒体内部ROS含量的影响趋势;G为NAC和细辛脂素对MC细胞活力的影响趋势;H和I为NAC和细辛脂素对MC细胞周期变化的影响趋势;J和K为NAC和细辛脂素对MC细胞凋亡发生的影响;L和M为NAC和细辛脂素对MC细胞克隆形成能力的影响趋势。
图7.胃癌前病变动物模型病理程度图。A为细辛脂素对胃癌前病变小鼠胃黏膜的影响趋势;B和D为细辛脂素对胃癌前病变小鼠胃黏膜腺体形态的影响趋势;C和E为细辛脂素对胃癌前病变小鼠胃黏膜肠化生情况的影响趋势。
图8.胃癌前病变动物胃黏膜上皮细胞活性及线粒体功能趋势图。A和D为细辛脂素对胃癌前病变小鼠胃黏膜细胞凋亡发生的影响趋势,B和C为细辛脂素对胃癌前病变小鼠胃黏膜ROS含量的影响趋势;E为细辛脂素对胃癌前小鼠胃黏膜MDA含量的影响趋势;F为细辛脂素对胃癌前病变小鼠胃黏膜GSH含量的影响趋势。
具体实施方式
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
细辛脂素可以通过购买市售产品得到,也可以按照以下方法制备得到。
实施例1细辛脂素的制备
S1:取细辛的根与根茎洗净,用恒温干燥箱烘干后粉碎,得细辛粗粉;
S2:取S1步骤的细辛粗粉称重,用5-6倍量(V/W)的90%乙醇浸泡20-24h,然后回流提取3次,每次2.5-3小时,回收乙醇得到流浸膏;
S3:取S2步骤的流浸膏,用水蒸汽蒸馏法提取流浸膏中的挥发油成分,得到棕色液;
S4:取S3步骤的棕色液,加入氢氧化钾水溶液使KOH浓度为50%,然后用石油醚萃取3次,每次2.5-3小时,所得石油醚层再用水洗至流出水液无色,回收石油醚,所得剩余部分加无水乙醇热溶后冷却得到细辛脂素结晶粗品;
S5:用甲醇热溶反复重结晶得白色柱状结晶,即细辛脂素精品,纯度90%。实施例2细辛脂素对胃癌前病变模型细胞生长及线粒体功能的影响1.实验材料
细辛脂素(Asarinin),纯度98%,批号:BP0199,成都普瑞法科技开发有限公司;N-Acetyl-L-cysteine(NAC),N-Methyl-N'-nitro-N-nitrosoguanidine(MNNG),购自MedChemExpress(上海,中国)。RPMI-1640培养基,RPMI-DMEM培养基购自Thermo FisherScientific。MitoTraker Green染料,MitoTraker CMXRed染料,JC-1染料,ROS燃料,线粒体通透性转换孔试剂盒,细胞凋亡试剂盒,细胞周期试剂盒,购置Beyotime Biotechnology(上海,中国)。
2.实验方法
2.1MC细胞的建立和细胞培养
人胃上皮细胞GES-1,来源于BNCC,以60%的密度种植在6孔板上,并用10% FBS(Gibco Life Technology,美国Gibco Life Technology)和1%抗生素抗真菌液含量的RPMI-DMEM培养基,在95%的空气和5%的二氧化碳的潮湿环境中,细胞保持在37℃。贴壁过夜后。用致癌剂MNNG(30μM)干预GES-1细胞24h,随后用RPMI-1640培养基进行传代培养,构建胃癌前病变细胞(MC细胞)。贴壁过夜后,用新鲜培养基更换培养基,并用不同浓度的细辛脂素处理。在指定的时间内收集细胞。
2.2细胞活力实验
用CCK8试剂盒(Beyotime Biotechnology)进行细胞活力实验。将细胞(5×103)接种于96孔板,过夜贴壁后,用不同浓度的细辛脂素处理细胞24h、48h。每孔加入10μl的CCK8溶液,将细胞在培养箱中孵育1-2h,用酶标仪测定在450nm波长处的吸光度,并根据OD值计算细胞活力。
2.3平板克隆形成实验
取对数生长期的MC细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,并把细胞悬浮在10%胎牛血清的1640培养液中备用。将1000个细胞分别接种在6孔板中,并轻轻转动,使细胞分散均匀,并用细辛脂素干预24h。置37℃5% CO2及饱和湿度的细胞培养箱中培养2~3周。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加4%多聚甲醛固定细胞5mL固定15分钟。然后去固定液,加适量结晶紫染色液(Beyotime Biotechnology)染10~30分钟,然后用流水缓慢洗去染色液,空气干燥。在显微镜(低倍镜)计数大于10个细胞的克隆数。最后计算克隆形成率。
克隆形成率=(克隆数/接种细胞数)×100%。
2.4Transwell实验
用CORNING公司的Matrigel 1:8稀释,包被Transwell小室底部膜的上室面,置37℃30min使Matrigel聚合成凝胶。制备细胞悬液前先让细胞撤血清饥饿12-24h,进一步去除血清的影响。消化细胞,终止消化后离心弃去培养液,(用PBS洗1-2遍),用含BSA的无血清培养基重悬。调整细胞密度至1×105/ml。取细胞悬液100μl加入Transwell小室。24孔板下室一般加入600μl含20%PBS的培养基,去除气泡,将小室放进培养板。常规培养48h,取出Transwell小室,弃去孔中培养液,用无钙的PBS洗2遍,甲醇固定30分钟,将小室适当风干。0.1%结晶紫染色20min,用棉签轻轻擦掉上层未迁移细胞,用PBS洗3遍。200倍显微镜下随即3个视野观察细胞,记数。
2.5细胞周期和凋亡实验
用PI/RNase染色缓冲液(Beyotime Biotechnology)和BECKMAN流式细胞仪检测细胞周期分布。将MC细胞培养在一个六孔培养板中,并孵育一夜以允许贴壁。然后,用细辛脂素处理细胞24h,消化收集细胞,用70%冰镇乙醇滴加固定4h。然后,用PBS洗涤细胞两次,再悬浮在0.5mLPI/RNase染色缓冲液中。充分混合后,在37℃孵育15分钟,并在1h内进行流式细胞仪分析细胞周期分布。
为了评估凋亡,用Annexin V FITC凋亡检测试剂盒(Beyotime Biotechnology)检测细胞凋亡情况。将MC细胞接种于6孔板中,用细辛脂素处理24h,通过短暂的胰酶消化收集总细胞,并在1800rpm下离心5分钟,然后处理细胞进行细胞周期分析。将细胞悬浮在0.5mlFITC/PI溶液中,然后细胞在室温下孵育30min,并使用BECKMAN流式细胞仪进行分析。
2.6线粒体结构分析
细胞内线粒体结构完整性的用Mito-Tracker Green试剂盒(Beyotime)测定。将细胞接种于六孔培养板中过夜,经细辛脂素孵育24h后,收集细胞,与200nM Mito-TrackerGreen黑暗孵育30min,洗涤3次。用OLYMPUS倒置荧光显微镜和BECKMAN流式细胞仪测定线粒体结构完整性。用Mitochondrial Permeability Transition Pore Assay Kit(Beyotime)检测线粒体通透性转换孔的开合水平。
2.7线粒体膜电位分析
将细胞接种于六孔培养板中过夜,经细辛脂素孵育24h,处理结束后,短暂胰酶消化收集细胞总数,1800rpm离心5min。每个样品的颗粒悬浮在1ml新鲜的温培养基中,从1mg/ml的染料原料中加入1.25μl JC-1染料,在37℃的黑暗中孵育20分钟,在PBS短暂洗涤2次后,随后用OLYMPUS倒置荧光显微镜和BECKMAN流式细胞仪进行观察。数据按JC-1单体/二聚体比值进行分析。
2.8ATP含量检测
用ATP试剂盒(碧云天)检测细胞内ATP含量变化。将MC细胞接种在12孔板中,用细辛脂素干预24h,处理结束后在4℃下用ATP裂解液充分裂解细胞,离心收集上清液。将ATP工作液加入到不透光的96孔板中,静置5min去掉底色,再加入上清液50μl,用Tecan酶标仪检测萤火虫荧光素酶发光值。
2.9ROS生成的测量
细胞内ROS的产生用ROS分析试剂盒(Beyotime)测定。将细胞接种于六孔培养板中过夜,经细辛脂素孵育24h后,收集细胞,与10μM DCFH-DA黑暗孵育30min,洗涤3次。用OLYMPUS倒置荧光显微镜和BECKMAN流式细胞仪测定ROS水平。用Mito-Tracker Red CMXRos红染剂检测线粒体内ROS水平。
3.实验结果
3.1细辛脂素能抑制MC细胞活力
为了研究细辛脂素对胃癌前病变细胞增殖的影响,首先选用正常人胃上皮细胞GES-1,用MNNG进行诱导建立胃癌前病变模型细胞(MC细胞)。为了选择对MC细胞毒性不大的浓度,用不同浓度的MNNG对GES-1细胞进行干预,并通过CCK8比色法检测细胞存活率。结果显示(图2A),MNNG在50μM浓度以上,会对GES-1细胞产生较大的细胞毒性。为了进一步检测MNNG引起的胃癌前病变程度,通过Western Blot检测胃癌前病变标记物-EMT蛋白的表达程度。结果显示MNNG能够诱导GES-1细胞进行上皮间充质化的进程(图2B-E)。随后挑选30μM的MNNG干预GES-1 24h,建立MC细胞。
为了进一步检测细辛脂素对MC细胞活力的影响,将GES-1细胞和MC细胞用细辛脂素分别干预24、48h,用CCK8比色法检测细胞存活率。结果显示(图2F),在48h的干预时间下,相同浓度的细辛脂素对MC细胞的活性抑制作用比GES-1细胞更加明显(P<0.01)。由表1可知,在48h的干预时间下(图2G),细辛脂素对MC细胞的活性抑制作用以剂量依赖的方式显著增加,且在80μM起尤为显著(P<0.01)。上述结果表明,细辛脂素能够显著抑制胃癌前病变模型细胞的活性,有潜力作为治疗胃癌前病变的药物。
表1.细胞活力实验结果
注:与空白组相比,
3.2细辛脂素抑制MC细胞恶性行为并诱导细胞凋亡
为了研究细辛脂素对MC细胞增殖能力的影响,选用80μM做为低浓度,140μM做为高浓度,采用克隆形成实验进行验证。克隆形成实验表明(图3A-B),经细辛脂素处理后MC细胞的克隆形成能力受到抑制(P<0.01)。为了进一步研究细辛脂素对MC细胞迁移和侵袭的影响,用划痕实验及Transwell实验检测MC的迁移、侵袭能力。结果发现(图3C-F),经细辛脂素处理后MC细胞的迁移和侵袭能力受到明显抑制(P<0.01)。为了进一步探讨细辛脂素抑制MC细胞增殖的机制,用流式细胞仪检测了MC细胞的周期分布。结果表明,细辛脂素诱导MC细胞发生G0/G1期停滞(图4A-B)。
细胞凋亡被广泛认为是抗癌药物在许多肿瘤细胞及癌前病变细胞类型中的主要抗增殖机制。因此,本实验还研究了细辛脂素对MC细胞凋亡的影响。结果表明(图4C-D),细辛脂素以剂量依赖的方式诱导MC细胞凋亡。根据表2可知,以上结果表示,细辛脂素能抑制MC细胞的增殖并诱导其凋亡。
表2.细胞恶性行为实验结果
注:与空白组相比,
3.3细辛脂素诱发MC细胞线粒体损伤
线粒体是细胞生命活动的能量中心,对肿瘤细胞以及癌前细胞的增殖和死亡有双向作用。线粒体膜电位是线粒体功能正常运行的关键调控因素,可以作为线粒体损伤的标志物。为了研究细辛脂素是否能够在MC细胞中触发线粒体损伤,本发明对细胞线粒体进行了实验,结果见表3。采用不同浓度细辛脂素干预MC细胞,用Mito-Tracker Green染料对细胞进行染色,并用倒置荧光显微镜和流式细胞仪进行观察。实验结果发现,经细辛脂素处理的MC细胞绿色荧光信号下降(图5A-C),且随着浓度递增荧光强度改变更加明显。这些结果显示,细辛脂素能够引起MC细胞线粒体损伤。为了进一步研究细辛脂素引起线粒体损伤的结果,用线粒体通透性转换孔染料对线粒体进行染色,结果显示经细辛脂素处理的细胞(图5D-F),绿色荧光信号比对照组细胞明显降低,且随呈现浓度依赖性(P<0.01)。这些结果表明,细辛脂素能够大量打开线粒体上的通透性转化孔,使细胞色素C等有害物质溢出线粒体进入细胞质,从而促进细胞的凋亡。
为了进一步研究细辛脂素引起线粒体损伤的机制,采用JC-1比色法,通过倒置荧光显微镜和流式细胞仪检测线粒体膜电位。结果显示(图5G-I),经细辛脂素处理的MC细胞,JC-1单聚体荧光强度增加,JC-1聚合物的荧光强度下降,JC-1红/绿荧光强度比明显降低且在高浓度下荧光强度变化更加明显(P<0.01)。这些结果提示,经细辛脂素处理后,MC模型细胞线粒体膜电位下降。线粒体是ATP的能量产地,当线粒体功能受损时,ATP的产量会下降。为了进一步探究细辛脂素对MC细胞内ATP含量的影响,采用ATP试剂盒,通过Tecan全荧光酶标仪检测了ATP含量。结果显示(图5J),经细辛脂素处理的MC细胞,ATP含量显著下降(P<0.01)。结果提示细辛脂素能够使线粒体功能障碍,影响ATP的含量。
综上所述,细辛脂素能够降低线粒体膜电位,引起线粒体的损伤,使线粒体通透性转换孔张开,触发线粒体的功能障碍,降低细胞内ATP含量,引起MC细胞凋亡。
表3.细胞线粒体实验结果
注:与空白组相比,
3.4细辛脂素诱导MC细胞线粒体中ROS的累积
活性氧(ROS)是细胞凋亡的关键调节因子。许多化疗药物最初都通过诱导细胞积累ROS来诱导肿瘤细胞凋亡。线粒体功能障碍和失衡导致线粒体膜电位改变,并进一步触发线粒体释放ROS。为了进一步证实线粒体ROS的存在,本发明采用ROS染料通过倒置荧光显微镜和流式细胞仪检测MC细胞中的ROS水平。结果表明(表4,图6A-C),经细辛脂素处理的MC细胞,DCFH-DA荧光信号增强,且随浓度呈递增性(P<0.01)。这些结果表明细辛脂素增加了MC细胞内ROS的产生。为了探讨ROS的来源,用Mito-Tracker Red CMXRos红染料通过倒置荧光显微镜和流式细胞仪检测线粒体中ROS水平。研究发现,经细辛脂素处理的细胞(图6D-F),红色荧光信号明显强于对照组细胞(P<0.01)。这些结果表明细辛脂素增加了MC细胞线粒体内ROS的产生。综上所述,经细辛脂素处理后,MC细胞线粒体功能受损,线粒体膜电位下降,增加了线粒体ROS的产生。
为了进一步明确细辛脂素诱导的细胞凋亡是否是由于ROS的产生,本发明用ROS清除剂NAC研究了抗氧化剂对细辛脂素诱导细胞凋亡的影响。结果表明(表5,图6G),NAC可明显减弱细辛脂素诱导的细胞增殖抑制(P<0.01)。NAC也明显抑制了细辛脂素诱导的GPL模型细胞G0/G1期停滞和凋亡(图6H-K)。此外,相较于用药组,在NAC处理的细胞中(图6L-M),细胞克隆增殖能力上升(P<0.01)。研究结果表明,细辛脂素可以通过增强线粒体ROS诱导MC细胞发生凋亡。
表4.细胞ROS实验结果
注:与空白组相比,
表5.细胞恶性行为实验结果
/>
注:与空白组相比,
上述实验结果表明,细辛脂素能够显著抑制胃癌前病变模型细胞的活性,显著抑制胃癌前病变模型细胞的克隆形成能力,显著抑制胃癌前病变模型细胞的迁移和侵袭能力;细辛脂能够降低线粒体膜电位,引起线粒体的损伤,使线粒体通透性转换孔张开,触发线粒体的功能障碍,降低细胞内ATP含量,引起胃癌前病变模型细胞凋亡。细辛脂素在制备治疗胃癌前病变的药物中具有优良的应用前景。
实施例3细辛脂素的对胃癌前病变动物模型的疗效
1.实验目的
探讨细辛脂素对胃癌前病变动物模型的胃黏膜病理及线粒体功能的改善作用。
2.实验材料
2.1实验药物及试剂
细辛脂素的来源同实施例2;N-Acetyl-L-cysteine(NAC),Methylnitronitrosoguanidine(MNNG),N-Nitroso-N-methylurea(MNU),购自MedChemExpress(上海,中国)。RPMI-1640培养基,RPMI-DMEM培养基购自Thermo Fisher Scientific。MitoTraker Green染料,MitoTraker CMXRed染料,JC-1染料,ROS燃料,线粒体通透性转换孔试剂盒,细胞凋亡试剂盒,细胞周期试剂盒,购置Beyotime Biotechnology(上海,中国)。
2.2实验动物
选用SPF级4周龄BABL/C小鼠,体质量18-20g,雌雄各半小鼠共24只,小鼠购自成都达硕实验动物有限公司。
3.实验方法
3.1实验分组及给药
小鼠随机分为4组(n=6):空白组、模型组、模型+细辛脂素高剂量组、模型+细辛脂素低剂量组。采用致癌剂MNU造模法制作胃癌前病变(GPL)小鼠模型:给予模型组小鼠300mmp的MNU溶液自由饮用,共计造模16周。同时,从MNU治疗第1天到第16周,模型+细辛脂素高组小鼠灌胃给予细辛脂素20mg/kg,1次/d,模型+细辛脂素低组小鼠灌胃给予细辛脂素5mg/kg,1次/d,正常组和模型组小鼠灌胃生理盐水10ml/kg,1次/d。第16周末用戊巴比妥纳(140mg/kg)灌胃麻醉。禁食12h后,颈椎脱位处死,立即取胃。这些实验得到了成都中医药大学动物研究伦理会的批准。
表6.各组给药剂量表
/>
3.2胃黏膜功能指标检测
3.3.1胃黏膜病理程度分析
禁食12h后,用戊巴比妥钠(140mg/kg腹腔注射)麻醉小鼠,取出胃组织,用10%中和福尔马林固定过夜,然后用酒精和二甲苯脱水。然后,制备3-μm石蜡包埋切片,并按标准程序在苏木精和伊红(H&E)中浸泡。根据厂家介绍,采用高铁二胺-阿利新蓝周期酸Schiff(AB-PAS染色)检测肠上皮化生的类型。正常黏膜中性粘蛋白染成洋红色,肠黏膜病变酸性粘蛋白染成蓝色。光镜下观察切片形态变化(IX71;奥林巴斯公司)。所用放大率分别为100×和200×。3.3.2胃黏膜MDA及GSH检测
将胃黏膜组织冲洗匀浆之后,5000r/min离心5min并收取上清液。设置标准品孔和样本孔,除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶标记的检测抗体100μL,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60min。清洗5次,每孔加入底物A、B各50μL,37℃避光孵育15min。每孔加入终止液50μL,在450nm波长处检测各孔的OD值。
3.4胃黏膜ROS免疫荧光染色
将组织切片脱蜡入水。抗原微波修复,温度92℃-96℃,10-15min,自然冷却至室温。正常羊血清封闭,去掉多余血清,滴加一抗4度过夜。滴加荧光素标记的二抗,37℃避光孵育1h,防淬灭封片剂封片,荧光显微镜拍照。
3.5统计学处理
所有实验数据以均数±标准差(X±SD)表示,数据组间比较采用单因素方差分析,以P<0.05示差异具有统计学意义。
4.取材
动物实验结束前一天,禁食小时12h后,用戊巴比妥钠(140mg/kg腹腔注射)麻醉小鼠,取出胃组织,用10%中和福尔马林固定过夜,然后用酒精和二甲苯脱水,备用。
5.实验结果
5.1细辛脂素改善GPL动物胃黏膜病理状态
5.1.1细辛脂素改善胃黏膜异型增生情况
如图6所示,肉眼观察下,空白组小鼠胃粘膜色泽红润,形态完整。而模型大鼠胃黏膜呈暗红色,光泽差,黏液少,表面粗糙。如图7A-B所示,HE染色后,在光镜下可见胃上皮细胞腺体及结构正常,光镜下胃上皮几乎无炎症浸润。模型组小鼠可见扭曲、拥挤的腺体,表现为细胞核增大、深染、核浆比增大。治疗组小鼠可见腺体扭曲现象减少,细胞核形态及核浆比部分恢复。如表7所示,SL评分评估小鼠胃黏膜病变程度,与空白组相比,模型组小鼠的胃黏膜异型增生病变程度明显(P<0.001),提示造模成功。与模型组相比,Asarinin-H组(P<0.01),胃黏异型增生病变程度改善情况具统计学差异;Asarinin-L组(P<0.05),对异型增生病变有改善作用,具有统计学差异。上述结果表明细辛脂素可显著改善GPL小鼠胃黏膜上皮的异型增生病变。
表7.胃黏膜腺体异型增生病变程度分析
注:与空白组相比,
5.1.2细辛脂素改善GPL动物胃黏膜肠上皮化生情况
采用AB-PAS染色检测胃黏膜肠上皮化生病变程度,由图7C可知,空白组小鼠胃黏膜未见蓝紫色阳性细胞。与空白组相比,模型组小鼠胃黏膜可见大量蓝色或紫色斑块,提示胃黏膜肠上皮化生病变明显。与模型组相比,Asarinin给药组小鼠胃黏膜蓝紫色斑块明显减少,提示胃黏膜肠上皮化生病变减轻。表8所示,用SL评分评估小鼠肠上皮化生病变程度,与空白组相比,模型组GPL程度高(P<0.001)统计学差异明显,提示造模成功。与模型组相比,Asarinin-H组(P<0.01)的胃黏膜肠上皮化生病变明显改善,具统计学差异;Asarinin-L组(P<0.05)胃黏膜肠上皮化生病变也有改善,具有统计学差异。上述结果表明细辛脂素对GPL小鼠的胃黏膜肠上皮化生有显著改善作用。
表8.胃黏膜肠上皮化生病变程度分析
注:与空白组相比,
5.1.3细辛脂素引发胃黏膜上皮细胞凋亡及ROS升高
为了进一步检测小鼠胃黏膜组织中凋亡细胞的数量以及ROS的水平,本实验采用了TUNEL染色法及免疫荧光法。由图8A-D及表9结果可知,与对照组相比,模型组细胞凋亡率下降(P<0.01),而治疗组小鼠组织中的细胞凋亡率相较于模型组显著上升(P<0.01)。结果提示细辛脂素能够显著诱导GPL小鼠胃黏膜病变细胞凋亡。采用免疫荧光检测小鼠组织内ROS水平,结果发现与对照组相比,模型组小鼠的组织中红色荧光信号显著增强(P<0.01);与模型组比较,Asarinin治疗组小鼠组织中红色荧光信号显著增强(P<0.01)。上述结果表明,细辛脂素可显著诱导GPL小鼠胃黏膜病变细胞凋亡,可显著升高GPL小鼠组织ROS水平。
表9.胃黏膜细胞抗氧化能力实验结果
注:与空白组相比,
5.1.4细辛脂素升高胃黏膜上皮的MDA并降低GSH水平
为了进一步验证细辛脂素对氧化应激的影响,采用ELISA法检测胃黏膜MAD和GSH的水平。由图8E-F及表9结果发现,与对照组相比,模型组小鼠的组织中GSH水平及MDA水平显著上升(P<0.01);相较于模型组,Asarinin治疗组的GSH水平显著下降(P<0.01),MDA水平显著上升(P<0.01)。以上结果提示在GPL中氧化应激水平升高,这有助于胃癌前病变细胞的增殖及恶化,然而细辛脂素能够进一步升高GPL胃黏膜中的ROS及MDA的水平,降低GSH水平,诱导GPL细胞凋亡,阻断GPL的进一步发展。上述实验结果表明,细辛脂素给药对GPL动物模型的病变细胞生长及抗氧化能力有改善作用。
上述实验结果表明,细辛脂素可显著改善胃癌前病变小鼠胃黏膜上皮的异型增生病变,显著改善胃癌前病变小鼠的胃黏膜肠上皮化生,显著诱导胃癌前病变小鼠胃黏膜病变细胞凋亡,显著升高胃癌前病变小鼠组织ROS水平,显著改善胃癌前病变小鼠的病变细胞生长及抗氧化能力。细辛脂素在制备治疗胃癌前病变的药物中具有优良的应用前景。
综上,本发明提供了细辛脂素或含有细辛脂素的细辛提取物在制备预防和/或治疗胃癌前病变的药物中的用途。本发明首次发现细辛脂素能够降低胃癌前病变细胞线粒体膜电位,引起线粒体的损伤,使线粒体通透性转换孔张开,触发线粒体的功能障碍,降低胃癌前病变细胞ATP含量,引起胃癌前病变细胞凋亡。本发明还发现细辛脂素能够显著改善胃癌前病变小鼠胃黏膜上皮的异型增生病变,改善胃癌前病变小鼠的胃黏膜肠上皮化生,诱导胃癌前病变小鼠胃黏膜病变细胞凋亡,升高胃癌前病变小鼠组织ROS水平,改善胃癌前病变小鼠的病变细胞生长及抗氧化能力。细辛脂素或含有细辛脂素的细辛提取物在制备预防和/或治疗胃癌前病变(包括慢性萎缩性胃炎,胃黏膜肠上皮化生、胃黏膜异型增生)的药物中具有广阔的应用前景。
- 细辛总木脂素提取物及其提取方法和在制备减轻或抑制咳嗽药物中的用途
- 细辛总木脂素提取物及其提取方法和在制备减轻或抑制咳嗽药物中的用途
